同型半胱氨酸通过上调Rap1a诱导小鼠小胶质细胞炎性极化*
2024-01-17韦爱君贺杜鹃张梅奎
韦爱君,贺杜鹃,张梅奎△
(1陕西中医药大学第一临床医学院,陕西 咸阳 712046;2解放军总医院医疗保障中心远程医学科,北京 100853)
同型半胱氨酸(homocysteine,Hcy)是一种蛋白质含硫氨基酸,代谢涉及再甲基化途径和转硫途径[1]。Hcy 在生理状态下呈低水平,过高则会出现一些病理性变化。诸多研究表明,Hcy被认为是动脉粥样硬化、血管内皮障碍、心血管疾病、外周血管炎症发病的独立危险因素。近年来,同型半胱氨酸被报道作为一种神经毒性氨基酸,参与阿尔茨海默病、痴呆等神经退行性疾病的发生发展[2]。有研究发现,Hcy 通过增加氧化应激反应和升高NO 水平来增加神经变性及神经毒性[3]。本实验室前期研究发现,Hcy 参与慢性应激诱导的脑神经源性生长因子(brain-derived neurotrophic factor,BDNF)减少和相关认知功能障碍[4]。也有研究表明,Hcy 诱导缺血性脑卒中的小胶质细胞激活并诱导炎症反应[5]。小胶质细胞是中枢神经系统的常驻免疫细胞,当机体受到高强度或持续性应激损伤时,小胶质细胞发生M1型极化,释放神经毒性物质及促炎因子,诱导神经炎症的发生[6]。小胶质细胞介导的炎症反应在神经退行性疾病的发展进程中起着重要的作用[7]。同型半胱氨酸对于小胶质细胞介导的炎症反应研究仍缺乏机制探索。
Rap1a 是Ras 家族相关蛋白(Ras-related protein,Rap)中的一种,是一种小GTP 酶[8],这些蛋白质的活性形式以瞬时GTP 结合状态存在,介导信号传导[9]。Rap1a 广泛分布于各种组织细胞中,与细胞的增殖、极性的形成、分化、黏附、血管重塑等多种生物学功能密切相关[10]。最早关于Rap1a 的研究表明,Rap1a可能为癌基因,参与肿瘤发生的进展。例如,最早就有文献报道,Rap1a 表达参与miR-337-3p 介导的宫颈癌细胞的迁移、侵袭及凋亡[11]。此外,Rap1a 介导的整合素途径在胶质母细胞瘤细胞增殖中激活G 蛋白偶联受体,这就提示Rap1a 在体内胶质母细胞瘤肿瘤生长中起着关键的调节作用[12]。近年来,越来越多的研究发现Rap1a 可通过多种信号通路调节机体免疫炎症反应,其中有研究结果显示,Rap1a 可激活心脏成纤维细胞下游AGE/RAGE 信号通路,诱导炎症介质磷酸化的NF-κB 表达增加,并促进可能的氧化应激及炎症反应,这就表明Rap1a 参与调控炎症反应[13]。也有研究结果表明,长链非编码RNA TGFB3-AS1 通过Rap1a/Wnt 信号通路促进Hcy 诱导巨噬细胞炎症,这就表明Rap1a/Wnt 信号通路在炎症调节方面起着重要的作用[14]。另外,也有研究发现,Rap1a 过表达促进了miR-340-5p 诱导的COX2、IL-1β、IL-6、TNF-α 等炎症因子的表达水平,Rap1a通过增加炎症反应,加重慢性缩窄性大鼠的神经性疼痛[15]。目前虽然有大量研究表明Rap1a 参与介导多种细胞的炎症反应。但是Rap1a 在神经系统炎症调节方面报道仍然较少,因此,我们的研究旨在探索Rap1a在Hcy诱导的小胶质细胞炎症反应中的作用。
本研究以小鼠小胶质细胞系BV2 细胞为研究对象,探讨Rap1a在Hcy诱导的BV2细胞炎症反应中的作用机制,为Hcy 介导的神经炎症性疾病的预防和治疗提供新的依据。
材 料 和 方 法
1 材料与试剂
小鼠小胶质细胞系BV2 细胞购于武汉普诺赛公司;Hcy 为Sigma 产品;高糖培养液购自Gibco;青霉素和链霉素购自Solarbio;BCA 法蛋白定量试剂盒购自天根生化科技有限公司;慢病毒由武汉枢密公司负责构建;Rap1a Ⅰ抗购于Cell Signaling Technology;β-actin Ⅰ抗购于Proteintech Group;辣根过氧化物酶标记的山羊抗兔IgG 购自中杉金桥公司;Trizol 试剂和逆转录cDNA 试剂盒购于Themo Fisher;实时荧光定 量TB Green®Premix Ex TaqTMⅡ(Tli RNase H Plus)的试剂盒购于TaKaRa;PAGE 凝胶购于Meilunbio;小鼠ELISA 检测试剂盒购自Abclonal;本实验所用引物由擎科生物有限公司合成。
2 实验方法
2.1 细胞培养 BV2 细胞(脑组织来源的小鼠小胶质细胞)购自武汉普诺赛;培养液为含有10%胎牛血清、100 U/mL 青霉素和100 U/mL 链霉素的高糖培养液,于37 ℃、5% CO2和饱和湿度的培养箱中培养。
2.2 细胞传代 镜下观察细胞密度达到80%即可进行细胞传代。用含终浓度50、100 和150 μmol/L Hcy的培养液干预细胞24 h,建立高同型半胱氨酸血症(hyperhomocysteinemia,HHcy)细胞模型,用于后续实验。
2.3 细胞分组及Rap1a 过表达和干扰慢病毒转染将培养的处于对数生长期的细胞种于6 孔板,用终浓度为50、100 和150 μmol/L 的Hcy 干预BV2 细胞24 h 后,筛选最佳Hcy 干预浓度;正常对照组仅加入等体积的完全培养液;依据病毒滴度通过预实验筛选出慢病毒的最佳感染复数(multiplicity of infection,MOI)为80,将过表达Rap1a 慢病毒(Rap1aoverexpressing lentivirus,oeRap1a)、Rap1ashRNA(shRap1a)及二者对应的无序序列oeRap1a-scramble(oeRap1a-sc)、shRap1a-scramble(shRap1a-sc)分别转染至小鼠小胶质细胞系BV2 细胞后用100 μmol/L Hcy 处理,6 h 后换正常培养液。过表达慢病毒Rap1a实验分组为:oeRap1a-sc组、oeRap1a组、Hcy组和Hcy+oeRap1a 组;敲减慢病毒Rap1a 实验分组为:shRap1a-sc 组、shRap1a 组、Hcy 组 和Hcy+shRap1a组。实验重复3次。
2.4 RT-qPCR 检测mRNA 表达 细胞培养24 h 后,收集细胞,用Trizol 法提取细胞RNA,用微量分光光度计测定样本RNA 纯度及浓度,根据反转录试剂配制体系说明书将RNA 反转为cDNA 备用。实验检测用引物序列详见表1,RT-qPCR 反应体系根据SYBR Green 说明书进行配制,以cDNA 为模板扩增各目的基因,计算各目的基因的相对表达量。
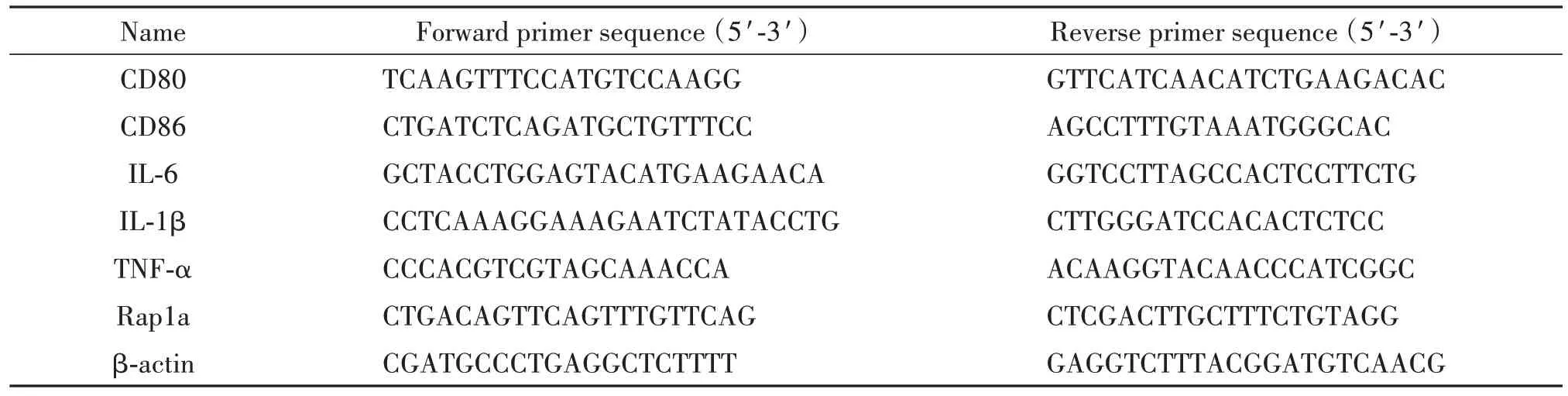
表1 引物序列Table 1. Primer sequences
2.5 ELISA 法检测炎症因子IL-6、IL-1β 和TNF-α 浓度 收集细胞,具体按照ELISA 试剂盒说明书进行操作,首先准备配制好标准品和洗涤液,将包被IL-6、IL-1β、TNF-α 抗体的96 孔板洗涤3 次,前2 列每孔依次加入100 μL 配制好的标准品,在其他孔中加入100 μL待测样品,37 ℃孵育2 h,弃去原有液体,洗板3 次,每孔加入100 μL 生物素化抗体工作液,37 ℃孵育1 h,重复上述洗涤步骤,每孔加入100 μL 链霉亲和素-HRP工作液,37℃孵育30 min,再次重复上述洗涤步骤,加入100 μL 底物溶液,37 ℃避光孵育15~20 min,加入50 μL终止液,5 min内检测450 nm 波长的A值样品的含量可根据其A值由标准曲线计算出相应的浓度。本实验重复3次。
2.6 Western blot 检测Rap1a 蛋白的表达 细胞培养24 h 后提取细胞总蛋白,BCA 法检测样品中的蛋白浓度,制备25 μg 蛋白上样品,进行SDS-PAGE,再将带有蛋白的PVGE 凝胶转移至PVDF 膜,用5%脱脂奶粉封闭2 h,TBST 洗膜3 次,每次5 min,配制I 抗(Rap1a 抗体、β-actin 抗体,均按1∶1 000 稀释),4 ℃孵育过夜,12~16 h 后回收Ⅰ抗,TBST 洗膜3 次,每次5 min,加入辣根过氧化物酶标记的山羊抗兔Ⅱ抗(1∶5 000),室温孵育2 h,TBST 洗膜3 次,加入ECL超敏发光液,显影拍照,以β-actin 为内参照,Image Lab软件进行定量分析。本实验重复3次。
3 统计学处理
用GraphPad Prism 9.4.1 软件进行统计学分析,所有数据均以均数±标准差(mean±SD)表示。首先评估数据是否为正态分布,再进行正态分布数据的方差齐性检验,方差齐的两组数据采用t检验,多组数据采用单因素方差分析(one-way ANOVA)。以P<0.05为差异有统计学意义。
结 果
1 Hcy对BV2细胞M1型极化的影响
小鼠小胶质细胞系BV2 细胞经50、100、150 μmol/L 等不同浓度Hcy 干预24 h 后,RT-qPCR 结果显示,Hcy浓度为100 μmol/L 以上时,小胶质细胞M1型极化标志物CD80、CD86 mRNA 表达水平均高于对照组(P<0.05),见图1。
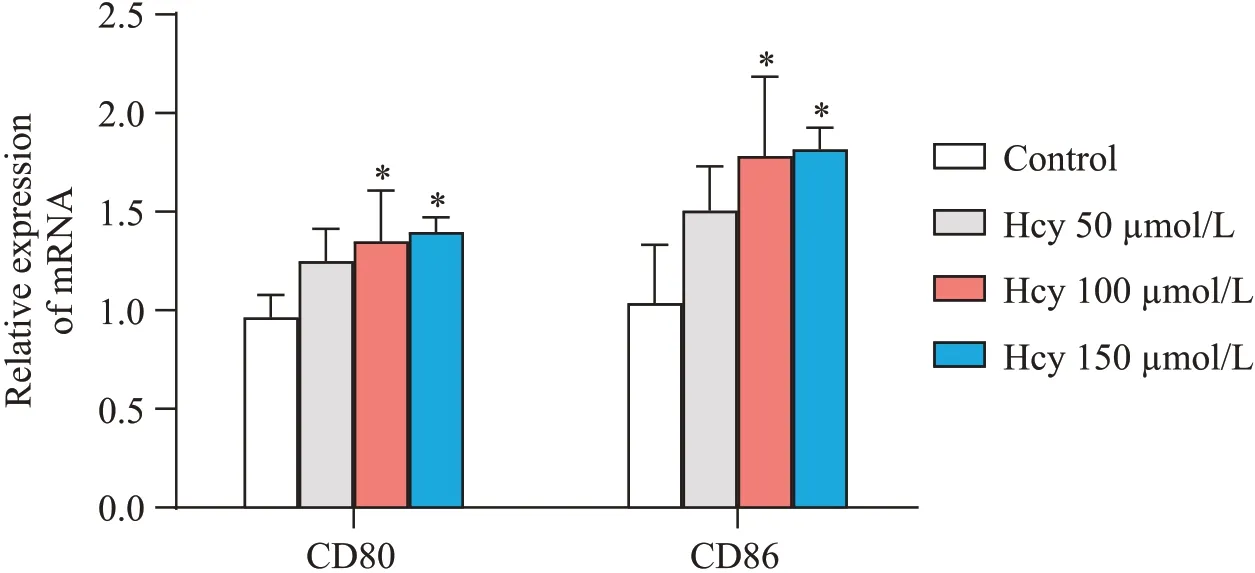
Figure 1. Effect of Hcy on M1 polarization markers in BV2 cells. The mRNA level of CD80 and CD86 in microglia were detected.Mean±SD. n=4. **P<0.05 vs control group.图1 Hcy对BV2细胞M1型极化标志物表达的影响
2 Hcy对BV2细胞释放部分炎症因子的影响
Hcy 浓度为100 μmol/L 以上可诱导BV2 细胞发生M1型极化,接下来用RT-qPCR 法及ELISA 法检测部分炎症因子的mRNA 及含量变化,结果显示,100 μmol/L 以上浓度Hcy 干预BV2 细胞,部分炎症因子IL-6、IL-1β、TNF-α mRNA 水平及细胞匀浆中蛋白水平均显著高于对照组(P<0.05),见图2。

Figure 2. Effect of Hcy on the mRNA (A) and protein (B) expression of IL-6,IL-1β and TNF-α in BV2 cells. Mean±SD. n=4. *P<0.05,**P<0.01 vs control group.图2 Hcy对BV2细胞部分炎症因子水平的影响
3 Hcy对BV2细胞Rap1a水平的影响
RT-qPCR 和Western blot 结果提示,100 μmol/L以上浓度Hcy 干预BV2 细胞后,Rap1a 的mRNA 表达和蛋白表达水平均显著高于对照组(P<0.05),见图3。这个结果提示,Hcy 能够促进BV2 细胞中Rap1a的表达。接下来我们将Rap1a mRNA 表达水平与BV2 细胞M1 型极化标志物CD80 mRNA 表达水平及炎症因子IL-1β、TNF-α 含量作相关性分析,结果提示,CD80 mRNA 表达水平及炎症因子的含量均与Rap1a 的mRNA 表达水平存在显著正相关:R2分别为0.9153、0.8881和0.3528(P<0.05)。
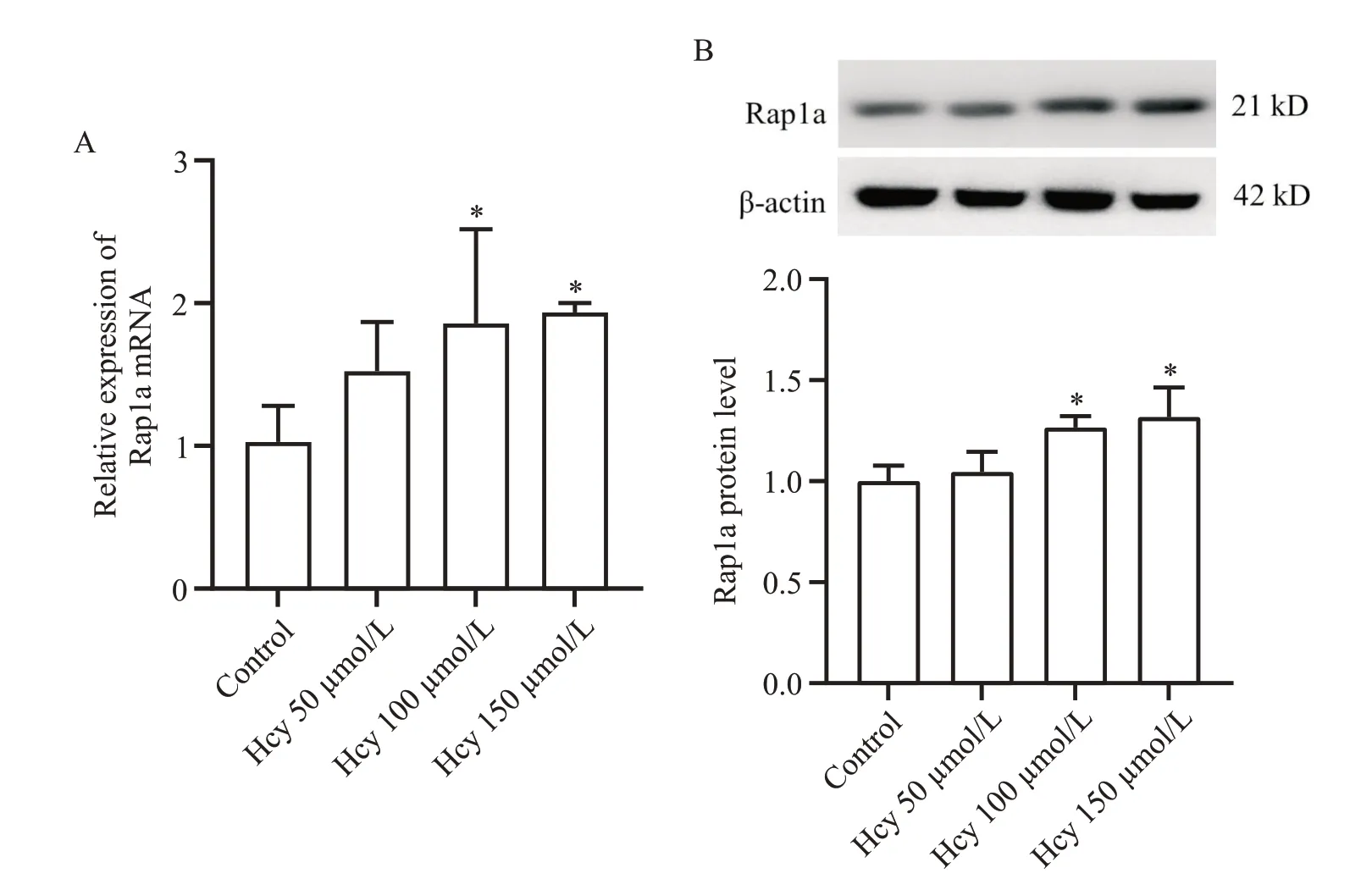
Figure 3. Effect of Hcy on mRNA (A) and protein (B) expression of Rap1a. Mean±SD. n=3. *P<0.05 vs control group.图3 Hcy对Rap1a mRMA及蛋白表达的影响
4 过表达Rap1a 可促进Hcy 诱导的BV2 细胞炎性极化
为了探索Rap1a 在Hcy 诱导BV2 细胞炎性极化中的作用,将BV2 细胞转染oeRap1a 慢病毒,荧光显微镜观察病毒感染效率达80%以上为有效(图4A);RT-qPCR 及Western blot 验证BV2 细胞中转染oeRap1a 后Rap1a 的mRNA 及蛋白表达水平均显著升高(P<0.05),见图4B。
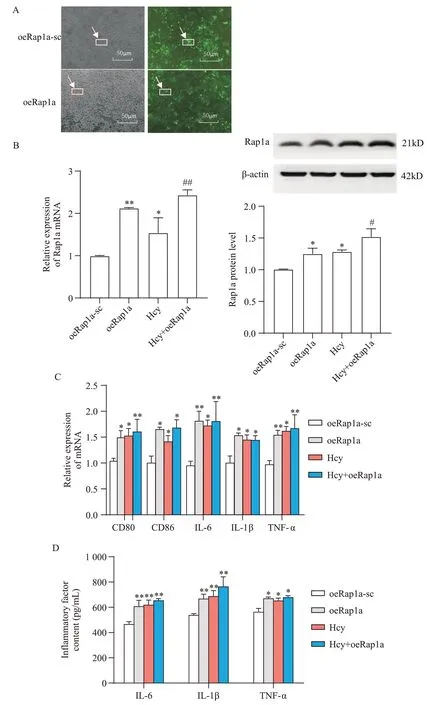
Figure 4. Effect of overexpression of Rap1a on Hcy-induced inflammatory polarization in BV2 cells. A: fluorescence images of BV2 cells transfected with Rap1a overexpression virus; B: the mRNA and protein expression levels of Rap1a in BV2 cells after Rap1a overexpression; C: the mRNA expression levels of M1 polarization marker and inflammatory cytokines IL-6,IL-1β and TNF-α in BV2 cells after overexpression of Rap1a; D: the secretion levels of inflammatory cytokines IL-6,IL-1β and TNF-α in BV2 cells after overexpression of Rap1a. Mean±SD. n=3. *P<0.05,**P<0.01 vs oeRap1a-sc group; #P<0.05,##P<0.01 vs Hcy group.图4 过表达Rap1a对Hcy诱导的BV2细胞炎性极化的影响
在BV2细胞转染oeRap1a慢病毒后,RT-qPCR结果显示,oeRap1a 组细胞M1 型极化标志物及部分炎症 因 子IL-6、IL-1β、TNF-α mRNA 表达水平与oeRap1a-sc 组相比显著升高(P<0.05)(图4C);ELISA 结果显示,oeRap1a 组细胞炎症因子分泌水平较oeRap1a-sc组显著升高(P<0.05)(图4D)。
5 敲减Rap1a 可改善Hcy 诱导的BV2 细胞炎性极化
为进一步研究Hcy 是否通过Rap1a 调控BV2 细胞的炎性极化,在BV2 细胞转染shRap1a 慢病毒,荧光显微镜观察病毒转染效率达80%以上为有效(图5A);RT-qPCR 及Western blot 检测转染shRap1a 的BV2 细胞中Rap1a的mRNA 及蛋白表达水平均显著降低(P<0.01)(图5B)。
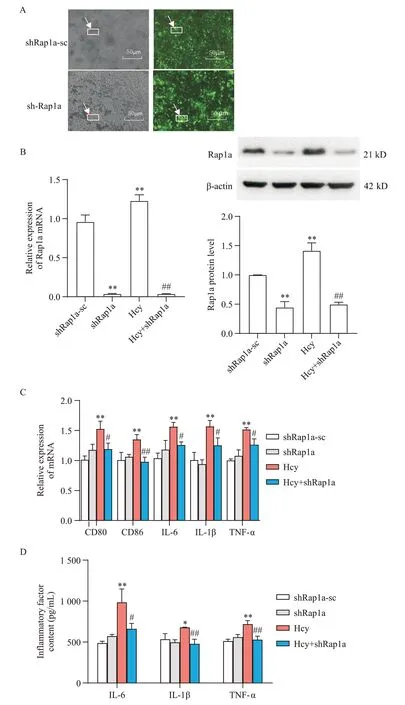
Figure 5. Effect of Rap1a knockdown on Hcy-induced inflammatory polarization of BV2 cells. A: fluorescence images of BV2 cells transfected with Rap1a knockdown virus; B: the mRNA and protein expression levels of Rap1a in BV2 cells after Rap1a knockdown; C: the mRNA expression levels of M1 polarization marker and inflammatory factors IL-6,IL-1β and TNF-α in BV2 cells after Rap1a knockdown; D: the secretion levels of inflammatory cytokines IL-6,IL-1β and TNF-α in BV2 cells after Rap1a knockdown. Mean±SD. n=3. **P<0.05,**P<0.01 vs shRap1a-sc group; #P<0.05,##P<0.01 vs Hcy group.图5 敲减Rap1a对Hcy诱导的BV2细胞炎性极化的影响
在BV2细胞转染shRap1a慢病毒后,RT-qPCR结果显示,Hcy+shRap1a组细胞M1型极化标志物CD80和CD86 及部分炎症因子IL-6、IL-1β、TNF-α mRNA表达水平与Hcy 组相比显著下降(P<0.05),见图5C;ELISA 结果显示,Hcy+shRap1a 组细胞炎症因子分泌水平与Hcy 组相比显著下降(P<0.05),见图5D。该结果提示敲减Rap1a可减弱Hcy 诱导的BV2细胞炎性极化,这就说明Rap1a参与调控Hcy诱导的BV2细胞M1型极化及炎症反应。
讨 论
Hcy 是蛋氨酸转化为半胱氨酸过程中形成的中间氨基酸[16]。通过转甲基产生,并通过再甲基化或转硫途径代谢[17]。血浆Hcy 水平升高涉及多种病理过程,其中介导的炎症反应是重要的致病机制[18]。多项研究发现,高同型半胱氨酸作为动脉粥样硬化发病的独立危险因素,通过诱发氧化应激及炎症反应加重动脉损伤[19]。其中,有研究报道,HHcy 通过激活NOX-ROS-NLRP3炎症小体途径,进一步加速动脉粥样硬化进程[20]。炎症与多种疾病的病理过程相关,毫无疑问,Hcy 与外周血管内皮、心肌细胞、巨噬细胞等多种细胞的炎症有着密切的联系,其中的机制研究也不在少数。然而,目前Hcy 与神经炎症方面的研究也有报道,例如有研究发现,高同型半胱氨酸血症小鼠小胶质细胞处于活化状态,并且释放大量促炎因子,介导神经炎症的发生[21]。众所周知,小胶质细胞在神经损伤的急性期或亚急性期,其自身通过吞噬作用发挥神经保护作用[22]。越来越多的研究发现,许多神经退行性疾病都与大脑的慢性炎症有关,小胶质细胞作为大脑的免疫细胞,介导神经炎症的发生[23]。近年来,神经炎症性疾病困扰着越来越多的人类,并且临床治疗存在局限性,因此,我们研究HHcy 对于神经炎症性疾病的发生发展具有一定的临床价值。
本研究是以小鼠小胶质细胞系BV2 细胞为研究对象,外源性给予Hcy干预BV2细胞24 h,构造HHcy模型,结果显示100 μmol/L以上浓度Hcy刺激下BV2细胞M1 型极化标志物及部分炎症因子IL-6、IL-1β、TNF-α mRNA 表达水平及含量显著升高,我们的结果与文献报道一致[24]。目前为止,Hcy与神经炎症方面有部分报道,但是其中的机制探索仍不完善。
为了探索Hcy 诱导BV2 细胞炎性极化的相关机制,我们发现Rap1a 作为一种小分子G 蛋白,属于Ras家族的亚群之一Rap1,Rap1包括Rap1a和Rap1b两个亚型,且两者具有高度相似的同源性[25]。Rap1a充当分子开关,将细胞外信号连接到细胞内反应,在各种细胞活动中起着至关重要的作用[26]。Gao 等[27]研究发现,Hcy 可以促进肝细胞中Rap1a 高表达,且miR-488-3p 可通过靶向Rap1a 促进Hcy 介导的肝细胞自噬,表明Rap1a与Hcy在肝细胞上有响应。近年许多学者旨在探索Rap1a 在各类细胞及组织中的炎症反应,然而,不同细胞类型中Rap1a 发挥着不同的功能。我们的研究结果中Hcy 促进BV2 细胞中Rap1a 显著升高,与文献报道Hcy 促进巨噬细胞Rap1a 表达升高结果相一致[28-29]。但也有文献描述了一种新机制,Rap1 缺失导致细胞因子受体信号传导和促炎机制NF-κB 激活来诱导内皮细胞的炎症反应[30]。这与我们的研究结果不完全一致,当然,不同细胞类型中Rap1功能也不相同,加之虽然Rap1两种亚型高度相似,但两种亚型对不同细胞的调节功能也不完全相同。所以后续值得对Rap1 进行进一步探索。
为了明确Rap1a 是否参与调控Hcy 诱导的BV2细胞炎性极化,我们用过表达及敲减Rap1a慢病毒转染BV2 细胞,实验结果发现,过表达Rap1a 可以使BV2 细胞M1 型极化标志物水平升高及部分炎症因子表达显著升高,与Hcy 干预BV2 细胞产生同样的炎症反应,在一定程度上还可加剧这种炎症反应。反之,在Hcy 干预BV2 细胞的条件下,敲减Rap1a可明显减轻这种炎症反应。这就表明Rap1a 参与调控Hcy诱导的小鼠小胶质细胞炎性极化。
综上所述,我们的研究结果提示,以Rap1a 为靶点可调控小胶质细胞介导的炎症反应,这就为临床上Hcy 相关神经炎症性疾病的预防及治疗提供新的理论依据。
