硫化氢对糖尿病大鼠皮肤创面自噬和血管形成的影响*
2024-01-17李媛媛赵富生张可心陈永兰姜昕悦谷春付
李媛媛,赵富生,张可心,陈永兰,张 娜,姜昕悦,谷春付,武 庚
(牡丹江医学院,黑龙江 牡丹江 157000)
糖尿病(diabetes mellitus,DM)是一种常见多发的慢性代谢性疾病,据糖尿病联合会发布的报告显示,2021 年全球20~79 岁人群DM 患病率为10.5%,到2045 年将上升至12.2%[1]。糖尿病皮肤溃疡(diabetic cutaneous ulcer,DCU)是DM 患者常见的并发症之一,致残率高且治疗昂贵,严重影响DM 患者的生活质量。目前,DCU 治疗方法主要包括控制血糖、抗感染和清创治疗等,但效果并不理想,因此迫切需要探索新的治疗策略[2]。DM 皮肤创面难以愈合的病理机制主要包括创面局部生长因子分泌减少、氧化应激、血管受损、慢性炎症反应等[3]。研究表明,在创伤愈合过程中,适度自噬具有维持局部组织内环境稳定,减轻氧化应激和炎症反应,促进血管生成和组织重建等作用[4]。DM 创伤后产生的大量活性氧可导致创面组织自噬失调,加剧局部组织炎症反应,进而影响创面愈合[5]。因此,调节DM 创面组织的自噬活性,可能是一种有效的治疗策略。
硫化氢(hydrogen sulfide,H2S)被认为是继一氧化氮和一氧化碳之后的第三种气体信号分子。机体内H2S 主要由胱硫醚γ-裂解酶(cystathionine γ-lyase,CSE)、胱硫醚β-合成酶和3-巯基丙酮酸硫转移酶三种酶催化合成[6]。H2S 具有抗炎症、抗凋亡、抗氧化应激、调控自噬以及舒张血管等多种生理功能[7-9]。然而,H2S 是否可以调控自噬,促进DM 皮肤创面血管形成和愈合,目前尚不清楚。本研究通过建立DM大鼠皮肤损伤模型,观察H2S 对DM 大鼠皮肤创面愈合的影响,并探究其可能机制。
材 料 和 方 法
1 材料
1.1 实验动物 SPF 级雄性SD 大鼠36 只,8 周龄,体质量(250±10) g,购自辽宁长生生物技术股份有限公司,许可证号为SCXK(辽)2020-0001。大鼠饲养于牡丹江医学院实验动物中心,环境温度22~24 ℃,通风良好。实验过程符合国家及单位实验动物管理和使用规定。
1.2 主要试剂及仪器 链脲佐菌素(streptozocin,STZ;北京索莱宝科技有限公司);H2S 荧光探针C-7Az(7-azido-4-methylcoumarin)、硫氢化钠(sodium hydrosulfide,NaHS; Sigma-Aldrich);CSE、CD31、微管相关蛋白1 轻链3(microtubule-associated protein 1 light chain 3,LC3)、caspase-3、Bcl-2 和Bax 抗体(武汉三鹰生物技术有限公司);beclin-1、P62、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)、蛋白激酶B(protein kinase B,PKB/Akt)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、p-PI3K、p-Akt 和p-mTOR 抗体,碘化丙啶(propidium iodide,PI),以及TUNEL染色液(碧云天生物技术有限公司)。激光共聚焦显微镜(LSM700,Zeiss)。
2 方法
2.1 糖尿病大鼠皮肤创伤模型的建立及分组 DM大鼠模型制备前禁食18 h(不禁水),腹腔注射1% STZ(50 mg/kg)诱导DM,72 h 后尾静脉采血检测大鼠血糖,血糖≥16.67 mmol/L表示DM模型制备成功。饲养三周后,制备皮肤创伤模型[10]。具体操作如下:大鼠腹腔注射1.5%戊巴比妥钠(30 mg/kg),清除大鼠背部毛发,常规消毒,剪切直径为2 cm 全层皮肤,深至筋膜。将DM 皮肤创伤大鼠随机分为DM 组和DM+NaHS 组,未注射STZ 大鼠为正常对照(control)组,每组12只。DM+NaHS组大鼠于创面建立当日腹腔注射NaHS(56 μmol/kg),每天1 次,连续注射21 d[11]。DM组和control组大鼠每日腹腔注射等体积生理盐水。
2.2 标本采集 创面建立第21 天,每组随机选取6只大鼠乙醚麻醉断颈处死,取创面皮肤组织,一半制备石蜡切片用于HE染色,另一半制备冰冻切片行免疫荧光染色;各组剩余6 只大鼠,取创面组织于-80 ℃冰箱保存,用于Western blot 分析。实验动物处理流程见图1。
2.3 创面愈合率分析 手术第0、7、14、21 天采集创面图像,用ImageJ 软件分析创面面积,计算创面愈合率。创面愈合率(%)=(原始创面面积-未愈合创面面积)/原始创面面积×100%。
2.4 创面组织H2S含量检测 取冰冻切片,复温、固定后,加C-7Az 工作液(1∶100),激光共聚焦显微镜采集图像,用ImageJ 软件分析荧光强度。取皮肤创面组织裂解、匀浆、离心,BCA 法测定蛋白浓度。SDS-PAGE 分离蛋白,转膜、封闭后,加入CSE 抗体(1∶1 000),4 ℃孵育过夜,次日加入相应Ⅱ抗,37 ℃孵育2 h,加ECL 发光试剂,置成像仪中成像。采用ImageJ软件分析目的蛋白条带相对灰度值。
2.5 HE 染色 取石蜡切片(5 μm),二甲苯脱蜡、水化、苏木精-伊红染色,常规脱水、中性树脂封片,光镜下观察组织形态结构及血管分布,通过ImageJ 软件分析创面愈合情况。
2.6 创面组织血管生成检测 (1)取冰冻切片固定、封闭,加CD31 抗体(1∶200),4 ℃孵育过夜,次日加Cy3标记的Ⅱ抗,DAPI染色细胞核,激光共聚焦显微镜采集图像,ImageJ 软件分析CD31 荧光强度。(2)蛋白分离、转膜后,加CD31 抗体(1∶1 000)和β-actin抗体(1∶2 000),4 ℃孵育过夜,次日加相应Ⅱ抗,显影成像,用ImageJ软件分析CD31条带相对灰度值。
2.7 创面组织血管内皮细胞自噬检测 (1)取冰冻切片,加入CD31和beclin-1抗体(1∶100),4 ℃孵育过夜,次日加FITC 和Cy3 标记的Ⅱ抗,DAPI 染细胞核。采用ImageJ 软件分析CD31+/beclin-1+细胞数。(2)蛋白分离、转膜后,加入LC3抗体(1∶500)、P62抗体(1∶1 000)、beclin-1 抗体(1∶1 000)和β-actin 抗体(1∶2 000),4 ℃孵育过夜,次日加入相应Ⅱ抗,显影成像。用ImageJ软件分析目的蛋白条带相对灰度值。
2.8 创面组织血管内皮细胞凋亡检测 (1)取冰冻切片固定,加入CD31 抗体(1∶200)、TUNEL 染色液、caspase-3 抗体(1∶200)和PI 染色液(50 mg/L),4 ℃孵育过夜,次日加入相应Ⅱ抗,DAPI 染细胞核。激光共聚焦显微镜采集图像,用ImageJ 软件分析CD31+/TUNEL+细胞数。(2)蛋白分离、转膜后,加入Bcl-2 抗体(1∶1 000)、Bax 抗体(1∶1 000)和β-actin 抗体(1∶2 000),4 ℃孵育过夜,次日加入相应Ⅱ抗,37 ℃孵育2 h,显影成像,ImageJ软件分析目的蛋白相对灰度值。
2.9 创面组织PI3K/Akt/mTOR通路蛋白表达检测蛋白分离、转膜后,加入Ⅰ抗(PI3K、p-PI3K、Akt、p-Akt、mTOR 和p-mTOR 抗体,1∶1 000;β-actin抗体,1∶2 000),4 ℃孵育过夜,显影成像,ImageJ 软件分析目的蛋白相对灰度值。
3 统计学处理
应用SPSS 18.0 软件进行统计分析。计量资料以均数±标准差(mean±SD)表示,创面愈合实验采用多因素方差分析重复测量。其余实验采用单因素方差分析,方差齐用LSD 法,方差不齐用Dunnett's T3检验。P<0.05为差异有统计学意义。
结 果
1 NaHS对皮肤创面愈合的影响
手术第0、7、14、21 天,各组大鼠创面愈合情况如图2 所示。DM+NaHS 组创面愈合率在术后第7、14、21 天显著高于DM 组(P<0.05),但低于control 组愈合水平(P<0.05)。
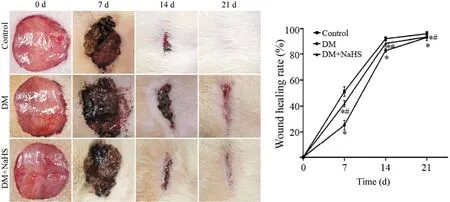
Figure 2. The skin wound healing of rats at different time points in each group. Mean±SD. n=12. *P<0.05 vs control group; #P<0.05 vs DM group.图2 不同时间点各组大鼠皮肤创面愈合情况
2 NaHS对皮肤创面组织H2S含量的影响
C-7Az 荧光染色及分析如图3A~3B 所示,与control 组相比,DM 组C-7Az 荧光强度显著降低(P<0.01);与DM 组相比,DM+NaHS 组C-7Az 荧光强度显著升高(P<0.01),但未恢复到control 组水平(P<0.01)。CSE 蛋白表达如图3C 所示,与control 组相比,DM 组CSE 表达水平显著降低(P<0.01);与DM组相比,DM+NaHS 组CSE 表达显著升高(P<0.01),但仍低于control组水平(P<0.01)。
3 NaHS对皮肤创面组织形态学的影响
HE 染色如图4A 所示,control 组创面修复良好,可见肉痂、毛囊及较多毛细血管;DM 组创面表层薄,陈旧性肉芽组织多,毛细血管少;DM+NaHS 组创面表层较厚,可见新生肉芽组织、大量纤维成分及毛细血管。创面宽度分析如图4B 所示,与DM 组相比,DM+NaHS 组表皮层创面宽度显著减小(P<0.01),但仍宽于control组水平(P<0.01)。
4 NaHS对皮肤创面组织血管生成的影响
如图5A 所示,control 组血管数量多,分布均匀;DM 组血管管径细且数量少,分布杂乱;DM+NaHS 组血管数量较多。CD31 免疫荧光染色结果显示,与control 组相比,DM 组CD31 荧光强度显著降低(P<0.01);DM+NaHS 组CD31 荧光强度较DM 组显著增加(P<0.01),但仍低于control 组(P<0.01),见图5B、C。Western blot 结果显示,与control 组相比,DM 组CD31 表达水平显著降低(P<0.01);DM+NaHS 组CD31 表达水平较DM 组显著升高(P<0.01),但未恢复到control组水平(P<0.05),见图5D。
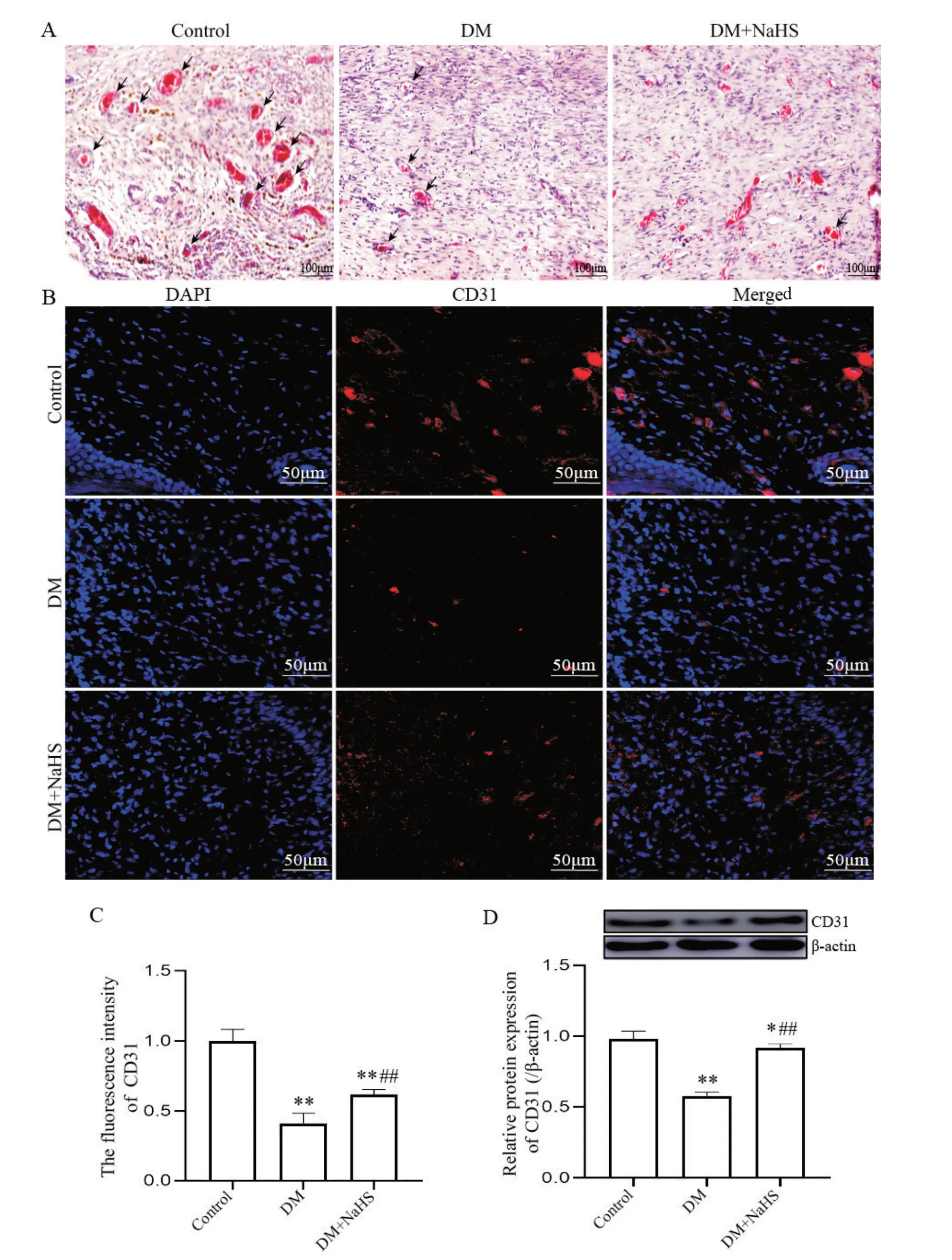
Figure 5. Angiogenesis of skin wound tissues of rats in each group. A: representative HE stained images of rat skin wound tissues in each group (scale bar=100 μm); B: representative immunofluorescence staining images of CD31 in skin wound tissues of each group (red represents CD31,while blue represents nuclei stained with DAPI; scale bar=50 μm); C: fluorescence intensity comparison of CD31 in rat skin wound tissues of each group; D: comparison of relative expression of CD31 in rat skin wound tissues of each group. Mean±SD. n=6. *P<0.05,**P<0.01 vs cntrol group; ##P<0.01 vs DM group.图5 各组大鼠皮肤创面组织血管生成比较
5 NaHS对皮肤创面组织血管内皮细胞自噬的影响
血管内皮细胞自噬检测如图6A、6B 所示,与control 组相比,DM 组CD31+/beclin-1+阳性细胞增多(P<0.01);经NaHS 干预后,DM+NaHS 组CD31+/beclin-1+阳性细胞显著减少(P<0.01),但仍多于control组(P<0.01)。

Figure 6. Comparison of endothelial autophagy in rat skin wound tissues of each group. Representative immunofluorescence staining images of CD31 and beclin-1 in rat skin wound tissues of each group (red and green represent beclin-1 and CD31,respectively,while blue represents nuclei stained with DAPI; scale bar=100 μm) and comparison of the number of CD31+/beclin-1+ cells. Mean±SD. n=6. **P<0.01 vs control group; ##P<0.01 vs DM group.图6 各组大鼠皮肤创面组织血管内皮细胞自噬比较
Western blot 结果如图7A~7D 所示,与control 组相比,DM 组P62 表达水平降低(P<0.01),LC3-II/LC3-I和beclin-1表达显著升高(P<0.01);经NaHS干预后,DM+NaHS 组P62 表达升高(P<0.01),LC3-II/LC3-I 和beclin-1 表达显著降低(P<0.01),但未恢复到control组水平(P<0.05)。

Figure 7. Comparison of the expression of autophagy-related proteins in skin wound tissues of each group. Mean±SD. n=6. *P<0.05,**P<0.01 vs control group; ##P<0.01 vs DM group.图7 各组大鼠皮肤创面组织自噬相关蛋白表达比较
6 NaHS对皮肤创面组织血管内皮细胞凋亡的影响
血管内皮细胞凋亡检测如图8A、8B 所示,与Control 组相比,DM 组CD31+/TUNEL+阳性细胞增加(P<0.01);经NaHS 干预后,DM+NaHS 组CD31+/TUNEL+阳性细胞显著减少(P<0.01),但仍高于control组水平(P<0.01)。创面组织caspase-3 和PI 染色如图8C~8F 所示,与control 组相比,DM 组caspase-3 和PI 荧光强度增加(P<0.01);经NaHS 干预后,DM+NaHS 组caspase-3 和PI 荧光强度显著降低(P<0.01),但仍高于Control组水平(P<0.01)。
7 NaHS对皮肤创面组织凋亡相关蛋白表达的影响
Western blot 结果如图9A、9B 所示,与control 组相比,DM 组创面组织Bcl-2 表达降低(P<0.01),Bax表达升高(P<0.01);经NaHS 干预后,DM+NaHS 组Bcl-2表达升高(P<0.01),Bax表达降低(P<0.01),但未恢复到control组水平(P<0.05)。
8 NaHS对PI3K/Akt/mTOR通路蛋白表达的影响
Western blot 结果如图10A~10D 所示,与control组相比,DM 组p-PI3K/PI3K、p-Akt/Akt、p-mTOR/mTOR 比值均显著降低(P<0.01);经NaHS 干预后,DM+NaHS 组p-PI3K/PI3K、p-Akt/Akt、p-mTOR/mTOR比值均显著升高(P<0.01),但未恢复到control 组水平(P<0.05)。
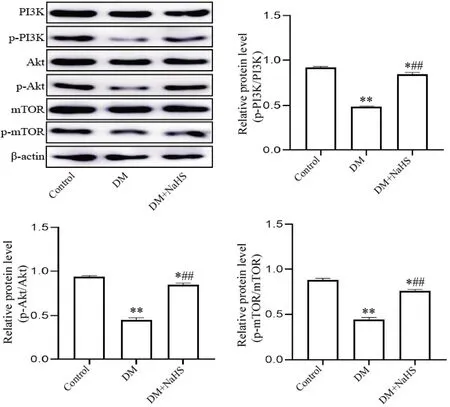
Figure 10. Comparison of the expression of PI3K/Akt/mTOR signaling pathway-related proteins in rat skin wound tissues of each group. Mean±SD. n=6. *P<0.05,**P<0.01 vs control group; ##P<0.01 vs DM group.图10 各组大鼠皮肤创面组织PI3K/Akt/mTOR信号通路相关蛋白表达的比较
讨 论
DM 患者长期高血糖状态会引起全身小动脉和终末微小血管硬化,造成组织缺血缺氧易诱发溃疡创面形成。由于氧化应激、慢性炎症、微小血管病变等原因,DM 患者皮肤创面难以治愈,严重会发生坏疽导致截肢甚至危及生命。目前,DM 患者皮肤溃疡尚无有效的治疗手段。一些新兴的治疗方法,如干细胞治疗、新型合成生物材料、生长因子疗法等均存在治疗成本高、免疫原性等局限性。因此,亟需探索安全、有效的治疗措施促进DM创面的愈合。
H2S 作为一种新型气体信号分子,在抗炎、抗氧化和抗凋亡多个方面发挥调节作用[12]。研究显示,H2S 能够抑制炎症反应和氧化应激,缓解1 型DM 小鼠的焦虑样行为[13],减轻高血糖引起的动脉粥样硬化[14]。在哺乳动物,H2S主要由两种5'吡哆醛磷酸依赖酶,即CSE 和胱硫醚β-合成酶催化合成[15]。本研究结果显示,DM 大鼠皮肤创面组织H2S 含量和CSE蛋白水平均显著降低,提示DM创面延迟愈合可能与H2S 合成受损有关。基于H2S 参与调节机体多种病理生理过程,我们推测,NaHS能够增加DM 大鼠皮肤创伤组织H2S 含量,上调创面组织CSE 蛋白表达,改善或促进DM大鼠皮肤创面愈合。
自噬是一种依赖溶酶体的分解代谢过程,对维持机体内环境稳态起着重要作用[16]。LC3、P62和beclin-1 蛋白是自噬形成过程中的关键蛋白。当自噬激活时,胞浆中LC3-I 被转化为LC3-II,后者在溶酶体分解代谢转化为LC3-I。P62作为一种自噬特异性底物,与LC3 相互作用进入自噬体内,被溶酶体降解。P62蛋白降低的同时伴随LC3-II蛋白上调,提示自噬活性增加[17]。有研究报道,血管紧张素IV 通过抑制FoxO1 诱导的自噬,减轻DM 小鼠心肌损伤[18]。研究显示,自噬在DM 创面愈合的炎症期、增殖期和组织重建期发挥重要作用,自噬增强或抑制可导致细胞凋亡,不利于DM创伤的恢复[19]。本研究结果显示,DM 大鼠皮肤创面组织内皮细胞自噬活性显著增强,创面组织LC3-II/LC3-I 和beclin-1 表达增加,P62表达减少,提示DM大鼠皮肤创面组织内皮细胞自噬过度激活,给予外源性H2S能够抑制创面组织内皮细胞的自噬活性,促进DM大鼠创面组织血管形成和创面愈合。
自噬和凋亡为调控细胞生物学功能的两种基本分子机制,其信号分子通过各种关联和干扰,影响多种疾病的病理生理过程,如冠心病等[20]。索拉非尼可通过髓样细胞白血病1 激活beclin-1 诱导肝癌细胞自噬性死亡[21]。caspase-3 家族蛋白是细胞凋亡的重要效应因子,为细胞凋亡的执行蛋白,其激活预示着凋亡进入不可逆转阶段[22]。Bax 是机体中重要的凋亡基因之一,具有促进细胞凋亡的作用。Bcl-2 是一种抗凋亡蛋白,可维持线粒体膜的完整性,阻止促凋亡蛋白释放,发挥抗凋亡作用[23]。本研究结果显示,DM 大鼠皮肤创面组织内皮细胞凋亡数量显著增多,caspase-3 和Bax 表达增加,Bcl-2 表达减少,推测可能与自噬过度激活有关。然而,NaHS 能够减轻DM 大鼠创面组织血管内皮细胞自噬和凋亡,发挥抗凋亡作用,促进皮肤创面的愈合。
PI3K/Akt/mTOR 是调控细胞自噬的信号通路,参与细胞增殖、分化和凋亡过程。本研究结果显示,DM 大鼠皮肤创面组织PI3K/Akt/mTOR 信号通路蛋白表达显著降低。由此推测,PI3K/Akt/mTOR 信号通路可能参与DM皮肤创面的愈合过程。研究表明,半胱氨酸通过激活Akt/PI3K/mTOR 通路减轻内质网应激和炎症反应,改善高糖诱导的人脂肪基质干细胞代谢异常[24]。此外,有研究报道胰高血糖素样肽1受体激动剂可激活PI3K/Akt/mTOR 信号通路减轻高糖诱导的髓核细胞损伤[25]。本研究结果显示,NaHS干预能够上调DM 大鼠皮肤创面组织PI3K/Akt/mTOR 通路蛋白表达,增加创面组织毛细血管密度,提高创面愈合率,促进DM大鼠皮肤创面愈合。由此推测,H2S 可能通过调节PI3K/Akt/mTOR 信号通路,减轻创面组织血管内皮细胞自噬及凋亡,发挥促进DM创伤愈合的作用。
综上所述,H2S 能够促进DM 大鼠皮肤创面愈合,其作用机制可能与激活PI3K/Akt/mTOR 信号通路,抑制血管内皮细胞自噬及凋亡,促进创面组织血管形成有关。本研究为DCU治疗提供了新的实验依据,但实验结果均为体内研究,下一步将采用细胞模型进一步探讨H2S可能激活的信号通路及分子机制。
