miR-184通过TIMP-2/MMP-14促进PNX模型中代偿性肺生长*
2024-01-17向旭东王忠慧王琼川邵世豪马维浩朱波波
彭 静,向旭东,王忠慧,王琼川,邵世豪,马维浩,朱波波,赵 力△
[1昆明医科大学第三附属医院(云南省肿瘤医院)麻醉科,云南 昆明 650118;2昆明医科大学第三附属医院(云南省肿瘤医院)胸外科,云南 昆明 650118]
代偿性肺生长(compensatory lung growth,CLG)是指在某种原因导致肺组织受损时,身体通过增加肺组织的数量或改变肺组织的结构来适应呼吸功能的需要[1]。CLG可以通过多种途径实现,包括细胞增殖、肺泡扩张和血管重塑等[2]。这些途径可以增加肺组织的表面积,提高气体交换效率,从而改善呼吸功能。研究显示,成人在接受右肺切除术后发生了CLG 现象[3]。而且在大多数成年哺乳动物的肺切除术(pneumonectomy,PNX)模型中,手术切除肺组织也会导致剩下的肺快速生长[4]。在CLG 过程中,其余肺叶的肺泡上皮细胞增殖与肺重量增加和网络重建有关[2]。虽然对于调节CLG 的分子机制依旧还没有明确的解释,但它可能为治疗肺部疾病和肺组织工程提供重要线索。
微小RNA(microRNA,miRNA,miR)是真核生物中一个由19~24个核苷酸组成的小非编码RNA 家族,可在转录后水平后调节基因[5]。有研究表明,miRNAs 可以调节肺细胞增殖、分化、凋亡、肺泡化、血管生成和血管化[6-7]。探索miRNAs 在肺发育/损伤中的作用渐渐成为研究热点。研究显示,miRNAs 家族中的miR-184 在非小细胞肺癌中低表达,可作为非小细胞肺癌的潜在治疗靶点[8]。还有研究观察到miR-184 在EGFR 突变的非小细胞肺癌脑转移患者中高表达,可用于非小细胞肺癌脑转移的新生物标志物[9]。但目前尚不清楚miR-184 在肺发育中的生理和病理功能。基质金属蛋白酶14(matrix metalloproteinase-14,MMP-14)是一种金属蛋白酶,主要参与细胞外基质的代谢和重塑过程,在发育、组织修复和炎症等生理和病理过程中发挥着重要作用。研究显示,PNX 诱导的肺毛细血管内皮细胞激活VEGFR2 和FGFR1,可触发MMP-14 的产生,进而刺激上皮细胞的扩张[10]。此外,MMP-14的活性还受到金属蛋白酶组织抑制物2(tissue inhibitor of metalloproteinase-2,TIMP-2)的调控,TIMP-2 作为一种天然的抑制物,其主要作用是调节金属蛋白酶的活性,以维持细胞外基质的稳态[11]。那么,miR-184在肺发育中的作用是否通过TIMP-2/MMP-14 通路来实现,目前尚不清楚。本研究通过切除小鼠左肺构建PNX动物模型,以及进行体外实验,探讨miR-184 的作用及其与TIMP-2/MMP-14通路的关系。
材 料 和 方 法
1 实验对象
1.1 临床样本 从昆明医科大学第三附属医院收集了16 例多原发肺癌(multiple primary lung cancer,MPLC)患者和肺叶切除术后恢复较好患者(CLG)的肺组织样本,在任何与研究有关的程序之前,已获得所有个体参与者的知情同意并获得了云南省肿瘤医院伦理委员会的批准(伦理号:KYCS2022141)。
1.2 动物 从湖南斯莱克景达实验动物有限公司获得20 只8 周龄SPF 级的雄性C57BL/6J 小鼠(体重20~22 g),许可证号为SCXK(湘)2019-0004。所有动物实验的操作获得了昆明医科大学动物伦理委员会的批准(实验动物伦理号:kmmu2020272)。
1.3 细胞 人肺泡上皮细胞从深圳豪地华拓生物科技有限公司获得,并培养于含10%胎牛血清和1%青霉素-链霉素双抗的DMEM 培养液(HyClone)中,置于37 ℃、5% CO2恒温孵育箱中培养。
2 实验分组与处理
2.1 动物分组(n=5) PNX 组:在麻醉诱导室中用4.0%异氟烷麻醉小鼠后,用乙醇和碘溶液处理好左胸,沿左侧腋前线切开皮肤;在第5 肋间隙处开胸进入左肺,并用4-0 丝缝线(Ethicon)结扎肺门;用PDS缝线缝合胸廓切口和皮肤切口,然后皮下注射3 mL温生理盐水进行复苏;术后皮下注射单剂量丁丙诺啡缓释剂(3.25 mg/kg)镇痛。PNX+miR-184 mimic组:术后将miR-184 mimic 慢病毒(1.5×108TU/mL,200 μL;上海吉玛基因公司)通过尾静脉注射入PNX小鼠体内。在第4 天对小鼠进行肺功能测定后,将小鼠进行脱颈处死,取肺组织进行相关指标的测定。
2.2 细胞分组(n=3) 将人肺泡上皮细胞在24孔板中培养过夜,待细胞密度达到60%~70%左右时,根据Lipofectamine 3000(Invitrogen)说明书将NC-mimic、miR-184 mimic、OE-NC 和OE-TIMP-2(上海吉玛基因公司)以终浓度100 nmol/L 按分组转染至细胞中,于37 ℃、5% CO2培养箱中培养48 h,并检测转染效率。
3 主要实验方法
3.1 肺功能测定和肺组织病理学观察 (1)在术后第4 天,参考前人的方法[12],用异氟烷麻醉小鼠,从颈部中线切口切开气管;用20 号空心针插入气管,随后将其连接到flexiVent 系统(SCIREQ);总肺活量和肺顺应性由压力-容积环路得出。(2)取出剩余的右肺,用10%福尔马林在30 cmH2O 下充气,通过水置换法测量肺容量来评估肺生长[13]。所有参数都根据体重进行归一化处理。(3)取肺组织置于4%甲醛溶液中,固定48 h;常规脱水、石蜡包埋、制备组织切片,厚度约为5 μm;进行HE 染色;自然晾干后,于光镜下观察肺组织病理学变化并拍照。
3.2 RT-qPCR 实验 使用Trizol 试剂(Invitrogen)分别提取肺组织和人肺泡上皮细胞中的总RNA,采用First-Strand cDNA 合成试剂盒(武汉君诺德生物技术有限公司)将RNA 逆转录合成cDNA,使用SYBR Green实时荧光定量PCR 试剂盒(北京索莱宝科技有限公司)进行实时荧光定量PCR,以GAPDH 和U6 为内参照,结果采用2-ΔΔCt法计算。引物序列见表1。

表1 RT-qPCR引物序列Table 1. Sequences of the primers for RT-qPCR
3.3 Western blot实验 用含1%蛋白酶抑制剂和磷酸酶抑制剂的RIPA缓冲液(Sigma-Aldrich)提取人肺泡上皮细胞和肺组织中的蛋白;根据BCA 检测试剂盒(Thermo Fisher)说明书测定蛋白浓度;总蛋白通过SDS-PAGE 分离,再转移到PVDF 膜(Millipore)上,然后用5%脱脂奶粉在室温下封闭1.5 h;加入稀释过的Ⅰ抗[MMP-14抗体(1∶2 000; ab51074)、TIMP-2抗体(1∶1 000; ab180630)和GAPDH 抗体(1∶1 000;ab9485)均购自Abcam],4 ℃下过夜;将膜与Ⅱ抗(1∶4 000; ab97051,Abcam)在室温下孵育1 h;用增强化学发光试剂盒(Millipore)显色;最后用ImageJ软件对条带进行半定量分析。
3.4 细胞增殖检测 (1)将人肺泡上皮细胞(每孔5×103个)接种在96 孔板中,在37 ℃、5% CO2培养箱中培养24 h;按分组处理各组细胞;处理结束后每孔加入10 μL CCK-8 试剂;用酶标仪在450 nm 处测量每孔吸光度。(2)将细胞以每孔1×103个的密度接种在6 孔板中,连续培养2 周以形成集落;每孔加入5 mL 4%多聚甲醛并孵育15 min;随后用甲醇固定菌落并用Giemsa 染色试剂盒染色15 min;用自来水洗涤后,观察各组细胞集落形成情况。
3.5 双萤光素酶基因报告实验 通过TargetScan 和miRDB 数据库预测miR-184 和TIMP-2 的结合位点。将含有miR-184 结合位点的TIMP-2 3'-UTR 克隆至pGL3 载体(Promega),构建野生型(wild-type,WT)TIMP-2载体。采用定点诱变试剂盒产生突变型(mutant,MUT)TIMP-2 载体。采用Lipofectamine 3000 将WT 或MUT 与miR-184 mimic 或NC-mimic 共 转染 至293T细胞。48 h后采用双萤光素酶报告分析系统检测萤光素酶活性。
4 统计学分析
使用GraphPad Prism 8 软件分析数据。所有数据用均数±标准差(mean±SD)表示。所有实验至少重复3 次。采用单因素方差分析和t检验来进行统计学分析。以P<0.05为差异有统计学意义。
结 果
1 miR-184 在肺叶切除术后恢复较好的患者中高表达
RT-qPCR 结果显示,miR-184 在MPLC 患者癌组织中低表达,而在肺叶切除术后恢复较好的患者(CLG)肺组织中高表达(P<0.01),见图1。
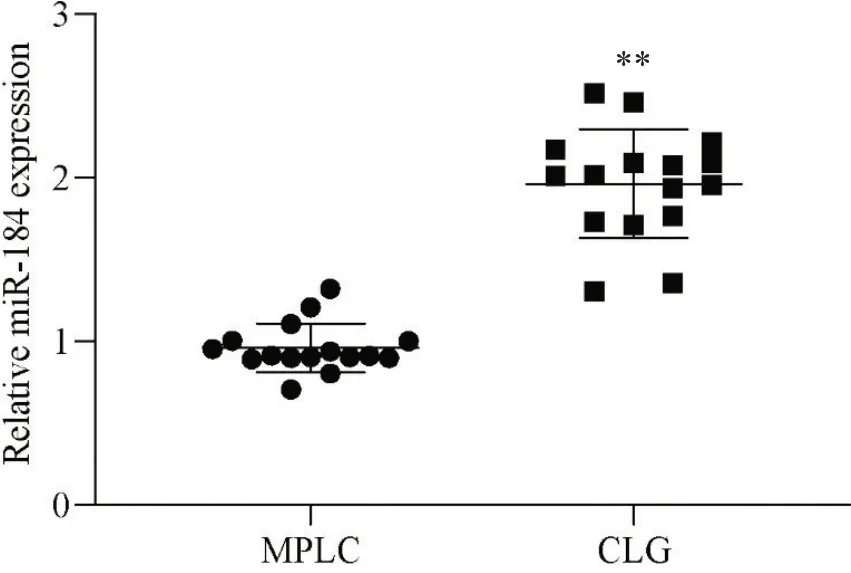
Figure 1. miR-184 was highly expressed in multiple primary lung cancer (MPLC) patients with good recovery (compensatory lung growth,CLG) after lobectomy. RT-qPCR was used to measure the expression of miR-184 in tissues. Mean±SD. n=16. **P<0.01 vs MPLC.图1 miR-184在肺叶切除术后恢复较好的患者中高表达
2 过表达miR-184促进人肺泡上皮细胞增殖
miR-184 mimic 的转染效率检测结果显示,与NC-mimic 组相比,miR-184 mimic 组的miR-184 表达量显著上调(P<0.01),见图2A。接着检测MMP-14的表达显示,与NC-mimic 组相比,miR-184 mimc 组MMP-14的mRNA和蛋白表达显著上调(P<0.01),见图2B、C。最后CCK-8 和集落形成实验结果显示,miR-184 mimic 的转染显著提高人肺泡上皮细胞活力并促进其增殖(P<0.01),见图2D、E。

Figure 2. Overexpression of miR-184 promoted the proliferation of human alveolar epithelial cells. A: RT-qPCR was used to measure the transfection efficiency of miR-184 mimic in the cells; B: RT-qPCR was used to measure the mRNA expression of MMP-14 in the cells; C: Western blot was used to determine the protein expression of MMP-14 in the cells; D: CCK-8 assay was used to measure the viability of human alveolar epithelial cells; E: the proliferation of human alveolar epithelial cells was determined by colony formation assay. NC: normal control. Mean±SD. n=3. *P<0.05,**P<0.01 vs negative control mimic(NC-mimic) group.图2 过表达miR-184促进人肺泡上皮细胞增殖
3 miR-184靶向抑制TIMP-2的表达
通过TargetScan 和miRDB 数据库预测miR-184的靶向结合关系,确定TIMP-2 是miR-184 的下游靶标,见图3A。同时,双萤光素酶报告基因实验证实,miR-184可靶向调控TIMP-2的表达,见图3B。TIMP-2 表达的检测结果显示,与NC-mimic 组相比,miR-184 mimic 组人肺泡上皮细胞中TIMP-2 的表达显著下调(P<0.01),见图3C、D。

Figure 3. miR-184 achieved targeted inhibition of TIMP-2 expression. A: the target binding relationship of miR-184 and TIMP-2 predicted by TargetScan and miRDB; B: dual-luciferase reporter assay was used to verify whether miR-184 regulated the expression of TIMP-2; C: TIMP-2 mRNA expression was measured by RT-qPCR; D: TIMP-2 proptein expression was determined by Western blot. NC: negative control; WT: wild-type; MUT: mutant. Mean±SD. n=3. **P<0.01 vs NC-mimic group.图3 miR-184靶向抑制TIMP-2的表达
4 过表达TIMP-2 减弱miR-184 mimic 对人肺泡上皮细胞增殖的促进作用
OE-TIMP-2 转染效率检测结果显示,与OE-NC组相比,OE-TIMP-2 组人肺泡上皮细胞中TIMP-2 表达量显著上调(P<0.01),见图4A。TIMP-2表达的检测结果显示,与NC 组相比,miR-184 mimic 组TIMP-2的表达显著下调(P<0.01),而OE-TIMP-2 组TIMP-2的表达显著上调(P<0.01 或P<0.05);与miR-184 mimic 组相比,miR-184 mimic+OE-TIMP-2 组TIMP-2的表达显著上调(P<0.05),见图4B、C。MMP-14 表达的检测结果显示,与NC 组相比,过表达miR-184显著促进MMP-14 的表达(P<0.01),过表达TIMP-2则是显著抑制了MMP-14 的表达(P<0.05),且可显著逆转miR-184 mimic 对MMP-14 表达的促进作用(P<0.01 或P<0.05),见图4D、E。CCK-8 和集落形成实验结果显示,与NC 组相比,miR-184 mimic 的转染显著提高人肺泡上皮细胞活力并促进其增殖(P<0.01),而OE-TIMP-2 的转染则显著抑制人肺泡上皮细胞活力和增殖(P<0.05),且可显著逆转miR-184 mimic对细胞活力和增殖的促进作用(P<0.01),见图4F、G。

Figure 4. Overexpression of TIMP-2 attenuated the promotion of human alveolar epithelial cell proliferation by miR-184 overexpression. A: Western blot was used to determine the overexpression efficiency of TIMP-2 in the cells; B: RT-qPCR was used to measure the mRNA expression of TIMP-2 in the cells; C: the protein expression of TIMP-2 in the cells was determine by Western blot. D: RT-qPCR was used to measure the mRNA expression of MMP-14 in the cells; E: Western blot was used to determine the protein expression of MMP-14 in the cells; F: CCK-8 assay was used to determine the viability of the cells; G: the proliferation of the cells was determined by colony formation assay. NC: negative control; OE: overexpression. Mean±SD. n=3. *P<0.05,**P<0.01 vs OE-NC or NC group; #P<0.05,##P<0.01 vs miR-184 mimic group.图4 过表达TIMP-2减弱过表达miR-184对人肺泡上皮细胞增殖的促进作用
5 miR-184促进PNX后小鼠的肺功能恢复
小鼠肺功能检测结果显示,与PNX 小鼠相比,miR-184 mimic 的处理显著提高小鼠的肺容量、肺活量和肺顺应性(P<0.01),见图5A~C。HE 染色结果显示,与PNX 组相比,PNX+miR-184 mimic 组小鼠肺部细胞显著增多,见图5D。RT-qPCR 结果显示,与PNX 组相比,PNX+miR-184 mimic 组的miR-184 表达显著上调(P<0.01),见图5E。MMP-14 和TIMP-2 表达的检测结果显示,与PNX 组相比,PNX+miR-184 mimic 组小鼠肺组织中MMP-14 的表达量显著上调(P<0.01),TIMP-2 的表达量显著下调(P<0.01),见图5F、G。

Figure 5. miR-184 promoted the recovery of lung function in mice after pneumonectomy (PNX). A: mouse lung volume measurement; B: mouse total vital capacity measurement; C: mouse lung compliance measurement; D: HE staining was used to observe the pathological changes of mouse lung tissues (scale bar=100 μm); E: RT-qPCR was used to measure the expression of miR-184 in mouse lung tissues; F: Western blot was used to determine the protein expression of TIMP-2 and MMP-14 in mouse lung tissues; G: RT-qPCR was used to measure the mRNA expression of TIMP-2 and MMP-14 in mouse lung tissues. Mean±SD. n=5. **P<0.01 vs PNX group.图5 miR-184促进PNX后小鼠的肺功能恢复
讨 论
MPLC 通常是指在肺部同时或相继出现两个或更多的独立原发癌症[14]。对于MPLC 患者,肺叶切除术是一种常见治疗方法。动物实验结果表明,在PNX 后,剩余的肺组织还会发生CLG,以弥补切除部分的功能[15]。CLG 可以通过肺容积的增加、肺组织的重塑和肺功能的提高来实现[16]。目前关于CLG 机制的研究较少,本研究确认了一种与CLG 发生的新的分子机制,即miR-184可以通过调控TIMP-2/MMP-14改善PNX后小鼠肺功能。
miRNA 是基因表达的关键调节因子,参与多种细胞的生物功能调节[17]。目前已有很多关于miR-184 研究的报导。如Rao 等[18]的研究显示,miR-184在肺腺癌中低表达,过表达miR-184 能有效抑制肺腺癌细胞的增殖、迁移和侵袭。Wu 等[19]的研究显示,促进miR-184 表达可以抑制非小细胞肺癌细胞的增殖和顺铂耐药性。此外,还有研究显示miR-184作为小细胞肺癌的肿瘤抑制因子,能在体外抑制小细胞肺癌细胞的迁移和侵袭[20]。但并未有miR-184对CLG 影响的相关报道。本研究观察到miR-184 在肺叶切除术后CLG 的MPLC 患者中显著高表达。miR-184 的差异表达让我们猜想其可能在CLG 中发挥重要作用。通过在人肺泡上皮细胞中转染miR-184 mimic 观察miR-184 的作用,发现miR-184 mimic的转染可以有效促进人肺泡上皮细胞增殖。本研究观察到的miR-184 对细胞增殖的作用与前人研究不同,可能是前人的研究集中在癌细胞上,而本研究集中在正常细胞中,由此可见miR-184作用广泛。
本研究进一步探究miR-184 调控人肺泡上皮细胞增殖的下游机制。通过生物信息网站预测到TIMP-2 是miR-184 的下游靶标。此外,研究显示肺损伤后细胞外基质的重塑依赖于降解胶原的MMP及其内源性抑制剂TIMP[21]。因此我们推测TIMP-2可能也在CLG 进程中有重要作用。Yang 等[22]报道,miR-550a-3p 可以通过下调TIMP-2 促进非小细胞肺癌细胞增殖和转移。本研究观察到miR-184 靶向负调控TIMP-2,并且miR-184 mimic对人肺泡上皮细胞增殖的促进可以被过表达TIMP-2 所逆转。这表明miR-184 通过靶向负调控TIMP-2 促进人肺泡上皮细胞增殖,与既往研究表现出一致的miRNA 调控TIMP-2进而影响疾病进程的调控机制。
此外,TIMP-2 作为MMP 的内源性抑制剂之一[23],其抑制人肺泡上皮细胞增殖的作用可能是通过调控MMP 实现的。已有研究表明,下调MMP-14能抑制肺癌细胞的增殖、迁移和侵袭[24]。在Ding等[25]的研究中,在PNX 之后,抑制MMP-14 的表达干扰了肺泡的再生。而且McLaughlin 等[26]的研究表明,TIMP-2 能通过抑制MMP-14 表达,抑制乳腺癌细胞的侵袭。因此,我们同样检测了MMP-14在本研究中的表达情况,观察到过表达miR-184 显著促进MMP-14 的表达,而过表达TIMP-2 则显著抑制MMP-14 的表达。这表明TIMP-2 对人肺泡上皮细胞增殖的抑制作用是通过抑制MMP-14实现的。
总之,本研究揭示了miR-184 通过抑制TIMP-2促进MMP-14的表达,进而促进人肺泡上皮细胞增殖以及PNX后小鼠肺功能的恢复。然而本研究存在一定的局限性。首先,没有做关于MMP-14调控人肺泡上皮细胞生长的实验,未来需要进一步验证。其次,只在体外验证了miR-184/TIMP-2/MMP-14 信号通路对人肺泡上皮细胞的调控作用,并没有在动物体内完全验证整条信号通路,需要更多的体内实验来证明这一结论。
