通塞颗粒对AECOPD大鼠气道上皮屏障及EGFR/ERK 通路的影响*
2024-01-17魏焱鑫刘新光田燕歌刘学芳
魏焱鑫,魏 毓,刘新光,2,田燕歌,2,刘学芳,2,赵 迪,2,赵 鹏,2△
(1河南中医药大学呼吸疾病中医药防治省部共建协同创新中心,河南省中医药防治呼吸病重点实验室,河南 郑州 450046;2河南中医药大学中医药科学院,河南 郑州 450046)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种可预防可治疗的常见呼吸系统疾病,以持续呼吸道症状和气流受限为特征[1]。吸烟等有害物质暴露是诱发、加重疾病进展的重要因素,可增加患者对于细菌和病毒的易感性[2],导 致COPD 急 性 加 重(acute exacerbation of COPD,AECOPD)。AECOPD 以肺功能迅速下降、咳嗽咳痰增多、呼吸困难、生活质量恶化和死亡率显著升高为特征[3-5]。气道上皮细胞由闭锁小带蛋白1(zonula occludens-1,ZO-1)、闭 合 蛋 白(occludin,OCC)等紧密连接蛋白和上皮钙黏素(E-cadherin,ECad)等黏附连接蛋白构成一个连续的屏障结构,能够抵御空气过敏原、污染物和病原体等有害物质入侵,及时启动免疫应答清除有害物质[6],维持气道微环境稳态[7-8]。研究发现COPD 患者支气管上皮ZO-1、OCC和E-Cad表达降低,上皮屏障功能减弱[9-12];香烟烟雾抑制小鼠支气管上皮ZO-1 表达,损伤气道上皮屏障,诱导COPD 发生及其急性加重[13]。因此,保护气道上皮屏障是改善AECOPD的潜在途径。
中医药治疗AECOPD 具有一定优势,可明显减轻患者症状。AECOPD 多以实证类为主,其中痰热壅肺为常见证候,治法当以清肺化痰、降逆平喘为基本原则[14]。据此拟定的通塞颗粒(Tongsai granules,TSG)方药具有清热涤痰活血、宣肺降气平喘、扶正虚、祛邪实之功效。TSG 可有效减轻AECOPD 患者症状,改善肺功能,提高动脉血氧含量,抑制炎症反应[15-16],但其作用机制有待进一步阐释。本研究通过建立AECOPD 模型大鼠和香烟烟雾诱导气道上皮细胞屏障损伤模型,探讨TSG 保护气道上皮屏障缓解AECOPD的作用及其机制。
材 料 和 方 法
1 材料
1.1 动物 SD 大鼠24 只(雄性,6~8 周,200~240 g),购自北京维通利华实验动物有限公司,许可证号SYXK(Yu) 2020-0004。本研究通过河南中医药大学实验动物福利伦理审查委员会审查批准(伦理审查批号:DWLL202003210)。
1.2 细胞 人支气管上皮细胞BEAS-2B 购于上海子实生物有限公司。
1.3 香烟与细菌 红旗渠过滤嘴香烟(烤烟型,烟碱量1.0 mg,烟气一氧化碳含量11 mg,焦油量10 mg)由河南中烟工业有限责任公司生产。肺炎克雷伯杆菌(Klebsiellapneumoniae,Kp;菌株编号:46117)由中国医学细菌保藏管理中心提供。
1.4 药物 TSG由葶苈子、地龙、浙贝母、酒大黄、蜜麻黄、赤芍、矮地茶、人参、麦冬和石菖蒲组成,以上药材均购自瑞龙药业有限公司。莫西沙星(moxifloxacin,MXF)购自德国拜耳医药公司;硫酸沙丁胺醇(salbutamol,STL)购自江苏阿邦益生药业有限公司。
1.5 试剂 DMEM 高糖培养基(Solarbio);胎牛血清(Lonsera);PBS 和10% SDS-PAGE 凝胶试剂盒(雅酶)。ZO-1、E-Cad、OCC、表皮生长因子受体(epidermal growth factor receptor,EGFR)和GAPDH 抗体,以及辣根过氧化物酶标记的山羊抗兔IgG Ⅱ抗(Proteintech);细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)和 磷 酸 化ERK(phosphorylated ERK,p-ERK)抗体(Genetex);磷酸化EGFR(phosphorylated EGFR,p-EGFR)抗体(Cell Signaling Technology)。
2 方法
2.1 动物模型建立与分组 将SD大鼠24只随机分为control 组、model 组、TSG 组和MXF+STL 组。第1~8 周采用反复香烟烟雾(cigarette smoke,CS)暴露[(3 000±500)×10-6,每天2 次,每次30 min]联合Kp感染(6×1011CFU/L,每只100 μL,每5 d 一次)复制COPD 大鼠模型[17]。第9 周第3 天,经鼻滴入Kp(6×1017CFU/L,100 μL)建立AECOPD 大鼠模型。第9周第1~2 天和第4~7 天,control 组和model 组大鼠给予生理盐水灌胃,TSG 组给予TSG(生药8.01 g·kg-1·d-1,每天2 次)灌胃,MXF+STL 组给予MXF(36 mg·kg-1·d-1,每天1 次)和STL(1.08 mg·kg-1·d-1,每天1次)混合液灌胃[18]。药物灌胃剂量采用等效剂量(D)系数换算公式计算:D大鼠=D人×HI大鼠/HI人×(W大鼠/W人)2/3(HI:体积系数;W:体重)。第10 周第1 天,以2%戊巴比妥钠(40 mg/kg)腹腔注射麻醉大鼠,处死解剖后取左肺10%甲醛滴注15 min 后浸泡固定,取右肺组织检测相应指标(图1A)。

Figure 1. Flow chart of the animal experiments (A),and schematic diagram showing the preparation of the active ingredients of TSG(B). CS: cigarette smoke; Kp: Klebsiella pneumoniae; TSG: Tongsai granules.图1 动物实验流程和TSG活性部位制备
2.2 细胞模型建立与分组 BEAS-2B 细胞使用含10%胎牛血清的DMEM 高糖培养液于37 ℃、5% CO2环境下培养,以每皿1.5×105个接种于35 mm 培养皿12 h,待细胞密度达80%更换为DMEM 高糖培养基饥饿3 h,给予TSG 活性部位TSG1~5(100 mg/L)及TSG2(20、50和100 mg/L)作用3 h后,加入10% CS提取物(CS extract,CSE)作用24 h[19]。
2.3 复方药物及活性成分制备 TSG 采用水煎法和乙醇提取浓缩药液,冷冻干燥后获得浓缩药粉,每克干粉相当于原生药2.627 g,用于动物灌胃。将TSG 浓缩药粉溶于甲醇中,与大孔树脂混合,大孔树脂加入层析柱,分别使用0%、10%、30%、60%和90%乙醇冲洗获得活性部位TSG1~5(图1B)。通过蒸馏浓缩和冷冻干燥后,将提取液浓缩粉溶解于DMSO,成为100 g/L浓缩液,以备细胞实验用。
2.4 HE染色及免疫组化染色 HE染色观察肺组织结构损伤,免疫组化染色检测白细胞介素1β(interleukin-1β,IL-1β)、IL-6、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、基质金属蛋白酶2(matrix metalloproteinase 2,MMP2)和MMP9 的表达。使用Case-Viewer软件在×200视野下,每张肺组织切片随机选取6个肺泡及气道视野拍摄,通过Image-Pro Plus 6.0软件计算综合吸光度(integrated absorbance,IA)。
2.5 肺功能测定 第10周采用WBP 系统测定呼气峰流速(peak expiratory flow,PEF)。
2.6 免疫荧光染色 肺组织切片脱蜡封闭30 min后,孵育ZO-1 和OCC 抗体于4 ℃过夜,PBS 洗涤后使用荧光Ⅱ抗于室温孵育50 min,DAPI染色15 min后,封片在荧光显微镜下观察。使用CaseViewer 软件在×200 和×400 视野下,每张肺组织切片随机选取6个气道视野拍摄。
2.7 Western blot 制备肺组织匀浆及细胞裂解液上清,采用BCA 蛋白定量统一样本浓度,通过电泳、转膜和封闭后,孵育ZO-1、E-CA、OCC、p-EGFR、EGFR、p-ERK、ERK 和GAPDH 抗体于4℃过夜,1× TBST洗涤后室温孵育Ⅱ抗1 h后显影,检测蛋白表达。
2.8 网络药理学分析 采用UPLC-Q/TOF-MS/MS分析TSG2 所含成分,通过Swiss Target 数据库(http://www. swisstargetprediction. ch/)和PharmMapper 数据库(http://lilab-ecust. cn/pharmmapper/index.html)筛选成分潜在靶点,Genecard(https://www.genecards. org/)数据库鉴定AECOPD 相关基因,STRING数据库(https://string-db. org/)考察蛋白质相互作用(protein-protein interaction,PPI)网络及靶点相关KEGG通路,使用Cytoscape 3.9.1可视化结果数据。
3 统计学分析
通过SPSS 23.0 软件进行统计学分析。数据以均数±标准差(mean±SD)表示。采用单因素方差分析,方差齐者采用LSD-t法,方差不齐者采用Dunnett's T3法。以P<0.05为差异有统计学意义。
结 果
1 TSG减轻AECOPD大鼠肺组织病变
肺组织HE染色结果(图2A)显示,control组大鼠肺组织未见明显病理损伤;model组大鼠肺气管壁增厚,周围大量炎性细胞浸润,肺泡壁部分断裂融合,肺泡腔扩大并伴有炎性细胞浸润;与model 组比较,TSG 组和MXF+STL 组以上病理损伤均有所减轻。与control 组比较,model 组大鼠支气管壁厚度(bronchial wall thickness,BWT)和肺泡平均线性截距(mean linear intercept,MLI)显著升高,平均肺泡数(mean alveolar number,MAN)显著降低(P<0.01);与model 组比较,TSG 组和MXF+STL 组BWT 和MLI 均显著降低,MAN均显著升高(P<0.01),见图2B~D。
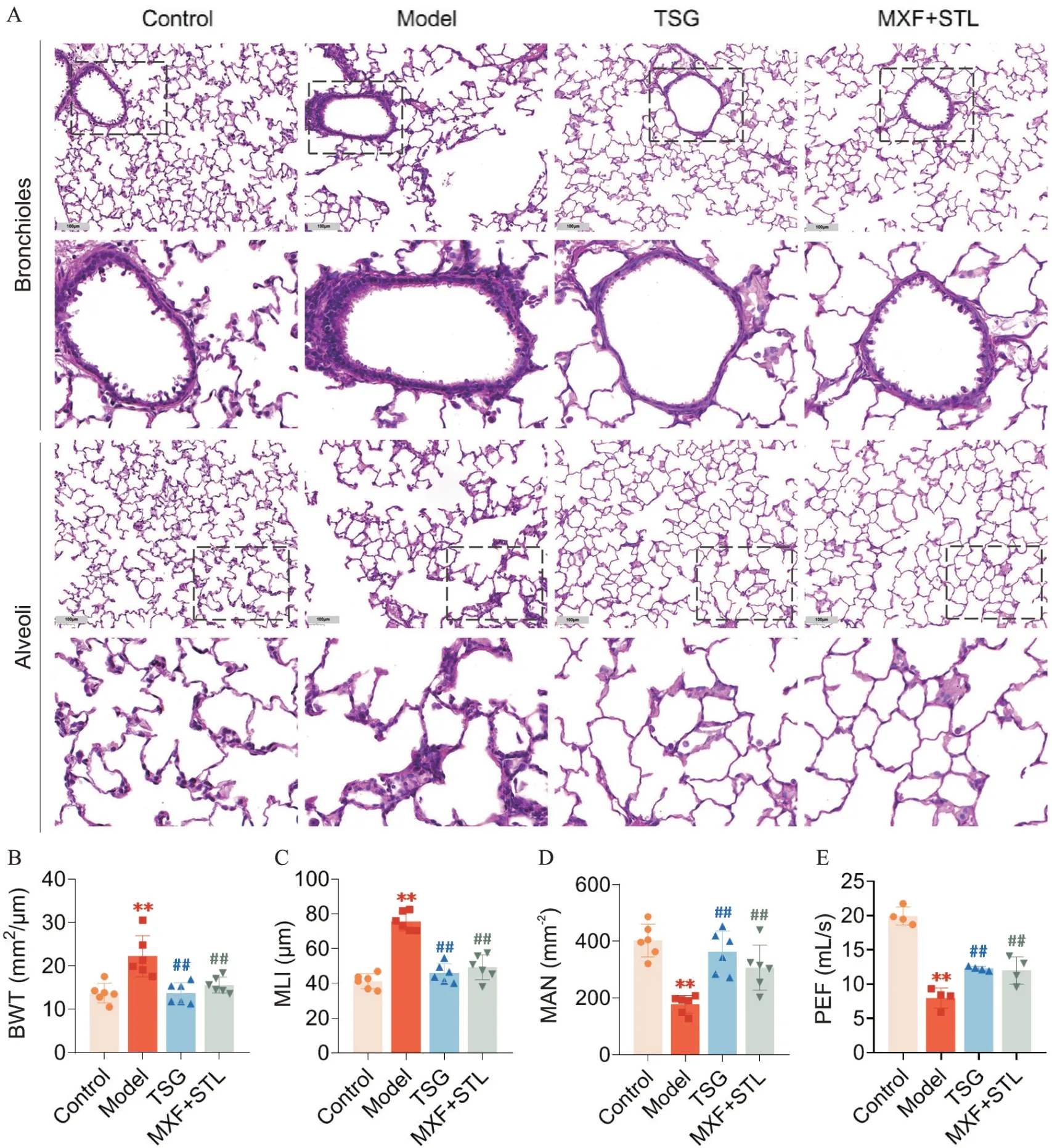
Figure 2. Tongsai granules (TSG) suppressed lung histopathological changes and improved lung function of the rats with acute exacerbation of chronic obstructive pulmonary disease. A: histopathologic changes of lung tissues at week 10 (HE staining,×200 and ×500): B,C and D: comparison of lung injury indicators,including bronchial wall thickness (BWT),alveolar mean linear intercept (MLI) and mean alveolar number (MAN); E: comparison of peak expiratory flow (PEF) at week 10.MXF: moxifloxacin; STL: salbutamol. Mean±SD. n=6. **P<0.01 vs control group; ##P<0.01 vs model group.图2 TSG减轻AECOPD大鼠肺组织病理变化并改善肺功能
2 TSG改善AECOPD大鼠肺功能
肺功能检测结果显示,与control 组比较,model组大鼠PEF 显著降低,(P<0.01);与model 组比较,TSG 组和MXF+STL 组大鼠PEF 显著上升(P<0.01),见图2E。
3 TSG 减少AECOPD 大鼠肺组织炎症因子及MMP表达
免疫组化结果显示,与control 组比较,model 组大鼠肺组织IL-1β、IL-6、TNF-α、MMP2 和MMP9 表达水平显著升高(P<0.05或P<0.01);与model组比较,TSG 组和MXF+STL 组大鼠肺组织IL-1β、IL-6、TNFα、MMP2 和MMP9 表达水平显著降低(P<0.05 或P<0.01),见图3。

Figure 3. Tongsai granules (TSG) inhibited the increases in the levels of inflammatory cytokines and matrix metalloproteases(MMPs) in lung tissues of AECOPD rats. The expression levels of interleukin (IL)-6,IL-1β,tumor necrosis factor (TNF)-α,MMP2 and MMP9 in lung tissues of rats were analyzed by immunohistochemistry (×200),and the integrated absorbance (IA) values were analyzed. MXF: moxifloxacin; STL: salbutamol. Mean±SD. n=6. *P<0.05,**P<0.01 vs control group; ##P<0.01 vs model group.图3 TSG降低AECOPD大鼠肺组织炎症因子及MMP表达
4 TSG 增加AECOPD 大鼠肺组织上皮连接蛋白表达
Western blot 结果显示,与control 组比较,model组大鼠肺组织ZO-1、E-Cad 和OCC 表达水平均显著降低(P<0.01);与model 组比较,TSG 组大鼠肺组织ZO-1、E-Cad和OCC 表达水平显著升高,MXF+STL 组ZO-1 和E-Cad 表达水平显著升高,OCC 表达水平显著下降(P<0.05 或P<0.01),见图4A。免疫荧光染色结果显示,model组大鼠肺组织上皮连接蛋白ZO-1和OCC 表达水平降低;与model 组相比,TSG 组和MXF+STL组ZO-1和OCC表达水平升高,见图4B。
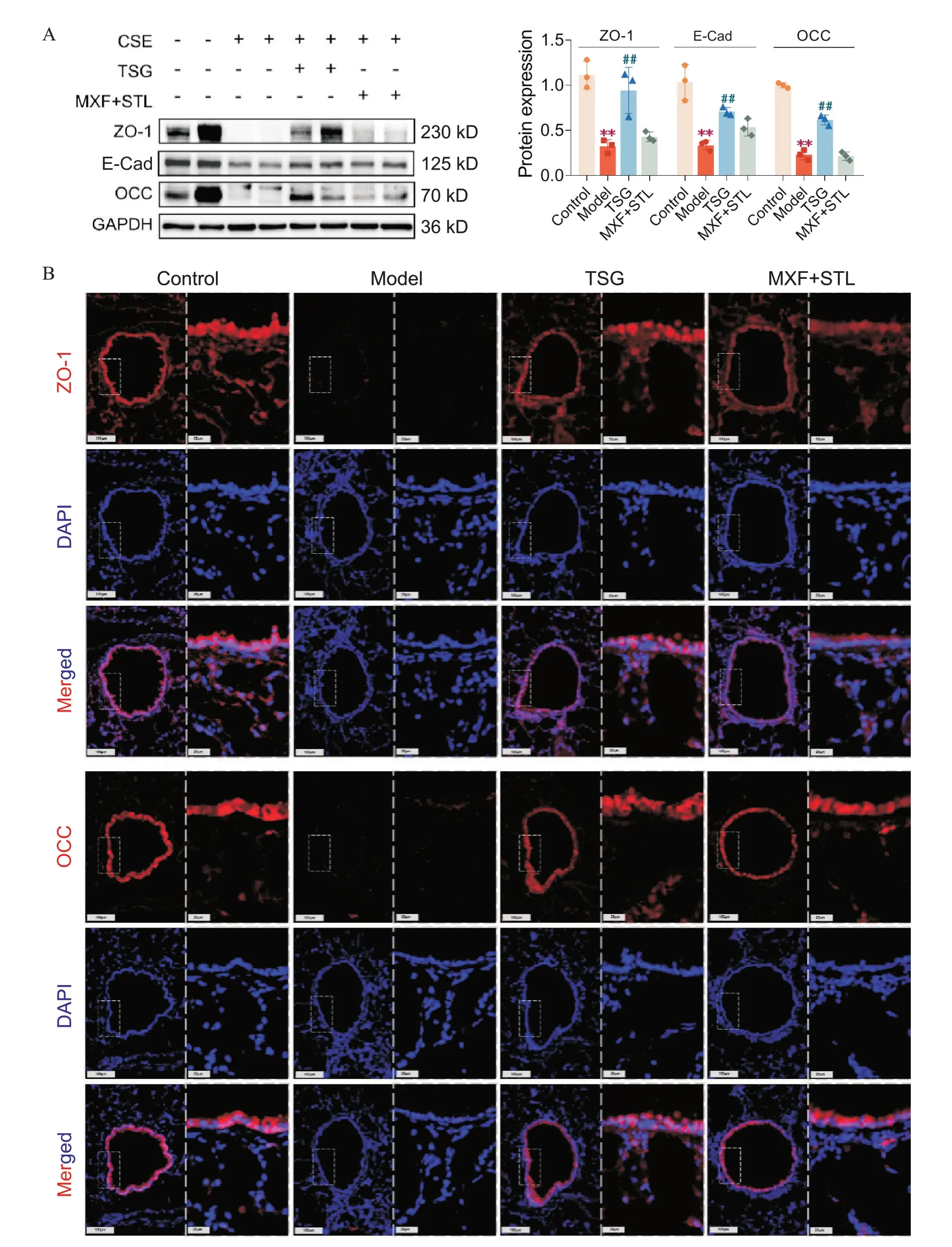
Figure 4. Tongsai granules (TSG) increased the expression of epithelial junction proteins in AECOPD rats. A: the protein levels of zonula occludens-1 (ZO-1),occludin (OCC) and E-cadherin (E-Cad) in lung tissues were detected by Western blot; B:the expression levels of ZO-1 and OCC in lung tissues were detected by immunofluorescence (×200 and ×400). MXF:moxifloxacin; STL: salbutamol. Mean±SD. n=6. **P<0.01 vs control group; ##P<0.01 vs model group.图4 TSG升高AECOPD大鼠肺组织上皮连接蛋白表达
5 TSG2显著升高支气管上皮细胞连接蛋白表达
如图5A 所示,TSG1~3可抑制CSE 诱导的BEAS-2B 细胞中ZO-1 表达水平降低,TSG1~4 可抑制OCC表达水平降低(P<0.01),其中TSG2 效果较好。TSG2(20、50 和100 mg/L)呈浓度依赖性地升高ZO-1和OCC表达水平(P<0.05或P<0.01),见图5B。
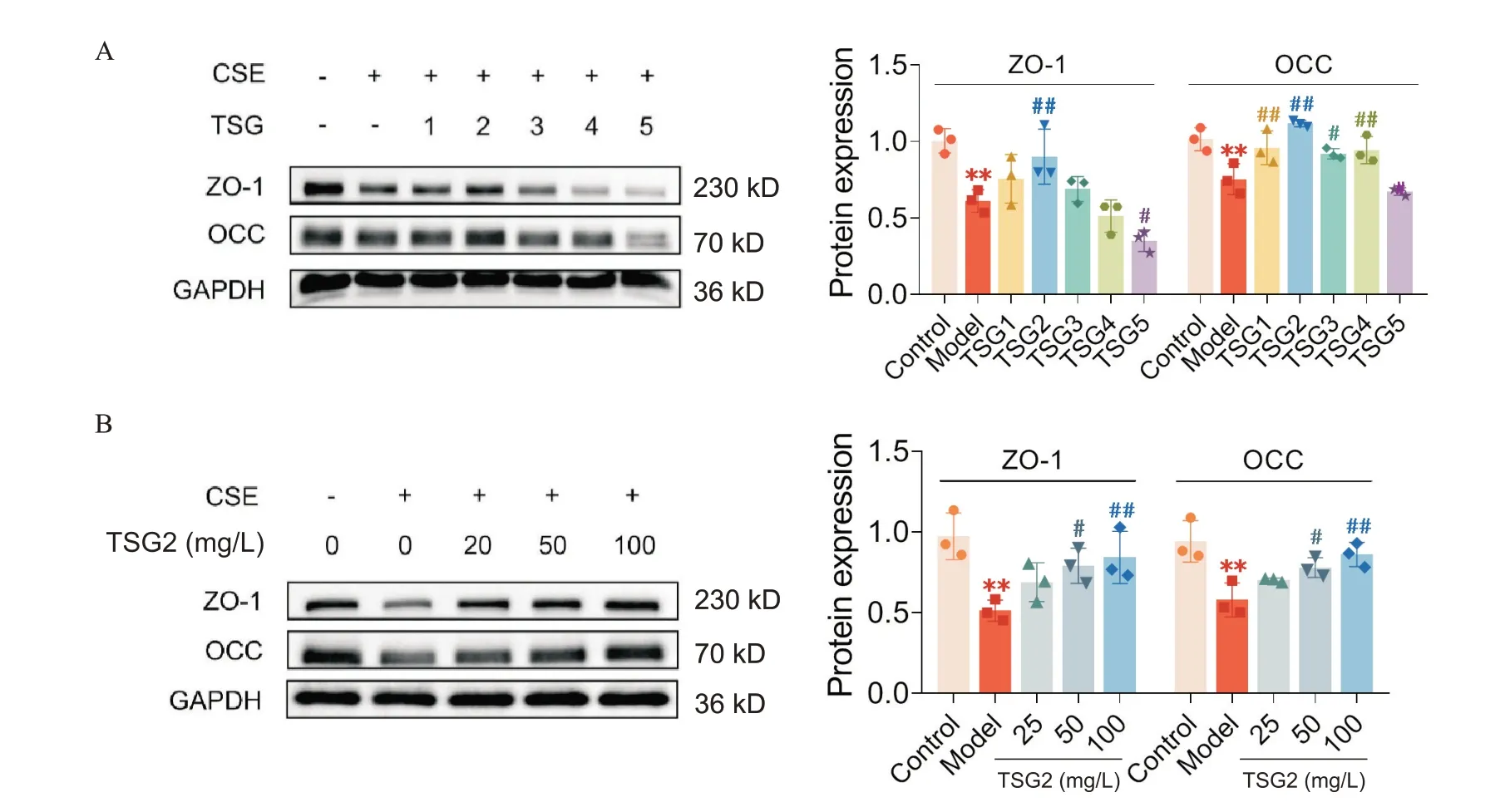
Figure 5. Treatment with TSG2 significantly increased the expression of zonula occludens-1 (ZO-1) and occludin (OCC) in bronchial epithelial cells. A: the protein levels of ZO-1 and OCC in the cells treated with TSG1~5 were detected by Western blot; B:the protein levels of ZO-1 and OCC in the cells treated with TSG2 (20,50 and 100 mg/L) were detected by Western blot.Mean±SD. n=3. **P<0.01 vs control group; #P<0.05,##P<0.01 vs model group.图5 TSG2显著增加支气管上皮细胞连接蛋白表达
6 TSG2干预AECOPD的网络药理分析
UPLC-Q-Extractive-Orbitrap MS 检 测TSG2 化 学成分,共发现33 种化合物(图6A)。通过检索Swiss Target 和PharmMapper 数据库获得3 种化合物麻黄碱、伪麻黄碱和岩白菜素的328 个靶点(图6B)。通过Genecard 疾病数据库获取AECOPD 相关疾病基因3 864 个。取328 个靶点和3 864 个疾病基因交集构建PPI 网 络,degree≥29 的 前20 个核心节点用于KEGG 通路富集分析(图6C、D)。分析结果表明,TSG2 调控多种信号通路,包括ERBB2、ERK、EGFR、interleukins和WNT等信号通路(图6E)。
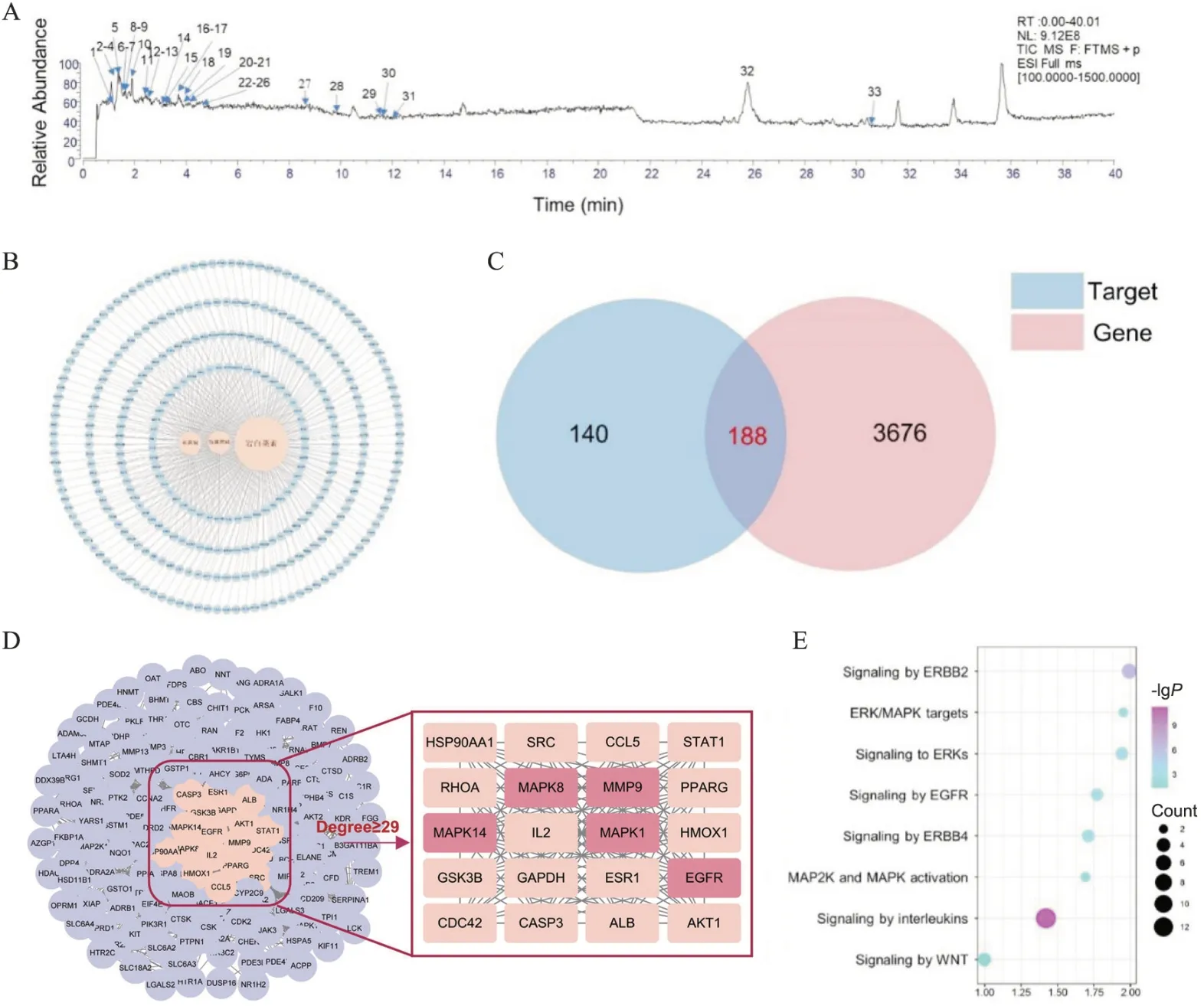
Figure 6. Network pharmacology analysis to elucidate the mechanism of TSG2 for the treatment of AECOPD. A: chemical composition of TSG2 determined by UPLC-Q-Extractive-Orbitrap MS; B: compound-target network composed of 3 compounds and 328 targets; C: Venn plot of 328 targets and 3 864 genes associated with AECOPD; D: the PPI network of targets and differently expressed genes constructed by STRING (pink circle: the top 20 nodes arranged by degree value); E: KEGG pathway analysis of the top 20 nodes.图6 TSG2干预AECOPD的网络药理分析
7 TSG2抑制EGFR/ERK 信号活化
Western blot 结果显示,与control 组比较,model组细胞p-EGFR 和p-ERK 蛋白水平均显著升高(P<0.01);与model 组比较,TSG2(20、50 和100 mg/L)可显著降低p-EGFR 和p-ERK 蛋白水平(P<0.05 或P<0.01),见图7。
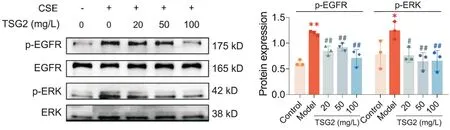
Figure 7. Treatment with TSG2 inhibited epidermal growth factor receptor(EGFR)/extracellular signal-regulated kinase(ERK) signaling pathway in bronchial epithelial cells exposed to cigarette smoke extract (CSE). The protein levels of p-EGFR and p-ERK were determined by Western blot. Mean±SD. n=3. *P<0.05,**P<0.01 vs control group; #P<0.05,##P<0.01 vs model group.图7 TSG2抑制CSE诱导的支气管上皮细胞EGFR/ERK 信号通路活化
讨 论
AECOPD 是导致COPD 患者肺功能急剧下降、疾病迅速恶化的主要原因[20-23]。现有治疗主要包括抗生素、支气管扩张剂和吸入糖皮质激素等药物,可有效减轻气道阻塞,缓解呼吸困难[24-27],但其作用有限且易导致免疫功能紊乱,增加再次感染风险。中医药治疗AECOPD 具有独特优势,可以有效减轻患者的症状,提高生活质量。TSG 是临床治疗AECOPD的有效方药,方中以葶苈子和地龙共为君药,清热祛痰、降气平喘通络;配合麻黄、大黄、赤芍、贝母等药合用,针对AECOPD 共奏清热祛痰活血、宣肺降气平喘、扶正虚、祛邪实之功效。本课题组前期临床试验证实,TSG 可有效减轻老年AECOPD 患者症状,改善其肺功能[15],降低TNF-α、IL-1β、IL-6 和IL-8 水平[16],同时降低血清I型胶原、可溶性细胞间黏附分子和E-选择素水平[28]。本研究发现,TSG 可改善AECOPD大鼠肺功能,减轻肺病理变化,抑制炎症反应,减少MMP表达等,这表明TSG可以有效缓解AECOPD。
气道上皮屏障结构是抵御外界刺激保护机体气道微环境稳定的重要屏障,在COPD 发生发展中扮演着重要的角色[29]。气道上皮细胞间连接方式主要包括紧密连接(tight junctions,TJs)和黏附连接(adherens junctions,AJs)[26]。TJs 环绕于支气管上皮细胞顶部,可限制上皮细胞通透性和维持组织内环境的稳定,由ZO-1 和OCC 等组成。AJs 位于紧密连接下方,执行稳定细胞粘附、调节肌动蛋白细胞骨架等多种功能,由E-Cad等蛋白等组成[26-27]。CS暴露可以诱发气道上皮屏障失调,增加COPD 患者细菌和病毒感染风险,导致免疫细胞募集和持续炎症[30]。研究表明,在COPD 患者支气管气道上皮中TJs 和AJs相关蛋白(包括ZO-1、E-Cad 和OCC)的表达下调,上皮屏障功能减弱[25,31]。本研究发现,AECOPD 大鼠气道上皮连接蛋白表达水平降低,TSG 治疗后可上调连接蛋白表达;此外CSE 可以直接诱导支气管上皮细胞BEAS-2B 连接蛋白表达水平降低,诱导屏障损伤,而TSG 可以直接作用于气道上皮保护屏障功能。因此,TSG 可以直接减轻CS 诱导的AECOPD 大鼠气道上皮屏障功能损伤。
TSG 由10味中药组成,成分复杂,不利于作用机制研究。本文采用大孔树脂分离柱将TSG 分成5 个活性部位,发现其中TSG2 显著抑制CSE 诱导的气道上皮细胞中连接蛋白表达降低,因此以TSG2 为代表探讨TSG 作用机制。通过质谱分析发现TSG2 含有33种化合物,将33种化合物通过检索Swiss Target 和PharmMapper数据库获得靶点共328个对应3种化合物(麻黄碱、伪麻黄碱和岩白菜素),再检索Genecard疾病数据库,获取AECOPD 相关疾病基因3 864 个。取328 个靶点和3 864 个疾病基因的188 个交集基因,构建PPI 网络,取degree≥29 的前20 个核心节点用于KEGG通路富集分析,涉及ERBB2、ERK、EGFR、interleukins 和WNT 等信号通路。研究表明,EGFR和ERK 在气道上皮屏障损伤中发挥重要作用,其中COPD 患者肺组织中EGFR、HER2 和ERK 磷酸化水平显著升高[33];CSE 激活小鼠肺组织ERK1/2 信号,破坏上皮屏障完整性[34];而ERK1/2 抑制剂U0126 和EGFR 抑制剂AG1478 可显著抑制CS 诱导的人支气管上皮细胞系中TJs 解离[35]。本研究发现,TSG2 可显著抑制CSE 诱导的支气管上皮细胞中EGFR/ERK信号通路激活。因此,TSG 保护气道上皮屏障可能与抑制EGFR/ERK信号通路有关。
综上所述,TSG 可有效减轻AECOPD 大鼠肺组织病变,改善肺功能,抑制炎症反应,保护气道上皮屏障功能,可能与EGFR/ERK 信号通路相关。本研究为TSG的临床应用提供理论依据。
