疏肝祛瘀解毒方介导p53通路诱导铁死亡抑制裸鼠肝癌生长的研究*
2024-01-17蔡晓钧杨仁义王智槟朱姝静
李 菁,蔡晓钧,杨仁义,王智槟,朱姝静,瞿 荧,钟 崇
(1湖南中医药大学第一附属医院,湖南 长沙 410007;2湖南中医药大学中西医结合学院,湖南 长沙 410208;3湖南中医药大学,湖南 长沙 410208;4广州中医药大学第一附属医院,广东 广州 510405)
原发性肝癌(primary liver cancer,PLC)在我国尤为高发,发病率和死亡率分别位居我国第四和第二[1-2]。PLC 病理分型75%~85%为肝细胞癌(hepatocellular carcinoma,HCC),其中因大多数患者确诊时为中晚期,已丧失根治性治疗机会,故全身治疗尤为重要[1,3]。但全身治疗常常因发生耐药、身体基础条件差无法耐受不良反应等因素而无法继续使用,导致无法达到预期疗效。相比之下,中医药具有多靶点不易耐药、低毒性副作用小和成本低等特点,是治疗PLC 的一种有前景的策略,将有可能对患者带来大获益。
疏肝祛瘀解毒方(decoction for soothing liver and removing stasis and toxicity,SGQYJDF)由我国著名中西医结合肿瘤专家、广东省名中医林丽珠教授以四逆散为基础所创,多年临床实践证明其行之有效,可明显提高肝癌患者的生存质量和生存时间[4]。前期研究已在细胞层面证明了疏肝祛瘀解毒方含药血清能够抑制人肝细胞癌MHCC97H细胞的增殖,其作用机制可能是通过上调肿瘤蛋白53(tumor protein 53,p53)的水平,抑制溶质载体家族7 成员11(solute carrier family 7 member 11,SLC7A11/xCT)、谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)的水平,导致脂质过氧化物的累积,从而诱导铁死亡[5]。但尚未在动物层面证明该机制,故本研究通过建立SKHep-1细胞异种皮下移植瘤模型,探讨疏肝祛瘀解毒方对裸鼠肿瘤增殖的抑制作用及其作用机制,为临床的使用提供科学依据。
材 料 和 方 法
1 动物与细胞株
SPF 级BALB/c 雌性裸鼠25 只,4 周龄,体质量18~22 g,由湖南中医药大学实验动物中心代购并饲养于SPF 级动物实验室,温度22~24 ℃,湿度50%~60%,昼夜12 h/12 h 间断照明,动物可自由饮水摄食。实验方案经湖南中医药大学实验动物伦理委员会审批并通过(编号:LL2022101909)。人肝癌细胞株SK-Hep-1购自普诺塞,货号:CL-0212。
2 主要试剂
疏肝祛瘀解毒方购自湖南中医药大学第一附属医院,由柴胡(甘肃NG21060101)、白芍(河北TH21051702)、枳壳(湖南HY23041802)、桃仁(河北国安221201)、半枝莲(安徽2212020031)、龙葵(安徽2210190051)、山慈菇(贵州2023032402)、肿节风(江西2022091904)组成,其经过张裕民教授鉴定,符合2020 年版《中华人民共和国药典》及《湖南省中药饮片炮制规范2010 版》标准。甲苯磺酸索拉非尼片(重庆药友制药有限公司,货号H20203403)。
胎牛血清(Bovogen,货号C0230);青霉素-链霉素溶液、DMEM 培养基、0.25%胰蛋白消化酶和PBS缓冲液(武汉普诺赛,货号分别为PB180120、PM150210、PB180226、PB180327);苏木素伊红(HE)染色试剂盒(碧云天,货号:C0105M);4%多聚甲醛、辣根过氧化物酶标记山羊抗兔IgG(H+L)、辣根过氧化物酶标记山羊抗小鼠IgG(H+L)(上海碧云天,货号分别为P0099、A0208、A0216);Anti-p53抗体、重组Anti-xCT 抗体、重组Anti-Glutathione Peroxidase 4 抗体和Anti-beta Actin 抗体(Abcam,货号分别为ab26、ab175186、ab125066、ab8226);KI67 多 克隆 抗 体、SLC7A11/xCT 多克隆抗体(Proteintech,货号27309-1-AP、26864-1-AP);高效RIPA 裂解液、BCA 蛋白浓度测定试剂盒、Skim Milk 脱脂奶粉、2.5% Gluta 固定液(Solarbio,货 号 分 别 为R0010、PC0020、D8340、P1126);丙二醛(malondialdehyde,MDA)比色法测试盒、亚铁离子比色法测试盒、还原型谷胱甘肽(glutathione,GSH)比色法测试盒(Elabscience,货号E-BCK025-M、E-BC-K773-M、E-BC-K030-M)。
3 主要方法
3.1 疏肝祛瘀解毒方及索拉非尼药液的制备(1)疏肝祛瘀解毒方由柴胡10 g、白芍15 g、枳壳15 g、桃仁10 g、半枝莲30 g、龙葵30 g、山慈菇15 g 和肿节风30 g 组成,按剂量混匀后于10 倍蒸馏水中浸泡30 min,加热煮沸,微沸60 min 后倒出过滤药液,再加8 倍蒸馏水重复上述操作,将两次药液混合,浓缩至含生药2.5 g/mL,于4 ℃冷藏保存备用。(2)取甲苯磺酸索拉非尼(Sorafenib)研碎后放到离心管中,加入生理盐水至终浓度为4 g/L,于4 ℃冷藏保存备用,使用前超声助溶30 min,用生理盐水稀释。
3.2 细胞培养 将SK-Hep-1 肝癌细胞培养于DMEM 高糖培养基中(含10%胎牛血清、100 U/mL青霉素和100 mg/L 的链霉素),放置于37 ℃、5% CO2恒温恒湿培养箱中,取对数生长期细胞用于实验。
3.3 SK-Hep-1 细胞异种皮下移植瘤裸鼠模型的建立及分组给药 取3.2 项下细胞,用0.25%的胰蛋白酶消化、离心后,去上清液,用无血清的DMEM 培养基洗涤两遍,再加入DMEM 培养基将细胞浓度调整为5×1010/L。在无菌条件下用注射器抽取0.2 mL细胞悬液注射到裸鼠右腋下方皮下,等待14 d左右,待皮下肿瘤最大直径大于5 mm 且体积大于50 mm3即造模成功。将造模成功的裸鼠随机5 组,即模型对照(control)组、SGQYJDF 低剂量(SGQYJDF-low)组、SGQYJDF 中剂量(SGQYJDF-medium)、SGQYJDF高剂量(SGQYJDF-high)和SGQYJDF 中剂量联合Sorafenib(SGQYJDF+Sorafenib)组,根据《人与动物体表面积换算表》计算,SGQYJDF低、中、高剂量组每日给予相同体积、成人等效量的0.5、1、2 倍疏肝祛瘀解毒方中药液灌胃(10.075 g·kg-1·d-1、20.15 g·kg-1·d-1、40.3 g·kg-1·d-1),SGQYJDF 联合Sorafenib 组每日给与相同体积、成人等效量的1 倍等效量的中药液和甲苯磺酸索拉非尼药液灌胃(20.15 g·kg-1·d-1、52 mg·kg-1·d-1),模型对照组给予相同体积的生理盐水灌胃,连续灌胃14 d[6]。
3.4 肿瘤体积和质量的测量以及生长抑制率的测定 灌胃期间,每2 d 测量1 次裸鼠异种移植瘤长径和短径,计算肿瘤体积,末次给药后1 h 脱颈处死动物,取出瘤体称重并计算生长抑制率。剪切部分肿瘤组织放于4%多聚甲醛溶液中固定,剩余肿瘤组织用于检测铁死亡生化指标水平,以及Western blot 检测p53、GPX4和xCT蛋白的表达情况。
肿瘤体积=长径×短径2/2;肿瘤生长抑制率(%)=(模型对照组瘤重-给药组瘤重)/模型对照组瘤重×100%。
3.5 苏木精伊红染色(Hematoxylin and Eosin staining,HE)法观察肿瘤组织病理学形态 将固定于4%多聚甲醛溶液中的肿瘤组织样本,通过梯度乙醇脱水、二甲苯透明、石蜡包埋后,用组织切片机将其切为厚度4 μm 的石蜡切片。石蜡切片烘烤、二甲苯脱蜡、梯度乙醇脱苯、PBS 缓冲液冲洗后,按照HE 染色试剂盒说明书进行染色,再通过梯度乙醇脱水、二甲苯透明、中性树胶封片后显微镜下观察肿瘤组织病理学形态并拍照。
3.6 比色法检测肿瘤组织铁死亡生化指标水平
3.6.1 比色法检测肿瘤组织亚铁离子(ferrous ions,Fe2+)水平 按照试剂盒说明书,取各组肿瘤组织0.1 g,加入900 μL 提取剂,12 000 ×g离心10 min,取300 μL 上清液,加入150 μL 检测液,37 ℃孵育10 min,再12 000 ×g离心10 min,将上清液加入酶标板,用酶标仪检测波长593 nm 处的吸光度(A)值,根据标准曲线计算各组肿瘤组织内Fe2+的含量,并计算其相对含量。
相对含量=给药组含量/模型对照组平均含量;下同。
3.6.2 比色法检测肿瘤组织丙二醛水平 按照试剂盒说明书,取各组肿瘤组织0.1 g,加入900 μL 裂解液、12 000 ×g离心10 min,取100 μL 上清液加入200 μL 检测液、100 ℃孵育10 min、1 000 ×g离心10 min,取200 μL 上清液加入96 孔板,用酶标仪检测波长532 nm 的A值,根据标准曲线计算各组细胞内MDA的A值,并计算其相对含量。
3.6.3 比色法检测肿瘤组织谷胱甘肽水平 按照试剂盒说明书,取各组肿瘤组织0.1 g,加入900 μL提取剂,8 000 ×g、4 ℃离心10 min,取20 μL 于96 孔板中,并加入180 μL 检测液常温孵育2 min,用酶标仪检测波长512 nm 的A值,根据标准曲线计算各组细胞内GSH的含量,并计算其相对含量。
3.7 免疫组化(immunohistochemistry,IHC)法检测肿瘤组织Ki67 和GPX4 的表达 同3.5 制备石蜡切片,将其烘烤、二甲苯脱蜡、梯度乙醇脱苯、PBS 缓冲液冲洗后,分别于 Ki67 (1∶2 000)和 GPX4(1∶200)Ⅰ抗溶液中4 ℃孵育过夜、Ⅱ抗孵育、DAB 显色和苏木精复染后,再通过梯度乙醇脱水、二甲苯透明、中性树胶封片后显微镜下观察。显微镜下随机选取5个视野拍照,ImageJ分析计算平均光密度值。
3.8 免疫荧光(immunofluorescence,IF)法检测肿瘤组织p53 和xCT 的表达 同3.5 制备石蜡切片,将其烘烤、二甲苯脱蜡、梯度乙醇脱苯、PBS 缓冲液冲洗后,分别于p53(1∶1 000)和xCT (1∶250)Ⅰ抗溶液中4 ℃孵育过夜、荧光Ⅱ抗孵育、DAPI 染色后,荧光显微镜下观察。随机选取5个视野拍照,ImageJ分析计算平均荧光强度。
3.9 Western blot 法检测肿瘤组织p53、GPX4 和xCT的表达 称取适量肿瘤组织,研磨后加入裂解液,离心后取上清液,经BCA 定量后,每孔蛋白质上样20 μg,在恒压160 V电泳30 min分离、恒流400 mA转膜30 min、5%脱脂牛奶封闭1 h、TBST洗涤3次,然后将膜分别于p53(1∶4 000)、 GPX4(1∶8 000)、 xCT (1∶5 000)和β-actin(1∶5 000)Ⅰ抗溶液中4 ℃孵育过夜,再用TBST洗涤3次后将膜与Ⅱ抗(1∶8 000稀释)在37 ℃孵育2 h,然后用TBST 洗涤膜3 次,最后ECL显色,以β-actin为内参照,应用ImageJ软件计算相对蛋白质表达量。相对蛋白表达量=目的蛋白表达量/内参蛋白表达量
4 统计学处理
所有数据以均数±标准差(mean±SD)表示,采用R (4.2.1)版本进行统计分析,数据满足正态分布、方差齐用单因素方差分析(one-way ANOVA)检验,满足正态分布、方差不齐用Welch one-way ANOVA检验,不满足正态分布用Kruskal-Wallis test 检验;多重假设满足正态分布、方差齐用Games-Howell 事后检验和Tukey HSD 事后检验,不满足正态分布、方差不齐用Dunn's test 检验;以P<0.05 表示差异具有统计学意义。
结 果
1 疏肝祛瘀解毒方对皮下移植瘤裸鼠肿瘤及其增殖的影响
通过观察肿瘤体积变化,发现模型对照组、低剂量复方组瘤体体积迅速增长,中、高剂量复方组及联合组体积增长相对缓慢,与模型对照组相比,第4 天联合组开始具有统计学意义(P<0.01),第6 天高剂量复方组开始具有统计学意义(P<0.01),第8 天中剂量复方组开始具有统计学差异(P<0.01);且由肿瘤质量计算生长抑制率可知,SGQYJDF 低浓度对肿瘤质量的影响无统计学意义(P>0.05),而SGQYJDF中、高剂量及联合给药均可抑制肿瘤生长(P<0.01);且与SGQYJDF 高剂量对比,联合给药效果更胜(P<0.01)。此外,各组裸鼠解剖时均未见明显浸润。见图1。
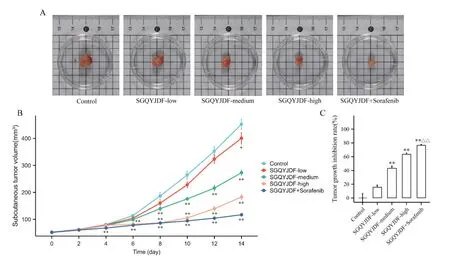
Figure 1. Effects of SGQYJDF on the general condition of subcutaneously transplanted tumor in nude mice. A: subcutaneously transplanted tumors; B: volume changes of subcutaneously transplanted tumors; C: suppression rate of growth for subcutaneously transplanted tumors. Mean±SD. n=5. *P<0.05,**P<0.01 vs control group; △△P<0.01 vs SGQYJDF-high group.图1 疏肝祛瘀解毒方对皮下移植瘤裸鼠肿瘤一般情况的影响
同时,通过IHC 观察肿瘤组织Ki-67 阳性细胞,计算Ki-67 阳性细胞率可知,与模型组对比,SGQYJDF 低、中、高剂量组及联合组均可减低Ki-67的表达,抑制肿瘤增殖(P<0.01),而与SGQYJDF 高剂量组对比,联合组效果更胜(P<0.01)。见图2。
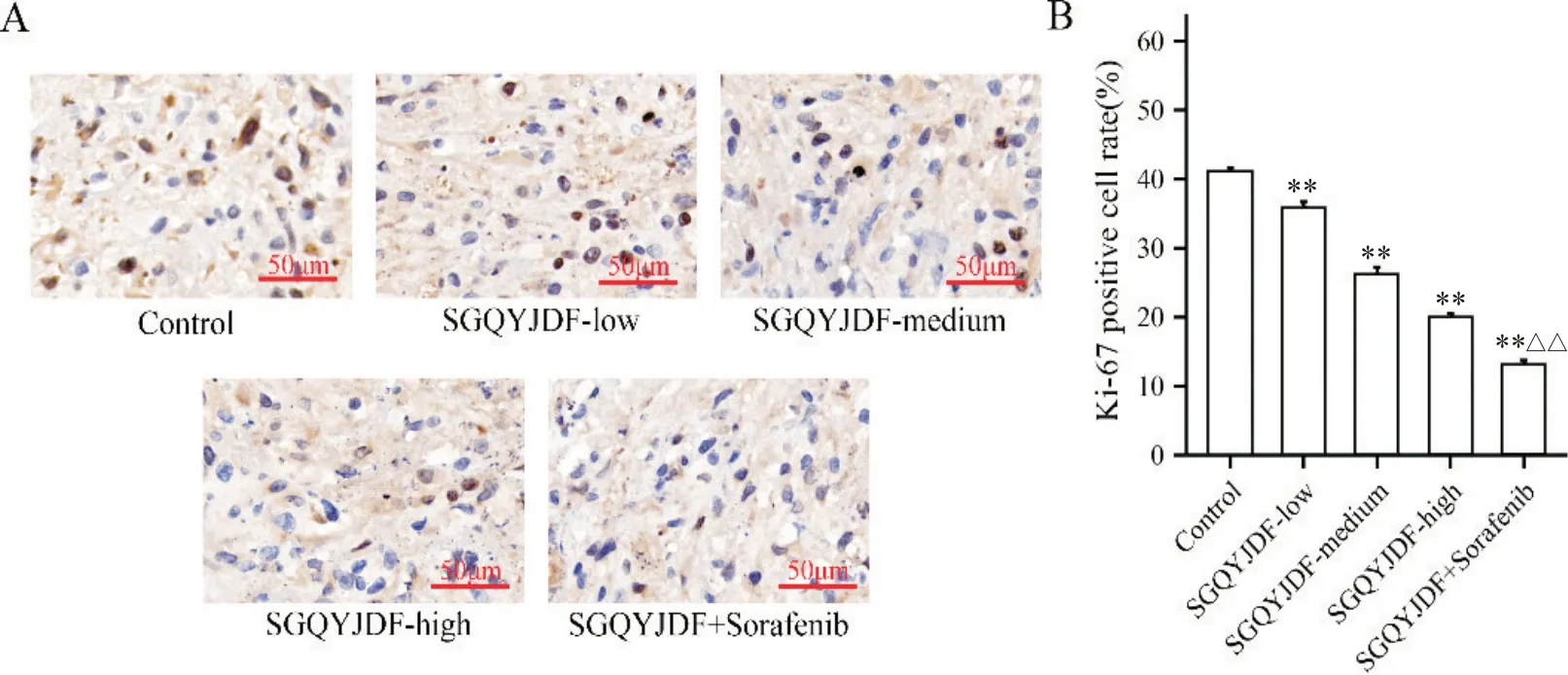
Figure 2. Effects of SGQYJDF on the proliferation marker Ki-67 in subcutaneously transplanted tumor tissues of nude mice. A: immunohistochemical detection of Ki-67 expression(scale bar=50 μm); B: the percentage of Ki-67 positive cells. Mean±SD. n=5. **P<0.01 vs control group; △△P<0.01 vs SGQYJDF-high group.图2 疏肝祛瘀解毒方对皮下移植瘤裸鼠肿瘤组织增殖标志物Ki-67的影响
2 疏肝祛瘀解毒方对皮下移植瘤裸鼠肿瘤组织的病理学影响
通过HE 染色观察各组肿瘤组织细胞形态,各组肿瘤组织细胞排列不规则、形态不一、核质比增加,表现出肿瘤细胞的特征,可见肿瘤坏死区。其中模型对照组肿瘤细胞较为密集、饱满、核大深染;与模型对照组相比,各组给药组均可见不同程度的核固缩、核质比减小、坏死区域变大,呈剂量依赖性变化,联合组最为明显。见图3。

Figure 3. Effects of SGQYJDF on the pathology of subcutaneously transplanted tumor in nude mice. HE staining of the subcutaneously transplanted tumors (scale bar=100 μm).图3 疏肝祛瘀解毒对皮下移植瘤裸鼠肿瘤组织的病理学影响
3 疏肝祛瘀解毒方对皮下移植瘤裸鼠肿瘤组织铁死亡相关指标的影响
根据对应标准曲线,计算肿瘤组织内MDA、Fe2+和GSH 的含量,计算其相对含量。与模型对照组比较,SGQYJDF 低、中、高剂量及联合给药均可导致MDA、Fe2+的相对含量增多(P<0.01),且与SGQYJDF高剂量组对比,联合组效果更胜(P<0.01)。同时,SGQYJDF 低、中、高剂量组及联合组均可导致GSH相对含量降低(P<0.01),SGQYJDF 高剂量组与联合组无差异(P>0.05)。见图4。
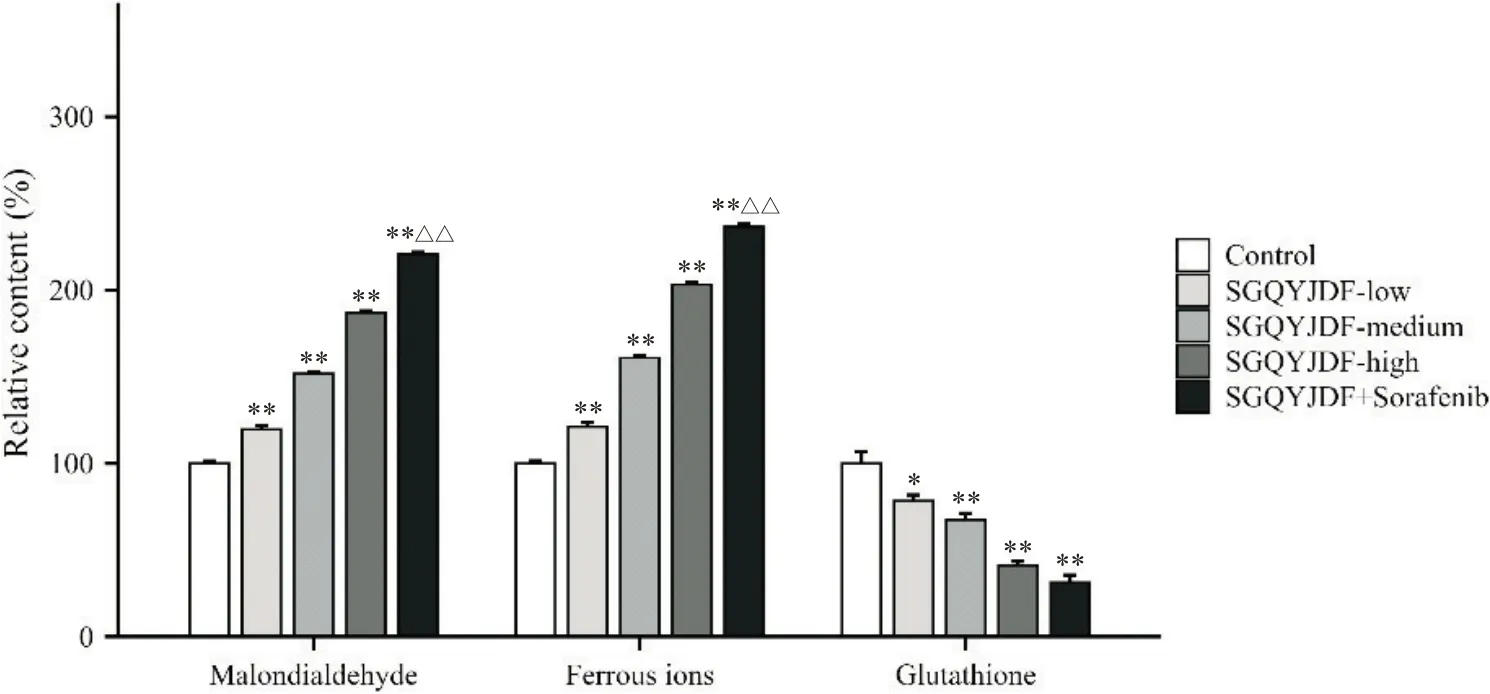
Fiureg 4. Effects of SGQYJDF on ferroptosis-related indicators in the subcutaneously transplanted tumor of nude mice. Mean±SD. n=5. *P<0.05,**P<0.01 vs control group; △△P<0.01 vs SGQYJDF-high group.图4 疏肝祛瘀解毒对皮下移植瘤裸鼠肿瘤组织铁死亡相关指标的影响
4 疏肝祛瘀解毒方对皮下移植瘤裸鼠肿瘤组织相关蛋白的影响
通过ImageJ 分析肿 瘤 组织IF 的p53 和xCT 平均荧光强度,结果显示,与模型对照组对比,SGQYJDF低、中剂量可上调p53 和下调xCT 表达,但无统计学意义(P>0.05),而SGQYJDF 高剂量及联合给药均能够上调p53 的表达,同时下调xCT 的表达(P<0.05、0.01)。与SGQYJDF 高剂量对比,联合给药组虽可见差异,但无统计学意义(P>0.05)。见图5。
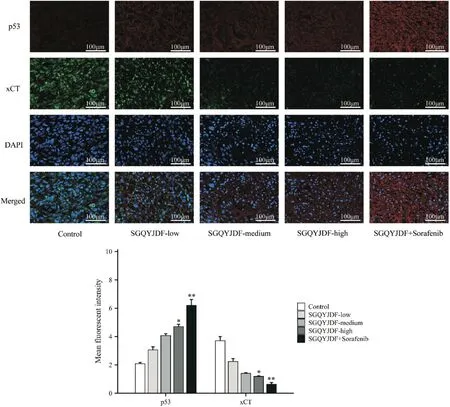
Figure 5. Effects of SGQYJDF on the expression of p53 and xCT in the subcutaneously transplanted tumor tissues of nude mice. Scale bar=100 μm. Mean±SD. n=5. *P<0.05,**P<0.01 vs control group.图5 疏肝祛瘀解毒方对皮下移植瘤裸鼠肿瘤组织p53和xCT的影响
通过ImageJ 分析肿瘤组织IHC 的GPX4 阳性区域平均吸光度值,结果显示,与模型对照组对比,SGQYJDF 低、中、高剂量及联合给药下调GPX4 表达(P<0.01)。与SGQYJDF 高剂量对比,联合给药效果更胜,差异具有统计学意义(P<0.01)。见图6。
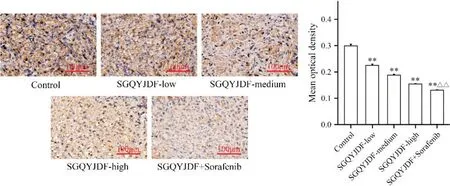
Figure 6. Effects of SGQYJDF on the expression of GPX4 in the subcutaneously transplanted tumor tissues of nude mice. (Scale bar=100 μm). Mean±SD. n=5. **P<0.01 vs control group; △△P<0.01 vs SGQYJDF-high group.图6 疏肝祛瘀解毒方对皮下移植瘤裸鼠肿瘤组织GPX4的影响
通过ImageJ 分析Western blot 条带灰度值,计算相对蛋白表达量,结果显示,与模型对照组对比,SGQYJDF 低、中剂量可上调p53,同时下调xCT 和GPX4 的表达,但无统计学意义(P>0.05),而SGQYJDF 高剂量及联合给药均能够上调p53 的表达,同 时 下 调xCT 和GPX4 的影响(P<0.05、P<0.01)。与SGQYJDF 高剂量对比,联合给药组对p53、xCT 和GPX4 的影响虽可见差异,但无统计学意义(P>0.05)。见图7。
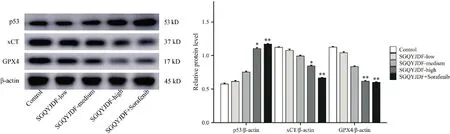
Figure 7. Effects of SGQYJDF on the expression of p53,xCT,and GPX4 proteins in the subcutaneously transplanted tumor tissues of nude mice. Mean±SD. n=5. *P<0.05,**P<0.01 vs control group.图7 疏肝祛瘀解毒方对皮下移植瘤裸鼠肿瘤组织p53、xCT和GPX4蛋白的影响
讨 论
HCC 作为PLC 的主要病理类型,其治疗策略在不断的改进,但目前其预后仍然不尽人意,一线治疗策略除了化疗、靶向治疗和免疫治疗外,还包括了传统中医辨证论治以及具有肝癌适应症的现代中药制剂[3]。中医药在临床上具有可观的疗效,越来越多的研究探讨了中药及其有效成分对HCC的效果及作用机制,为中医药现代化提供科学理论依据[7]。铁死亡(Ferroptosis)作为一种程序性死亡方式,指铁依赖性脂质过氧化导致细胞膜破裂,最终导致细胞死亡[8]。目前已有多种中药及其有效成分被证实能够通过诱导铁死亡发挥抗肿瘤的作用,例如双氢青蒿素能够通过促进PEBP1/15-LO 的形成诱导肝细胞癌中的铁死亡、荜茇酰胺(荜茇的有效成分)能够通过诱导铁死亡快速诱导人胰腺癌细胞死亡[9-10]。此外在其他疾病中,也发现了例如甘草、槲皮素、姜黄素和黄芪苷等能够调控铁死亡[11]。不仅如此,现代药物例如HCC一线治疗药物中的索拉非尼也被证实可通过铁死亡发挥作用[12]。由此可见,中药及其有效成分在通过铁死亡抗HCC具有广阔的前景。
疏肝祛瘀解毒方由柴胡、白芍、枳壳、桃仁、半枝莲、龙葵、山慈菇和肿节风八味药组成,方中柴胡辛行苦泄,性善条达肝气,疏肝解郁;白芍味酸,主入肝经,偏易肝之阴血,长于养血柔肝,缓急止痛;枳壳行滞消胀;桃仁味苦通泄,入心肝血分,善泄血滞,祛瘀力强;半枝莲味辛苦寒,功能化瘀消肿,善治黄疸,消鼓胀;龙葵味苦寒,功用为解毒活血消肿;山慈菇味辛能散,有解毒消肿散结之功;肿节风味苦辛性平,功用为解毒凉血,活血消斑散瘀。方中以四逆散为基础,紧扣“肝郁、气滞、血瘀”的关键病机,共奏疏肝行气、化瘀解毒之功[4]。在前期研究的体外实验中,疏肝祛瘀解毒方已被验证其含药血清可能通过调控p53/xCT/GPX4 通路诱导肝癌细胞铁死亡,本研究通过建立皮下移植瘤模型在动物层面验证体内机制,进一步探讨疏肝祛瘀解毒方在体内的作用机制[5]。
首先,为验证疏肝祛瘀解毒方对裸鼠肝癌增殖的影响,一方面,我们通过观察各组肿瘤体积变化,计算生长抑制率,发现疏肝祛瘀解毒方能够呈剂量相关性的抑制裸鼠肿瘤体积的增长;另一方面,通过HE 染色法观察病理变化,结果提示疏肝祛瘀解毒方能够呈剂量相关性的导致裸鼠肿瘤组织坏死;最后,Ki-67 是一种细胞周期相关的一种核蛋白,其可以反映肿瘤的增殖状态,我们通过IHC 发现疏肝祛瘀解毒方能够呈剂量相关性降低肿瘤组织Ki-67 的阳性细胞率,这些结果表明疏肝祛瘀解毒方可以抑制裸鼠肝癌皮下移植瘤的生长,同时印证了体外实验的结果。
其次,铁死亡作为一种细胞程序性死亡方式,不同于其他细胞死亡方式,其相关的检测指标主要包括脂质过氧化、铁含量和谷胱甘肽含量,故为探讨疏肝祛瘀解毒方能否诱导裸鼠肝癌铁死亡,我们选择通过比色法检测肿瘤组织MDA、Fe2+和GSH 的水平来反映铁死亡的程度[8,13]。其中MDA 作为脂质过氧化的产物,其含量可以反映脂质发生过氧化的程度;Fe2+作为铁死亡的驱动因子,其含量可以反映脂质发生过氧化的难易程度;GSH 作为抗氧化的主要物质,可以反映肿瘤抗过氧化的能力。本研究比色法检测结果表明疏肝祛瘀解毒方可呈剂量相关性的提高肿瘤组织内MDA和Fe2+水平,同时减低GSH水平,提示其能够诱导肝癌裸鼠肿瘤组织铁死亡,该结果与体外实验结果相符。
最后,为进一步探讨疏肝祛瘀解毒方如何调控铁死亡,我们通过网络药理学技术发现疏肝祛瘀解毒方能够靶向于p53,其作为肿瘤抑制因子,可通过多种途径抑制肿瘤。而针对铁死亡,现有的研究发现,其与System Xc-和GPX4 关系密切,其中System Xc-是一种跨膜氨基酸转运体,由跨膜转运蛋白xCT(即SLC7A11)和跨膜调节蛋白SLC3A2 组成,能够将将胞内的谷氨酸和胞外的胱氨酸交换,胱氨酸进入细胞后,转化为半胱氨酸,用于GSH 的合成;而GSH在GPX4 的作用下,可将过氧化的脂质还原,从而抵抗铁死亡的发生[8]。同时,GPX4 的活性也需要GSH的维持[14]。此外,有研究发现,HCC 一线治疗药物索拉非尼能够通过上调p53 的表达,下调xCT 和GPX4通路,诱导铁死亡的发生[12,15]。故我们推测疏肝祛瘀解毒方能够通过调控p53/xCT/GPX4 通路诱导肝癌铁死亡,并在细胞实验中证明[5]。故本研究通过IHC、IF 和WB 在动物层面验证疏肝祛瘀解毒方对肿瘤该通路的影响。本研究结果提示疏肝祛瘀解毒方能够剂量相关的上调p53 的表达,同时下调xCT 和GPX4 的表达。但在IF 的图片中,未发现p53 与xCT有明显的共定位,故p53如何调控xCT的表达还需我们进一步探索。
总的来说,本研究验证了疏肝祛瘀解毒方在裸鼠体内可能通过上调p53 的水平,抑制xCT 和GPX4的水平,导致铁含量和脂质过氧化物的累积以及抑制GSH的生成,从而诱导铁死亡,最终达到抑制肿瘤增殖的目的,为今后疏肝祛瘀解毒方的作用机制研究提供了新的思路,为疏肝祛瘀解毒方的临床应用提供了科学理论依据,扩充了中草药调控铁死亡的方式。此外结果也提示疏肝祛瘀解毒方与索拉非尼联用效果比两倍疏肝祛瘀解毒方效果更甚,中西医结合更有利于患者。但本研究仍有不足,疏肝祛瘀解毒方是否通过其它的作用机制及表型发挥更为明显的效应,疏肝祛瘀解毒方与索拉非尼联用是否有协同作用等我们仍未知,这将是我们进一步探索的重要方向。
