氧化石墨烯-壳聚糖用于中药派特灵膜剂载体的制备与表征
2024-01-16王欣施章浪刘晓青崔曼李媛文继红
*王欣 施章浪 刘晓青 崔曼 李媛 文继红*
(1.吉林大学材料科学与工程学院 吉林 130012 2.吉林大学第一医院 吉林 130021)
为了保障传统中药派特灵技术的推广与应用,本工作拟分别以氧化石墨烯(GO)、壳聚糖(CS)及GO-CS为载体,以派特灵水剂为目标药物,采用溶液共混结合溶剂蒸发法,在合适的基底上制备载药膜剂。GO纳米材料是石墨烯的衍生物,具有sp2和sp3杂化结构,片层表面和边缘富含羟基、环氧基和羧基等含氧官能团,纳米片尺寸及胶体浓度易于调控[3]。大的比表面积、优异的胶体稳定性、良好的生物相容性和生物降解性使其在纳米医药和生物医学领域有着广泛的研究和应用,尤其在药物可控释放和靶向输运方面,GO不仅可与传统药物载体复合,发挥协同载药作用,而且有望成为一种新型的多功能药物载体材料[3-5]。但是,目前GO作为中药载体的研究还很少[5-6]。将GO纳米片与高分子材料的结合形成复合材料,可以改善单一高分子材料的力学、热学和电学等多种性质,提升天然或人工合成高分子材料在各个领域的应用潜力。CS是甲壳素脱乙酰基后得到的天然大分子多糖,生物相容性良好,在人体内能够自然降解并排出体外,已广泛应用于医药、食品和化工等领域。作为药物载体,CS材料易于制备成凝胶形态或者薄膜[7]。
基于GO和CS都是优异的药物载体材料,有着各自独特的特性,本研究首先探讨单质载体负载药物成膜的条件,然后将GO作为添加剂与CS复合制备载药膜,旨在保持CS优异的生物相容性、可生物降解性及药物释放的pH敏感特性[8],同时改善纯CS的力学性能、载药能力和稳定性不足的问题。本研究对上述膜剂进行谱学分析和载药性能评估,以期开发药物新剂型,弥补传统给药方式的不足,方便医患。
1.材料及仪器
(1)药品与试剂。派特灵浓缩液(原药液,规格为15mL/瓶,北京派特博恩生物技术集团有限公司,批注文号:(玉江)卫消证字[2018]第0001号);天然鳞片石墨粉(325目,Alfa Aeasar公司);壳聚糖(分子量200000,脱乙酰度≥95%,上海阿拉丁生化科技有限公司)。
浓硫酸、硝酸钠、盐酸、高锰酸钾、过氧化氢、氨水(北京化工厂);无水乙醇(天津市富宇精细化工有限公司)。其他试剂均为市售分析纯。
(2)仪器。磁力搅拌器(金坛市大地自动化仪器厂);超声波清洗器(深圳市华策科技有限公司);水浴恒温振荡器(上海比朗仪器制造有限公司);高速离心机(安徽中科中佳科学仪器有限公司);真空干燥箱(上海一恒科技仪器有限公司);傅里叶变换红外光谱(Perkin Elmer,Spectrum One B,英国);拉曼光谱仪(LabRAM Hr Evolution,激发波长514nm,法国);紫外可见分光光度计(海阳光学Chemu B4000,美国)。
2.方法
(1)GO的制备
采用改良的Hummers法制备GO[9]。将2g天然鳞片石墨粉、2g硝酸钠和96mL浓硫酸置于锥形瓶中,于0℃冰水浴中搅拌,缓慢加入12g高锰酸钾,耗时约30min,再继续搅拌2h;升温至60℃,恒温水浴搅拌12h后取出,冷却至室温,加入去离子水,滴加约10mL过氧化氢使其变为明黄色且无明显气泡产生,静置24h后,分装于离心管中,先酸洗3次再水洗多次直至中性;超声分散处理约60min(功率为120W)得到GO溶液。
(2)膜剂的制备
①单质载体膜剂的制备。采用溶剂蒸发法制备GO载药膜和CS载药膜。量取适量GO分散液,稀释至6mg/mL,量取稀释后的GO分散液25mL,分别加入派特灵原液300μL、750μL、1.5mL,在加入去离子水增容至30mL,编号对应为GO-1、GO-2、GO-3,继续搅拌混合均匀,脱气处理后浇铸在聚苯乙烯表面,置于60℃真空干燥箱中成膜。
式中,mp为弹体质量;vp0为弹体初始速度;d0为弹体直径;h为侵彻深度。考虑到随着弹体侵彻速度的增加,在超过临界速度ver时,弹体的质量出现一定的磨蚀,弹体质量表示为
量取质量为600mg的CS粉末3份,放入锥形瓶中,倒入25mL去离子水和500μL冰醋酸,搅拌使其充分混合,再分别加入派特灵原液300μL、750μL、1.5mL,加入去离子水增容至30mL,编号对应为CS-1、CS-2、CS-3,继续搅拌混合均匀,脱气处理后浇铸在聚苯乙烯表面,置于60℃真空干燥箱中成膜。
②复合载体膜剂的制备。采用溶剂蒸发法制备GO-CS复合载药膜。量取质量为600mg的CS粉末3份,放入锥形瓶中,倒入25mL去离子水和500μL冰醋酸,搅拌使其充分混合,然后加入1mg/mL的GO水溶液1mL,再分别加入派特灵原液300μL、750μL、1.5mL,加入去离子水增容至30mL,编号分别为GO-CS-1、GO-CS-2、GO-CS-3,继续搅拌混合均匀,脱气处理后浇铸在聚苯乙烯表面,置于60℃真空干燥箱中成膜。
(3)膜剂的表征
①膜剂的结构分析
傅里叶变换红外光谱(FT-IR spectroscopy):将制备好的膜剂充分干燥,然后裁剪成合适尺寸,测试的扫描范围为400~4000cm-1,分辨率为2cm-1,每次扫描重复10次。
拉曼光谱(Raman spectroscopy):将适量的派特灵原液、载体原液和负载派特灵的载体混合溶液分别移入毛细管中,测试范围为200~3500cm-1,激发波长为514nm。
②膜剂的负载药物分析
A.标准曲线。精密量取50μL派特灵浓缩液,进行稀释处理,得到0.01~1.00μL/mL不同浓度的稀释液。采用紫外可见分光光度计,在286nm波长处测量不同浓度下的吸光值;以浓度为横坐标,吸光值为纵坐标,线性拟合得到药物释放标准曲线。重复实验三次取平均值。
B.载药量与包封率。精密称量5mg膜剂和5mg纯载体膜样品,剪碎,分别置于15mL的离心管中并加入PBS缓冲液10mL,摇晃1min后离心,分别吸取上清液2mL并均匀稀释,测量膜剂的吸光值I1和纯载体膜的吸光值I’1。重复实验三次取平均值。
精密称量5mg膜剂和5mg纯载体膜样品,剪碎,分别置于15mL的离心管中并加入10mL缓冲液,超声溶解并离心,分别吸取上清液2mL并均匀稀释,测量膜剂的吸光值I2和纯载体膜的吸光值I’2。重复实验三次取平均值。
将吸光值I1-I’1和I2-I’2分别代入标准曲线方程,得到相应的未包封的药物量V1和负载的药物量V2,通过下述公式计算载药量(单位为μL/mg)与包封率:
药物利用率是指膜剂中实际的载药量与初始添加的派特灵水剂浓缩液用量的比值。
C.药物释放。精密称量纯载体膜5mg和膜剂5mg,放置于离心管中,加入PBS缓冲液,于37℃恒温摇床中,以120r/min的转速下,分别在0.5h、1h、2h、4h、8h和12h时量取2mL上清液,同时补充2mL缓冲液;将上清液稀释至10mL,测定其吸光值。将载药膜的吸光值中去除纯载体膜的吸光值得到的差值代入标准曲线方程,即为各时间段药物的释放率,进而求得其累计释放率。
3.结果与讨论
(1)膜剂的光学图片
图1所示为三种药物载体,即GO、CS、GO+CS负载中药水剂派特灵制备的膜剂样品光学图片。膜剂具有良好的自支撑性,易于操作,膜表面光滑、膜体柔性好。其中CS膜与GO-CS复合膜透明度较好,GO与CS具有典型的阳离子-阴离子作用特性,可通过物理相互作用成膜,与水剂混合后,药物分布均匀,表面无明显可见非溶性药物颗粒的聚集。

图1 膜剂样品光学图片
(2)膜剂的化学结构分析
①FT-IR表征。以GO作为载体制备的三种剂量派特灵膜剂样品的FT-IR谱图如图2(a)所示。其中,3420cm-1位置对应-OH的伸缩振动峰,1042cm-1和1221cm-1分别对应于烷氧基C-O 和环氧基C-O 的伸缩振动峰,1726cm-1位置对应于羰基上的C=O伸缩振动特征峰,1608cm-1位置处是吸附在GO片层间的水分子的变形振动峰[10]。负载药物后,混合液的FT-IR谱图的峰形和峰位基本与GO的谱图一致,位于1042cm-1和1221cm-1处的C-O和1726cm-1处的C=O的伸缩振动峰增强,说明药物以物理吸附方式负载在GO表面;在500~900cm-1内出现药物指纹区是N-H弯曲振动峰,来源于药物中的大青叶,在1480~1590cm-1内存在药物特征区,来自于芳环,且峰强与药物浓度存在一定对应关系。图2(b)是CS载体与CS载药膜的FT-IR光谱图。其中,波数为1548cm-1对应于-NH2上的N-H的弯曲振动峰(酰胺II的吸收峰),1409cm-1为C-H的弯曲振动峰,1152cm-1为C-O-C的弯曲振动峰,1071cm-1和1024cm-1分别对应于二级醇和一级醇上的C-O的伸缩振动峰[11]。加入派特灵并没有改变CS载体的光谱形状和特征峰的峰位,说明加入药物后,药物与载体之间存在氢键相互作用,随着派特灵水剂量的增加,载体特征峰强度有所降低。图2(6)为复合载体与膜剂的FT-IR光谱图。从图中可以看出,由于GO的掺入量很少,所以GO-CS复合载体的FT-IR谱图以CS特征峰为主。加入派特灵水剂后,复合膜剂的特征峰的峰位没有发生变化,随着载药浓度的增加,其峰强有所减弱,变化规律类似于单一的CS载体膜剂。
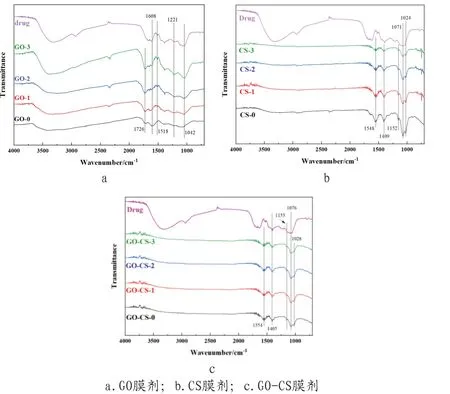
图2 样品的傅里叶变换红外光谱图
②Raman表征。我们对派特灵原液、GO和CS载体及其负载药物的混合溶液进行了Raman光谱分析,以进一步说明溶液共混方法较好保持了各载体的化学结构和药物稳定性,结果如图3所示。图3(a)中,药物原液中的主要成分大青叶、苦参、金银花等,含有的化学物质如绿原酸(C16H18O9)中富含羧基、羟基,可对应于Raman光谱中1100~1800cm-1波数范围;苦参碱(C15H24N2O)、靛玉红(C16H10N2O2)含有N-H与C-N键,对应于3220~3320cm-1波数范围;木犀草素(C15H10O6)内存在大量醇-OH与C-O-C,对应于2850~2950cm-1波数范围。低剂量下的混合溶液表现出十分微弱的药物峰,而在高剂量混合液出现明显的药物特征峰。负载药物后,GO的D峰和G峰位置未发生改变,峰强ID与IG的比值(ID/IG=0.86)几乎无变化,说明药物的负载并没有造成GO结构的明显变化,药物分子可通过π-π相互作用、氢键或静电相互作用,以非化学键方式与GO复合。同样,添加低剂量派特灵水剂的混合溶液表现出载体峰和药物峰,提高剂量,药物峰显著增强,表现出与派特灵原液相似的光谱图,说明混合后药物结构稳定,如图3(b)所示。
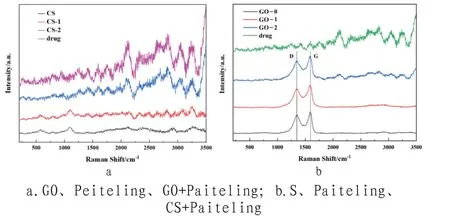
图3 样品的拉曼光谱图
(3)膜剂的载药性能与药物释放性能
表1给出了不同载体所对应的各膜剂药物的载药量、药物利用率和包封率,用以衡量不同载体和不同载药浓度下的膜剂的载药性能。从表中可以看出,三种载体膜剂的载药量与载药浓度均存在正向关联,但是药物的最大利用率则对应于中等剂量的载药浓度。GO载体膜剂的载药量和包封率均高于CS载体膜剂,这与GO纳米片大的比表面积为药物的吸附提供更多的活性位点相关;GO-CS复合载体膜剂具有较好的综合载药特性。
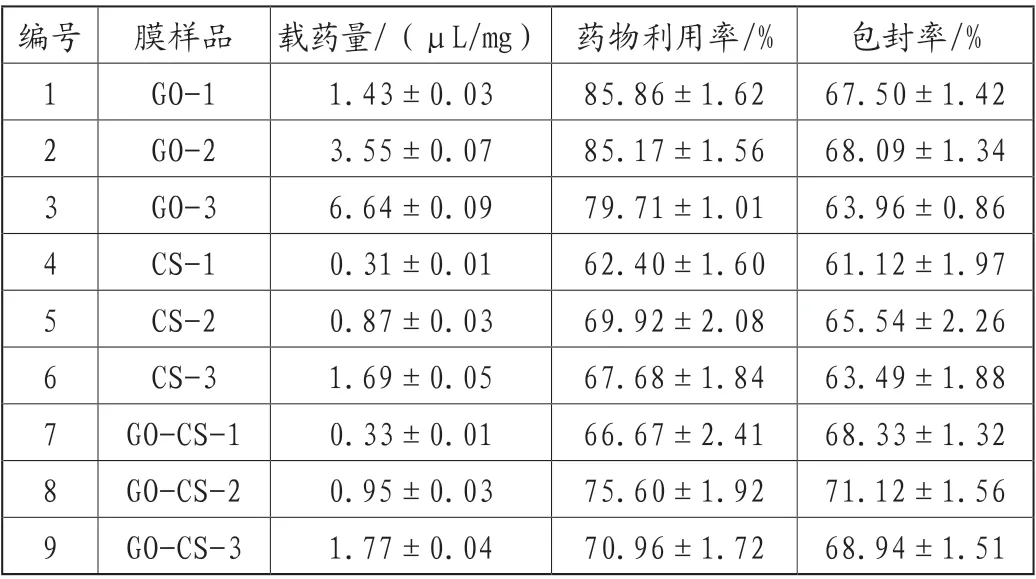
表1 几种膜剂的载药性能
我们选取了上述具有最佳包封率的膜剂进行药物释放性能测试,分别测试了两种pH条件,释放曲线结果如图4所示。可以看出,GO-CS膜剂的释放曲线规律类似于CS膜剂,复合膜剂在释放12h时未出现释放平台,且两种pH下的药物释放率相对于CS膜剂更低,说明GO的引入提升了复合膜的缓释性能;此外,复合膜剂的药物释放也存在pH敏感性,酸性环境有利于药物的释放。
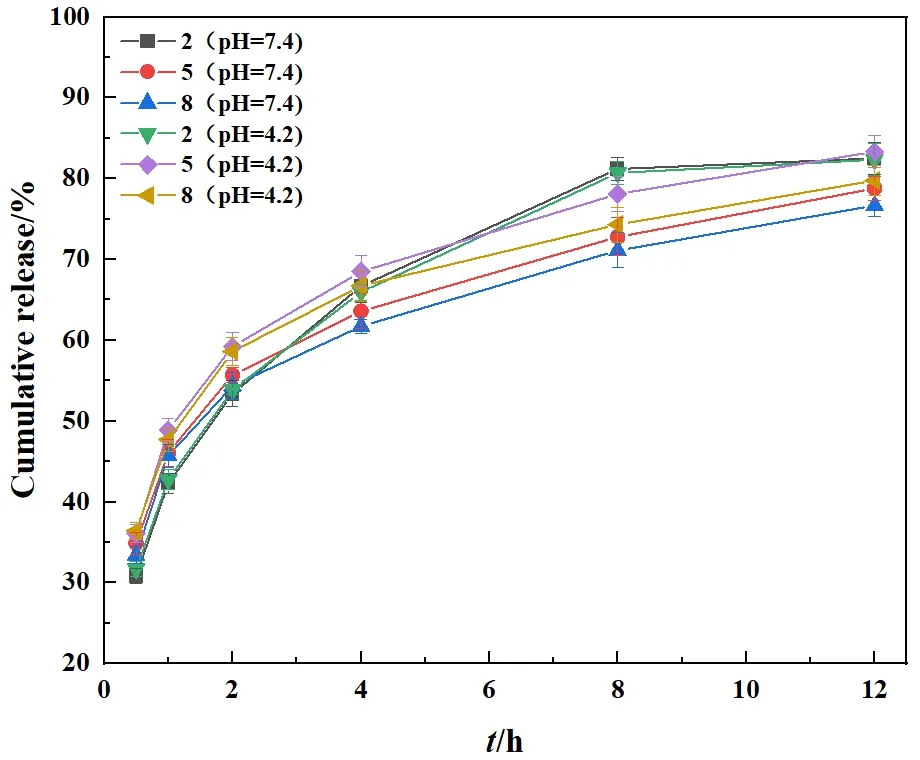
图4 药物膜剂在不同pH环境下药物累积释放曲线
4.结论
本研究以GO和CS单质及复合材料为载体,采用溶液共混和流延涂布方法,制备了负载不同剂量派特灵原液的膜剂,并对膜剂进行了化学结构表征,分析了膜剂的载药和药物释放特性。结果表明,GO-CS复合膜剂的载药量和包封率更高,其释放具有较好的缓释性,未出现明显的突释效应。
派特灵水剂临床使用时需棉球蘸取后放入宫颈处,约4~6h后取出,每次使用数个棉球不等。本研究所制备的单片膜剂的药物用量较为准确,施药无需专业人员,患者可自行上药;膜剂具有缓释效果,可有效减少上药次数;用药后,载体可生物降解。本研究表明复合膜剂制备工艺可行,具有广阔应用前景。
