胶原/纤维蛋白胶复合药膜的性质及其体外抑瘤效应初步研究
2016-04-10陈红丽徐佳迪南文滨郭双李武山连杰丰慧根林俊堂
陈红丽 徐佳迪 南文滨 郭双 李武山 连杰 丰慧根 林俊堂
453003新乡医学院生命科学技术学院;河南省干细胞与生物治疗工程技术中心
·论著·
胶原/纤维蛋白胶复合药膜的性质及其体外抑瘤效应初步研究
陈红丽 徐佳迪 南文滨 郭双 李武山 连杰 丰慧根 林俊堂
453003新乡医学院生命科学技术学院;河南省干细胞与生物治疗工程技术中心
目的制备载硫酸长春新碱(VCR)微球的胶原/纤维蛋白胶的缓释药膜并研究其性质,考察京尼平的交联浓度(0、0.05、0.1、0.2 mol/ml)对药膜性质的影响。方法冷冻干燥和京尼平交联法制备多孔胶原膜,将VCR微球混合纤维蛋白胶后加入多孔胶原膜中制备胶原/纤维蛋白胶复合药膜,考察药膜的表面形态、机械性能、降解性质和体外释药行为,并用CCK-8法检测药膜对3种肿瘤细胞(人肺癌细胞株A549、人乳腺癌细胞株MCF-7和人宫颈癌细胞株HeLa)的体外抑瘤率。结果随着交联剂京尼平浓度的增加,药膜机械强度增加,而断裂伸长率降低。VCR微球与纤维蛋白胶及胶原复合制备成药膜,可达到双重缓释的作用,减少药物突释,并延缓药物释放。未交联的F0药膜药物24 h突释为(41.8±3.4)%,京尼平交联后的F0.05、F0.1和F0.2药膜的药物突释分别为(38.4±4.1)%、(35.2±3.6)%和(34.3±3.7)%。未载药的F0.1药膜无显著细胞毒效应,而载药的F0.1药膜在不同时间释放的药液对3种肿瘤细胞株均有显著的抑制作用,且对各细胞株敏感度不同。结论F0.1药膜能不同程度减少药物的突释,使药物释放更加平稳缓慢,有望用作抗肿瘤药物载体。
京尼平;微球;胶原;纤维蛋白;体外抑瘤
Fund program:National Natural Science Foundation of China(U1304819,81401519);the Key Technologies R&D Program of Henan Province(122102210148);National Training Programs of Innovation and Entrepreneurship for Undergraduates(201310472034)
0 引言
胶原是一种天然蛋白质,因其低抗原性、可生物降解性和良好的生物相容性,作为药物载体和组织工程支架备受关注[1-3]。但其降解受局部因素的影响大,降解速度可控性不如人工多聚物,且机械性能差,故常采取交联以及添加多糖类物质等来弥补上述缺陷[4-5]。目前,胶原交联的方法以化学交联为主,但多数化学交联剂如甲醛、戊二醛等对细胞或组织具有一定的毒性。京尼平(Genipin)是来自植物栀子中的天然交联剂,其毒性低于化学交联剂[6-7]。本研究用天然交联剂京尼平对胶原支架进行交联,以期在提高生物材料抗降解能力的同时,保留其良好的生物相容性。胶原的另一个局限在于其只在酸性环境中溶解,由于胶原在中性环境中不能溶解分散,使得水溶性药物难以分散均匀,因而作为药物载体不能保证药物均匀且缓慢释放而发挥作用。纤维蛋白具有良好的血液和组织相容性,无毒副作用,作为可降解生物材料已在临床上应用[8-9],将包载药物的微球与纤维蛋白混合后,与胶原复合制备支架,可在一定程度改善胶原材料的上述缺点。本课题组前期制备了胶原/纤维蛋白胶的组织工程支架材料,具有良好的蛋白缓释性质[4]。本研究拟将硫酸长春新碱(vincristine sulfate,VCR)制成缓释微球,复合于纤维蛋白胶中,再将上述混合物加入京尼平交联的胶原多孔膜中,得到胶原/纤维蛋白胶复合药膜,考察药膜的形态、机械性能和药物释放特性,并探讨双重缓释药膜对3种肿瘤细胞株(人肺癌细胞株A549、人乳腺癌细胞株MCF-7和人宫颈癌细胞株HeLa)的抑制作用,为下一步体内实验提供参考,也为天然高分子载微球的药膜作为抗肿瘤植入药物载体的临床应用提供理论基础和参考。
1 材料与方法
1.1 主要材料与仪器
VCR(纯度>98%)(上海康爱生物制品有限公司),聚乳酸-羟基乙酸共聚物(PLGA)(分子质量为5×104~8×105u,50∶50)(山东省医疗器械研究所),胶原(以新鲜猪皮为原料,采用胃蛋白酶消化法自制,主要成分为I型胶原,含量>95%),纤维蛋白胶(广州倍绣生物技术有限公司),RPMI 1640培养基(美国Gibco公司),CCK-8(美国Sigma公司),乙腈、二氯甲烷等试剂均为分析纯或色谱纯级。人肺癌细胞株A549、人乳腺癌细胞株MCF-7和人宫颈癌细胞株Hela均购于中国医学科学院肿瘤研究所。
715高效液相色谱仪(法国Gilson公司),Zeiss Supra 55VP扫描电镜(德国Zeiss公司),SpectraMax Plus384紫外-可见分光光度计(美国BeckmanCoulter公司),ALPHA 2-4 LD plus低温冷冻真空干燥机(德国Christ公司),CTM8010万能材料试验机(协强仪器制造(上海)有限公司)。
1.2 方法
1.2.1 药膜的制备
将胶原分别用一定浓度(0、0.05、0.1、0.2 mol/ml)的京尼平(4℃,pH 6.5)交联12 h,去离子水充分漂洗去除交联液,二次冻干,得胶原多孔膜。选用W/O/W溶剂挥发法制备载VCR的PLGA微球[5],然后将微球与纤维蛋白按质量比1∶10混合均匀,在上述混合液中加入凝血酶后,立即注入制备好的胶原多孔膜(纤维蛋白胶与胶原的质量比为1∶3),分别得到不同交联剂浓度作用的胶原/纤维蛋白/VCR微球复合药膜(F0、F0.05、F0.1和F0.2)。最后,将制备好的缓释药膜切成直径1 cm的圆形试片待检。
1.2.2 微球及药膜形态观察
将药膜置入液氮冷冻定型后,取出切成小试片后置于金属片上,真空喷金处理后,扫描电镜观察药膜表面形态及其中微球的分布状态。
1.2.3 药膜的孔隙率、pH值及机械强度测定
在25℃条件下,装满乙醇的比重瓶称质量为K1;将质量为K0的药膜置于比重瓶中,脱气处理至乙醇完全充满于药膜中,再次加满乙醇,称质量得到K2;取出药膜后,将比重瓶与剩余的乙醇称质量得到K3。孔隙率(K%)的计算公式如下
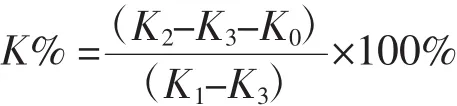
将各样品分别放入试管内,加入10 ml去离子水,使药膜完全浸没,振摇样品使其分散,37℃下浸提72 h。用pH计测量各样品浸提液和同条件下静置72 h去离子水的pH值。
取每种样品各5个,剪成长条状,计算其表面积,用万能材料试验机进行拉伸强度的测试(夹具间距为20 mm,拉伸速度为100 mm/min)。检测其断裂强度及断裂伸长率。

1.2.4 药膜的体外降解性
药膜在保干器中充分干燥至恒重后精确称质量为W0,加入酶解液(含I型胶原酶100 U/mg,纤溶酶0.2 mg/ml),置于(37±1)℃、(75±1)r/min的空气浴振荡器中计时反应。每种样品设3个平行实验。反应至一定时间时,各取出一片,用三蒸水充分漂洗,冷冻干燥后称质量W1。按以下公式计算降解百分率(D%)
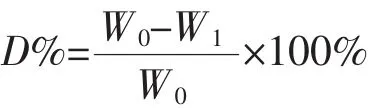
1.2.5 药膜的载药量及体外释药行为
将药膜试片置入试管,加入2.0ml含消化酶(I型胶原酶20 U/mg,纤溶酶0.05 mg/mL)的PBS(pH6.8,37℃),于空气浴振荡器中(37±1)℃、(75±1)r/min振荡,每种药膜的释放同时做4组平行样。相同条件下做对照微球的释放实验。于固定时间间隔离心取全部释放液,并加含等量消化酶的新鲜PBS,高效液相色谱法测定药物含量[5],以累计释放率为纵坐标,时间为横坐标绘制释放曲线。
1.2.6 CCK-8法测定体外抑瘤效应
将贴壁良好的处于指数生长期的3种细胞(A549、MCF-7、HeLa细胞),分别加入胰酶消化后用RPIM-1640培养基稀释成细胞悬液;向96孔板中每孔加入200 μl细胞悬液(1×104/孔),每组设3个空白,置37℃的CO2培养箱中培养24 h;将药膜在不同时间点的释放液加入细胞中,继续培养24 h;加入CCK-8试剂10 μl,孵育1.5 h后,用多功能酶标仪测定450 nm处的吸光度(OD)值,根据下式计算细胞存活率

式中:ODtreated和ODcontrol分别为药品处理及未处理的细胞的吸光度值,ODblank为不加细胞只加CCK-8试剂的吸光度值。
1.3 统计学方法
采用SPSS13.0统计学软件处理数据,数据以均数±标准差(±s)表示,样本均数间比较采用t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 药膜形态、孔径及机械性能
制备的药膜外观完整,表面较粗糙,厚度均匀。其中F0和F0.05药膜呈乳白色,F0.1和F0.2药膜则呈淡蓝色。扫描电镜观察微球呈圆整球形,表面光滑,无粘连;微球包埋于药膜中且分布较均匀(图1)。pH计测得各药膜浸提液的pH值均在6.8~7.2。
F0、F0.05、F0.1和F0.2药膜的平均孔径分别为(243± 42)nm、(182±40)nm、(146±41)nm和(142±34)nm。随着京尼平浓度的增加,支架材料的孔径减小,孔隙率呈下降趋势。未交联的F0药膜质地松软;随着京尼平浓度的增加,硬度增加,断裂伸长率降低(P<0.05,P<0.01),特别是0.2 mol/L京尼平交联的药膜(F0.2药膜)质地较脆。(图2)
2.2 药膜体外降解性

图1 微球与药膜的扫描电镜图
如图3所示,降解16 h时肉眼观察到未交联的药膜(F0药膜)大部分已崩解,只剩一些絮状纤维,经计算药膜剩余质量分数为(23.3±2.4)%;24 h时几乎完全降解,F0药膜只剩少量沉淀;随着京尼平浓度的增加,药膜的降解速率降低,如F0.05、F0.1和F0.2的药膜在16 h时的降解剩余质量分数分别为(50.4±3.5)%、(63.4±3.1)%和(67.2±3.2)%。在酶解液的作用下,F0.1和F0.2药膜的降解速率基本一致(P>0.05)。
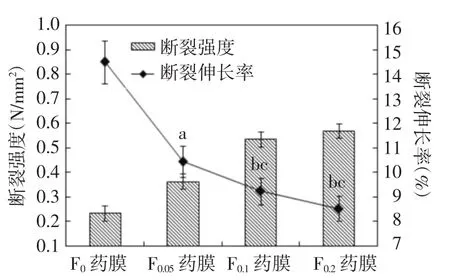
图2 药膜的断裂强度和断裂伸长率测定
2.3 药膜的释药行为
如图4所示,VCR在药膜的释放呈典型的三相释放,起始24 h突释在34.6%~41.8%;随着京尼平交联浓度的增加,药物的突释明显降低,3组交联后的药膜(F0.05、F0.1和F0.2药膜)的释放速率均小于未交联的药膜(F0药膜)。同时,F0、F0.05、F0.1和F0.2药膜分别在72、96、120和144 h时释药趋向平稳,释放量间差异无统计学意义(P>0.05)。其中F0.1和F0.2药膜的释放速率及释放行为基本一致。
2.4 药膜释放液的体外抑瘤效应
综合上述研究结果,选择F0.1药膜进行体外释放药液的抑瘤实验。采用CCK-8法测定药膜在不同时间释放的VCR药液对肿瘤细胞株的抑制作用。结果如图5所示,将未载药的F0.1药膜在不同时间的释放液分别加入3种肿瘤细胞株(A549、MCF-7和HeLa)培养24 h后3种细胞的细胞活力均在90%以上。载药的F0.1药膜在12 h时释放的药液对3种细胞的抑制率最大,A549、MCF-7和HeLa细胞的细胞活力分别为(12.4±1.2)%、(15.6±1.5)%和(17.2± 1.7)%;在144 h时释放的药液对细胞的抑制率最小,细胞活力最大。在3种细胞中,相同剂量(相同时间段的释放量)的VCR药液对A549细胞的抑瘤效应较强,差异具有统计学意义(P<0.05)。
3 讨论与结论

图5 不同时间的药膜释放液对3种肿瘤细胞活力的影响
化疗药物治疗肿瘤的疗效主要取决于肿瘤部位的有效药物浓度与作用时间。由于化疗药物毒性较大,限制了其临床用量,此外,化疗药物不能在肿瘤部位达到较高的药物浓度并维持较长的作用时间,导致效果不够理想。因此,寻找一种能在体内维持较长时间的有效药物浓度,尤其能在肿瘤局部发挥持续效用的化疗药物剂型,可对肿瘤的治疗产生良好效果[10-11]。鉴于此,本研究试图通过将化疗药物VCR制成微球后,再与纤维蛋白胶及胶原复合成药膜,达到双重缓释效果,微球加入到纤维蛋白胶中可使载药微球较均匀地分布于胶原膜中。该药膜目的用于植入肿瘤术后瘤床,进行间质化疗[5],起到类似靶向作用,实现肿瘤组织局部的高浓度持续给药,从而达到提高抗肿瘤效果的目的。
京尼平是天然来源的交联剂,以其低细胞毒性和高生物相容性成为研究热点,可交联细胞组织和包含伯胺的生物材料。Ⅰ型胶原蛋白材料经京尼平交联后,可通过分子间的化学反应使胶原内部和胶原间的联系更加紧密,从而改变材料的极限抗张强度、最大载荷及弹性模量等力学性能;同时,降解速度和体内稳定性亦可得到明显改善[6-7]。但是在一定条件下,京尼平与氨基酸能发生呈色反应生成栀子蓝色素[12],因此用京尼平交联后,Ⅰ型胶原蛋白材料由白色变为蓝色。
交联后的药膜随交联剂浓度的增加,机械强度增加,体外降解速率降低;明显降低了药物的突释,并延缓了药物的释放,使释放速率更缓慢、平稳。在一定浓度时,随交联剂浓度增加,药物缓释的效果愈加明显。F0.1和F0.2药膜的体外降解速率基本无差异,其体外药物释放行为也基本一致。这是因为药物释放受浓度梯度和体系降解两方面因素影响。药物被速度限制性可降解载体膜(PLGA、纤维蛋白胶和胶原)包裹,药物随着载体的降解而释放;如果载体基质降解速度高于药物扩散速率,药物释放就由载体基质降解速率决定[13-14]。
药膜由于其药物释放缓慢,且可较长时间地发挥作用,因此推测对肿瘤细胞的抑制作用更为明显。结合药膜的机械性能与释药行为,选择F0.1药膜进行体外抑瘤效应实验。VCR属细胞周期特异性药物,临床主要用于治疗急性淋巴细胞白血病、恶性淋巴肿瘤、小细胞肺癌、乳腺癌、卵巢癌和消化道癌[11]。F0.1药膜体外12 h时释放的药液,对3种肿瘤细胞的抑制率最显著,这和体外药物在12 h时释放的药量最大一致;120~144 h之间F0.1药膜释放的药液无显著增加,故此时间段释放的药液,细胞抑制率最小。研究发现,3种肿瘤细胞株具有不同的药物敏感度,其中药物对A549细胞的抑瘤效应最强。另外需要特别指出,由于体内外的药物释放行为存在着差别,体内外抑瘤实验也并不完全等同,因此上述研究结果尚待下一阶段的动物实验证实。由于肿瘤细胞株具有不同的生物学效应,故对药物的敏感性也不同,继而不同肿瘤的用药剂量也不同,需根据具体情况给药。
综上所述,将载药微球与纤维蛋白胶和胶原制备成复合药膜,可减少药物突释,延长药物作用时间。选用京尼平作为交联剂可增强药膜的机械强度,延缓体内降解速率。综合考虑药膜的理化等性质,F0.1药膜各方面性质最优,符合本研究需要,体外细胞抑瘤实验表明F0.1药膜对于A549细胞抑瘤效应较强。下一步将通过体内肿瘤模型实验进一步研究该植入药膜的抑瘤效应。
[1]陈红丽,晏杰,张彤,等.胶原-壳聚糖复合材料作为组织工程支架的研究[J].国际生物医学工程杂志,2010,33(4):197-200.DOI: 10.3760/cma.j.issn.1673-4181.2010.04.002. Chen HL,Yan J,Zhang T,et al.Study on collagen-chitosan complex film in tissue engineering scaffolds[J].Int J Biomed Eng,2010,33(4): 197-200.DOI:10.3760/cma.j.issn.1673-4181.2010.04.002.
[2]PeiY,YangJ,LiuP,etal.Fabrication,propertiesand bioapplications of cellulose/collagen hydrolysate composite films[J]. Carbohydr Polym,2013,92(2):1752-1760.DOI:10.1016/j.carbpol. 2012.11.029.
[3]Kojima C,Nishisaka E,Suehiro T,et al.The synthesis and evaluation of polymer prodrug/collagen hybrid gels for delivery into metastatic cancer cells[J].Nanomed-Nanotechnol,2013,9(6):767-775.DOI:10.1016/j.nano.2013.01.004.
[4]陈红丽,吕洁丽,南文滨,等.胶原/纤维蛋白胶/载BSA微球复合支架的制备及体外性能研究[J].中国生物医学工程学报,2014, 33(1):79-85.DOI:10.3969/j.issn.0258-8021.2014.01.012. Chen HL,Lv JL,Nan WB,et al.Preparation and in vitro characteristics of collagen/fibrin/BSA microspheres complex tissue engineering scaffolds[J].Chin J Biomed Eng,2014,33(1):79-85. DOI:10.3969/j.issn.0258-8021.2014.01.012.
[5]Chen HL,Chen H,Liu LR,et al.The study of improved controlled release of vincristine sulfate from collagen-chitosan complex film[J]. Artif Cell Blood Sub,2008,36(4):372-385.DOI:10.1080/ 10731190802239057.
[6]Gorczyca G,TylingoR,Szweda P,etal.Preparationand characterization of genipin cross-linked porous chitosan-collagengelatin scaffolds using chitosan-CO2solution[J].Carbohydr Polym, 2014,102(15):901-911.DOI:10.1016/j.carbpol.2013.10.060.
[7]Ko CS,Huang JP,Huang CW,et al.Type II collagen-chondroitin sulfate-hyaluronan scaffold cross-linked by genipin for cartilage tissue engineering[J].J Biosci Bioeng,2009,107(2):177-182.DOI: 10.1016/j.jbiosc.2008.09.020.
[8]Chatzistavrou X,Rao RR,Caldwell DJ,et al.Collagen/fibrin microbeads as a delivery system for Ag-doped bioactive glass and DPSCs for potential applications in dentistry[J].J Non Cryst Solids, 2016,432,Part A(15):143-149.DOI:10.1016/j.jnoncrysol.2015.03. 024.
[9]Rioja AY,Annamalai RT,Paris S,et al.Endothelial sprouting and networkformationincollagen-andfibrin-basedmodularmicrobeads[J]. Acta Biomater,2016,29(1):33-41.DOI:10.1016/j.actbio.2015. 10.022.
[10]Charoen KM,Fallica B,Colson YL.et al.Embedded multicellular spheroids as a biomimetic 3D cancer model for evaluating drug and drug-device combinations[J].Biomaterials,2014,35(7):2264-2271. DOI:10.1016/j.biomaterials.2013.11.038.
[11]Conter V,Valsecchi MG,Silvestri D,et al.Pulses of vincristine and dexamethasone in addition to intensive chemotherapy for children with intermediate-risk acute lymphoblastic leukaemia:a multicentre randomised trial[J].Lancet,2007,369(9556):123-131.DOI:10. 1016/S0140-6736(07)60073-7.
[12]Liang HC,Chang Y,Hsu CK,et al.Effects of crosslinking degree of an acellular biological tissue on its tissue regeneration pattern[J]. Biomaterials,2004,25(17):3541-3552.DOI:10.1016/j.biomaterials. 2003.09.109.
[13]Ahmad E,Fatima MT,Hoque M,et al.Fibrin matrices:The versatile therapeutic delivery systems[J].Int J Biol Macromol,2015,81:121-136.DOI:10.1016/j.ijbiomac.2015.07.054.
[14]Hong CK,Kim YB,Hong JB,et al.Sealing of cerebrospinal fluid leakage during conventional transsphenoidal surgery using a fibrincoated collagen fleece[J].J Clin Neurosci,2015,22(4):696-699. DOI:10.1016/j.jocn.2014.10.019.
Characteristic of collagen/fibrin complex film and the preliminary study of its in vitro anti-tumor effect
Chen Hongli,Xu Jiadi,Nan Wenbin,Guo Shuang,Li Wushan,Lian Jie,Feng Huigen,Lin Juntang
School of Life Science and Technology,Xinxiang Medical University;Stem Cell and Biotherapy Technology Research Center of Henan Province,Xinxiang 453003,China
Corresponding author:Chen Hongli,Email:chenhlhl@126.com
ObjectiveTo investigate the properties of vincristine sulfate(VCR)loaded collagen/fibrin microspheres complex film,especially to give evaluation of the concentration of genipin(0,0.05,0.1 and 0.2 mol/ml) as a cross-linking agent on the properties of the film.MethodsPorous collagen film were fabricated by freeze-drying method and cross-linked by genipin.VCR loaded microspheres were mixed with fibrin into collagen scaffolds to fabricate the complex film.The physiochemical properties of the film,such as surface morphology,mechanical function,in vitro degradation and VCR release kinetics were also measured.In vitro cytotoxicities of VCR loaded film were evaluated using CCK-8 assay.ResultsThe tensile strength of the film was strengthened and the breaking elongating rate of the film decreased with more proportion of genipin.The degradation rates of the films(F0.05,F0.1and F0.2)were slower than that of the F0film.VCR was released from the film in a prolonged period and the initial burst release of the film was less significant.The initial release of F0was(41.8±3.4)%,while of the films which cross linked (F0.05,F0.1and F0.2)were(38.4±4.1)%,(35.2±3.6)%and(34.3±3.7)%,respectively.The results showed that drug free film cross-linked by genipin(F0.1)possesses very low cytotoxicity to the tumor cells.The released VCR showed high in vitro inhibitive effects on HeLa,MCF-7 and A549 with different sensitivity on each line.ConclusionsF0.1film can achieve the release kinetics at a relatively constant speed.It has the potential for application as a carrier of anticancer drugs.
Genipin;Microspheres;Collagen;Fibrin;In vitro anti-tumor effect
陈红丽,Email:chenhlhl@126.com
10.3760/cma.j.issn.1673-4181.2016.01.001
国家自然科学基金(U1304819,81401519);河南省科技攻关项目(122102210148);国家级大学生创新训练计划项目(201310472034)
2015-11-04)
