共聚焦显微镜观察2型糖尿病患者角膜神经纤维变化情况
2024-01-13张金金田建英
朱 艳,张金金,潘 薇,田建英
2型糖尿病是一种以胰岛素分泌和作用受损为特征的代谢性疾病[1],已成为全球性流行病。长期慢性高血糖可导致多种微血管及神经病变。糖尿病的眼部并发症包括糖尿病视网膜病变(DR)、糖尿病视神经病变、白内障和眼表疾病等[2]。目前,糖尿病眼部并发症的研究主要集中在眼底病变方面,例如DR已经得到了广泛的研究。有研究指出,糖尿病患者眼表并发症发生率较高,在糖尿病人群中的发生率为17.5%~65.3%[3],然而,目前对于糖尿病患者眼表病变的研究相对较少[3]。糖尿病患者会出现角膜神经纤维进行性丢失和角膜敏感度下降等情况[4]。这可能导致神经再生延迟、伤口愈合延迟、干眼症、持续上皮缺损和营养不良性溃疡[5],严重影响患者的生活质量。而活体角膜共聚焦显微镜是一种研究角膜神经纤维结构的重要方法。本研究通过共聚焦纤维镜观察角膜神经纤维的结构改变来为探究角膜神经纤维结构损害的发病机制提供参考。
1 资料与方法
1.1 一般资料:本研究纳入2020年6月至2023年1月于宁夏回族自治区人民医院眼科确诊的2型糖尿病患者90例(90只眼)及正常人群30例(30只眼)。将2型糖尿病患者分为非增殖期DR(NPDR)组及增殖期DR(PDR)组,无DR的糖尿病患者则纳入NDR组。
1.1.1 纳入标准:年龄≥18岁且无全身病,除轻度屈光不正外无眼部疾病;NDR组、对照组人群选右眼为纳入眼。如果DR患者双眼均可入组,则选择右眼纳入。
1.1.2 排除标准:年龄<18岁;屈光不正等效球镜度数绝对值>3[D],无法配合角膜共聚焦显微镜检查的个体;角膜共聚焦显微镜所获取的图片质量差者;患有特殊类型糖尿病或1型糖尿病者;合并严重糖尿病并发症者,包括低血糖、酮症酸中毒等;长期佩戴美瞳或隐形眼镜者;有眼部外伤史、手术史的患者;患有除糖尿病眼病外的其他眼部病变者,如维生素B12缺乏症等;患有其他可引起周围神经病变者;严重干眼症或睑板腺功能障碍者;屈光介质混浊且影响眼底情况评估的患者。
1.2 诊断标准:依据《中国2型糖尿病防治指南》(2020年版)[6]做出诊断,即糖尿病典型症状加上空腹血糖≥7.0 mmol/L或加上随机血糖≥11.10 mmol/L或加上口服葡萄糖耐量试验2 h 血糖≥11.10 mmol/L或加上HbA1c≥6.5%。典型糖尿病症状有多饮、烦渴、多食、多尿、原因不明的体重下降,对于无典型糖尿病症状的患者则需进行复查后再确认[6]。
1.3 DR诊断:依据国际临床糖尿病视网膜病变量表对NDR和DR患者进行诊断和分期[7]。
1.4 方法:收集纳入人群的基本信息,包括年龄、性别,有无眼部疾病、外伤史、手术史、佩戴美瞳、隐形眼镜史或其他疾病史,对于糖尿病患者还须记录其糖尿病病程。所有入组的患者均行基本眼科检查,包括最佳矫正视力、眼压、裂隙灯检查、裂隙灯下眼前节及眼底检查、眼底彩照等。
1.5 角膜共聚焦显微镜检查及神经纤维指标的测量:角膜共聚焦显微镜检查采用德国海德堡公司的HRT3激光角膜共聚焦显微镜。该显微镜使用了670 nm波长的激光作为扫描光源,其具有800倍的高放大倍率和1pm的横向分辨率,能够覆盖每幅图像400 μm×400 μm大小的角膜面积并可采集大小为384像素×384像素的图像。所有患者的共聚焦显微镜检查都由同一位技师完成。在进行检查时,受检者须预先进行充分的眼球表面麻醉,随后使用开睑器撑开眼睑,嘱咐受检者垂直坐立,使头位和显微镜探头保持垂直。使用手柄调节探头与角膜的距离,使其接触至中央角膜表面。选定瞳孔区的中央角膜上皮基底下神经丛作为采集区域,扫描的深度为30~90 μm。调整焦平面调节旋钮,使图像清晰显示,采集入组患眼角膜中央区域的正中、左、右、上、下处神经纤维结构图像5张。使用Image-Pro Plus 6.0软件对所采集的图像进行逐一分析计算并取其平均值。记录入组个体角膜的角膜神经纤维密度(NFD),即图像中神经纤维主干的数量除以图像面积,单位为条/mm2;角膜神经纤维长度(NFL)即图像中的神经纤维主干的长度加上所有神经纤维分支的长度再除以图像面积,单位为mm/mm2; 角膜神经纤维分支密度(NFB)即图像中神经纤维分支的数量除以图像面积[8-9],单位为条/mm2;角膜神经纤维弯曲度(NFT)依据Oliveira-Soto分级标准进行评分[10]。该标准使用角膜神经的方向变化幅度和频率进行评分。0分表示神经纤维的走形基本呈直线;1分表示神经纤维走形略有弯曲;2分表示神经纤维走形呈中度弯曲,出现方向变化频繁的神经纤维但其变化幅度小;3分表示神经纤维走形呈明显弯曲,方向变化的幅度较大;4分表示神经纤维方向改变较为突然且频繁,走形非常弯曲。

2 结果
2.1 基本资料:本研究共纳入正常个体的30只眼及2型糖尿病患者的90只眼,90只眼包括NDR(30只眼)、NPDR(30只眼)及PDR(30只眼)。各组一般资料特征及比较见表1。正常对照组、NDR组、NPDR组及PDR组的年龄、性别之间比较,差异无统计学意义(P>0.05),见表1。
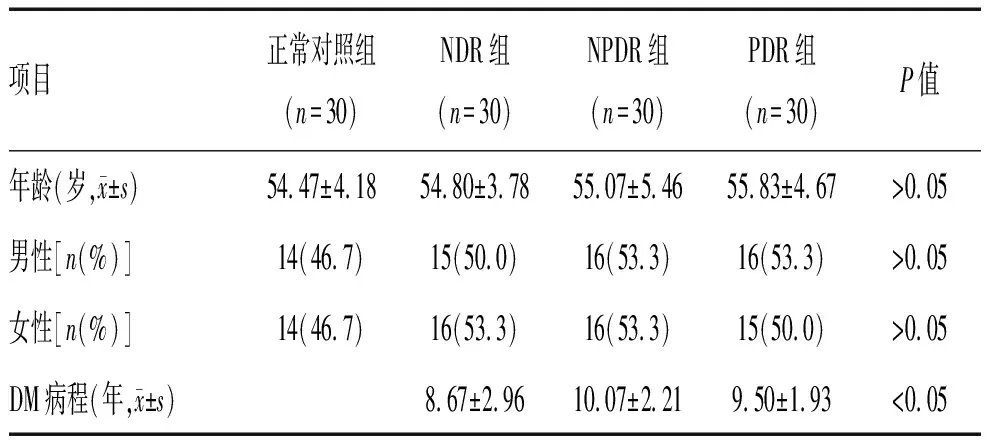
表1 2组患者基本资料比较
2.2 正常对照组及糖尿病患者角膜神经纤维基本特征:正常对照组、NDR组、NPDR组及PDR组神经纤维比较差异有统计学意义(P<0.05),见表2。各组神经纤维共聚焦结果见图1(目次后)。

表2 正常对照组及糖尿病患者角膜神经纤维基本特征
2.3 糖尿病患者角膜神经纤维参数与年龄、糖尿病病程的相关性分析:将所有糖尿病患者的角膜神经纤维参数与年龄、糖尿病病程进行Pearson相关系数分析,见表3。糖尿病患者NFL与糖尿病病程相关(P<0.05),而与年龄不相关(P>0.05)。将Pearson相关系数分析中与角膜神经纤维显著相关的参数输入多元线性逐步回归模型中,以最终检验每个参数与角膜神经纤维指标的独立关联。NFL与糖尿病病程呈负相关(P<0.05);NFD与年龄糖尿病病程呈负相关(P<0.05);NFT与年龄、糖尿病病程呈正相关(P<0.05),见表4至表6。

表3 糖尿病患者角膜神经纤维参数与年龄、糖尿病病程的相关分析(r值)

表4 糖尿病患者NFL的多元线性逐步回归分析

表5 糖尿病患者NFD的多元线性逐步回归分析

表6 糖尿病患者NFT的多元线性逐步回归分析
3 讨论
本研究利用活体角膜共聚焦显微镜探究糖尿病患者角膜神经纤维结构改变。结果发现NDR组、NPDR组及PDR组NFL、NFD、NFB均显著降低,而NFT显著升高,提示糖尿病患者在出现明确的眼底病变前,其角膜神经纤维就已出现隐匿性的神经纤维损害。进一步的多元线性回归分析结果显示,NFL与糖尿病病程呈显著负相关;NFD与年龄、糖尿病病程呈显著负相关;NFT与年龄、糖尿病病程显著呈正相关。上述结果提示角膜神经纤维结构参数可能受多种因素影响,包括年龄、糖尿病病程。
角膜是人身体中神经分布最密集的组织,1 mm2约有7 000个游离神经末梢[11]。其神经纤维来源于三叉神经的眼支,在进入角巩膜韧带后约1 mm处失去神经鞘和髓鞘。神经纤维在角膜层间穿行,于角膜Bowman层和基底上皮层之间形成支配角膜上皮的基底神经丛[12]。既往对角膜神经纤维的研究往往利用光学和电子显微镜对离体角膜组织进行观察[13]。然而,由于离体的角膜神经在人死亡后的14 h内就已经出现进行性退化,故利用上述技术进行的研究可能会产生不可靠的结果[14]。随着光学设备的进步,活体共聚焦显微镜可对活体角膜组织提供800倍的放大倍率,能精确地对角膜细胞和神经特性进行定量评估[13]。
大量的研究表明,活体角膜共聚焦显微镜是一种可靠的观测手段,可对神经纤维进行观测和量化[15]。利用该技术,本研究发现在出现DR改变前,角膜神经纤维就已出现NFL、NFD、NFB的下降及NFT的增高,提示长期慢性高血糖可导致神经的隐匿性损害。这一发现与既往研究一致,Messmer等发现角膜感觉正常及震动感正常的糖尿病患者已出现显著的NFL、NFD及NFB损害[16]。糖尿病患者角膜神经支配损害可独立存在于未出现神经病变的患者中,即未出现明确神经病变的患者的角膜也可能出现隐匿的角膜神经损害[17]。此外,研究表明角膜神经纤维结构指标与DR的严重程度密切相关。Nitoda等发现,与正常对照组相比,角膜NFL、NFD、NFB在NDR、NPDR及PDR患者中显著降低,而PDR患者NFT则显著升高[18]。此外,与正常对照组相比,NDR患者已出现NFL的显著下降,且NPDR和PDR患者NFD、NFL和NFB差异更大,说明角膜神经纤维损害随着DR的进展而加深[19]。另有研究表明,PDR患者角膜神经损害程度比未患DR者更为明显[20]。这些研究结果与本研究结果类似。因此,长期高血糖会导致角膜神经纤维结构的隐匿性损害,角膜共聚焦显微镜可在出现明显DR改变前甚至在糖尿病前期检测出该结构是否损害。
本研究发现,2型糖尿病患者角膜神经纤维结构受多种因素影响,可能的因素包括年龄、糖尿病病程。有研究表明,正常人角膜神经纤维密度随着年龄的增长呈现缓慢下降的趋势,平均每年下降0.25%~0.30%[21],其他针对正常人的研究亦得出类似结果[22]。在糖尿病患者中,有研究表明1型糖尿病患儿角膜NFL、NFD、NFB与年龄显著正相关[23]。本研究显示糖尿病病程对NFL、NFD、NFB、NFT的影响大于年龄对其影响。
