免疫治疗联合安罗替尼治疗难治性晚期非小细胞肺癌的效果
2024-01-13王志妍王超冯丽娜
王志妍,王超,冯丽娜
作者单位:024000 内蒙古自治区赤峰市肿瘤医院/赤峰学院第二附属医院
肺癌作为临床常见、高发性恶性肿瘤疾病之一,其中85%左右为非小细胞肺癌(NSCLC)。近年来,在环境污染问题加剧的影响下,肺癌临床发病率呈高发性势态。肺癌患者早期缺乏特异性症状表现,多数群体在确诊时已进展至中晚期,5年内生存期较低。现阶段,对于晚期NSCLC患者临床有明确的一线及二线治疗方案,但针对既往二线及以上系统性化疗失败的患者而言,不同治疗方案其临床疗效及安全性存在明显差异。安罗替尼属于多靶点受体酪氨酸激酶激动剂,其可抑制血管内皮生长因子受体、血小板衍生生长因子受体、成纤维细胞生长因子受体、肿瘤细胞增殖相关受体c-Kit激酶受体的激活,有效抑制血管生成,实现抗肿瘤效果[1]。既往研究调查发现,安罗替尼用于难治性NSCLC患者三线治疗中可延长患者无进展生存期,且不良反应小,安全可控。现阶段,在肺癌治疗中抗血管生成药物与免疫治疗方案已获批,调查发现,该治疗方案的抗肿瘤效果较标准化疗更优[2]。本研究观察免疫治疗联合安罗替尼治疗难治性晚期NSCLC患者的疗效,报道如下。
1 资料与方法
1.1 临床资料 选择2020年1月—2021年12月赤峰市肿瘤医院收治的难治性晚期NSCLC患者300例,采用随机数字表法分为观察组和对照组,每组150例。观察组男83例,女67例;年龄45~73(58.69±5.52)岁;肿瘤分期:Ⅲ期53例,Ⅳ期97例;吸烟史82例,无吸烟史68例;体质量45~86(64.98±4.68)kg。对照组男80例,女70例;年龄43~75(57.56±5.33)岁;肿瘤分期:Ⅲ期46例,Ⅳ期104例;吸烟史79例,无吸烟史71例;体质量46~87(65.85±4.33)kg。2组患者性别、年龄等资料比较差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审核批准,所有患者或家属均对研究内容知情且签署知情同意书。
1.2 选择标准 纳入标准:(1)经组织病理学或细胞学检查证实为晚期NSCLC(Ⅲb期、Ⅳ期);(2)经一线、二线药物多周期化疗失败;(3)预期生存周期超过6个月;(4)年龄18~78岁;(5)经过基因型检测,ECFR或ALK阳性患者已接受过相应靶向治疗;(6)患者凝血功能、心电图、肝肾功能、血尿常规、甲状腺功能、血脂等检查结果均正常。排除标准:(1)存在认知障碍、严重精神障碍的患者;(2)心肝肾功能器质性障碍患者;(3)小细胞肺癌患者;(4)发生脑转移出现症状者;(5)重要血管受到侵犯可能引起大出血者;(6)非自愿参与者。
1.3 治疗方法 对照组应用盐酸安罗替尼胶囊(正大天晴药业集团股份有限公司生产)12 mg口服,每天1次,持续给药2周,停药1周,即3周为1个周期,治疗3个周期。治疗过程中定期复查血压、血尿常规、肝肾功能、凝血功能、心电图、血脂等指标,如患者持续出现Ⅲ~Ⅴ级不良反应[根据美国国立癌症研究所通用毒性分级标准(NCL-CTC)3.0评估]则延迟给药,直至改善到Ⅱ级以下,下调1个剂量水平后持续给药。观察组在对照组基础上应用免疫治疗:帕博利珠单抗注射液[MSD Ireland(Carlow)生产]100 mg加入0.9%氯化钠注射液或5%葡萄糖注射液稀释成1~10 mg/ml静脉滴注,固定用药剂量,每3周1次,持续给药3次。
1.4 观察指标与方法 (1)肿瘤相关因子:治疗前后采集患者肘部静脉血3 ml,抗凝处理,使用离心机离心10 min(转速3 000 r/min)后保留血清,采用酶联免疫吸附法测定肿瘤坏死因子-β1(TNF-β1)、血管内皮生长因子(VEGF)、基质金属蛋白酶2(MMP2)、金属肽酶组织抑制剂-1(TIMP-1)水平。(2)免疫功能指标:治疗前后采集患者空腹静脉血,离心机离心后保留血清,采取全自动化发光免疫分析仪,采用双抗夹心酶联免疫法测定T淋巴细胞亚群(CD3+、CD4+、CD4+/CD8+)、自然杀伤细胞(NK)活性。(3)生存质量:治疗前后参考世界卫生组织生命质量测定量表(WHOQOL-BREF)评估患者生存质量,涉及心理、生理、社会关系、环境、精神世界及独立性6个功能模块,分值与生活质量呈正比。
1.5 疗效评定标准 完全缓解(CR):治疗后全部可见病灶均消失;部分缓解(PR):治疗后全部目标病灶直径总和下降程度>30%;稳定(SD):治疗后全部目标病灶直径总和下降程度20%~30%;进展(PD):治疗后全部目标病灶直径总和下降程度<20%,出现1个或多个新病灶。疾病控制率(DCR)=(CR+PR+SD)/总例数×100%。
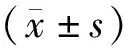
2 结 果
2.1 近期疗效比较 观察组患者DCR为83.33%,高于对照组的74.00%(χ2=3.893,P=0.048),见表1。

表1 对照组与观察组患者近期疗效比较 [例(%)]
2.2 肿瘤相关因子水平比较 治疗前,2组患者TNF-β1、VEGF、MMP2、TIMP-1水平比较差异无统计学意义(P>0.05);治疗3个周期后,2组患者TNF-β1、VEGF、MMP2、TIMP-1均低于治疗前,且观察组低于对照组(P<0.01),见表2。
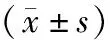
表2 对照组与观察组患者治疗前后肿瘤相关因子水平比较
2.3 免疫功指标比较 治疗前,2组患者CD3+、CD4+、CD4+/CD8+、NK水平比较差异无统计学意义(P>0.05);治疗3个周期后,2组患者CD3+、CD4+、CD4+/CD8+、NK水平均高于治疗前,且观察组高于对照组(P<0.01),见表3。
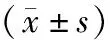
表3 对照组与观察组患者治疗前后免疫功能指标比较
2.4 生存质量评分比较 治疗前,2组患者WHOQOL-BREF各维度评分比较差异均无统计学意义(P>0.05);治疗3个周期后,2组患者WHOQOL-BREF各维度评分均高于治疗前,且观察组高于对照组(P<0.01),见表4。
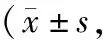
表4 对照组与观察组患者治疗前后生存质量评分比较 分)
3 讨 论
肺癌作为高发性恶性肿瘤疾病的一种,近年来,受到环境污染问题加剧、社会人口老龄化发展等因素的影响,其临床发病率呈明显上升趋势,发病率、病死率在恶性肿瘤疾病中居首位[3]。NSCLC是肺癌的常见类型,致病因素较多,临床普遍认为,其发生与遗传、环境因素、肺部感染、辐射等因素存在相关性。NSCLC转移速度及生长较缓慢,但在早期临床症状不具备典型性,且受当前医疗水平及技术的影响,临床早期诊断准确率普遍较低,多数患者在确诊时疾病已进展至中晚期,错失最佳手术时机,导致5年内生存率明显下降[4]。针对进展期NSCLC患者,临床标准一线治疗方案是以铂类为基础的双药化疗,但目前化疗疗效已进入瓶颈,多数患者在化疗后仍处于肿瘤进展期,而二线单药化疗药物存在较大毒性,且晚期患者普遍机体耐受度差,身体状态不良,患者总体生存期无显著改善,疗效有限[5]。近年来,驱动基因阳性的NSCLC患者应用分子靶向药物治疗后患者预后得到显著改善,但仍有部分群体最终会出现耐药情况。对于此类经标准化疗或表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)治疗无效的难治性晚期NSCLC患者尚无统一治疗方案,临床待完善[6]。
肿瘤脉管系统会影响肿瘤生长,在一定不良肿瘤微环境下,可促使其转移,加快肿瘤进展;且肿瘤生长与转移依赖血管的生成,血管为肿瘤生长输送氧气及营养,同时血管是肿瘤细胞离开肿瘤部位进入血液循环的有效通道,其中抗血管生成因子、促血管生成因子均参与该过程的调节;而肿瘤微循环中肿瘤脉管系统的形成与促血管生成因子、血管内皮生长因子的过度表达密切相关,故各种血管生成抑制的靶向药物被研发出来。VEGF是促进血管生成的重要因子,VEGF信号抑制是肿瘤治疗的重要方法,如利用贝伐单抗[7]。常见的促血管生成因子有血小板衍生因子(PDGF)、碱性成纤维细胞生长因子(FGF-2)、VEGF等,其中PDGF、FGF-2不仅能够独立发挥促血管生成作用,同时还可以辅助VEGF发挥作用,但受抑制肿瘤的VEGF促血管生长作用仍较大,故对于VEGF靶点药物对晚期肿瘤患者的疗效受限,且发生耐药的风险较高[8-9]。研究发现,肿瘤细胞的异常增殖及分化、转移与蛋白酪氨酸激酶信号通路密切联系,利用对酪氨酸激酶通路的阻断、干扰,可实现对肿瘤细胞生长的直接影响。安罗替尼是一种口服小分子多靶点酪氨酸激酶抑制剂,可以强效抑制VEGF、PDGF、FGF-2等促血管生成的多个靶点,实现抗肿瘤生长的作用,同时该药物与VEGF等单克隆抗体不发生交叉耐药性[10]。安罗替尼还可对促进肿瘤细胞增殖的相关受体c-Kit及通路发挥抑制作用,控制肿瘤细胞增殖,在抗肿瘤方面发挥双重作用。此外,在NSCLC治疗中应用安罗替尼可有效减少口腔黏膜、高血压、腹泻等不良反应发生风险,保障治疗安全性。
近年来,随着新的免疫治疗靶点被发现,免疫治疗逐渐被广泛应用于临床,研究资料显示,该治疗手段对提高晚期NSCLC患者治疗安全性及有效性发挥显著作用[11]。程序性死亡受体-1(PD-1)抑制剂可提高肿瘤细胞PD-1配体,有效抑制激活的T细胞,增强T细胞、巨噬细胞、NK等抗癌细胞能力,同时还能对肿瘤病灶进行免疫监视,使PD-1活性被阻断,实现杀死或破坏细胞的作用,以有效控制病情进展,提高患者生存周期[12]。本研究结果显示,观察组患者DCR高于对照组;治疗后,2组患者TNF-β1、VEGF、MMP2、TIMP-1水平均低于治疗前,且观察组低于对照组,可见实施免疫治疗联合安罗替尼治疗,可起到良好的抗肿瘤效果,对肿瘤细胞生长抑制,同时可调控肿瘤细胞凋亡,进而控制肿瘤病灶生长,预后良好[13]。此外,本研究结果显示,治疗后2组患者CD3+、CD4+、CD4+/CD8+、NK水平及WHOQOL-BREF量表各维度评分均高于治疗前,且观察组高于对照组。在晚期难治性NSCLC患者治疗中在安罗替尼基础上联合应用PD-1,可明显加剧细胞程序性死亡,增强机体免疫,控制肿瘤细胞增殖;通过该治疗方案可有效改善患者整体健康状态,分析原因是联合应用安罗替尼与PD-1,可抑制肿瘤细胞,缩小肿瘤病灶,进而有效降低肿瘤负荷,改善患者脏器压迫,同时患者经治疗后胸闷、疼痛等肺癌相关症状得显著改善,机体生理不适感明显降低,焦虑、抑郁等情绪也得到缓解,患者心理状态良好。通过研究可发现,免疫治疗联合安罗替尼是晚期NSCLC患者治疗的新方案,可行性高,且安全可靠,即使患者经多线治疗失败后应用免疫治疗联合安罗替尼仍可取得良好的疗效。但本研究纳入样本量较少,数据存在一定局限性,后期需进一步扩大样本容量以评估免疫治疗联合安罗替尼治疗的安全性及有效性[14]。
综上所述,免疫治疗联合安罗替尼治疗难治性晚期NSCLC的效果好,可使患者获益,提高疾病控制率,控制病情进展,增强机体免疫功能,进一步提升患者生存质量。
利益冲突:所有作者声明无利益冲突。
