上海地区支气管扩张症患者铜绿假单胞菌耐药机制和分子流行病学特征
2024-01-12孙景勇
陈 庆 徐 蓉 孙景勇
(1.上海交通大学医学院附属瑞金医院临床检验诊断中心,上海 200025;2.上海市临床检验中心临床微生物学研究室,上海 200126)
铜绿假单胞菌(Pseudomonas aeruginosa,PA)是一种条件致病革兰阴性杆菌,在自然界中普遍存在,是医院获得性感染的主要病原。根据菌落形态,PA可分为黏液型和非黏液型。支气管扩张症被认为是仅次于哮喘和慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)的第三大常见慢性呼吸道疾病,患者痰样本中常分离出PA,PA感染是影响支气管扩张严重程度和患者预后的一个重要危险因素,PA反复感染会导致病情频繁恶化、死亡率增加。目前,支气管扩张合并PA感染患者PA的耐药特征、耐药机制和分子流行病学相关研究较少。本研究拟分析支气管扩张合并PA感染患者耐药和分子流行病学特征,为临床诊治提供参考。
1 材料和方法
1.1 样本来源
收集分离自2019年6月—2021年11月上海地区6家三级甲等医院18~75岁支气管扩张症患者痰样本的PA 73株。采用基质辅助激光解析电离-飞行时间质谱(matrix-assisted laser desorption ionization time-of-flight mass spectrometry,MALDI-TOF,bio Mérieux,France)进行菌种鉴定,采用下一代基因测序技术(next generation sequencing,NGS)进行确认,通过菌落形态和拉丝试验判定是否为黏液型PA。质控菌株铜绿假单胞菌(ATCC 27853)购自上海市临床检验中心。本研究经上海交通大学医学院附属瑞金医院伦理委员会审核通过。
1.2 方法
1.2.1 体外药物敏感性试验
参照美国临床实验室标准化协会(the Clinical and Laboratory Standards Institute,CLSI)M100-Ed32文件[1]对分离的PA菌株进行体外药物敏感性试验。测定的抗菌药物包括:头孢他啶(ceftazidime,CAZ)、哌拉西林/他唑巴坦(piperacilin/tazobactam,TZP)、美罗培南(meropenem,MEM)、妥布霉素(tobramycin,TOB)、阿米卡星(amikacin,AMK)、环丙沙星(ciprofloxacin,CIP)、左氧氟沙星(levofloxacin,LEV)、多黏菌素B(polymyxinB,PB)、头孢吡肟(cefepime,FEP)、亚胺培南(imipenem,IPM)、哌拉西林(piperacillin,PIP),结果根据CLSI M100-Ed32文件[1]中的标准进行解释。
1.2.2 DNA旋转酶、DNA拓扑异构酶Ⅳ、膜孔蛋白OprD比对
培养、分离、纯化PA菌株后,提取分离株的DNA,送至上海美吉生物医药科技有限公司进行NGS(细菌基因组扫描图),获得分离株的核酸序列和预测的氨基酸序列。将73株PA中对左氧氟沙星或环丙沙星非敏感菌株预测的氨基酸序列与GenBank数据库(https://blast.ncbi.nlm.nih.gov/)PA标准株PAO1的DNA旋转酶亚单位GyrA、GyrB和DNA拓扑异构酶Ⅳ亚单位ParC、ParE的氨基酸序列进行比对分析;将73株PA中对亚胺培南非敏感菌株预测的氨基酸序列与GenBank数据库(https://blast.ncbi.nlm.nih.gov/)PA标准株PAO1中膜孔蛋白OprD的氨基酸序列进行比对分析。使用SnapGene-4.24软件对上述结果进行比对分析。
1.2.3 耐药基因检测和同源性分析
将NGS所得核酸序列与Resfinder数据库(https://cge.cbs.dtu.dk/services/ResFinder/)进行比对,统计PA分离株中所含的耐药基因。根据测定的核酸序列对菌株进行多位点序列分型(multilocus sequence typing,MLST),将所得核酸序列(7个管家基因:guaA、acsA、mutL、trpE、aroE、nuoD、ppsA)与PubMLST数据库(https://pubmlst.org/organisms/pseudomonasaeruginosa)进行比对,统计分离株的MLST结果,用phyloviz-2.0软件进行MLST分析,基于phyloviz算法对菌株进行分组,基于等位基因特征的组定义绘制草图,以显示遗传关系[2-3]。
1.3 统计学方法
采用WHONET 5.6软件分析最终药物敏感性试验数据,采用SPSS 25.0软件分析黏液型与非黏液型PA耐药率的差异。以P<0.05为差异有统计学意义。
2 结果
2.1 不同性别患者黏液型PA检出情况
73株PA中,分离自男性、女性患者样本的菌株分别为24株(32.9%)、49株(67.1%)。73株PA中,有43株(58.9%)为黏液型PA,30株(41.1%)为非黏液型菌株。
2.2 PA分离株对不同抗菌药物的耐药性
73株PA对喹诺酮类抗菌药物的耐药率最高,对左氧氟沙星的耐药率为41.1%,对环丙沙星的耐药率为34.2%;非黏液型PA对亚胺培南的耐药率(20.0%)远高于黏液型PA(7.0%)。未发现对多黏菌素B和阿米卡星耐药的PA菌株。黏液型与非黏液型PA对临床常用抗菌药物的耐药率差异无统计学意义(P>0.05)。见表1。
2.3 PADNA旋转酶、DNA拓扑异构酶Ⅳ比对结果
73株PA中,对左氧氟沙星或环丙沙星耐药的PA共44株。将这44株PA与PAO1进行比对,结果显示,有单个蛋白突变15株,双蛋白突变15株,3个蛋白突变10株,4个蛋白突变1株,4个蛋白均无突变菌株3株。见表2。

表2 PA DNA旋转酶、DNA拓扑异构酶Ⅳ突变预测结果
2.4 PA膜孔蛋白OprD比对结果
73株PA中,对亚胺培南非敏感的铜绿假单胞菌共13株,将这13株菌与PAO1进行比对,结果显示全部存在突变或缺失。13株对亚胺培南敏感的PA中,有7株(53.8%)的突变类型(43D-N、57S-E、59S-R、202E-Q、210I-A、230E-K、240S-T、262N-T、267A-S、281AG、296K-Q、301Q-E、310R-G、359V-L、372-383:MSDNNVGYKNYG-VDSSSS缺失YAGL)完全一致,有5株(38.5%)存在替换合并大片段丢失,有1株(7.7%)存在3个位点(103TS、115K-T、170F-L)的突变。
2.5 PA分离株检出获得性耐药基因情况
73株PA中,共发现20种不同类型的获得性耐药基因,包括β-内酰胺类、氨基糖苷类、磷霉素类、氯霉素类、磺胺类、喹诺酮类,见表3。所有菌株都含有blaPAO、aph(3')-IIb、fosA和catB7;体外药物敏感性试验结果显示,绝大多数耐药基因与耐药表型是一致的,但所检出的获得性耐药基因crpP与喹诺酮类抗菌药物的耐药表型不相符。
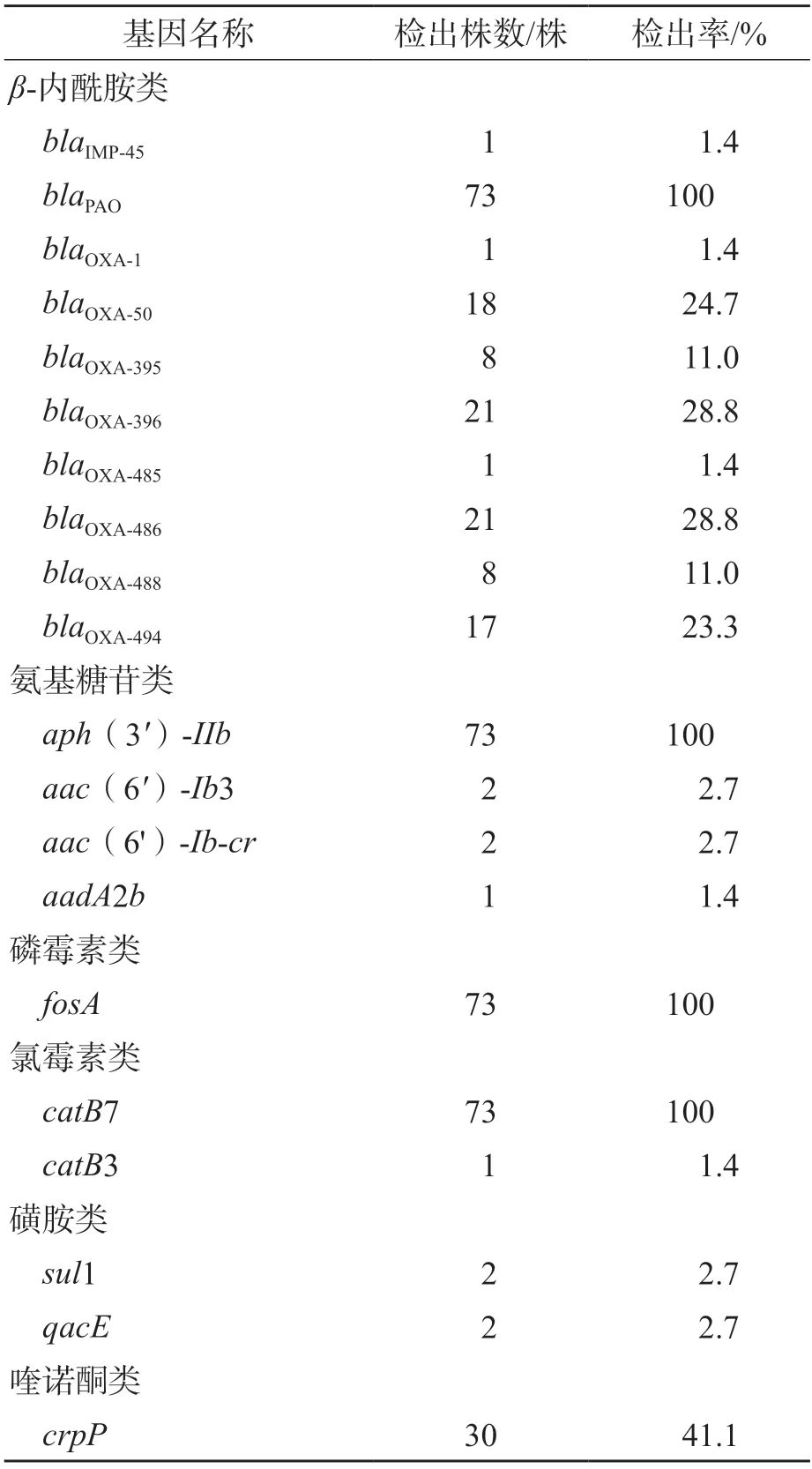
表3 73株PA耐药基因分布
2.6 73株PA的MLST结果
73株PA共检出52个ST型别,其中1株为新发现的ST型,已递交PubMLST数据库。居第1位的ST型别为ST277,占5.5%(4/73),其次是ST274、ST357、ST514,各占4.1%(3/73)。52种ST型被分成12个克隆复合体,仅ST357(编号C470、C473、C694)与ST3991(编号C125)属于同一个克隆复合体,并在进化上具有一定的同源性。73株PA菌株MLST最小生成树见图1。

图1 PA MLST最小生成树
3 讨论
PA是常见的条件致病菌,也是导致支气管扩张症患者感染的最主要病原体。PA的感染或定植与支气管扩张的发生、发展关系密切,该菌及其毒力基因会影响疾病的急性加重频率和患者预后(如肺功能较差、肺功能下降速度更快、病死率更高)[4]。本研究收集了上海地区73例支气管扩张症患者痰样本中分离出的PA,从性别比例上看,女性多于男性,与顾悦等[5]的研究结果相符。本研究结果显示,支气管扩张症患者感染的PA中,黏液型所占比例较大(58.9%),与相关研究结果[6]一致。黏液表型的出现与PA通过群集感应系统调控生物膜的形成有关。而黏液型PA更容易定植于支气管扩张症患者气道中,产生生物膜,不易被清除,同时产生毒力因子攻击宿主细胞,导致多重耐药和反复的支气管-肺感染,为临床治疗带来更多的挑战。
本研究结果显示,PA对氟喹诺酮类药物的耐药率最高(对左氧氟沙星、环丙沙星的耐药率分别为41.1%和34.2%),且黏液型PA的耐药性高于非黏液型PA;对亚胺培南的耐药率为12.3%,但黏液型菌株的耐药率低于非黏液型;对其他类抗菌药物的耐药率均<6%。2020年全国细菌耐药监测报告显示,PA对环丙沙星、左氧氟沙星的耐药率全国平均分别为12.2%、13.4%[7],远低于本研究结果。任何药物在治疗PA感染的过程中均可产生耐药,而氟喹诺酮类药物是支气管扩张症患者清除PA感染的一线治疗药物,此类患者往往反复感染,导致氟喹诺酮类药物的长期反复使用,从而造成其耐药率的上升,建议在治疗前根据药物敏感性试验结果合理选择抗菌药物[1]。本研究NGS结果显示,73株PA对氟喹诺酮类药物的主要耐药机制为DNA旋转酶、DNA拓扑异构酶Ⅳ的突变,最主要的突变位点集中在GyrA的83位和87位、GyrB的466位、ParC的646位和262位,ParE的533位,且Thr-83→Ile为主要的突变方式,与以往的报道[8]相似。有研究发现,有41.1%的PA菌株中含有一种近年来新发现的获得性喹诺酮耐药基因crpP,该基因编码的酶可通过磷酸化修饰环丙沙星而使其失去作用[9],但本研究中携带有crpP基因的PA基因型和耐药表型并不一致,部分菌株表现为对环丙沙星高度敏感,与相关研究结果[10-11]一致,原因尚需进一步探究。PA对亚胺培南的耐药机制主要为产碳青霉烯酶和膜孔蛋白OprD的缺失或突变[11],本研究分离的13株亚胺培南非敏感PA除1株因携带blaIMP-45基因而产生耐药外,其他菌株均存在OprD蛋白的突变或缺失,其中有7株的突变类型一致,且在372~383位点出现了广泛的替代突变,同时还伴有氨基酸的缺失,与相关研究结果[12-13]相似。本研究仅发现4株对头孢他啶或头孢吡肟耐药的菌株,除1株携带blaIMP-45外,NGS未检测到超广谱β-内酰胺酶基因,而是和其他敏感株一样,含有多种OXA型β-内酰胺酶,但这些OXA型β-内酰胺酶通常仅水解青霉素类药物,并不介导细菌对头孢菌素的耐药。基于上述3株耐药菌株同时对哌拉西林/他唑巴坦耐药,本研究推测其可能的耐药机制为诱导型AmpC酶突变引起酶的高表达。本研究中,PA对多黏菌素B和氨基糖苷类药物高度敏感,仅发现1株对妥布霉素耐药菌株,上述抗菌药物的吸入治疗是国外指南[14]推荐的清除PA支气管扩张症患者感染的重要措施。我国抗菌药物吸入剂型尚未获批,但考虑到此类药物的高敏感性,可以联合β-内酰胺类静脉用药作为二线治疗。本研究中,黏液型与非黏液型PA耐药率差异无统计学意义,可能与收集的菌株数量较少有关。
定义PA高危克隆株流行特征的金标准是19年前Barry Curran开发的MLST分型方案[15],迄今为止已经发现了超过4 000个ST型别。ST235、ST111和ST175是全球范围内PA流行的主要克隆株[16]。然而,在本研究中,73株PA被分成53种ST型,其中最多的ST277(在巴西广泛流行[17])也仅占5.5%(4/73),其次为ST274、ST357(与高毒力相关[18])、ST514,各占4.1%,提示上海地区支气管扩张症患者感染的PA不存在明显的暴发流行。遗憾的是,本研究菌株数较少,且缺乏我国支气管扩张症患者感染PA的分子流行病学数据,尚需进一步扩大菌株数,以进一步明确上海地区支气管扩张症患者感染的PA的分子流行特征。
