HDL-C 对T2DM 患者缺血性脑卒中发病风险的预测价值
2024-01-12张立红
吴 颖 张立红 高 吟
(1.南京医科大学附属南京医院 南京市第一医院核医学科,江苏 南京 210006;2.南京中医药大学附属无锡市中医医院医学检验科,江苏 无锡 214000)
2型糖尿病(type 2 diabetes mellitus,T2DM)是脑卒中发病的独立危险因素之一,缺血性脑卒中(cerebral ischemic stroke,CIS)约占所有脑卒中的70%,T2DM合并CIS患者具有较高的致残率和致死率[1-2]。有研究结果显示,急性CIS合并糖尿病患者高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)水平与不良预后密切相关[3]。MAI等[4]的研究结果显示,低HDL-C水平与CIS患者颈动脉硬化和狭窄相关。糖尿病和脂蛋白异常是重要的公共卫生问题,老年人群中血糖、血脂水平异常者5年内发生心脑血管疾病的风险较高[5]。低HDL-C水平是脂蛋白异常的主要原因之一,与T2DM患者心血管疾病风险增加有关[6]。然而,关于低HDL-C水平与T2DM患者发生CIS的关系尚存在争议。本研究拟探讨HDL-C在T2DM患者合并CIS中的作用。
1 材料和方法
1.1 研究对象
选取2020年1月—2022年2月南京市第一医院T2DM患者298例,其中男159例、女139例,年龄(72.8±7.3)岁。根据是否合并CIS分为单纯T2DM患者150例[对照组,其中男83例、女67例,年龄(72.1±7.5)岁],合并CIS患者148例[CIS组,其中男76例、女72例,年龄(82.2±7.0)岁]。2个组之间性别差异无统计学意义(P>0.05),年龄差异有统计学意义(P<0.001)。本研究经过南京市第一医院伦理委员会批准(KY20192912-22),所有患者均签署知情同意书。
1.2 纳入和排除标准
纳入标准:1)T2DM符合《中国2型糖尿病防治指南(2020年版)》中的诊断标准[7];2)CIS符合2018年中国急性缺血性脑卒中诊治指南诊断标准[8];3)合并CIS的患者均为首次发病,且在发病12 h内入院就诊。排除标准:1)伴蛛网膜下腔出血、脑出血、心源性或病因不明确的脑卒中和急性冠状动脉综合征等血栓栓塞性疾病;2)患1型糖尿病、妊娠糖尿病等其他糖尿病;3)合并营养不良、低蛋白血症、恶性肿瘤、器官功能障碍、精神障碍、免疫缺陷症;4)近3个月服用影响血脂的药物(他汀类药物、贝特类药物、氢氯噻嗪等);5)近1年内有手术史和侵入性损伤。
1.3 方法
本研究所有成员均接受统一培训。通过医院信息系统收集所有患者的临床资料,包括年龄、性别、病程、合并高血压、吸烟史(≥20支/d,持续≥1年)、血压。采用BC-6900全自动血液分析仪(深圳迈瑞公司)和配套试剂检测C反应蛋白(C-reactive protein,CRP)、血小板(platelet,PLT)计数、中性粒细胞绝对数(the absolute value of neutrophils,NEUT#)。采用ARCHITECT c16000全自动生化分析仪(美国雅培公司)和北京中生北控公司试剂检测空腹血糖(fasting plasma glucose,FPG)、总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、HDL-C、低密度脂蛋白胆固醇(lowdensity lipoprotein cholesterol,LDL-C)、尿酸(uric acid,UA)、肌酐(creatinine,C r)、同型半胱氨酸(homocysteine,Hcy)、载脂蛋白A1(apolipoprotein A1,apo A1)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、丙氨酸氨基转氨酶(alanine aminotransferase,ALT)。采用D100糖化血红蛋白分析仪(美国伯乐公司)和配套试剂检测糖化血红蛋白(glycated hemoglobin A1c,HbA1c)。采用ADVIA 2400全自动生化分析仪(德国西门子公司)和北京百奥泰康公司试剂盒检测血清淀粉样蛋白A(serum amyloid A,SAA)水平。计算TG/HDL-C比值、SAA/apo A1比值和非高密度脂蛋白胆固醇(non-high-density lipoprotein cholesterol,non-HDL-C)。non-HDL-C=TC(mmol / L)-HDL-C(mmol / L)。
1.4 列线图预测模型的构建
比较对照组和CIS组的一般资料,将多因素Logistic回归分析中有统计学意义的结果纳入R软件(R3.3.2)和rms软件包,构建列线图预测模型。
1.5 列线图预测模型的评价
采用Bootstrap法重复抽样1 000 次,做内部验证,并计算一致性指数(C-index),分别采用H-L拟合优度检验和受试者工作特征(receiver operating characteristic,ROC)曲线评估原列线图模型和经内部验证后的列线图模型的校准度和区分度。
1.6 统计学方法
采用SPSS 25.0软件进行统计分析,采用GraphPad Prism 5.0软件作图。呈正态分布的计量资料以x±s表示,2个组之间比较采用t检验。呈非正态分布的计量资料以中位数(M)[四分位数(P25,P75)]表示,组间比较采用非参数秩和检验。采用多因素Logistic回归分析评估影响T2DM患者发生CIS的危险因素。采用ROC曲线评价各项指标判断T2DM患者发生CIS的效能。以P<0.05为差异有统计学意义。
2 结果
2.1 对照组和CIS组临床资料比较
对照组和CIS组高血压史、收缩压、舒张压、HbA1c、TG、Hcy、CRP、HDL-C、SAA/apo A1比值、non-HDL-C、TG/HDL-C比值差异有统计学意义(P<0.05),病程、吸烟史、FPG、TC、LDL-C、UA、Cr、NEUT#、PLT、AST、ALT差异无统计学意义(P>0.05)。见表1。

表1 对照组和CIS组临床资料比较
2.2 T2DM患者发生CIS的危险因素
将差异有统计学意义的因素纳入多因素Logistic回归分析。结果显示,HDL-C、non-HDL-C、TG/HDL-C比值、SAA/apo A1比值、HbA1c、高血压史、年龄是T2DM患者发生CIS的危险因素(P<0.05)。见表2。
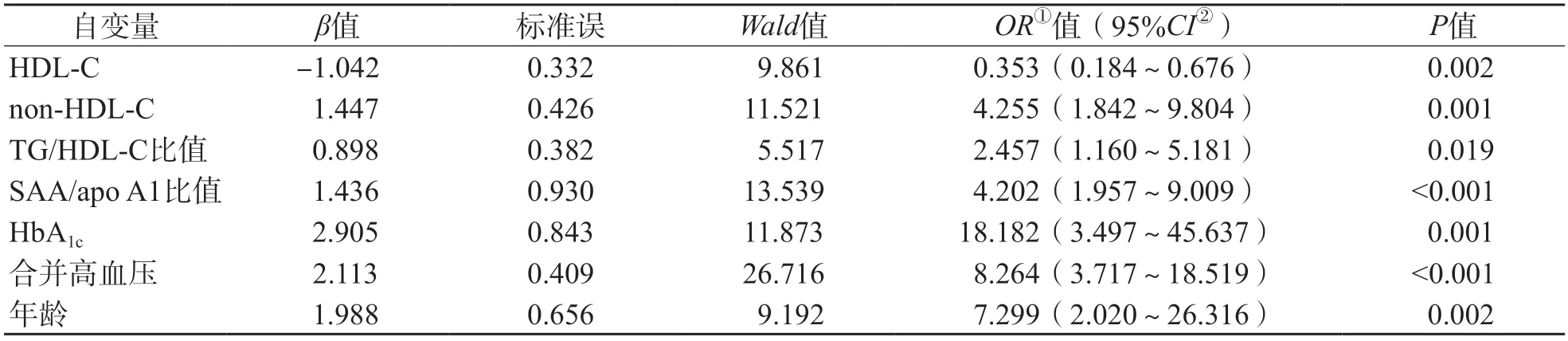
表2 T2DM患者发生CIS的危险因素
2.3 HDL-C判断T2DM患者发生CIS的效能
ROC曲线分析结果显示,HDL-C判断T2D患者发生CIS的曲线下面积(area under curve,AUC)(95%CI)为0.627(0.593,0.689)(P<0.001),最佳临界值为0.63 mmol/L,敏感性和特异性分别为34.5%、93.3%。见图1。
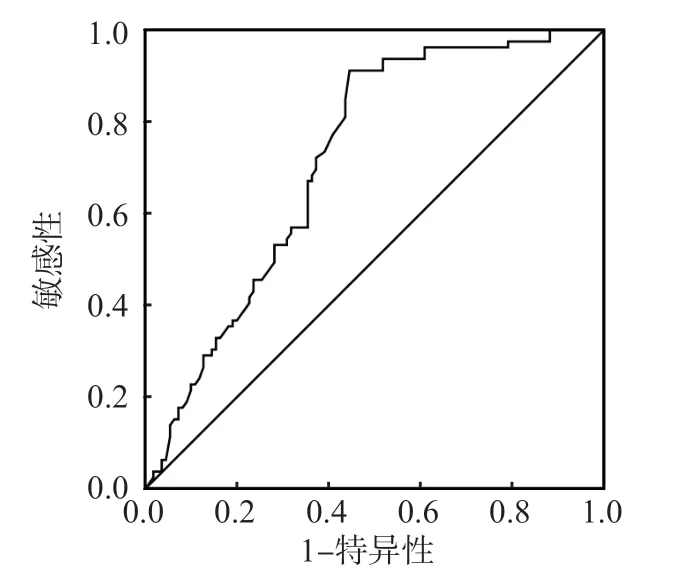
图1 HDL-C预测T2DMCIS发生风险的ROC曲线
2.4 列线图模型的建立
将多因素Logistic回归分析确定的危险因素(HDL-C、non-HDL-C、TG/HDL-C比值、SAA/apo A1比值、HbA1c、合并高血压、年龄)纳入R软件构建列线图模型,见图2。基于列线图结果,采用Bootstrap法验证列线图模型,C-index(95%CI)为0.859(0.853~0.862)。ROC曲线分析结果显示,列线图模型判断T2DM发生CIS的AUC(95%CI)为0.859(0.723~0.892),敏感性为78.0%,特异性为76.0%,见图3。校正曲线分析结果显示,预测结果与实际结果具有较好的一致性,见图4。采用Hosmer-Lemeshow检验模型的拟合度,结果显示,列线图模型拟合优度较好(P=0.180)。
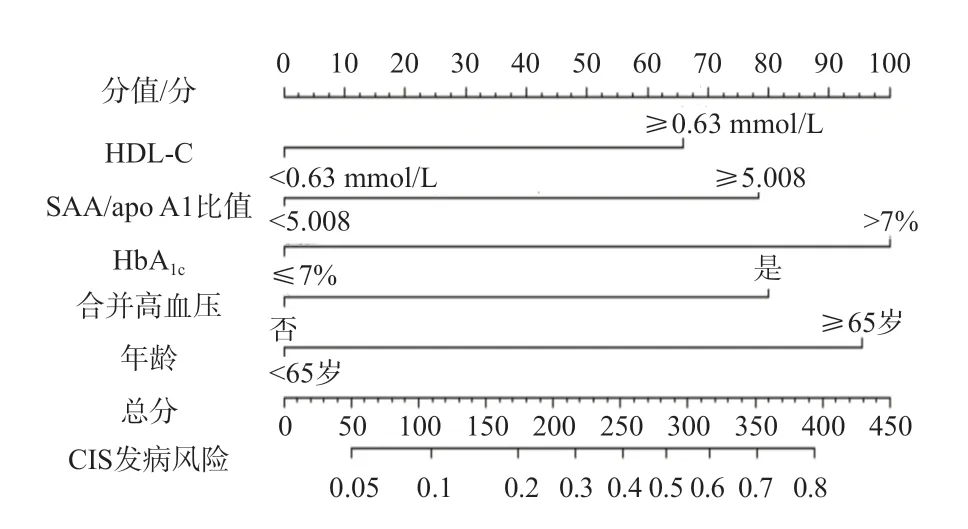
图2 预测T2DM患者发生CIS的列线图
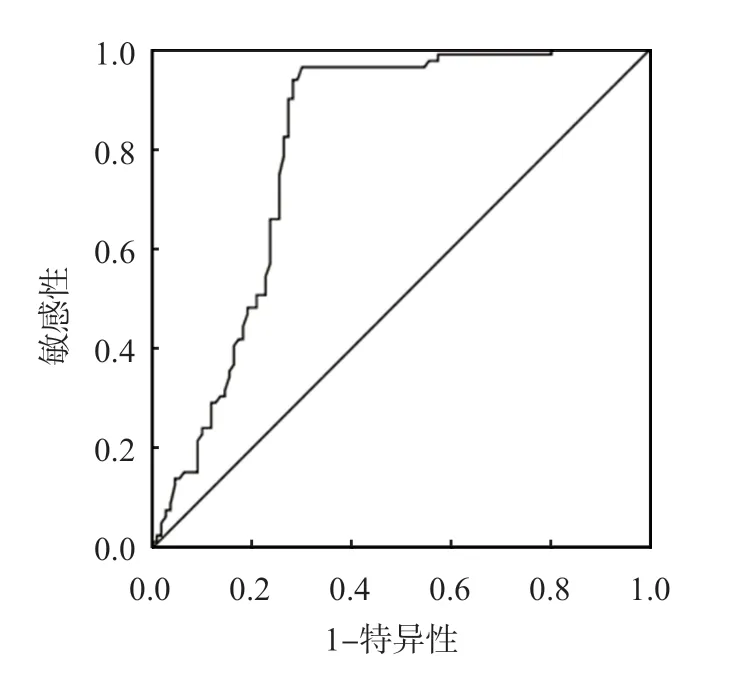
图3 列线图模型预测T2DM患者发生CIS的ROC曲线

图4 列线图模型预测T2DM患者CIS发生风险的校正曲线
3 讨论
脑血管疾病是引起残疾和死亡的主要原因,其中CIS所占比例高达70%,是严重的社会公共卫生问题[9]。有研究结果显示,T2DM是CIS的独立危险因素,同时,CIS也是T2DM患者高发的并发症[10]。T2DM属于内分泌障碍性疾病,长期高血糖会损伤血管内皮细胞,进而出现动脉粥样硬化,脱落的斑块会阻塞血管形成血栓,造成脑组织缺血缺氧,进而发生损伤[11]。高密度脂蛋白(high-density lipoprotein,HDL)对动脉内膜具有保护作用,可通过降低血管中细胞黏附分子1等黏附因子的表达来缓解血管内皮细胞损伤[12]。有研究结果显示,HDL-C是预防心血管疾病的潜在保护因素[13]。尽管使用他汀类药物可以有效地降低LDL-C,但目前尚无针对HDL-C的特定药物。因此,HDL-C与心血管疾病或动脉粥样硬化的关系受到临床的广泛关注。
CHATTERJI等[14]的研究结果显示,有超过50%的T2DM患者的HDL-C水平偏低,且T2DM患者血清HDL-C水平越低,心血管疾病发生风险越高[15]。本研究结果显示,对照组与CIS组AST、ALT水平差异均无统计学意义,可排除肝功能障碍对HDL-C的影响;多因素Logistic回归分析结果显示,HDL-C降低是T2DM发生CIS的独立危险因素(OR=0.353,95%CI为0.184~0.676),与文献报道[14-16]类似。原因可能为:1)HDL水平降低会促进血小板和红细胞聚集,使血液黏稠度升高,进而增加了CIS的发生风险;2)HDL水平降低会损伤脑动脉内皮功能,也会增加CIS的发生风险。有研究结果显示,TG/HDL-C比值与胰岛素抵抗密切相关[17]。胰岛素抵抗参与了多种代谢性疾病的发生、发展,除直接引起糖尿病外,还可导致脂质代谢紊乱,促进炎症因子大量生成,诱导炎症因子损伤血管内皮功能,导致动脉硬化,出现斑块,进而增加心脑血管疾病的发生风险。高TG/HDL代表着更高的动脉硬化发生风险[18]。SAA是一种急性时相反应蛋白,属于HDL相关载脂蛋白,apo A1是HDL主要的载脂蛋白,SAA与apo A1结构类似,在发生炎症反应时,SAA水平升高,竞争性抑制apo A1生成,对早期动脉粥样硬化起促进作用[19]。本研究多因素Logistic回归分析结果显示,HDL-C、non-HDL-C、TG/HDL-C比值、SAA/apo A1比值、HbA1c、高血压史、年龄均是T2DM患者发生CIS的危险因素(P<0.05)。T2DM患者多存在脂质代谢紊乱,血管壁会沉积大量脂质,加重血管硬化,促使动脉硬化形成。HDL主要由肝脏合成、分泌,可与磷脂、胆固醇发挥协同转运功能,消除外周组织的胆固醇。本研究结果显示,CIS组HDL-C水平显著低于对照组(P<0.001),提示合并CIS的T2DM患者脂质代谢紊乱的程度较单纯T2DM患者严重,加快了动脉粥样硬化的进展。因此,建议临床重点关注T2DM患者的血脂水平,及时纠正脂质代谢紊乱,降低CIS的发生风险。有研究结果显示,具有高水平HDL-C的患者的CIS发生率并未降低[20],因此本研究验证了HDL-C预测CIS发生的效能。本研究ROC曲线分析结果显示,HDL-C判断T2DM患者发生CIS的AUC为0.627。说明虽然HDL-C参与了T2DM患者CIS的发病,但单项预测价值并不高。因此,本研究根据多因素Logistic回归分析结果构建列线图预测模型,并对模型进行评价。ROC曲线分析结果显示,列线图模型判断T2DM发生CIS的AUC为0.859,区分度良好(C-index为0.859),校正曲线显示预测结果与实际结果具有较好的一致性,且拟合优度良好(P=0.180)。这说明HDL-C需联合其他指标才能较好地预测T2DM患者发生CIS的风险。
由于本研究为观察性研究,未监测患者HDL-C水平的动态变化,单次检测HDL-C水平对预后评估存在一定的局限性。因此,本研究结果还有待大样本量的多中心研究验证。
综上所述,HDL-C水平低的T2DM患者更易发生CIS。HDL-C联合其他相关指标有助于评估T2DM患者CIS的发生风险。
