舌下腺多形性腺瘤1例
2024-01-10周闻捷茅传青赖永圳蔡志宇陈伟辉
周闻捷, 茅传青, 赖永圳, 蔡志宇, 陈伟辉
多形性腺瘤(pleomorphic adenoma,PA)又称混合瘤(mixed tumor,MT),是涎腺肿瘤中最常见的良性肿瘤,占全部涎腺良性肿瘤的58.7%~90.0%[1-3]。PA好发于腮腺,发生于舌下腺的PA较为罕见,目前国内外仅有个案报道[4-6]。因临床表现及影像学表现无明显特异性,PA的临床诊断较为困难。为提高对该疾病的认识,减少临床误诊,现报道1例舌下腺PA。
1 病例介绍
患者,男性,22岁,于2023年1月19日以“发现左口底无痛性肿物1 a余”为主诉就诊于笔者医院口腔颌面外科,入院诊断为“左口底肿物”。1 a前发现左舌下一肿物。近1个月来,肿物渐进性增大且稍有触痛。专科检查:左口底可见隆起性肿物,大小约2.5 cm×3.5 cm,表面色泽较红,未见溃烂,质硬,边界清晰,基底未见明显浸润,活动度可,无明显触压痛(图1)。舌体活动自如,无麻木不适。颈部未触及肿大淋巴结。
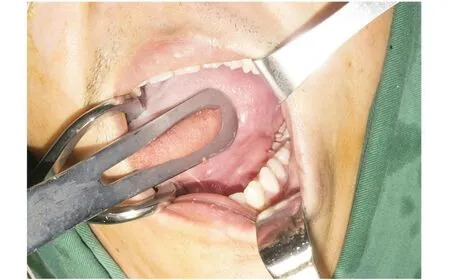
图1 术前口底肿物
舌根MRI检查显示:左侧舌体见一团片状异常信号影,T1WI呈低信号,T2WI呈高信号,境界不清,DWI见弥散受限,范围4.8 cm×2.0 cm×2.9 cm,信号欠均匀,局部骨质无明显吸收破坏(图2)。考虑左侧舌体占位性病变,恶性可能,未能做出定性诊断。
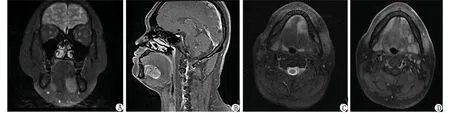
A:T1冠状位;B:T2矢状位;C:T1横断面;D:T2横断面。
考虑舌下腺产生的肿瘤恶性风险较高[7],患者入院后,切取左口底肿物进行活检以明确诊断。活检结果显示PA。完善术前检查后,全麻下经口内入路整体切除舌下腺及肿块。术中发现肿块位于舌下腺深处和下颌舌骨肌上方,对下颌骨、舌外肌组织和下颌舌肌进行钝性分离,保留颌下腺导管及舌神经,手术进展顺利(图3)。术后组织学病理结果显示:(1)肉眼见肿物切面呈灰白或灰红色,包膜完整,边界尚清,大小约4.0 cm×2.5 cm×2.0 cm;(2)镜下见PA结构,可见肌上皮细胞及腺上皮细胞。术后病理诊断:PA(图4)。术后5个月复查,伤口愈合良好,未见复发及其余并发症(图5)。

A:术中口底肿物;B:术后肿物外观;C:术后肿物横断面。

A:组织学染色切片(×100);B:组织学染色切片(×400)。
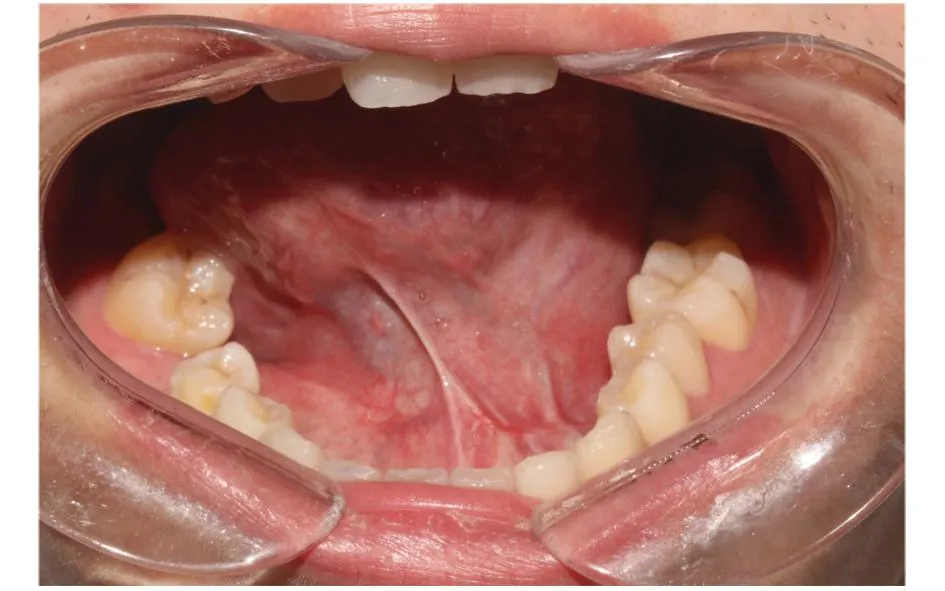
图5 术后5个月随访口内照
2 讨 论
2.1 流行病学分析 PA又称为MT,MT的概念于1874年首次被提出,而后为了反映其组织病理形态的多样性,于1948年又提出了PA这一名称[8]。
PA是常见的涎腺肿瘤,但在舌下腺中却极为罕见。回顾文献[9-10]发现,小唾液腺中PA的发病率达1.5%~25.1%,多发生于腭部的腺体,口底区域腺体的发病率低于1.6%。TIAN等[11]研究了6 982例唾液腺原发肿瘤,发现来自舌下腺的良性肿瘤仅4例(0.057%);LI等[12]研究了3 461例涎腺肿瘤,发现舌下腺良性肿瘤的发病率仅为0.1%;王张嵩等[3]研究了2 456例涎腺肿瘤,发现舌下腺PA的发病率仅为0.16%。
2.2 病理与临床 PA的大体标本多为孤立的圆形或椭圆形肿物,界限清楚,厚薄不一。切面为白色或灰黄色均质,部分呈软骨样外观,黏液区域可呈光亮感。PA被认为来源于唾液腺组织的肌上皮和导管成分,具有不同的组织病理学外观。PA的突出特点是细胞成分复杂,主要由包膜、上皮、肌上皮和间叶成分组成,显微镜下观可有很大程度的形态学变异。上皮细胞类型较多,可见立方状、基底样和梭形等;间叶成分为黏液样或伴黏液样变性的纤维组织、软骨样或伴透明变性的软骨基质成分。以上各种成分在PA中相互组合,形成不同构象。包膜存在与否及厚度也不尽相同[10,13]。PA常表现为无痛性、缓慢增大的包块,直径2~5 cm,一般不表现出溃疡或神经麻痹症状。包块通常可活动,但若发生于腭部或多次复发者,则活动性较差。肿瘤常被很好地界定和包裹,少见附着在周围组织上,但也有包膜浸润和纤维包膜不完整或缺失的肿瘤病例[14]。PA的标准治疗方法是手术切除,因其复发的主要原因有瘤体突破包膜、术中肿瘤外溢或是切除不彻底[15],手术时不能单纯摘除肿瘤,而应在肿瘤包膜外的正常组织处进行切除。舌下腺良性肿瘤的治疗采取的就是将舌下腺连同肿瘤完整切除,以达根治效果[1,15-16]。本研究中,肿瘤被舌下腺组织包裹,考虑包膜浸润或纤维包膜不完整、缺失等可能,遂将肿瘤和舌下腺一并切除。
2.3 影像学分析 涎腺肿瘤的诊断成像技术包括超声、CT和MRI等。影像学检查可确定肿瘤的位置,检测其良恶性特征,评估局部扩展和侵袭程度,并观察是否有淋巴结转移和全身受累情况[17]。对于腮腺、颌下腺和舌下腺肿瘤,超声是理想的初步评估工具,可获得相对浅表结构,并提供优异的分辨率和组织特征,一旦出现肿瘤边界不清或内部多发钙化灶,应考虑恶性可能[18]。对于腮腺深叶和小涎腺的病变,MRI和CT是首选的影像学检查方式。对于舌下腺的肿瘤,因其为恶性肿瘤的风险较高,建议行MRI检查。MRI在显示软组织的分化方面具有优势,能有效显示肿瘤与周围组织的界面。MRI使用的是高分辨率技术,可检测深部炎症扩展、骨髓浸润和神经周围扩散,还可检测区域淋巴结中的信号变化和包膜外扩散,且不存在辐射危害[19]。对于涎腺肿瘤,MRI是定性诊断的最佳影像学检查技术。PA的MRI检查通常会产生内部信号不均匀的边缘图像,T1WI信号强度低,T2WI信号强度高[20-21]。T2WI的信号强度可用于区分PA和癌:癌症通常具有低到中等信号强度,而PA则为高信号强度。高级别恶性肿瘤T2WI图像上低信号强度的发现与早期研究一致[22]。本病例MRI检查也发现了类似结果。
目前,确定肿瘤的性质仍以活检及组织病理学结果作为金标准。细针穿刺活检(fine needle aspiration biopsy,FNAB)作为一种简单且微创的手术在临床上广泛应用。然而,由于组织学特征和类型的多样性,FNAB诊断涎腺肿瘤的准确率较低,并且由于细胞采样计数较低,样本质量较差[23-25],诊断效率也需进一步提升。而粗针穿刺活检(core needle biopsy,CNB)作为诊断的另一种手段,相比于FNAB可获取更多组织,且可利用免疫组织化学技术进行组织病理学检测。研究[26-27]发现,CNB在诊断头颈部肿瘤(特别是恶性肿瘤)时有较高的准确率,具有一定的诊断优势。然而,CNB时发生出血、疼痛或肿瘤种植转移等并发症的风险显著高于FNAB,且更耗时,费用也更高[27-28]。因此,采用CNB时,应充分考虑其技术优势及其风险,在提高准确性的同时兼顾安全性和舒适性,并权衡成本效益。关于FNAB和CNB在涎腺肿瘤中的应用,一项Meta分析结果显示,检查后仅发现有限的肿瘤种植转移病例[29-30],且超声引导下的穿刺活检的安全性已被广泛接受[31]。本研究中,鉴于舌下腺来源肿瘤的恶性风险高,笔者对肿瘤进行活检以确定其性质。当然,涎腺肿瘤的切取活检同样存在肿瘤细胞扩散和神经损伤的风险,以及活检后因组织愈合出现的粘连导致手术难度增高的可能[5,32],需要具体评估。
舌下腺PA的病例极为罕见,目前主要的治疗方法是将舌下腺连同肿瘤一并切除。PA的预后良好,但仍有1%~5%的病例复发[33]。考虑长期复发和多次复发易导致恶性肿瘤的发生,未来仍需仔细监测患者的预后情况。
