基于β-环糊精修饰的碳量子点对D, L-色氨酸的识别和L-色氨酸定量分析
2024-01-10王昆郑慧娟汪灿刘爱林雷云
王昆, 郑慧娟, 汪灿, 刘爱林, 雷云
作为人体的必需氨基酸,色氨酸(tryptophan,Trp)及其代谢产物5-羟色胺、烟酸等广泛参与人体的蛋白合成和新陈代谢中,对情绪、生理节律、细胞生长发育及免疫功能均起到重要的调控作用[1]。研究[2-3]表明,Trp及其代谢产物可通过影响免疫系统,对炎症性肠病进行调节,同时也与结直肠癌的发生密切相关。Trp代谢紊乱可引起免疫细胞的功能障碍甚至凋亡,促进免疫抑制微环境形成,从而影响抗肿瘤药物免疫检查点抑制剂的疗效[4]。此外,新型冠状病毒感染者预后可能因Trp吸收和代谢的改变产生长期疲劳、头疼等症状[5]。
与大部分必需氨基酸相同,Trp具有手性中心,存在D型(D-Trp)和L型(L-Trp)对映体,两者在药理和生化方面差异显著。L-Trp作为血清素的前体,其摄入量与睡眠质量[6]、抑郁和焦虑情绪等密切相关[7]。此外,L-Trp还可协同Ca2+激活人类钙离子感应受体(calcium-sensing receptor,CaSR),有助于CaSR新型药物的开发利用[8]。而D-Trp作为非天然蛋白质氨基酸,不具备L-Trp的生理功能[9]。因此,进行D,L-Trp的手性识别和定量分析,对疾病的诊断、单一对映体药物的杂质检测和药代动力学研究,以及对映体识别方法的研究与评价等均具有重要意义。目前,已发展成熟的Trp对映体手性识别方法主要有液相色谱法[10]和气相色谱法[11]等。随着现代科学技术的发展,荧光检测技术因具有灵敏度高、响应快、选择性好和操作简单等优点,已逐渐成为手性识别研究的重要方法之一。
碳量子点(carbon quantum dots,CQDs)是一种零维碳基荧光材料,具有良好的光学性质,且具有水溶性好、毒性低、成本低和生物相容性好等诸多优点[12-14],现已广泛应用于生物传感[15]、药物传递[16-17]、药物分析[18-19]、病毒检测[20]和生物成像[21]等生物医药领域。环糊精(cyclodextrin,CD)是一种由葡萄糖单元组成的中空圆筒立体环状低聚糖,具有亲水的外部空腔和疏水的内部空腔,可对有机分子进行识别和选择,其中的β-环糊精(β-cyclodextrin,β-CD)因空腔适中易发生包合作用、造价低、易获取和成膜能力强,已被应用于D,L-Trp对映体的手性识别[22-23]。目前已有利用β-CD对D,L-Trp 对映体手性识别进行荧光分析的报道,其原理主要是因为D,L-Trp的构型不同,在与β-CD发生包合作用后,其对应的包合物的荧光强度也不同,从而实现手性识别,但这种识别能力易受共存对映体的干扰。
1 材料与方法
1.1 仪器与试剂 荧光分光光度计(F-4600型,日本日立公司);紫外-可见分光光度计(UV-2450型,日本岛津公司);红外光谱仪[Nicolet 380,驭锘实业(上海)有限公司];X射线电子能谱仪(ESCALAB 250Xi型,美国赛默飞世尔科技有限公司);微孔滤膜(德国MEMBERNA公司);即用型透析袋(截留分子质量为1 ku,美国Spectrum技术公司);超滤离心管(截留分子质量为3 ku,美国Millipore公司)。
碳纤维、HNO3、NaOH、NaH2PO4·2H2O、Na2HPO4·12H2O、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐(EDC)、N-羟基丁二酰亚胺(NHS)、硫酸奎宁、H3PO4、D,L-Trp、乙二胺-β-CD(NH2C2H4NH-β-CD)均购置于阿拉丁化学试剂有限公司。
1.2 方法
1.2.1β-CD/CQDs复合物的合成 将碳纤维剪成细碎状,取0.30 g分散于7.50 mol/L的硝酸中,140 ℃恒定温度下油浴加热48 h,冷却后调节 pH值至中性,并用0.22 μm滤膜除去大颗粒杂质后,用透析袋透析24 h,再用超滤离心管离心(10 000 r/min,30 min),收集分子质量<3 ku的部分,冷冻干燥,得固体CQDs待用。取一定量的CQDs溶于PBS缓冲液中(pH值5.0)制备CQDs溶液待用。取4 mg EDC和1 mg NHS 溶于1 mL CQDs溶液,搅拌30 min后,将pH值调节至中性,加入5 mg NH2C2H4NH-β-CD,反应12 h,得到β-CD/CQDs复合物溶液,过滤(0.22 μm),透析(截留分子质量为1 ku,24 h)除去EDC、NHS,以及未反应完成的NH2C2H4NH-β-CD等小分子物质。
1.2.2 荧光量子产率(quantum yield,QY)的测定 配制适当浓度的硫酸奎宁标准溶液和待测物质,使其在特定的激发波长(350 nm)下吸光度值相等,比较在该激发波长下的荧光积分强度,可测得待测物质的QY。为减少误差,取吸光度值在0~0.1范围内的5个浓度值,扫描荧光光谱得到不同浓度的荧光积分强度。以吸光度值为横坐标、荧光积分强度为纵坐标作线性关系图,得到一条直线,该直线的斜率记为f,并用公式计算出待测物质的QY。其中ΦST和ΦX分别为硫酸奎宁和待测物质的QY,ηST和ηX分别代表硫酸奎宁和待测物质的折射率,fST和fX分别代表硫酸奎宁和待测物质对应直线斜率。
ΦX=ΦST×(fX/fST)×(ηX2/ηST2)
形式主义的根源,是名利思想和懒惰作风作怪。自私主义滋生功利主义,功利主义滋生形式主义。无论是不符合实际的政绩工程,还是不负责任的工作作风,都是私心和私欲在膨胀。只顾个人前途,只为上级高兴,只图自己舒服,不顾长远利益,不讲实际效果,不管群众疾苦。
(1)
1.2.3β-CD/CQDs复合物对D,L-Trp对映体的识别性能 取100 μL 10 μmol/L的D(或L)-Trp与100 μL 0.10 g/L的β-CD/CQDs复合物溶液于棕色EP管中,混匀后置于恒温水浴反应14 h,测定其荧光光谱。
1.2.4β-CD/CQDs复合物对L-Trp的荧光定量分析 配制2~42 μmol/L不同浓度的L-Trp溶液。各取不同浓度的L-Trp溶液100 μL分别与100 μL 0.20 g/L的β-CD/CQDs复合物溶液混合,于40 ℃恒温水浴反应14 h后,测量其荧光光谱。
2 结 果
2.1β-CD/CQDs复合物的表征
2.1.1 紫外-可见吸收与荧光光谱表征 CQDs及β-CD/CQDs复合物的紫外-可见吸收光谱见图1A,可见CQDs在295 nm和361 nm有明显的吸收峰,而β-CD/CQDs复合物在361 nm的吸收峰变弱,出现了1个336 nm肩峰。在CQDs及β-CD/CQDs复合物的荧光光谱中(图1B),CQDs发射光谱出现在454 nm,β-CD/CQDs复合物的发射光谱则出现在427 nm。

CQDs:碳量子点;β-CD:β-环糊精。A:紫外-可见吸收光谱;B:荧光光谱。
2.1.2 形貌与表面结构表征 利用透射电子显微镜(transmission electron microscope,TEM)表征CQDs和β-CD/CQDs复合物的形貌,显示2种纳米材料均为类球形,经Nano Measurer计算得平均粒径分别为(3.1±0.1)、(3.2±0.1)nm,晶格常数均为0.23 nm(图2A、B)。
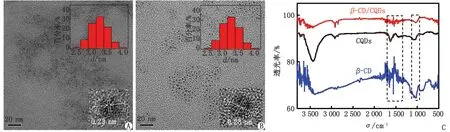
CQDs:碳量子点;β-CD:β-环糊精;TEM:透射电子显微镜;FTIR:红外光谱;σ:波数。A:CQDs的TEM图;B:β-CD/CQDs的TEM图;C:β-CD,CQDs和β-CD/CQDs的FTIR图。
通过红外光谱(fourier transform infrared spectroscopy,FTIR)表征β-CD/CQDs复合物的表面官能团,β-CD、CQDs和β-CD/CQDs的FTIR谱图见图2C。可见CQDs在~3 430 cm-1处有强的 —OH 伸缩振动,在~2 849 cm-1处有较窄的C—H伸缩振动,~1 628 cm-1处的吸收峰对应C=O的伸缩振动,~1 090 cm-1处存在C—O—C伸缩振动峰,~878 cm-1处的吸收峰为C—H键的面外弯曲振动。β-CD/CQDs复合物的FTIR中CQDs的特征峰不明显,而在2 000~1 000 cm-1出现了β-CD的特征峰。
用X射线电子能谱(X-ray photoelectron spectroscopy,XPS)表征CQDs与β-CD/CQDs复合物的元素分布情况。图3A为CQDs的XPS图,显示在284.80、401.60、531.40 eV处存在3个峰,分别对应C1s、N1s、O1s的特征峰。图3B为CQDs 的C1s高分辨XPS谱,可拟合拆分为C—C/C=C(284.70 eV)、C—O(287.00 eV)和 O—C=O(288.50 eV)3个峰。图3C为β-CD/CQDs复合物的XPS表征图,表明该复合物主要由C、O和N元素组成,与CQDs比较,β-CD/CQDs复合物中的C1s XPS 谱中出现了C—N官能团。
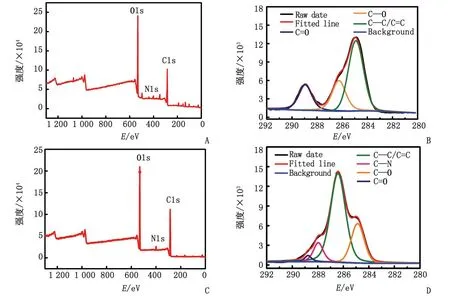
CQDs:碳量子点;β-CD:β-环糊精;XPS:X射线电子能谱;E:结合能。A:CQDs XPS全谱;B:CQDs中C1s XPS谱图;C:β-CD/CQDs XPS全谱;D:β-CD/CQDs中C1s XPS谱图。
2.2β-CD/CQDs 复合物对D,L-Trp对映体的手性识别 由D,L-Trp的荧光光谱图(图4A)可知,D,L-Trp的最佳激发波长和发射波长分别为280、353 nm,故实验选用激发波长为280 nm,分别测定L-Trp、D-Trp与β-CD/CQDs复合物反应后的荧光光谱(图4B、C)。如图4B所示,L-Trp与β-CD/CQDs 复合物发生包合作用后,其反应体系在400 nm 产生荧光发射峰,较单独的L-Trp(353 nm)红移且荧光强度下降,而其对映体D-Trp发生包合反应后,其反应体系的荧光发射峰位置和强度都未产生明显变化(图4C)。

Trp:色氨酸;CQDs:碳量子点;β-CD:β-环糊精。A:D, L-Trp的激发光谱与荧光光谱;B:L-Trp、β-CD/CQDs 复合物以及两者反应后的荧光光谱(λex=280 nm);C:D-Trp、β-CD/CQDs复合物以及两者反应后的荧光光谱(λex=280 nm)。
2.3β-CD/CQDs 复合物合成条件优化
2.3.1 NH2C2H4NH-β-CD与CQDs的质量比 实验通过EDC-NHS偶联反应将NH2C2H4NH-β-CD通过酰胺键修饰到CQDs表面,NH2C2H4NH-β-CD与CQDs的质量比会影响β-CD/CQDs复合物的QY。如图5A所示,β-CD/CQDs复合物的QY随NH2C2H4NH-β-CD和CQDs的质量比增大而增大,当NH2C2H4NH-β-CD与CQDs的质量比达到3∶1 时,β-CD/CQDs复合物的QY明显上升,之后随着二者的质量比继续增大,QY无明显升高。

CQDs:碳量子点;β-CD:β-环糊精。A:不同NH2C2H4NH-β-CD与CQDs质量比合成的β-CD/CQDs复合物的QY(λex=350 nm);B:不同反应温度合成的β-CD/CQDs复合物的QY(λex=350 nm)。
2.3.2 偶联反应温度 实验考察了4、25、30、35、40 ℃等不同偶联反应温度下合成的β-CD/CQDs复合物的QY。由图5B可知,随着反应温度的升高,β-CD/CQDs复合物的QY反而降低,在4 ℃下偶联反应效率最高。
2.4β-CD/CQDs复合物对D,L-Trp手性识别条件优化
2.4.1 包合反应温度 为探究包合反应温度对β-CD/CQDs 复合物对手性药物识别性能的影响,研究在25、30、35、40、45 ℃下β-CD/CQDs复合物对D,L-Trp的手性包合作用。从图6A可见,在相同反应时间(14 h)内,随着反应温度的升高,β-CD/CQDs复合物与L-Trp反应后的荧光光谱中,L-Trp的荧光发射峰逐渐减小,且在395 nm附近产生1个荧光发射峰,当温度上升至40 ℃时,L-Trp的荧光发射峰完全消失。然而,D-Trp与β-CD/CQDs复合物的反应体系的荧光发射峰的位置和强度并未随着温度的改变而发生明显变化(图6B)。而当温度达45 ℃时,β-CD/CQDs复合物与不同构型Trp的荧光光谱未见明显差异。

Trp:色氨酸;CQDs:碳量子点;β-CD:β-环糊精。A、B:分别为在不同温度下L-Trp或D-Trp与β-CD/CQDs复合物反应后的荧光光谱(λex=280 nm);C、D:分别为在不同pH值条件下L-Trp或D-Trp与β-CD/CQDs复合物反应后的荧光光谱(λex=280 nm)。
2.4.2 包合反应的pH值 为探究在β-CD/CQDs复合物与D,L-Trp的包合反应体系中,pH值对荧光强度的影响,实验分别考察了在pH值为3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0和8.0的条件下,β-CD/CQDs 复合物分别对L-Trp和D-Trp手性包合作用。对比图6C和6D,发现pH值为5.5或6.0时,荧光发射峰的位置和强度差异最显著,而在其他pH值条件下,与L-Trp或D-Trp包合反应后的荧光光谱图非常相似。
2.5β-CD/CQDs复合物对L-Trp的荧光定量检测β-CD/CQDs复合物能有效识别D,L-Trp对映体,且L-Trp能使β-CD/CQDs复合物的荧光强度发生改变。在最优的实验条件下,建立基于β-CD/CQDs 的L-Trp荧光定量新方法。随着L-Trp 的浓度从6 μmol/L增加至38 μmol/L时,荧光强度逐渐增大(图7A),L-Trp浓度继续增至42 μmol/L,荧光强度几乎不变。从图7B可知。L-Trp 的浓度在6~38 μmol/L范围内,荧光强度(Y)与L-Trp 的浓度(X)之间具有良好的线性关系。

Trp:色氨酸;CQDs:碳量子点;β-CD:β-环糊精。A:荧光光谱;B:标准曲线。
Y=28.38X-59.34
(r=0.998,检测限为0.94 μmol/L)
(2)
3 讨 论
作为人体必需氨基酸,具有手性中心的Trp存在D-Trp和L-Trp对映体,二者在药理活性方面具有显著差异,而这直接影响到Trp的临床疗效。因此,实现对D-Trp和L-Trp的识别和定量检测具有重要的临床意义。CQDs因具有良好的光学性能,且易溶于水、生物毒性低、生物相容性好、表面具有丰富的易于功能化修饰的羧基,而被广泛应用于生物传感、药物运输、细胞标记等医药生物领域。该研究利用CQDs表面丰富的羧基,通过 EDC-NHS 试剂将其活化,从而将乙二胺-β-CD共价偶联修饰到CQDs表面,成功制备了β-CD/CQDs复合物,据此构建了一个手性识别荧光传感器。利用紫外-可见吸收光谱、荧光光谱、FTIR及XPS对CQDs及β-CD/CQDs 复合物的光学性能、表面官能团和元素组成进行表征。此外,还通过测定QY,考察了不同配比以及不同温度对合成β-CD/CQDs 复合物的影响。实验基于β-CD对不同手性药物的不同包合效果,通过荧光光谱实现了对D,L-Trp 的识别和对L-Trp的定量分析。
从β-CD/CQDs复合物的紫外-可见吸收与荧光光谱表征结果可以看出,CQDs在295、361 nm的明显吸收峰是由于CQDs中的C=O键发生了n→π*跃迁,而β-CD/CQDs复合物在295、336 nm 出现的吸收峰,说明β-CD/CQDs复合物在336 nm较CQDs在361 nm吸收峰蓝移了25 nm。在图1B的荧光光谱中,β-CD/CQDs复合物的发射光谱(427 nm)较CQDs发射光谱(454 nm)也出现了27 nm 的蓝移,该现象与紫外吸收光谱图结果一致,表明CQDs表面的 —COOH和 NH2C2H4NH-β-CD 中的 —NH2发生了共价结合,使得共轭效应减弱。
从CQDs及β-CD/CQDs复合物的TEM图可以观察到,2种纳米材料微观上的形貌均为单分散的类球形,碳点表面经β-CD 功能化修饰前后,颗粒大小未发生明显变化。
从β-CD、CQDs和β-CD/CQDs的FTIR可知,相较CQDs的FTIR中官能团表现明显的特征峰,β-CD/CQDs复合物的FTIR中CQDs的特征峰则不明显,而在2 000~1 000 cm-1出现了β-CD的特征峰。可见β-CD已成功修饰到CQDs表面,从而使β-CD/CQDs表面表现出β-CD中官能团的特征峰。
通过比较CQDs和β-CD/CQDs的XPS表征图可知,β-CD/CQDs复合物的C、O和N的百分比分别为62.21%、34.40%和3.39%,乙二胺-β-CD偶联修饰于CQDs表面后,各元素分配比例有所变化,C1s XPS谱中出现了C—N官能团(287.95 eV),以上结果表明β-CD已成功修饰到CQDs表面。
通过比较L-Trp、D-Trp和β-CD/CQDs复合物反应后的荧光光谱发现,包合作用发生后,反应体系的荧光发射峰较L-Trp发生红移且荧光强度变弱,而其对映体D-Trp与β-CD/CQDs复合物反应后,反应体系的荧光发射峰位置和强度与D-Trp相比,均未发生明显变化。这是由于β-CD独特的空腔结构表现出对D-Trp对映体显著的手性包合差异[24],L-Trp可进入β-CD/CQD复合物表面CD的疏水腔体中,从而与β-CD/CQD形成新的包合物,其荧光发射峰的位置和强度都发生了显著变化,而D-Trp由于CD的立体选择性未能进入β-CD/CQD表面的CD腔体中,因此,反应后荧光光谱未发生明显变化。由以上结果可知,由于CD手性空腔的立体作用,β-CD/CQD复合物与D,L-Trp对映体的包合常数不同,与D-Trp相比,β-CD/CQD与L-Trp之间的相互作用更强,表现出优良的Trp对映体手性识别能力。
QY是荧光物质的重要发光参数。从图5A可以看出,β-CD/CQDs复合物的QY随NH2C2H4NH-β-CD与CQDs的质量比的增大而增大,当质量比达到 3∶1 后,QY不再增强,表明反应达到饱和。因此,实验选取NH2C2H4NH-β-CD与CQDs的质量比为3∶1。此外,偶联反应温度是影响偶联效率的重要因素。从图5B可以看出,4 ℃下偶联反应效率最高,所制备的β-CD/CQDs复合物的QY达到最大值。因此,实验选择4 ℃为偶联反应温度。
此外,实验还优化了β-CD/CQDs复合物对D,L-Trp 手性识别的包合反应温度和pH值。从图6A可见,在相同时间内,随着温度的升高,包合反应程度不断加剧,L-Trp的荧光发射峰逐渐减小,同时因为L-Trp与β-CD/CQDs复合物发生荧光能量共振转移,包合产物在395 nm处附近出现1个荧光发射峰,当温度达40 ℃时,L-Trp的荧光发射峰完全消失,此时β-CD/CQDs与L-Trp的包合作用最强。而图6B中D-Trp与β-CD/CQDs复合物的反应体系中,荧光发射峰的位置和强度并未随温度的改变而发生明显变化。由此可见,β-CD/CQDs复合物对D,L-Trp表现出显著的包合差异。而当温度达45 ℃时,β-CD/CQDs复合物与L-Trp的包合作用骤减,对D,L-Trp未呈现手性包合差异。因此,40 ℃下,β-CD/CQDs复合物对D,L-Trp手性识别能力最强。对比图6C和6D,可发现β-CD/CQDs复合物与D,L-Trp包合反应体系中pH值对荧光强度的影响,pH值为5.5或6.0时,反应体系的荧光发射峰的位置和强度差异最显著,而在其他pH值的条件下,包合反应后的L-Trp和D-Trp的荧光光谱图无明显差异。由此可见,在pH值为5.5或6.0的体系中,β-CD/CQDs 复合物对D,L-Trp 手性识别能力最强。在上述最佳实验条件下,β-CD/CQDs复合物能有效识别D,L-Trp对映体,且L-Trp能使β-CD/CQDs复合物的荧光强度发生改变。基于β-CD 修饰CQDs的手性药物识别荧光传感器能够实现对D,L-Trp的识别,以及对L-Trp 的定量分析,在 6~38 μmol/L 范围内,L-Trp 的浓度与检测荧光强度之间具有良好的线性关系,检测限为0.94 μmol/L。从而建立了基于β-CD/CQDs 的L-Trp荧光定量新方法。
通过与部分既往文献报道的不同Trp测定方法得出的线性范围和检出限结果进行比较[25-29],发现本研究方法对L-Trp的定量检测具有较宽的线性范围和更低的检出限。此外,相较于其他检测方法,本研究通过引入β-CD/CQDs复合物,实现对D,L-Trp 的识别,以及对L-Trp的定量分析。该方法操作简单、特异性好,避免使用昂贵的大型仪器,更具普及前景,为手性药物识别提供了一种新的途径和思路。
