蒽醌类化合物用于溃疡性结肠炎治疗的研究进展
2024-01-10廖伊琦康玥综述余祥彬余越审校
廖伊琦, 康玥(综述), 余祥彬, 余越(审校)
根据病变累及的解剖范围,溃疡性结肠炎(ulcerative colitis, UC)通常可分为直肠炎、左半结肠炎(即乙状结肠或不累及降结肠)以及全结肠炎,少数患者还会累及回肠。UC的病因尚不明确,可能与免疫功能障碍、遗传易感性和微生物失衡有关。临床治疗中,常使用美沙拉嗪制剂、皮质类固醇和免疫抑制剂等药物来控制炎症反应,从而缓解症状,促进结肠黏膜愈合。近年来,具有新靶点的生物制剂不断进入临床试验,可通过减轻炎症反应及修复肠黏膜达到治疗目的[1]。然而,仍有部分患者出现药物无应答或停药后复发[2]。近年来,有关UC治疗药物的研究不断取得进展,针对其他单体成分和中药的研究发现,蒽醌类化合物可在UC的治疗中发挥良好的抗炎作用,现进行综述如下。
1 醌类化合物
醌类化合物可以分为苯醌(具有对苯醌和邻苯醌2种结构)、萘醌、菲醌和蒽醌4种类型(图1),其中蒽醌类化合物是天然醌类化合物中数量最多、最重要的一类化合物,分布于蓼科、豆科、玄参科及百合科等植物中(如大黄、芦荟、虎杖和番泻叶等)。在天然蒽醌类化合物中,9,10-蒽醌最为常见[3]。蒽醌类化合物在植物中可游离存在,也可与糖结合成苷。游离的蒽醌类化合物极性较小,微溶或不溶于水,但成苷后极性增大[3]。

图1 常见醌类化合物的结构式
2 蒽醌单体化合物治疗UC的研究
蒽醌单体化合物主要有大黄素(Emodin, Emo)、大黄酸(Rhein, Rh)、大黄酚(Chrysophanol, Chr)、芦荟大黄素和大黄素甲醚等,在抗肿瘤、抗炎及抗菌等方面均有相关研究报道[3]。有关蒽醌单体化合物治疗UC的研究主要涉及抑制炎症通路、抑制促炎因子释放和调节肠道微生物等方面。
2.1 蒽醌类化合物治疗UC与结肠黑变病(melanosis coli, MC)的关系 MC的本质是含有脂褐素样物质积聚在结肠黏膜固有层内的巨噬细胞中,导致结肠黏膜着色[4]。近年来,随着人们对用药的关注度增加,蒽醌类化合物导致MC的情况逐渐被重视。“黑变”与病变的联系一直是人们关注的问题之一。目前研究认为:(1)蒽醌类中药需要大剂量使用或正常剂量长期使用才会引发MC[5],而通常蒽醌类药物用于治疗UC时疗程短、剂量小,并不一定能达到引起MC的程度;(2)MC本身是一种代谢性、非炎症性的良性结肠黏膜色素沉着性疾病,目前尚无MC引发结直肠癌的直接证据[6]。因此使用蒽醌类化合物治疗UC仍可能是安全的。
2.2 Emo Emo的化学名为1,3,8-三羟基-6-甲基蒽醌(结构式见图2),具有多种药理活性,包括抗肿瘤、抗炎、抗氧化、抗感染、免疫抑制和促进成骨活性等[7-8]。Emo对多种疾病具有潜在的治疗作用,包括心肌梗死、动脉粥样硬化、糖尿病等[9-12]。
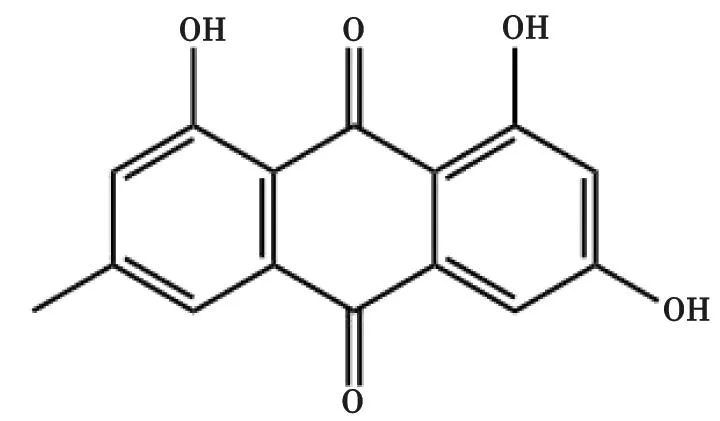
图2 大黄素的结构式
2.2.1 Emo治疗UC的潜在机制 GAO等[13]的实验证实,Emo可通过增加肠道有益微生物的丰度和抑制有害细菌的丰度,减轻大肠埃希菌(Escherichiacoli,E.coli)引起的肠道损伤,改善肠黏膜的
屏障功能。另外,脓毒症作为一种由细菌等病原微生物侵入机体引起的全身炎症反应综合征,可能通过引发肠道菌群紊乱参与UC的发病。张瑞[14]指出,Emo可在一定程度重新平衡脓毒症导致的肠道菌群紊乱,降低变形杆菌(Proteobacteria)的丰度,重新平衡早期脓毒症小鼠的肠道菌群构成比例,减少致病菌数量,减少促炎因子释放,从而缓解小鼠的UC症状。LUO等[15]发现,UC小鼠给予Emo灌胃后,结肠组织中表达增加的TLR5和NF-κB p65可被抑制,提示Emo对结肠炎的治疗作用与调节TLR5信号通路有关。
此外,XU等[16]的研究结果表明,小剂量黄芩苷与Emo合用,对葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的小鼠UC症状有明显的缓解作用,可缓解小鼠体质量减轻、抑制结肠缩短、降低疾病活动指数和减轻肠道损伤。黄芩苷可降低CD14的表达[17],Emo可增加PPAR-γ的表达,两者均可抑制NF-κB的活性,在UC小鼠中表现出联合抗炎作用,降低UC小鼠结肠中CD14/TLR4/NF-κB通路蛋白的表达,同时增加PPAR-γ蛋白的表达。
2.2.2 Emo制剂治疗UC 虽然目前已有部分Emo治疗UC的研究报道,但Emo在水中的溶解性极低,给临床用药增加了难度。PU等[18]将乳铁蛋白(lactoferrin, LF)包裹Emo的纳米粒(Emo-NPs)负载到β-1,3-D-葡聚糖微载体酵母细胞壁微粒子(β-1,3-D-glucan based microcarrier, yeast cell wall microparticles, YPS)中,形成一种具有双靶向层的纳米微米系统(Emo-Nyps),用于结肠的靶向治疗。外层靶向策略:YPS与巨噬细胞上的β-葡聚糖-Dectin-1受体结合,促进Emo-Nyps靶向富含巨噬细胞的炎症部位,从而增强Emo的抗炎作用。YPS还具有保护Emo-Nyps在胃环境中的稳定性和控制结肠周围负载的Emo-NPs释放的能力。内层靶向策略:以负载LF配体的Emo-NPs靶向肠上皮细胞表面的LF靶点,增加细胞对Emo-NPs的摄取效率,增强黏膜的修复效果。研究提示,口服结肠靶向Emo-Nyps制剂可能是一种新型有效的治疗UC的药物递送方法。
2.3 Rh Rh的化学名为1,8-二羟基-3-羧基蒽醌(结构式见图3),是一种常见的蒽醌类化合物,具有多种药理活性,如抗炎、抗肿瘤、抗纤维化和调节血脂等[19]。
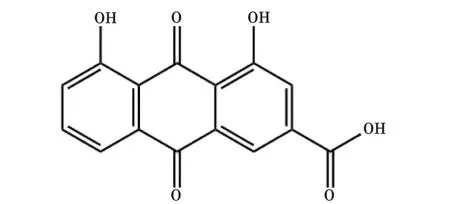
图3 大黄酸的结构式
2.3.1 Rh治疗UC的潜在机制 WU等[20]研究发现,Rh能明显减轻DSS诱导的UC,一定程度上恢复肠屏障功能。该实验采用16s rRNA基因测序手段,评估粪便菌群移植(fecal microbiota transplantation, FMT)对肠道菌群的作用,发现Rh并不能直接降低尿酸浓度,但可通过提高小鼠肠道中的乳酸菌属(Lactobacillus)的水平,间接改变嘌呤代谢,降低尿酸水平,以及降低肠内高尿酸相关的肠屏障通透性,从而达到治疗UC的目的。罗爽等[21]的研究认为,Rh可通过降低炎症因子的数量来缓解与治疗UC。ERRIDGE等[22]发现,UC小鼠的结肠组织中TLR5的表达增加,经Rh治疗后下降;结肠组织中NF-κB p65的表达也呈下降趋势。这表明Rh能够通过抑制TLR5/NF-κB信号通路,减少炎症因子产生,降低淋巴细胞浸润,从而缓解炎症。
此外,增加巨噬细胞的M2表型可能是控制肠道炎症的一种新方法[23]。Rh可上调CD206、Arg1、IL-10和Chil3的表达,从而引导巨噬细胞向M2表型转变。ZHOU等[24]发现,Rh在体内外均可阻止巨噬细胞IL-1β的成熟和分泌,减轻DSS引起的炎症细胞浸润。Rh还可通过阻止巨噬细胞向结肠扩散、促进巨噬细胞从M1亚群向M2亚群的分化、阻断结肠巨噬细胞中NLRP3炎症小体的激活,从而减轻巨噬细胞和肠道之间的炎症串扰。此外,DONG等[25]发现,Rh可通过抑制PI3K/Akt/mTOR信号通路中炎症因子的表达和调节肠道菌群平衡2种手段共同发挥抗炎作用。
2.3.2 Rh制剂治疗UC Rh难溶于水,LUO等[26]提出,可使用果胶钙(calcium pectin, CP)和透明质酸(hyaluronic acid, HA)修饰的LF纳米粒负载Rh形成CP/HA/Rh-NPs的双靶向纳米粒来治疗UC。细胞摄取实验证实,NPs可通过LF和HA形成具有特异性靶向的配体,并提高摄取速率。而体内实验表明,CP/HA/Rh-NPs通过抑制TLR4/MyD88/NF-κB 信号通路,显著减轻炎症反应。观察并测量小鼠结肠的X线片发现,CP/HA/Rh-NPs对DSS治疗中结肠缩短有良好的抑制作用。与DSS组比较,Rh-NPs组和CP/HA/Rh-NPs组小鼠具有更完整的隐窝,表明Rh-NPs组和 CP/HA/Rh-NPs组小鼠结肠炎症的症状和体征均得到改善。此外,CP/HA/Rh-NPs组小鼠脾的平均质量低于HA/Rh-NPs 组和Rh-NPs组,表明CP/HA/Rh-NPs 对UC的改善作用更大。
2.4 Chr Chr的化学名为1,8-二羟基-3-甲基蒽醌(结构式见图4),具有抗肿瘤、神经保护、改善学习认知功能障碍、保护心肌等多种药理作用[27]。

图4 大黄酚的结构式
内毒素处理的腹膜巨噬细胞可高表达COX-2,进而刺激前列腺素E2(prostaglandin E2, PGE2)过表达。KIM等[28]发现,Chr处理可显著抑制腹膜巨噬细胞的PGE2表达,使之接近正常水平,并可抑制IκBα蛋白的降解和Rel/p65的转位,进而抑制NF-κB 通路激活。进一步在动物体内进行研究,结果发现,DSS处理小鼠的结肠组织中NF-κB活化,IL-6和COX-2表达上调,但Chr治疗后模型小鼠的症状减轻,结肠组织Caspase-1激活受抑制,IL-6和COX-2表达下调。综上,离体和在体实验均表明,Chr可通过抑制内毒素诱导的NF-κB活化、IκBα降解和Caspase-1的激活发挥对UC的抗炎作用。
LEE等[29]的体内实验证实,Chr可通过抑制NF-κB/MAPK通路,有效降低促炎细胞因子的表达。在DSS诱导的UC动物模型中,Chr可缓解结肠组织的炎症反应,通过调节Th1/Th17细胞的活性来降低效应细胞因子的mRNA水平,并可通过下调CD40L的表达来调节T细胞激活。该研究首次报道了Chr对HT-29细胞和UC模型肠道炎症的调节作用,使用Chr预处理HT-29细胞,可有效抑制NF-κB通路刺激后炎症因子NF-κB、IL-8、IL-1β和IL-6的表达。
3 传统中医药中的蒽醌类化合物在UC治疗中的应用
3.1 传统中医药与蒽醌类化合物的关系 中医古籍虽无“溃疡性结肠炎”病名的记载,但历代中医药学者根据其临床表现和发病特点将其归属于“痢疾”或“滞下”等范畴。扁鹊《难经·五十七难》中记载:“大瘕泄者,里急后重……”[30]。“大瘕泄”的典型症状为“里急后重”,与临床上UC所表现的症状极为相似。中药治疗从中药活性成分、单味中药提取物、中药经典名方及中成药联用化药等多方面入手治疗UC[31],甘草、白术、黄连和茜草等富含蒽醌类成分的中药使用频次较高[32]。
3.2 中草药 芦荟是一种多年生常绿多肉质草本植物,属于百合科芦荟属。常见药用品种为库拉索芦荟(AloebarbadensisMiller, Aloe)[33],其主要活性成分芦荟苷是一种单体蒽醌类化合物。芦荟苷在生物机体内代谢为Emo、芦荟Emo和Rh等,从而发挥药理学作用。过去人们常将Aloe用作泻药或美容保健品,近年研究发现,Aloe对缓解UC症状也有一定效果[34-35]。
WANG等[36]的研究发现,低剂量(18 mg/kg)Aloe灌胃给药可显著增加UC大鼠结肠黏液层的厚度,提示Aloe在维持黏液屏障功能中起关键作用。此外,Aloe可缓解DSS诱导的UC,并上调黏蛋白MUC2和MUC5AC的表达。研究发现,Aloe可能通过抑制PI3K/AKT通路并激活PKC/ERK 通路发挥抗炎作用。有趣的是,与低剂量相比,高剂量的Aloe(72 mg/kg)并未表现出更好地缓解UC的效果,这可能与高剂量Aloe反而会抑制PGE2的合成、引起腹泻等不良反应有关。此外,WANG等[36]在小鼠实验模型中发现,Aloe还可显著增强IL-10的表达,以抑制过度的炎症反应,从而发挥对结肠的保护作用。
PARK等[37]发现,经口摄入Aloe成分可改善DSS诱导UC大鼠的肠道炎症反应,其血浆LTB4和TNF-α浓度均显著降低。Aloe、芦荟苷或芦荟凝胶灌胃的大鼠结肠黏膜中,TNF-α和IL-1β的表达均显著降低。
Aloe的主要成分芦荟苷单体也被证明具有治疗UC的潜力,能显著逆转UC所致的体质量减轻和结肠损伤,有效提高结肠组织中IL-4和IL-10 mRNA的表达,降低IFN-γ、IL-6、IL-1β和TNF-α的表达[38]。此外,芦荟苷还可显著增强UC的闭锁小带蛋白-1(zonula occluden-1, ZO-1)、咬合蛋白(occludin)及E-钙黏蛋白(E-cadherin)的表达水平,并通过激活AMPK信号通路来抑制UC增强的MLCK信号通路,抑制炎症因子表达,从而恢复上皮屏障功能。
3.3 中药制剂 致康胶囊(Zhikang capsules,ZKC)(国药准字Z20025043;规格:0.3 g×24粒;西安千禾药业有限责任公司)由大黄、黄连、三七和茜草等14味中药组成,其中含有多种蒽醌类成分。FEI等[39]在DSS诱导的UC动物模型中使用ZKC,发现NF-κB、IFN-γ、IL-1β和IL-12等主要致炎细胞因子的表达受抑制,且抗炎介质生成通路激活。以往研究发现,ICAM-1的表达降低可显著降低肠道炎症反应,提示ICAM-1的促炎作用[40-41]。实验结果显示,DSS模型小鼠中ICAM-1表达水平上升,但在使用ZKC后下降。ZKC还可明显抑制TLR4、MyD88、TRAF6和NF-κB的产生。以上结果均提示ZKC在UC动物模型中具有抗炎作用。
3.4 中药方剂 黄芩汤出自张仲景的《伤寒论》,由黄芩、芍药、甘草和大枣4味中药组成,富含蒽醌类成分[42]。黄芩汤用于UC治疗可能与保护肠黏膜屏障、抑制炎症反应、促进线粒体自噬、抑制氧化应激、调控肠道菌群及基因表达、抑制细胞增殖和促进细胞凋亡等多种机制相关。徐航宇等[43]通过16s rRNA基因测序分析发现,黄芩汤能够有效恢复UC大鼠肠道的乳酸杆菌属和理研菌属(Rikenella)等失衡菌群的丰度。刘滨等[44]的研究表明,黄芩汤可抑制促炎因子IL-2、IL-6、TNF-α、IFN-γ和IL-17A 的表达,提高抗炎因子IL-4、IL-10和 TGF-β的表达。此外,黄芩汤可能通过调节经典的细胞焦亡途径,降低结肠组织中NLRP3和Caspase-1的表达,减少血清IL-6、IL-1β和TNF-α表达,增加 IL-10 表达,从而减轻UC小鼠肠道黏膜炎症浸润[45]。
综上所述,蒽醌类化合物广泛存在于植物中,来源广、易提取,具有独特的化学结构和生物活性,其调节炎症通路以及维持肠道菌群稳态的作用在胃肠道炎症性疾病(尤其是UC)的治疗中受到越来越多的关注,特别是以天然植物入药、基于整体观念进行个体化辨证施治的中医药方法治疗UC,患者接受度高。然而,目前蒽醌类化合物的使用仍存在许多局限性,包括其相对较低的溶解度和生物利用度,以及活性成分在细胞信号通路中的潜在机制和因果关系的相关研究不够明确等。未来可以把蒽醌作为母核,进一步进行结构修饰,寻找毒性低、疗效好的衍生物。此外,药剂学的手段也是一种解决思路,利用合理的药用辅料,通过系列剂型改造修饰形成新型递药系统,提高药物生物利用度,以减少甚至消除其不利因素。
