多模态MRI技术鉴别肺癌病理类型的研究进展
2024-01-10张红玉综述钱丽霞审校
张红玉(综述), 钱丽霞(审校)
全球肺癌的发病率和病死率均较高。据全球癌症统计报告2020年的数据统计,全球肺癌新发病例约220万例,发病率居第二位(11.4%)[1];2018年,我国肺癌新发病例数和死亡数均列于首位[2]。肺癌是一种复杂的疾病,其治疗效果取决于患者的特征、肿瘤的组织学类型,以及评估的生物标志物,不同病理类型的肺癌治疗方案不同。因此,准确地判断肺癌的病理类型对患者的治疗及预后至关重要。
目前,临床用于鉴别肺癌病理类型的方式有很多种,例如:组织病理学活检、计算机断层扫描(computed tomography,CT)、正电子发射断层扫描(positron emission tomography,PET)及磁共振成像(magnetic resonance imaging,MRI)等,各种检查方式各有利弊。组织病理学检查是肺癌诊断和病理分型的金标准,广泛应用于临床,但也存在部分禁忌证,例如依从性差或心肺功能不好的患者易发生术前并发症或间质性肺病。CT或PET/CT是胸部最常用的检查方法,在肺癌病理类型的鉴别方面也有一定价值,例如多种双源CT灌注参数联合对非小细胞肺癌(non-small cell lung cancer, NSCLC)患者的病理类型具有较高鉴别价值,能谱CT多参数成像也能够为肺癌病理类型的鉴别诊断提供帮助,但CT的软组织对比度差且辐射剂量高。MRI则可提供良好的软组织对比度。研究[3]发现,MRI增强扫描及弥散加权成像(diffusion-weighted imaging, DWI)可出色地鉴别两者,同时MRI通过多序列成像提高了区分肺癌实性或坏死囊性区域的敏感性和准确度,从而提供更多有关病变成分的信息,且无电离辐射。SANCHEZ等[4]依据CT的检查结果将结节分类后行MRI检查,结果显示,肺部MRI有足够的性能检测实性和亚实性肺结节(>4 mm),可替代CT检查。这说明通过更强的梯度、更高的场均匀性、更短的回波时间和并行成像重建,可以实现MRI技术的发展(图1)。此外,从磁共振动态对比增强(magnetic resonance dynamic contrast enhancement, DCE-MRI)导出的常数和从体素内非相干运动(intravoxel incoherent motion, IVIM)DWI模型导出的表观扩散系数(apparent diffusion coefficient, ADC)均显示,功能MRI技术是一种区分肺癌与孤立性肺结节的潜在方法[5],但目前该技术尚未在临床上广泛使用。近年来,MRI被越来越广泛地应用于肺癌的研究中。本研究主要对多模态MRI技术鉴别肺癌病理类型的研究进展进行综述,主要包括酰胺质子转移(amide proton transfer, APT)成像、IVIM、DWI、弥散峰度成像(diffusion kurtosis imaging,DKI)、DCE-MRI、磁共振波谱成像(magnetic resonance spectroscopy,MRS)等技术,报道如下。
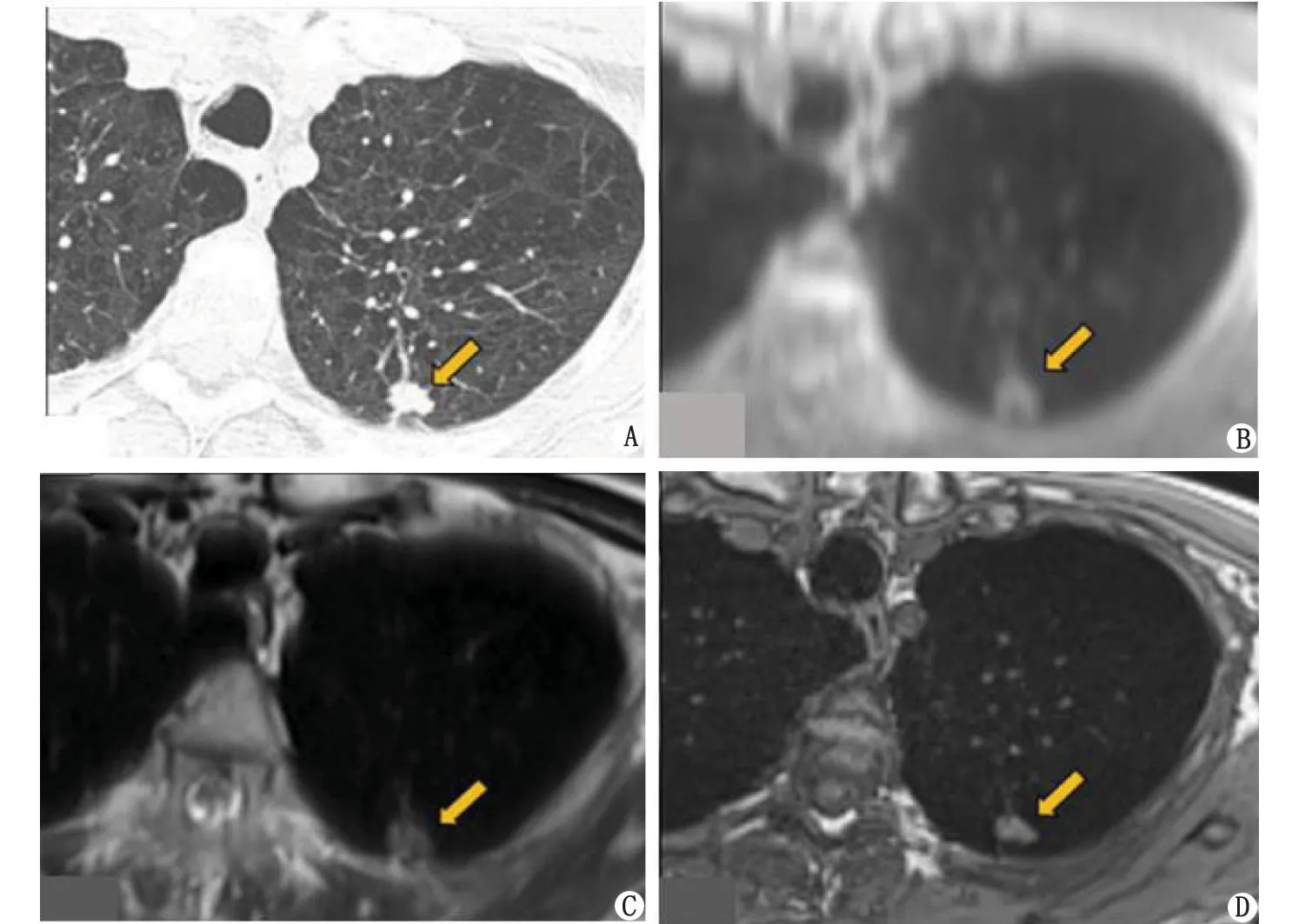
A:计算机断层扫描;B:超短回波时间;C:半傅立叶单次激发Turbo自旋回波;D:容积内插屏气检查。
1 传统检查方法筛查肺癌及鉴别病理类型的价值
CT是检测肺结节的常用方式,但辐射负荷高。目前,MRI作为CT潜在的无辐射的替代方法,广泛应用于临床。YU等[6]通过比较各种MRI序列与CT的肺结节检出率,得出r-Vibe可准确检测出94% 的肺结节,其中直径≥6 mm的肺结节的检出率为100%,显示出MRI检测肺结节的可行性。然而,一项荟萃分析[7]显示,MRI并不能取代CT诊断肺结节,CT和MRI在诊断肺结节方面均具有较高的准确性,但CT在敏感性、特异性、阳性似然比、阴性似然比和曲线下面积方面均优于MRI。此外,OHNO等[8]通过比较薄层MRI和低剂量薄层CT检测肺结节和评估结节类型的准确率,发现两者的差别无统计学意义。不同病理类型的肺癌在MRI上的表现各有特点,T2WI的信号形态改变尤为明显,这有助于不同病理类型肺癌的鉴别[9]。但传统MRI的肺部成像受到低质子密度、快速信号衰减和呼吸运动伪影的限制,筛查早期肺结节及鉴别肺癌病理类型的准确率还有待提高。因此,需要依靠MRI技术的发展,利用各种功能性MRI技术的不同优势来克服这些局限性,更有价值地补充传统MRI技术对于肺癌病理类型鉴别的意义。
2 APT成像筛查肺癌及鉴别病理类型的价值
2.1 原理 瘤灶代谢的变化反映了肿瘤的特征。非侵入性成像方法通过监测体内代谢物的变化或表征肿瘤微环境,在阐明肿瘤生物学方面发挥着重要作用。在MRI模式中,化学交换饱和技术(chemical exchange saturation transfer,CEST)已成为一种新技术,能够选择性饱和代谢物结合的质子,这种饱和通过化学交换进一步影响自由水的信号强度。因此,通过检测水的信号,可间接反映肽、葡萄糖、酰胺质子及黏多糖等低浓度代谢物及微环境的特征,可为肿瘤代谢和酸中毒的体内成像提供高空间分辨率和高灵敏度[10]。APT是CEST成像的一个子集,具体指游离组织水(体水)的质子与内源移动的蛋白质和肽的酰胺基团(—NH)之间的化学交换。该技术无需常规造影剂或放射性示踪剂即可获得有关代谢活动和组织微环境的额外信息。
2.2 应用 OHNO等[11]前瞻性评估APT加权CEST MRI表征胸部病变的能力,研究结果表明,恶性肿瘤磁化转移率的不对称性显著高于良性病变、腺癌显著高于鳞癌。APT加权CEST MRI成像可以显示恶性和良性胸部病变、肺癌和其他胸部恶性肿瘤、肺癌和恶性淋巴瘤以及腺癌和鳞癌之间的显著差异。因此,在3.0T MRI系统上使用CEST成像,有望鉴别和表征胸部结节或肿块。APT成像对于表征肺癌亚型潜在有用。TOGAO等[12]在小鼠肺癌原位模型的基础上进行研究,证明了肺肿瘤体内氨基质子转移成像的可行性,该方法可定量区分2种不同类型的肺肿瘤,且APT效应与肿瘤细胞的增殖能力呈正相关。APT成像有可能提供一种无创的区分肺癌类型或分级的表征测试,最终可能减少肺癌有创穿刺活检或切除的需要,利于早日开启治疗,改善肺癌患者的预后。还有学者[13]通过比较APT和IVIM与PET成像区分良性和恶性孤立性肺部病变及其亚型的能力,发现APT比PET成像能更有效地区分肺鳞癌和腺癌,可成为表征肺部病变的一种成像方式。OHNO等[14]收集了82例肺结节患者,比较APT、DWI和FDG-PET/CT成像区分恶性和良性肺结节的能力,结果发现,虽然ADC的敏感性显著高于非对称磁化转移率(magnetization transfer ratio asymmetry,MTRasym)和最大标准摄取值(maximum value of standard uptake value,SUVmax),但后两者的特异性显著高于ADC。MTRasym与SUVmax联合使用的灵敏度显著高于两者单独使用。此外,MTRasym(3.5×10-6)和SUVmax联合检测的特异性和准确性显著高于ADC,APT成像与DWI和FDG-PET/CT一样可用于区分恶性和良性肺结节。
3 IVIM 筛查肺癌及鉴别病理类型的价值
3.1 原理 生物体的微观运动包括水分子的扩散和血液的微循环。IVIM是一种双指数模型,它将生物组织分为2个组成部分:一个缓慢移动的组成部分,其中水分子基于布朗运动扩散;一个快速移动的组成部分,其中水分子由于血液循环而移动。IVIM的3个定量参数分别是纯扩散系数(D)、伪扩散系数(D*)和灌注分数(f)。D代表纯的水分子扩散运动(缓慢的扩散运动);D*为血液循环产生的假扩散系数,代表灌注相关的扩散运动(快速的扩散运动);f是感兴趣区域内毛细血管网中存在的血液循环灌注效应扩散在整体扩散效应中的体积分数,代表血流量。
3.2 应用 目前,IVIM技术已应用到活体肝脏、乳腺、肾脏、前列腺、胰腺和头颈等部位的多种疾病的灌注测量中,展示了IVIM技术的潜力。ZHENG等[15]通过评估IVIM定量参数在预测术前肺癌组织中Ki-67表达水平中的价值,以及IVIM和DKI定量值在小细胞肺癌(small cell lung cancer, SCLC)和NSCLC之间是否存在差异,得出IVIM导出的真实D值与肺癌组织中Ki-67的表达呈负相关,首次证明了IVIM的D值在区分SCLC和NSCLC方面的准确性,同时发现在3个定量参数中,D值在区分Ki-67高和低表达状态方面具有最高的诊断性能,这为预测Ki-67表达和区分不同肺癌类型提供了一种非侵入性的方法,未来可以用IVIM定量参数来评估肿瘤的增殖能力。陈明梅等[16]通过分析IVIM定量参数在不同类型肺癌中的意义,发现SCLC患者的D和D*值低于腺癌和鳞癌患者,而腺癌与鳞癌间的定量参数差别无统计学意义,且D值鉴别诊断肺癌病理类型的价值更高、各定量参数结合起来的诊断效能最佳。党珊等[17]通过探究 98例肺癌患者中IVIM 3个定量参数鉴别SCLC与NSCLC的价值,表明D值对于鉴别两者有意义,而D*值和f值对鉴别无意义。然而,另有学者[18]发现,腺癌的f值高于鳞癌和SCLC,而鳞癌与SCLC间差别无统计学意义。
4 DWI筛查肺癌及鉴别病理类型的价值
4.1 原理 DWI描述了生物组织中水分子的微观布朗运动,反映了水分子弥散限制的变化,以表征组织的微观结构,从而鉴别不同病理类型的肿瘤。扩散限制的变化可以使用ADC来量化。ADC是体内量化毛细血管灌注和自旋核与扩散分子合并的组合效应的最佳成像参数。Ki-67蛋白是一种与肿瘤增殖相关的核抗原,与肺癌的发生、转移和预后密切相关。Ki-67的高表达与肿瘤细胞高增殖状态有关,增加的肿瘤细胞密度限制了水分子扩散,并相应降低ADC值[19]。
4.2 应用 LI等[20]通过探讨原始T1-mapping和DWI对肺癌病理类型和分化程度的鉴别价值及其与Ki-67蛋白表达的相关性,得出SCLC与鳞癌、腺癌ADC值的差别均有统计学意义,鳞癌与腺癌ADC值的差别无统计学意义,ADC值与Ki-67指数之间存在负相关,且本次研究首次将DWI与T1-mapping 相结合,证实了两者联合可无创鉴定肺癌的病理类型和分化程度,并可提高分化程度的诊断功效。REN等[21]通过比较Ki-67指数在腺癌、鳞癌和SCLC中的不同表达水平,发现ADC值与Ki-67 指数间存在中度负相关(相关系数介于0.3~0.7),而在区分肺癌病理类型方面,两者并无相关性,且腺癌的ADC值高于其他类型肺癌。USUDA等[22]通过分析DWI的ADC与肺癌病理之间的关系,发现黏液腺癌的ADC值明显高于其他细胞类型的腺癌,且有坏死的肺癌的ADC值明显低于无坏死的肺癌,肺癌的ADC值随细胞分化程度的降低而降低。其他学者[23]也发现,NSCLC患者的ADC值明显高于SCLC患者,腺癌的ADC值明显高于鳞癌。原因可能是SCLC细胞的数量多且核大,几乎没有细胞质,从而限制了水分子的扩散,降低了ADC值。DWI可以比CT提供更多的信息,包括肿瘤内脉管系统、淋巴结受累和积液等(图2)。ZHANG等[24]分析了孤立性肺部病变(solitary pulmonary lesions,SPL)中ADC值与多个组织病理学参数之间的相关性,发现恶性SPL中细胞密度和黏液与ADC值独立相关,但核质比、坏死分数和分化程度均与ADC值无关;同时,良性肿瘤的ADC值与组织病理学参数无明显相关性。因此,ADC值可以准确鉴别良性和恶性肺肿瘤。
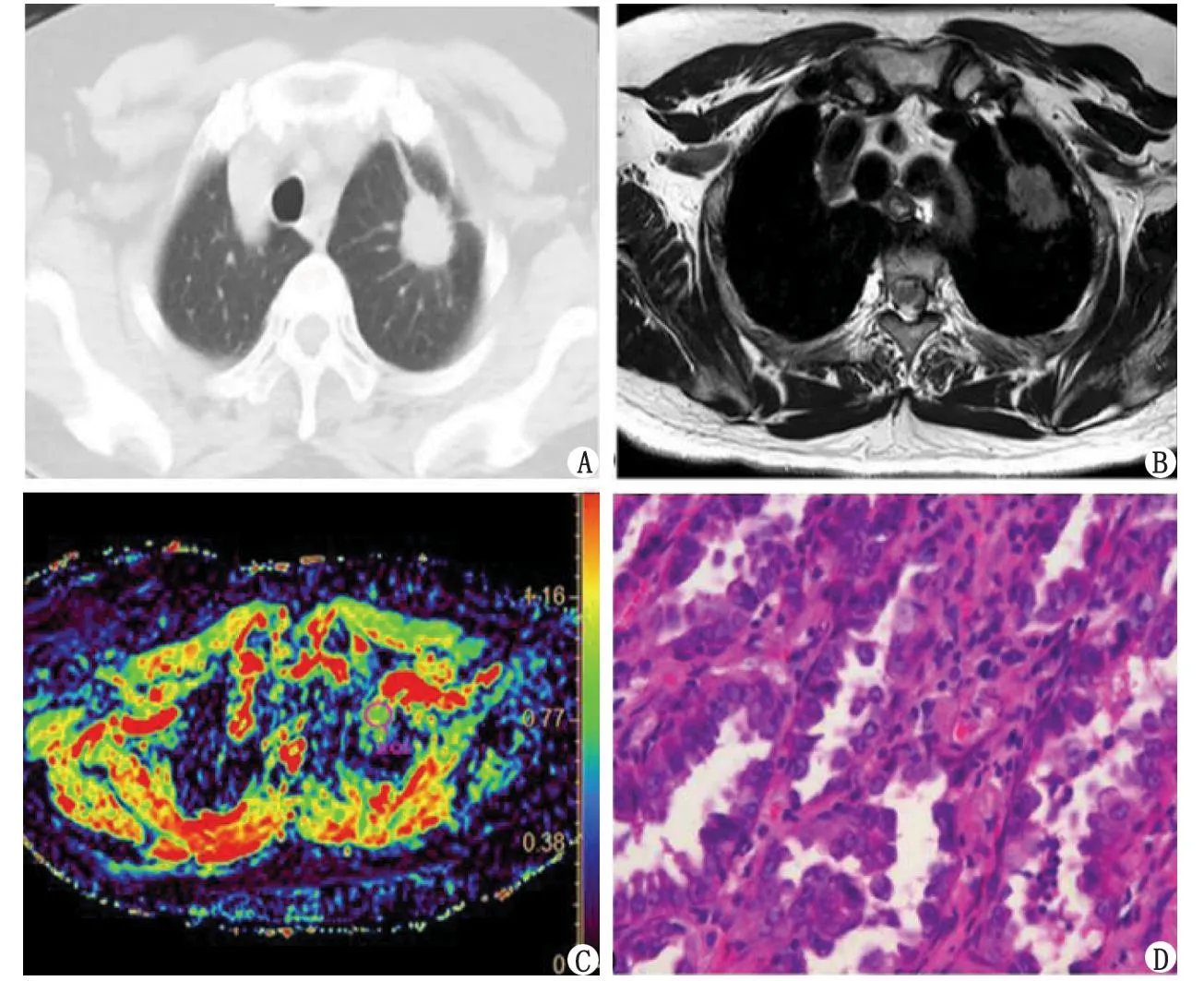
1例62岁左上叶肺腺癌女性患者。ROI:感兴趣区。A:CT图像;B:T2加权图像;C:放置ROI的DWI ADC图(ROI中的平均ADC值为1.01×10-3 mm2/s);D:用于分析的组织病理切片中的1个视野。
5 DKI筛查肺癌及鉴别病理类型的价值
5.1 原理 DKI是DWI的扩展[25],其特点是描述非高斯分布水分子扩散的模型,可以更加准确地反映癌灶的微观结构特征。DKI模型的2个定量参数分别是反映感兴趣区域组织微结构复杂性的平均扩散峰度值(mean kurtosis,MK)和反映水分子扩散水平及阻力的平均扩散率(mean diffusivity,MD)。
MK为DKI技术最关键的参数,定义为扩散峰度在所有方向的平均值。MD与ADC类似,均反映了水分子在单位时间内扩散运动的范围,并且与细胞密度数量即细胞内的基质紧密相关。
5.2 应用 目前,在肺部病变的评估领域,只有少数研究探讨了DKI在区分肺癌病理学类型方面的价值。谢磊等[26]通过探讨DKI模型成像技术在鉴别肺癌病理学类型中的价值,得出SCLC与腺癌及鳞癌MD值的差别均有统计学意义,而腺癌与鳞癌MD值的差别无统计学意义;SCLC、腺癌和鳞癌的MK值两两比较,差别均无统计学意义,且肺癌的分化程度与DKI的定量参数有关,即与MD值呈正相关,与MK值呈负相关。然而,部分研究却得出相反的结论,例如FENG等[27]通过研究DKI参数在NSCLC分型中的应用,发现腺癌的MK值显著高于鳞癌,2组的MD值差别无统计学意义。本研究进一步探讨了ADC和MD在评价NSCLC分期中的价值,结果显示,ADC和MD与NSCLC分期无明显关联。这可能是由于NSCLC分期是根据原发灶大小、浸润深度、邻近组织受累范围、有无淋巴结转移等多种因素综合判断的,而ADC和MD主要反映细胞密度。因此仅根据ADC和MD值不能准确预测肿瘤分期。
6 DCE-MRI筛查肺癌及鉴别病理类型的价值
6.1 原理 DCE-MRI通过高压注射器向静脉团中注入对比剂后,连续不断地在病变区域内扫描检查。由于对比剂的外渗及肺部不同性质的病变对代谢的影响差异,不同病灶的信号强度变化不同,从而可用于检测和反映肺癌的血供规律,对肺部的肿块性质进行定性和定量评估[5,28]。在扩展的Tofts数学模型的基础上进行分析,得到3个定量参数:从血浆到血管外细胞间隙(extravascular extracellular space,EES)的体积转移常数(Ktrans),主要受血流灌注及组织渗透率的影响;从EES到血浆的速率常数(Kep),是反映造影剂从血管外和细胞外空间转移回血液的速率的反向速率常数;作为每单位体积组织的EES的体积(Ve),反映血供情况、组织细胞结构特点,且与预后相关[29]。
6.2 应用 王大勇等[30]发现,DCE-MRI定量参数有助于鉴别肺癌的不同病理类型,可有效指导肺癌的临床诊治,肺腺癌的定量参数Ktrans、Kep及Ve值均显著高于鳞癌及SCLC。库雷志等[31]也发现,不同病理类型肺癌的3个定量参数有差异,鳞癌与SCLC的Ktrans、Kep及Ve值均小于腺癌(图3)。血流动力学的半定量参数也可用来展示肺部癌性病灶及微循环灌注的改变。孟思等[32]发现,肺癌患者血流动力学的半定量参数与肺癌的病理类型紧密相关,腺癌患者的达峰时间和流入速率均显著高于鳞癌和SCLC。此外,由于肺癌、肺部炎性及良性肿块患者之间信号强度-时间(SI-T)曲线的重叠与交叉,良性病灶与急性炎症患者病变区通常会产生肉芽肿,并伴有不同分化程度,且不同病理类型的肺癌患者SI-T曲线也存在一定差异,因此,不能单纯依靠SI-T曲线对肺部病变进行鉴别诊断。另有学者[33]发现,DCE-MRI定量灌注直方图可作为一种无创且可复制的方法,间接评价肺癌PI3K/Akt/mTOR信号通路基因的激活情况,为MRI在分子水平上评价肿瘤的异质性提供了新方法。
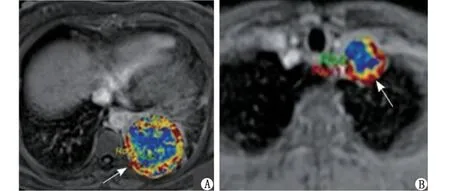
A:1例55岁左肺下叶鳞癌女性患者。箭头所指伪彩图示ROI内动态增强定量参数Ktrans、Kep、Ve值分别为0.297 min-1、1.633 min-1、0.185;B:1例55岁左肺上叶小细胞肺癌男性患者。箭头所指伪彩图上测的动态增强定量参数Ktrans、Kep、Ve值分别为 0.077 min-1、0.592 min-1、0.130。
7 MRS筛查肺癌及鉴别病理类型的价值
7.1 原理 MRS为目前唯一能无创性观察活体组织代谢及生化变化的技术[34],主要利用原子核化学位移现象进行成像。不同化合物的相同原子核以及相同化合物的不同原子核之间,由于所处的化学环境不同,其周围磁场可有轻微变化,共振频率也会有差异,这种情况就是化学位移现象。MRS的原理就是通过共振频率的微小差异区分不同化学位移,从而鉴别感兴趣区域内组织不同化学物质的类型及含量。MRS是振幅与频率的函数,横轴表示化学位移(频率差别),单位为百万分之一(10-6),纵轴表示信号强度。由于心脏搏动和呼吸运动导致匀场的受限及定位困难,体外1H-MRS 在肺组织的应用较为困难,且图像中乳酸峰与脂质信号常重叠,因此,MRS较少用于肺癌的检测。但FUJIMOTO等[35]用1H-MRS 检测了1例右上叶肺腺癌的乳酸和胆碱,显示出肺癌较正常组织有较高的乳酸和胆碱信号。
7.2 应用 血清代谢谱可能在临床无症状阶段检测出肺癌,因此,建立血清代谢谱可为临床提供巨大意义。JORDAN等[36]通过同时测量肺腺癌和鳞癌患者的组织和血清代谢谱,基于病理学结果使用可测量代谢物的主成分和典型分析,建立评价癌症类型的组织代谢组学特征及代谢谱,认为血清MRI光谱学可以区分肺癌的病理类型(图4)。ROCHA等[37]通过高分辨率魔角旋转MRI光谱分析肺癌病灶,指出腺癌与磷脂和蛋白质的分解代谢相关,而鳞癌与较强的糖酵解和谷氨酰胺的分解代谢相关。其他肿瘤代谢特征,如肌酸和谷胱甘肽在鳞癌中特别突出,牛磺酸和尿苷核苷酸在腺癌中增加较为明显,均显示出辅助鉴别肺肿瘤亚型的巨大潜力。还有研究[38]对常规临床实践期间获得的10例腺癌、10例鳞癌和10例非恶性疾病患者的淋巴结穿刺液进行代谢组学分析,生成代谢谱,证明了基于淋巴结抽吸物的代谢特征及淋巴结抽吸物代谢物分析鉴别肺癌病理类型的可行性和相关性,并揭示新的治疗靶点,补充和完善肺癌诊断的有效途径。
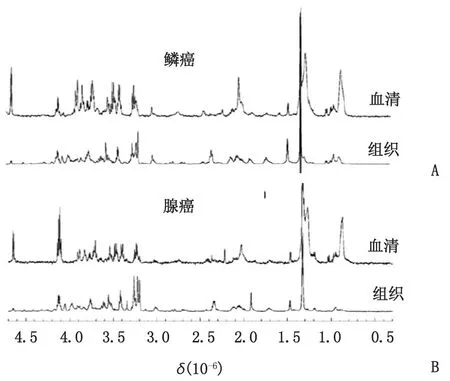
HRMAS:高分辨率魔角旋转。δ:化学位移。A:鳞癌患者完整组织和配对血清的HRMAS MRI谱;B:腺癌患者完整组织和配对血清的HRMAS MRI谱。
综上所述,虽然多模态MRI仍存在许多局限性,例如脂肪干扰、呼吸运动伪影及B0/B1不均匀性等,但该技术将在肺癌的诊疗中发挥应有的作用。组织病理学检查虽然是诊断肺癌和判断病理分型的金标准,但也存在一些禁忌证。无论是CT还是PET-CT都无法避免电离辐射,同时也不能直观反映肿瘤组织的分子生物学特征。MRI作为一种无创、安全且具有高分辨率的检查技术,与CT或PET-CT相比,具有无电离辐射的优点,不仅对解剖学成像,而且对生理和化学特性成像具有无限的可能性。利用其功能成像,可无创地了解病变的组织学特征,有助于区分肺癌的病理类型和肿瘤的分化程度,并且可通过分析相关定量参数与增殖指数Ki-67的相关性,发掘功能性MRI评估肺癌患者疾病进展的潜力,有望成为辅助肺癌诊治的有效手段。
