超重度免疫缺陷SPF 小鼠感染大肠埃希菌的案例分析
2024-01-09聂永胜高求炜
聂永胜,高求炜,周 烁,王 玮
( 仲恺农业工程学院动物科技学院,广东 广州 510000 )
大肠杆菌病是由大肠埃希菌(Escherichia coli,E. coli)引起的细菌性人畜共患病[1]。大肠埃希菌是动物或人肠道内的正常菌群,一般情况不具有致病力,只有某些特殊血清型的大肠埃希菌具有致病性[2],属于革兰氏阴性短杆菌,大小为(1.1~1.5) μm×(2~6) μm,多数有周身鞭毛[3]。在开展动物试验时,实验动物的异常死亡应引起重视,调查清楚死亡原因并明确其对试验结果的影响是实验动物兽医的职责。
在某次开展药效学试验时,实验室购买超重度免疫缺陷SPF 小鼠300 只(5~6 周龄,雌性,体重20~25 g),到货时发现死亡3 只,后续检疫期内陆续发现死亡5 只,共死亡8 只。为探究小鼠死亡原因,选择死亡小鼠中尚未发生自溶的5只小鼠进行大体病理解剖。本研究利用兽医临床微生物知识对超重度免疫缺陷小鼠出现死亡的原因进行了充分分析,最终找到了病因,为后续试验的顺利进行提供了帮助。此外,在研究过程中以质谱仪鉴定菌种,本研究结果也可为微生物快速鉴定技术的应用提供一定参考。
1 材料与方法
1.1 试验材料
1.1.1 仪器与耗材
CX23生物显微镜(奥林巴斯公司)、SPX150BE生化培养箱(力辰科技有限公司)、BSC-1300ⅡA2生物安全柜(苏州安泰空气技术有限公司)、Microflex LT/SH MALDITOF飞行时间质谱仪(德国布鲁克公司)等。
营养琼脂(N/A)平皿(南通凯恒生物科技发展有限公司)、麦康凯培养基(南京全隆生物技术有限公司)、革兰氏染液(比克曼生物公司)、一次性无菌接种环(比克曼生物公司)、生理盐水(山东齐都药业有限公司);细菌培养试管、细菌生化检测试剂(广东环凯生物公司)。解剖镊子剪刀由上海医疗器械基团有限公司生产,高压灭菌后使用。
1.1.2 试验菌株与动物
医学院校科研用大肠埃希菌标准菌株(需保密),同品系免疫缺陷SPF小鼠10只(供应商需保密)。
1.2 试验方法
1.2.1 解剖记录病理变化
对死亡但尚未发生自溶,具有病理解剖意义的5 只小鼠在二级生物安全柜中进行解剖,全程注意无菌操作并做好自身生物安全防护,拍照观察记录相关病理变化。
1.2.2 病变渗出物涂片革兰氏染色镜检
对小鼠胸腹腔渗出物与胶冻样物质进行涂片,操作方式同血涂片,蘸取一滴渗出液,推片接近渗出液,使液体呈一字展开,推片与载玻片呈30°角,匀速推向另一侧,厚薄适中,自然晾干。之后进行革兰氏染色:结晶紫染60 s,碘液染60 s水洗,无水乙醇脱色30 s,沙黄复染60 s后镜检。
1.2.3 病料培养
对渗出物用无菌采样环划线接种于无菌普通琼脂培养基与麦康凯培养基(全程在二级生物安全柜中进行),在生化培养箱中37.0 ℃培养48 h,观察菌落生长情况,并挑取菌落用无菌液稀释后涂片,进行革兰氏染色镜检。
1.2.4 细菌生化鉴定
培养出的细菌进行纯化分批接种于多管细菌培养试管中培养,菌种生长良好,之后开展乳糖、动力、葡萄糖产气、醋酸盐等细菌生化鉴定并汇总记录结果。
1.2.5 质谱仪细菌鉴定
对普通琼脂与麦康凯培养基培养出的细菌各接种于专业的运输培养基,送检第三方机构(检测机构需保密,有CNAS与CM资质),使用质谱仪对菌种进行鉴定。
1.2.6 攻毒试验
知悉病原菌种属后,使用该菌标准菌株对同品系的小鼠10只进行攻毒试验。设立试验组与对照组,每组5只小鼠,原菌液进行100 倍稀释,试验组每只小鼠灌服0.2 mL菌液,对照组灌服0.2 mL 生理盐水,饲养于屏障级独立通风系统笼具(IVC)内,饲养观察1周。
2 结果与分析
2.1 小鼠剖检结果(见图1~图3)

图1 小鼠肝脏表面有纤维素性渗出Fig.1 Anatomy shows a fibrinous exudation on the surface of the mice liver

图2 到货时死亡小鼠胸腔解剖结果Fig.2 Results of thoracic anatomy of the dead mice upon arrival
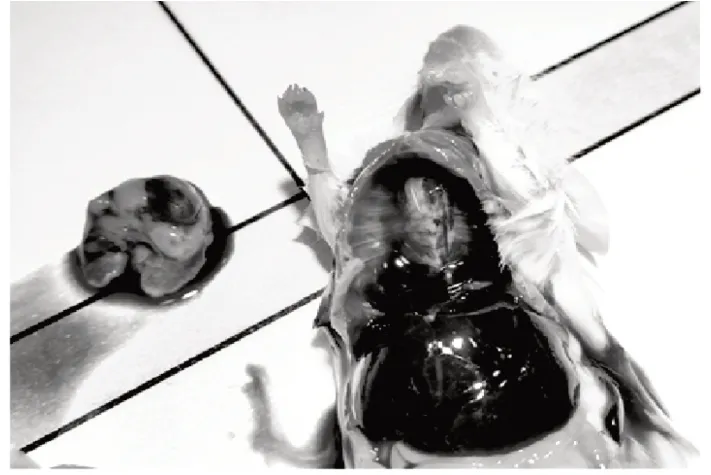
图3 检疫期内死亡小鼠胸腔解剖结果Fig.3 Results of thoracic anatomy of the dead mice during quarantine period
由图1~图3 可知,解剖的5 只小鼠表现的大体病理变化均为胸腹腔纤维素性渗出,部分肝脏表面被纤维素性渗出物附着,还有部分小鼠心肺被大量胶冻样物质包裹,出现“包心包肝”现象。
2.2 病变渗出物涂片革兰氏染色镜检结果(见图4)
由图4 可知,渗出物直接镜检可见少量炎性细胞和大量革兰氏阴性短杆菌。
2.3 病料培养及培养菌落镜检结果(见图5~图7)

图5 普通琼脂培养皿培养菌落Fig.5 Colonies were cultured in the ordinary AGAR dishes
由图5、图6 可知,普通琼脂菌落呈圆形、直径为2~3 mm、稍凸、边缘整齐、灰白色、不透明的菌落、少数菌株出现β溶血环、极少数出现较大、扁平、皱起的粗糙型菌落;在麦康凯琼脂平板上形成不透明、粉红色菌落,部分形成中间黄色、周围红色菌落。

图6 麦康凯琼脂培养皿培养菌落Fig.6 Colonies on the MacConkey AGAR plates
由图7 可知,渗出物培养皿挑取菌落进行革兰氏染色镜检,培养菌株为革兰氏阴性短杆菌。

图7 渗出物培养皿挑取菌落革兰氏染色镜检结果Fig.7 Results of Gram staining microscopy of the colonies picked from the exudate petri dishes
2.4 细菌生化分析结果(见表1)
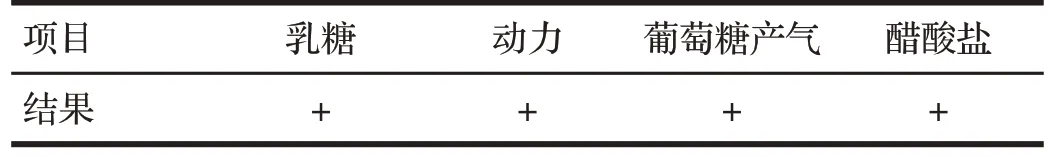
表1 细菌生化分析结果Tab.1 Results of the bacterial biochemical analysis
由表1可知,分离株乳糖、动力、葡萄糖产气、醋酸盐结果均为阳性,生化结果指向大肠埃希菌。
2.5 质谱仪细菌鉴定结果
第三方检测公司反馈分离株为大肠埃希菌。
2.6 攻毒试验结果
饲养1周后,对照组小鼠未见异常,试验组5只同品系小鼠中有2只出现症状后死亡,剖检可见胸腹腔纤维性渗出,胸腔心肺被胶冻样物质包裹的大体病理变化(见图8);对渗出物接种于麦康凯培养基培养,形成粉红色菌落(见图9);对所培养细菌进行革兰氏染色物镜检与质谱仪鉴定,确定分离株为大肠埃希菌(见图10)。

图8 攻毒试验小鼠大体病理表现Fig.8 Gross pathological findings of the mice in challenge experiments

图10 渗出物革兰氏镜检结果Fig.10 Gram microscopic examination of the exudate
3 讨论
大肠埃希菌为动物体内正常菌,作为一种构造简单的原核生物,因其具有遗传背景清晰、易培养、生长繁殖快速、在肠道中易成为优势菌等优点成为如今肠杆菌科原核工程菌的代表性菌株[4]。《中国药典》2010年版收载了大肠埃希菌的确认方法,即4-甲基伞形酮葡糖酸酐(MUG)和靛青质(indole)试验可作为确认的参考方法;IMViC 试验【包括靛基质试验(I)、甲基红试验(M)、乙酰甲基甲醇生成试验(V-P)、枸橼酸盐利用试验(C)试验】亦可作为鉴定和确认的参考[5]。
在本试验鉴定过程中,质谱仪发挥了很重要的作用,基质辅助激光解析/电离飞行时间质谱技术(MALDITOF MS)是一项微生物快速鉴定技术,以其快速、准确、重复性好、高通量的特点在细菌鉴定、耐药性和毒力监测中发挥重要的作用[6-7]。作为近年来发展起来的新型诊断技术[8-9],MALDI-TOF MS技术根据细菌的形态、生化、抗原、遗传等特征,可以快速完成对微生物种、属水平的鉴定[10]。MALDI-TOF MS 的样品处理简单快速,可提供复杂样品中各组分分子量的信息,逐渐发展成为系统细菌学研究人员的新工具[11]。MALDI-TOF MS 通过将扫描出的质谱数据结果与标准蛋白指纹图谱库中的信息进行比对,从而得出鉴定结果[12-13]。
实验动物按微生物等级划分为:普通级动物、无特定病原体级动物、无菌级动物[14]。不同级别的实验动物生活在不同要求的环境中,普通级动物饲养于普通环境,无菌级动物生活在隔离环境中。无特定病原体级动物生活在屏障环境中,该环境要求符合动物居住要求,严格控制人员、物品和空气的进出,适用于饲育清洁级和无特定病原体(specific pathogen free,SPF)级实验动物[15]。
超重度免疫缺陷鼠因其自身的免疫系统功能弱,B淋巴细胞、T细胞淋巴极少,树突状细胞、自然杀伤细胞等较免疫正常小鼠含量少,易发生微生物感染。因此,超重度免疫缺陷鼠需按照国标要求饲养在符合洁净度达到5级的环境中,建议使用IVC 或隔离包进行饲养,尽量减少人为污染。大肠埃希菌未列入新国标SPF 级别小鼠必须排除病原,但其对重度免疫缺陷鼠该菌的致病性还需要重点关注。本研究中,对于该菌的感染路径以及作用机制受限于实验条件,未能进一步展开;鉴于本试验中的小鼠生活在屏障环境中,接触的垫料、饮水、饲料皆是灭菌后使用,且并未发生大规模发病,表明大肠埃希菌在此类小鼠中的传染性有限。结合攻毒试验结果,目前推测是部分免疫缺陷小鼠肠道内菌群上行引起的内源性感染[16]。
肠道菌群主要通过跨肠上皮细胞转运和紧密连接转运等两种方式由肠静脉到达门静脉或由肠淋巴系统进入体循环。跨细胞转运主要是通过一些特殊的细胞通道以及泵膜,大肠埃希菌、变形杆菌等活细菌主要通过此类方式入侵。紧密连接转运主要源于肠腔内渗透压改变、肠上皮细胞骨架及其蛋白构架微管和微丝的直接破坏,大分子如内毒素就是通过疏松的紧密连接进行易位。高度免疫缺陷实验小鼠T 细胞缺失,致使其盲肠中厌氧菌含量较低,导致厌氧菌对肠杆菌的抑制作用减弱,大肠埃希菌过量繁殖[17],成为致病菌。有很多文献描述了肠道微生物易位感染。肠道不仅是最重要的消化和吸收器官,也是机体最大的免疫器官和重要的生理屏障。肠道覆盖着体内最大的黏膜层,可隔离机体与肠腔内大量内容物,以免微生物的侵袭和毒素、抗原分子的损害。肠腔内含有300~500种细菌,主要集中于下消化道,每毫升粪便中细菌量可达1012,约占粪便干重的60%[18]。在失血、失液、休克、严重烧伤、呼吸衰竭、营养不良、严重感染、缺血缺氧、严重创伤、免疫缺陷等应激状态下,肠壁通透性增加,肠屏障功能受损,原存在于肠腔内的细菌和毒素向区域淋巴结、门静脉及外周血易位,黏膜下层免疫细胞异常激活,炎症介质释放,进而引发系统性炎症反应综合征(systemic inflammatory response syndrome,SIRS)甚至多器官功能障碍 综 合 征(multiple organ dysfunction syndrome,MODS)[19]。为保证科学试验不受干扰,不能使用抗生素防控实验动物疾病,可从增强肠道抵抗力与整体免疫力的方面考量,如添加无菌营养胶,保证小鼠饲养环境洁净度,减少微生物富集,避免价格昂贵的实验鼠发病死亡。实验动物兽医需要作出专业的诊断,查明实验动物异常的原因,为相关动物试验的顺利开展提供技术支持。
4 结论
本研究中,综合评估培养基菌落形态、颜色及生化鉴定、质谱仪鉴定、攻毒试验等结果,判定该批超重度免疫缺陷小鼠发病原因为大肠埃希菌感染,并且由大肠埃希菌易位或上行引起渗出性炎症最终死亡等可能性较大。
