舒泰与赛拉嗪联合使用对巴马小型猪的麻醉效果及影响
2024-01-09冉艳洪颜欣欣周珊珊王俐梅
冉艳洪,颜欣欣,宋 慧,周珊珊,王俐梅,杨 威
( 广州湾区生物医药研究院 广东莱恩医药研究院有限公司广东省药物非临床评价研究企业重点实验室 国家中药现代化工程技术研究中心中药非临床评价分中心 广东省创新药物评价与研究工程技术研究中心,广东 广州 510990 )
在动物试验中,良好且稳定的麻醉既要求能够保证操作顺利进行、人员安全和动物福利,又要尽可能避免对采集的试验数据的干扰。小型猪作为实验动物具有很强的优势[1-2],在生物医学研究中常需使用药物对其进行镇静或麻醉,其中氯胺酮和舒泰是小型猪最常用的注射类麻醉药。然而,氯胺酮的购买、管理和使用均受到管控,限制了其在临床实践中的日常使用。舒泰作为新型的分离麻醉剂,属非管制类药品,易获得,已广泛应用于多种属动物,但肌松效果差。而赛拉嗪作为α肾上腺素受体激动剂,具有良好的镇静、镇痛和肌松效果,二者联合使用能够取长补短,具有广阔的应用前景[3]。值得注意的是,运用任何麻醉药物均可能导致动物产生潜在的生理并发症,如呼吸抑制、血流动力学改变和高脂血症等,但目前有关小型猪联合使用舒泰和赛拉嗪进行麻醉的用量尚无统一标准,对麻醉的稳定性及安全性也知之甚少。因此,本文旨在探索舒泰联合赛拉嗪对巴马小型猪的麻醉效果,并系统阐述麻醉剂量对动物生理指标的影响。
1 材料与方法
1.1 试验材料
1.1.1 试验动物
普通级巴马小型猪6 只,2 雌4 雄,7~8 月龄,体重(14.25±1.32) kg,均购自湖北奥菲生物科技有限公司,饲养于广东莱恩医药研究院有限公司(已获得国际AAALAC认可)普通环境动物房。
1.1.2 主要仪器
MC-347 型电子体温计【欧姆龙健康医疗(中国)有限公司】;SP2006 心电图采集与解析系统、BP-2010E 智能无创血压计(北京软隆生物技术有限公司);XN-1000[B3]全自动血液分析仪【希森美康医用电子(上海)有限公司】;7180全自动生化分析仪(日本日立公司);IW2-150电子台秤【赛多利斯工业称重设备(北京)有限公司】。
1.1.3 主要试剂
舒泰50(替来他明125 mg+唑拉西泮125 mg),由VIRBAC公司生产;盐酸赛拉嗪注射液(2 mL∶0.1 g),由吉林省华牧动物保健品有限公司生产;血常规检测试剂,由Sysmex 公司生产;血液生化学检测试剂,由浙江伊利康生物科技有限公司生产。
1.2 试验设计
试验设置3 个剂量组,6 只巴马小型猪间隔使用舒泰0.75 mg/kg+赛拉嗪6 mg/kg(A 组)、舒泰0.75 mg/kg+赛拉嗪12 mg/kg(B组)、舒泰1.00 mg/kg+赛拉嗪8 mg/kg(C组)经肌肉注射进行麻醉,注射部位为耳后三角区,不同组麻醉时间间隔5 d 以上,麻醉前禁食不禁水约12~14 h,麻醉过程中采用毛巾覆盖全身进行保温处理。
1.3 测定指标及方法
1.3.1 麻醉效果评估
观察动物麻醉过程中的体动情况和镇静镇痛效果,并记录麻醉诱导时间、维持时间和恢复时间。诱导时间指从注射麻醉药物到动物趴卧安静、翻正反射和眼睑反射消失的时间间隔;维持时间指无外界刺激下,自动物趴卧安静、翻正反射和眼睑反射消失至动物眼睑反射恢复、肢体恢复自主活动的时间间隔;恢复时间指在无外界刺激下,自动物眼睑反射恢复、肢体恢复自主活动至动物可以自主站立的时间间隔。
1.3.2 生理指标监测
在麻醉前后对巴马小型猪进行肛温、呼吸频率、收缩压(SBP)、舒张压(DBP)、平均动脉压(MBP)、心电图(ECG)以及血常规和血液生化的相关指标进行监测。在安静状态下使用智能无创血压计测量巴马小型猪前肢的SBP、DBP、MBP,使用Ⅱ导联监测心电图;使用全自动血液体液分析仪、全自动生化分析仪及相应的检测试剂检测血常规、血清生化检查指标。上述检测项目均按照试剂盒或仪器说明书进行操作。
由于实验室工作人员的待遇跟授课教师的待遇差别很大,没有得到同教学科研人员同等的待遇,导致很多实验室管理人员数量不足,并且存在散漫管理的现象,所以,民办高校要通过多种渠道提高实验室管理人员的工作热情。
血常规指标包括:白细胞数(WBC)、红细胞数(RBC)、血红蛋白(HGB)、血细胞比容(HCT)、平均红细胞体积(MCV)、平均血红蛋白含量(MCH)、平均血红蛋白浓度(MCHC)、血小板数(PLT)、嗜中性粒细胞数(NEUT)、淋巴细胞数(LYMPH)、单核细胞数(MONO)、嗜酸性粒细胞数(EO)、嗜碱性细胞数(BASO)。
血清生化检查指标包括:谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)、乳酸脱氢酶(LDH)、谷氨酰转移酶(GGT)、尿素氮(BUN)、肌酐(CREA)。
1.4 数据统计分析
采用SPSS 21.0 软件对试验数据进行统计分析,组间比较采用LSD-t检验,组内比较采用独立样本t检验。结果以“平均值±标准差”表示,P<0.05表示差异显著。
2 结果与分析
2.1 舒泰联合赛拉嗪对巴马小型猪麻醉效果的影响(见表1)
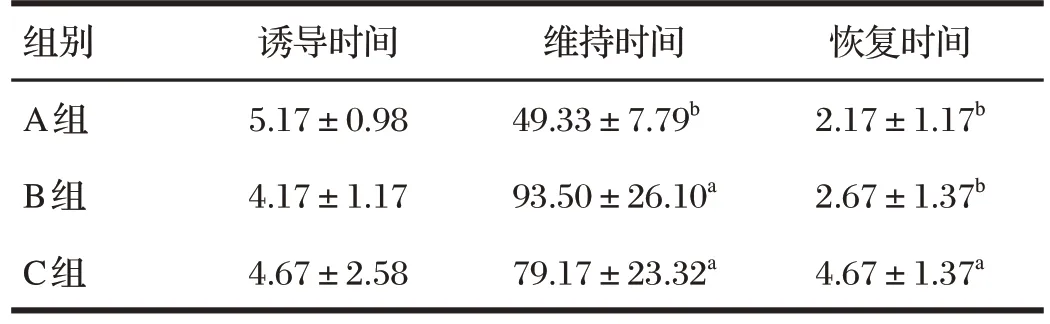
表1 舒泰联合赛拉嗪对巴马小型猪麻醉时间的影响Tab.1 Effect of zoletil combined with xylazine on anesthesia time in Bama miniature pigs 单位:min
A 组、B 组和C 组巴马小型猪在注射麻醉药物后均稳定进入麻醉状态,麻醉成功率100%,且维持麻醉期间内肌肉松弛良好、眼睑反射和角膜反射均消失,针刺四肢内侧皮肤无痛觉,亦未见动物死亡。
由表1 可知,各组诱导时间差异不显著(P>0.05);B 组、C 组维持时间显著高于A 组(P<0.05),B 组与C 组维持时间差异不显著(P>0.05);C组恢复时间显著高于A组、B组(P<0.05),A组、B组间差异不显著(P>0.05)。
2.2 舒泰联合赛拉嗪对巴马小型猪生理指标的影响

表2 舒泰联合赛拉嗪对巴马小型猪肛温的影响Tab.2 Effect of zoletil combined with xylazine on the rectal temperature of the Bama miniature pigs 单位:℃

表3 舒泰联合赛拉嗪对巴马小型猪呼吸频率的影响Tab.3 Effect of zoletil combined with xylazine on the respiratory rate of the Bama miniature pigs 单位:次/min
由表2、表3可知,A组、B组和C组的肛温和呼吸频率在麻醉后整体上呈现出降低趋势,在苏醒后约1 h 时已恢复至正常范围。组内分析结果显示,麻醉中(30±5) min时A 组猪的肛温显著低于麻醉前(P<0.05);麻醉中(50±5) min 时B 组猪的肛温显著低于麻醉前(P<0.05);麻醉中(30±5)、(50±5) min 时C 组猪的肛温显著低于麻醉前(P<0.05)。麻醉前后A 组、B 组猪的呼吸频率差异均不显著(P>0.05);麻醉中C组猪的肛温呼吸频率均显著低于麻醉前(P<0.05)。组间比较,麻醉前后各组猪的肛温和呼吸频率差异均不显著(P>0.05)。
2.2.2 舒泰联合赛拉嗪对麻醉中巴马小型猪无创血压的影响(见表4)
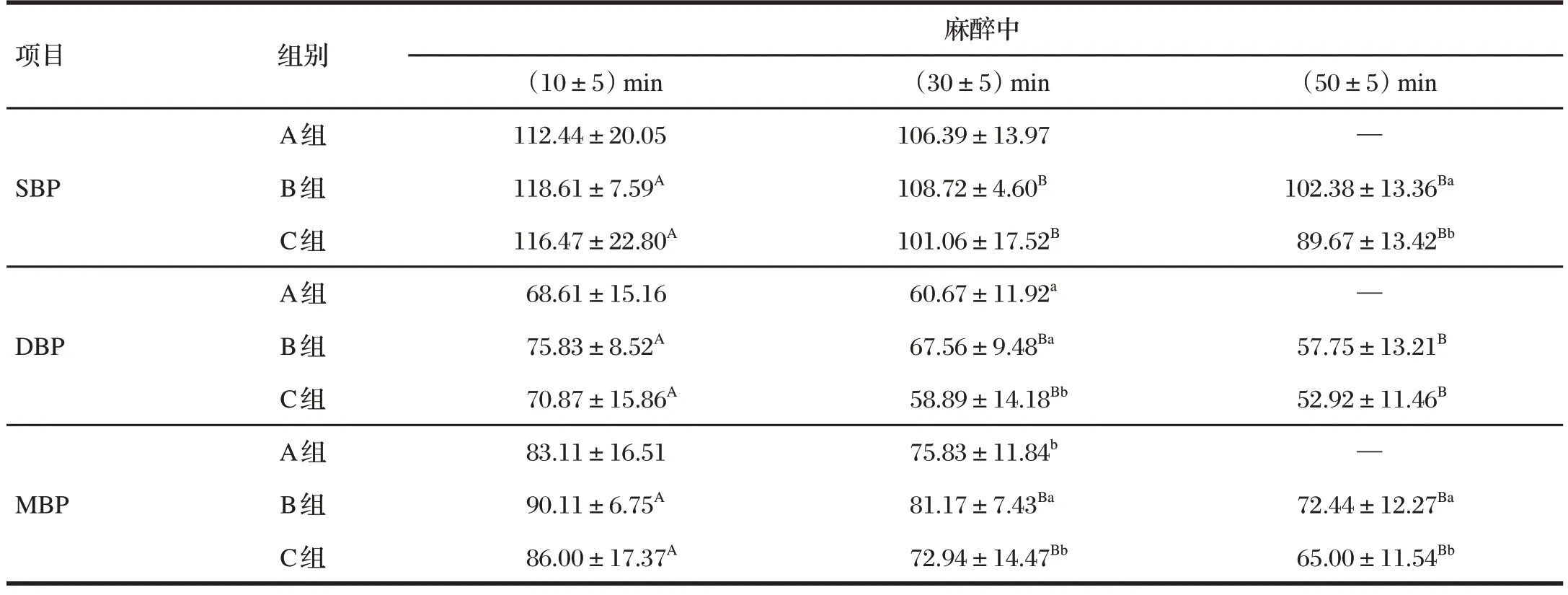
表4 舒泰联合赛拉嗪对麻醉中巴马小型猪无创血压的影响Tab.4 Effect of zoletil combined with xylazine on the non-invasive blood pressure of the Bama miniature pigs under anesthesia 单位:mmHg
由表4可知,随着麻醉时间延长,各组猪的SBP、DBP、MBP 均呈下降趋势,并且随着舒泰使用剂量增高,其对SBP、DBP、MBP 的影响更明显。麻醉中、后期B 组和C 组猪的SBP、DBP、MBP均显著低于麻醉初期(P<0.05)。
2.2.3 舒泰联合赛拉嗪对巴马小型猪心电图各间期的影响(见表5)
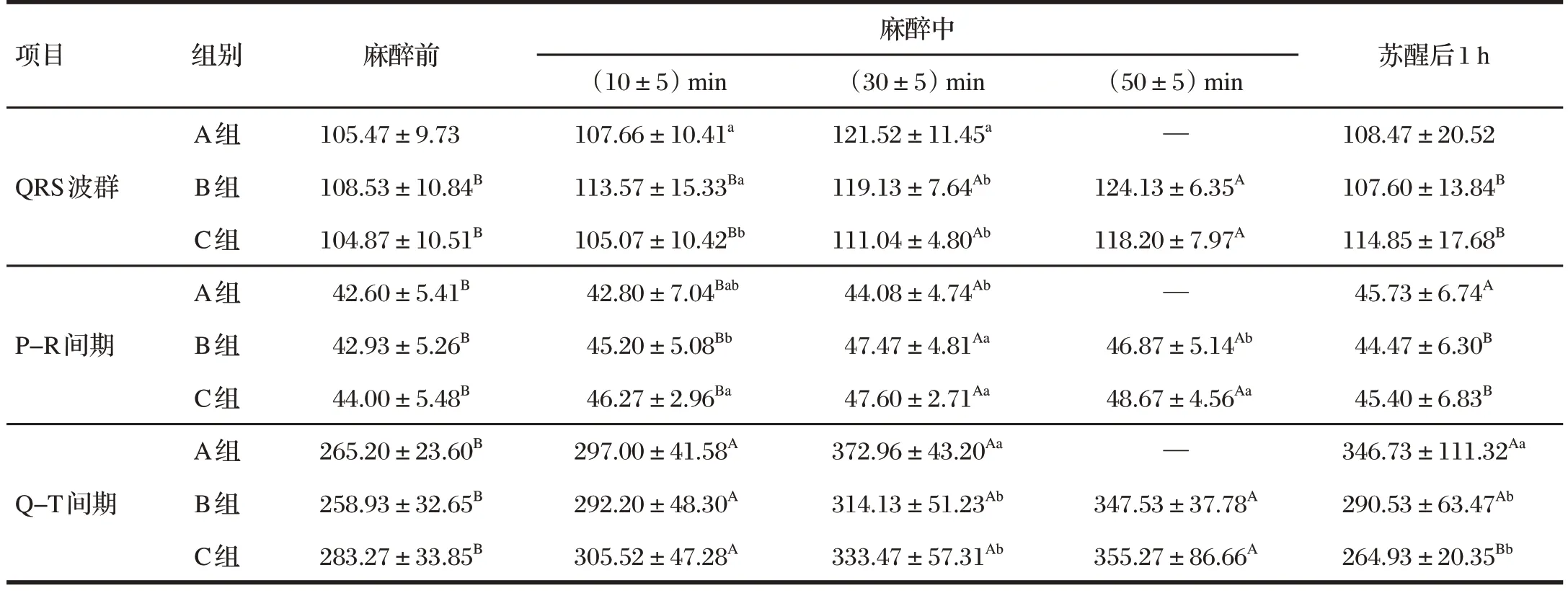
表5 舒泰联合赛拉嗪对巴马小型猪心电图各间期的影响Tab.5 Effect of zoletil combined with xylazine on the electrocardiogram intervals of the Bama miniature pigs 单位:ms
由表5 可知,巴马小型猪使用舒泰联合赛拉嗪麻醉首先会造成Q-T 间期延长,之后QRS 波群和P-R 间期也逐渐受到影响。
A 组猪整个麻醉期内的QRS 波群与麻醉前和苏醒后1 h 相比差异不显著(P>0.05),麻醉中(30±5) min 的P-R间期和麻醉中(10±5)、(30±5) min的Q-T间期显著高于麻醉前(P<0.05)。B 组与C 组麻醉过程中(30±5)、(50±5) min的QRS波群、P-R间期和整个麻醉期内的Q-T间期均显著高于麻醉前(P<0.05),其中Q-T 间期在苏醒1 h 后仍未恢复至正常范围(P>0.05)。
此外,B 组和C 组猪麻醉过程中(30±5) min 的QRS波群和Q-T间期时长均低于A组(P<0.05),而P-R间期时长高于A 组(P<0.05);苏醒后1 h 各组猪QRS 波群和P-R间期未见明显差异(P>0.05)。
2.3 舒泰联合赛拉嗪对巴马小型猪血常规指标的影响(见表6)
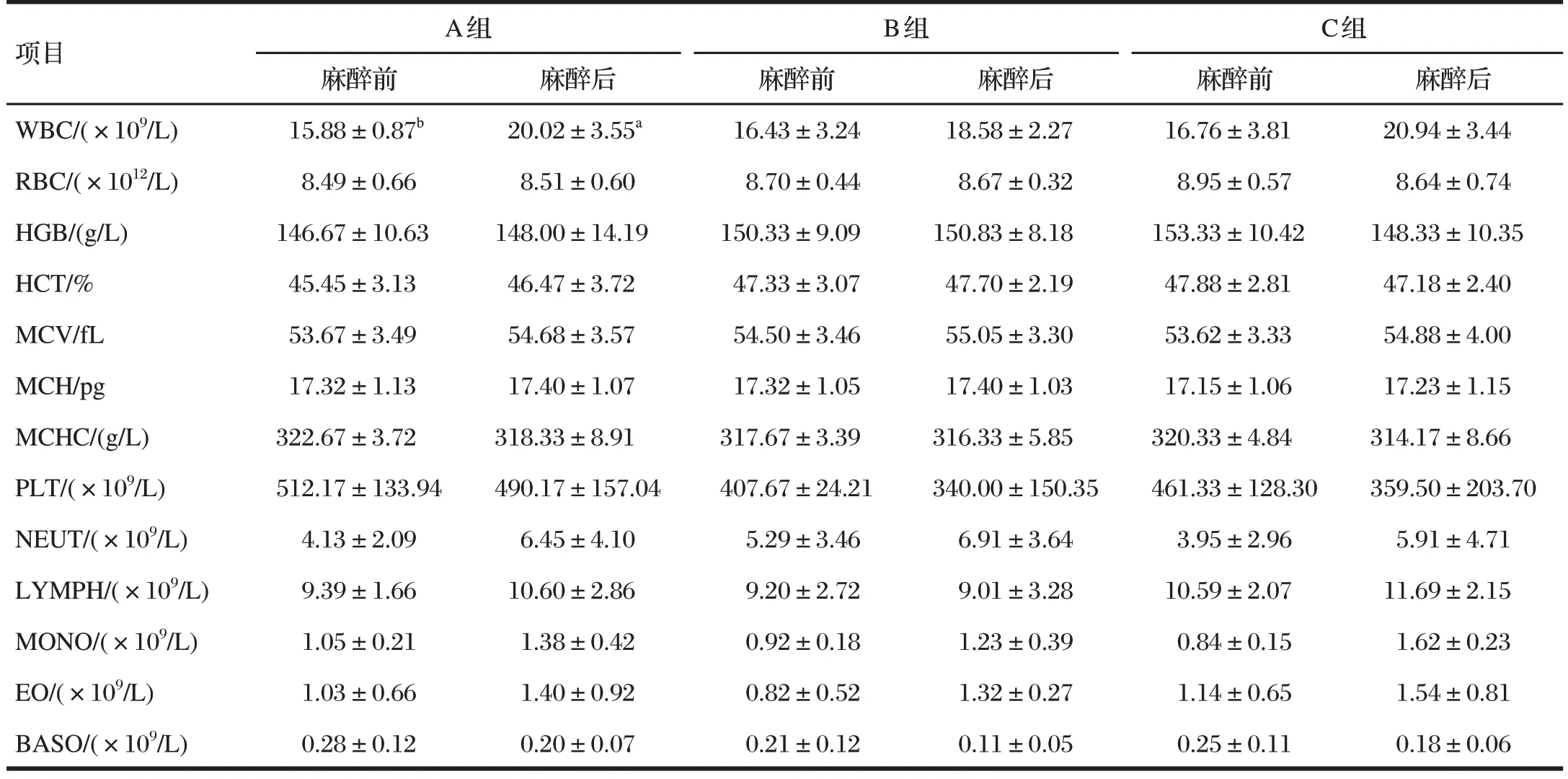
表6 舒泰联合赛拉嗪对巴马小型猪血常规指标的影响Tab.6 Effect of zoletil combined with xylazine on the blood routine indicators of the Bama miniature pigs
由表6 可知,麻醉后A 组猪WBC 显著高于麻醉前(P<0.05);各组猪其他血常规指标麻醉前后差异均不显著(P>0.05)。结果表明,巴马小型猪使用舒泰联合赛拉嗪麻醉后约24 h,血常规指标不会发生明显改变。
2.4 舒泰联合赛拉嗪对巴马小型猪血清生化指标的影响(见表7)
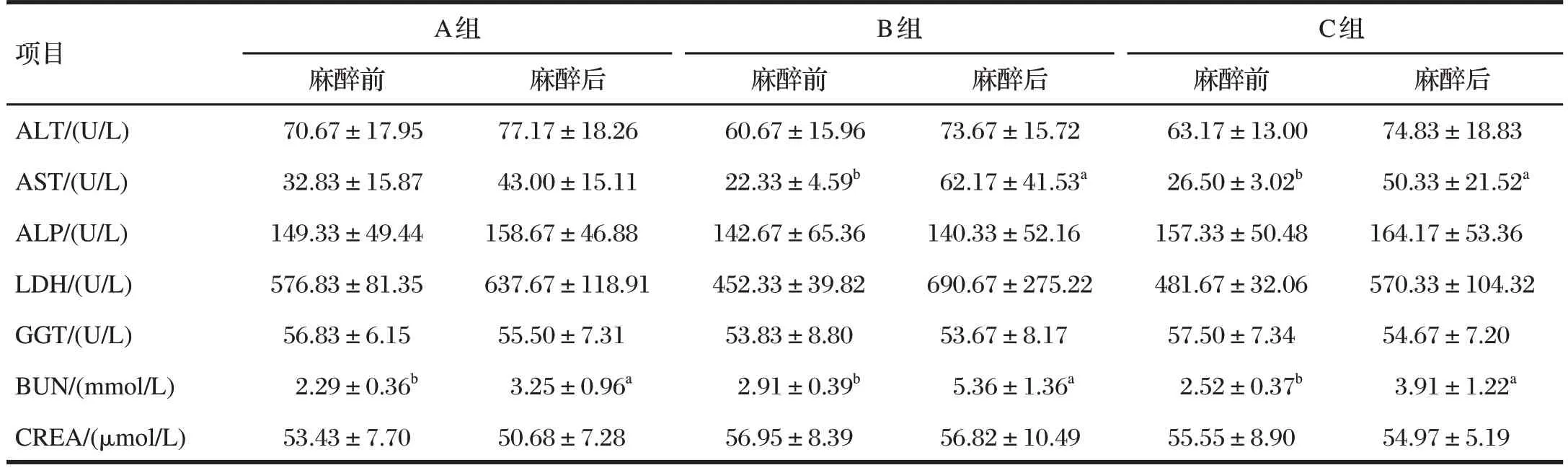
表7 不同剂量舒泰和赛拉嗪对巴马小型猪对血清生化指标的影响Tab.7 Effect of zoletil combined with xylazine on the serum biochemistry indicators of the Bama miniature pigs
由表7可知,麻醉后A组猪血清BUN含量以及B组与C 组猪血清AST 活性和BUN 含量均显著高于麻醉前(P<0.05),表明巴马小型猪使用舒泰联合赛拉嗪麻醉后约24 h能够影响肝肾功能相关指标。
3 讨论
在麻醉效果方面,本试验使用0.75~1.00 mg/kg舒泰联合6~12 mg/kg赛拉嗪进行麻醉,巴马小型猪均能够快速且稳定地进入良好的麻醉状态,维持麻醉期间镇痛、肌松效果良好,维持时间甚至可达到90 min以上,优于申晨等[4]使用氯胺酮复合赛拉嗪麻醉巴马小型猪的麻醉时长;麻醉维持时间与舒泰或赛拉嗪的使用剂量表现出明显的剂量-效应关系,这与薛来恩等[5]、Hernande-Godine 等[6]的研究结果一致,即麻醉维持时间随着麻醉药物使用剂量的增大而延长,同时二者诱导时间无较大差异,而麻醉恢复时间差异较大则主要与评判标准不一致有关。
在体温、呼吸频率影响方面,麻醉后各组巴马小型猪的肛温、呼吸频率整体上均呈降低趋势,之后在维持麻醉期内保持稳定,但麻醉期内的体温与麻醉前相比最大降幅度可达2.4 ℃,这与麻醉药物具有抑制体温调节中枢、扩张外周血管作用,造成机体体温自主调节能力丧失和产热散热失衡有关[5,7-10]。低体温可导致动物苏醒时间延长、凝血功能障碍、心血管不良事件和心肌缺血风险等,因此,在长时间麻醉中对动物在术前、术中和术后的体温进行连续监测并提供有效的加温措施非常必要。体温保护措施可分为被动保温和主动保温,被动保温仅能减少30%的热量散失,术后仍需根据动物状态确定是否实施主动保温措施以预防体温继续降低[11]。
在心脏功能抑制方面,本试验中,各组巴马小型猪在麻醉期内均出现QRS波群、P-R间期和Q-T间期延长以及SBP、DBP、MBP 降低的情况,证实了赛拉嗪作为强效α 肾上腺素受体激动剂可以通过抑制交感神经并兴奋迷走神经,抑制心脏传导,降低心率和心搏出量从而导致低血压的情况[3]。使用舒泰或氯胺酮联合赛拉嗪麻醉小型猪后发现,小型猪血压未见明显变化,这可能主要与使用剂量有关。此外,血压测量方法、测量部位也会造成一定差异[5,12-14]。值得注意的是,使血压维持在基础值±20%的范围内可有效避免心肌缺氧梗死,因此,当麻醉动物处于低血压状态时,应适时给予麻醉拮抗剂、α肾上腺素受体激动剂或肾上腺素、阿托品和多巴胺等升压药物进行解救[15-16]。
在肝脏、肾脏功能方面,本试验中各组巴马小型猪的血常规指标在麻醉后24 h 未见明显改变,而A 组猪血清BUN 含量以及B组、C组猪血清AST 活性、BUN 含量显著升高。申晨等[4]、李雯雯等[13]、秦超等[17]和贺绍君等[18]研究结果显示,单独或联合使用不超过2.2 mg/kg 赛拉嗪麻醉小型猪等动物后,血液生化指标未见明显改变,这主要与麻醉后的血液样本采集时间有关,种属差异也会产生一定影响,说明巴马小型猪使用赛拉嗪的麻醉剂量超过6 mg/kg时会影响肝肾代谢功能。但由于本试验未对上述血常规、血清生化指标的变化情况进行连续监测,因此,舒泰联合赛拉嗪麻醉对巴马小型猪肝肾功能影响的持续时间以及是否可逆仍有待进一步确认。
4 结论
本研究结果表明,巴马小型猪使用0.75~1.00 mg/kg舒泰联合赛拉嗪麻醉时,机体耐受性良好,并且可通过调整麻醉剂用量实现对麻醉时长和生理指标影响程度的控制,是一种安全、稳定的麻醉方法。
