何首乌对高血脂小鼠的降脂作用及转录组学研究
2024-01-08罗玲唐文婷易睿张楠周小娟唐亮
罗玲,唐文婷,易睿,张楠,周小娟,唐亮
(长沙医学院基础医学院,湖南 长沙 410219)
高血脂症(Hyperlipemia)是由于脂肪代谢运转异常造成血浆中的总胆固醇(Total cholesterol,TC)、甘油三酯(Triglycerides,TG)与低密度脂蛋白(Low density lipoprotein,LDL-C)高于正常值,或高密度脂蛋白(High density lipoprotein,HDL-C)低于正常值的一种疾病[1]。高血脂症发病因素较多,包括遗传因素、年龄、性别因素、饮食因素、情绪因素和生活习惯等[2]。目前,国内外对高血脂症的治疗以化学药物如他汀类、树脂类和降甘油三酯类为主[3]。与西药相比,中药对高血脂症的治疗效果已显示出诸多优点,但其作用机制比较复杂。
何首乌[Fallopia multiflora (Thunb.) Harald.]是廖科何首乌属多年生缠绕藤本植物[4]。研究发现,何首乌具有抗衰老、降血脂和保护神经细胞等功能[5]。已有研究报道了何首乌降血脂效果,其降血脂成分主要集中在水提多糖、碱提多糖、醋酸乙酯提取物和二苯乙烯苷类[6,7]。然而,有关何首乌降血脂的分子机制研究比较少见,仅有俞捷等[8]和韩晓等[9]报道了何首乌二苯乙烯苷可通过调控甘油三酯、胆固醇的合成、分解及转运的多个关键酶或关键蛋白及低密度脂蛋白受体的表达,达到降脂目的。因此,采用动物模型探究何首乌提取液的降脂机制具有重要意义。本研究参考邹佳益等[10]的方法,采用高脂饲料建立高脂动物模型,并利用何首乌提取液干预小鼠高血脂症模型,研究何首乌的降血脂效果。利用RNA-seq 测序检测肝脏组织差异表达基因,深入阐明何首乌降血脂的分子机制,为何首乌的降血脂研究提供试验依据和理论支撑。
1 材料与方法
1.1 试验药物
何首乌经仪器打磨成粉,过3 次四号筛(65 目),称取100g,然后加入6 倍体积的75%乙醇煎煮回流2次,每次1 h,通过离心10 min 后获取上清液。将2 次的上清液于旋转蒸发仪真空浓缩至无乙醇味,使最终的药物浓度相当于生药计1 g/mL,4 ℃冰箱保存待用。高浓度取1 g/mL、中浓度取1 g/mL 稀释为60%溶液(0.6g/mL),低浓度取1g/mL稀释为30%溶液(0.3g/mL)[8]。
1.2 试验动物
60 只昆明种雄性小鼠,购于长沙天勤生物技术有限公司,体重18~22 g,鼠龄3 个月,饲养于普通环境中,饲养温度23~26 ℃,相对湿度50%~60%。自由摄食和饮水,适应性喂养1 周。随机数字表法分为5 组(n=12):正常对照组,高脂模型组,何首乌提取液高、中、低浓度组。除正常对照组外,其他4 组采用高脂饲料喂养,诱导建立高血脂模型。8 周后何首乌提取液高、中和低浓度组分别采用1.0 g/mL、0.6 g/mL和0.3 g/mL进行腹腔注射(0.1 mL/10 g)[9]。正常对照组和高血脂模型组腹腔注射等体积生理盐水,每天给药1 次,持续60d。干预结束,小鼠腹腔注射4%水合氯醛(1 mL/100 g)。待小鼠麻醉后,摘除眼球取血,在4 ℃下3 500 r/min离心10 min,取上清于 20 ℃待用。断头处死小鼠,取出肝组织,于 80 ℃冰箱保存。
1.3 试剂
TC、TG、HDL-C 和LDL-C 试剂盒购自中国南京建成生物工程研究所。RNAiso Plus、PrimeScriptTMRT试剂盒(Code No.:RR037A)及TB GreenTMPremix Ex TaqTMⅡ试剂盒(Code No.:RR82WR)均购自日本TAKARA 公司。
1.4 仪器
RE-52AA旋转蒸发仪(长沙市卓成医疗器械有限公司);752N紫外可见分光光度计(上海仪电分析仪器有限公司)。
1.5 试验方法
1.5.1 血脂指标测定 取每组离心所得血清样本,根据试剂盒说明,配置检测TC、TG、HDL-C 和LDL-C含量所需的试剂溶液,通过化学比色分析并计算TC、TG、HDL-C 和LDL-C 含量[11]。
1.5.2 肝脏RNA 提取及RNA-seq 测序 根据干预结果,选取高浓度何首乌提取液组和模型对照组小鼠肝边缘区组织(n=3)。AMBION 试剂盒提取总RNA。NanoDrop 和Agilent 法检测总RNA 质量。通过高通量测序平台Illumina 进行测序得到转录组测序数据(由上海欧易生物科技有限公司完成)。
1.5.3 差异表达基因分析 利用DESeq 软件筛选差异蛋白编码基因。对差异表达基因进行GO 功能分析和KEGG pathway 分析。采用STRING 软件进行蛋白互作网络分析(PPI)。
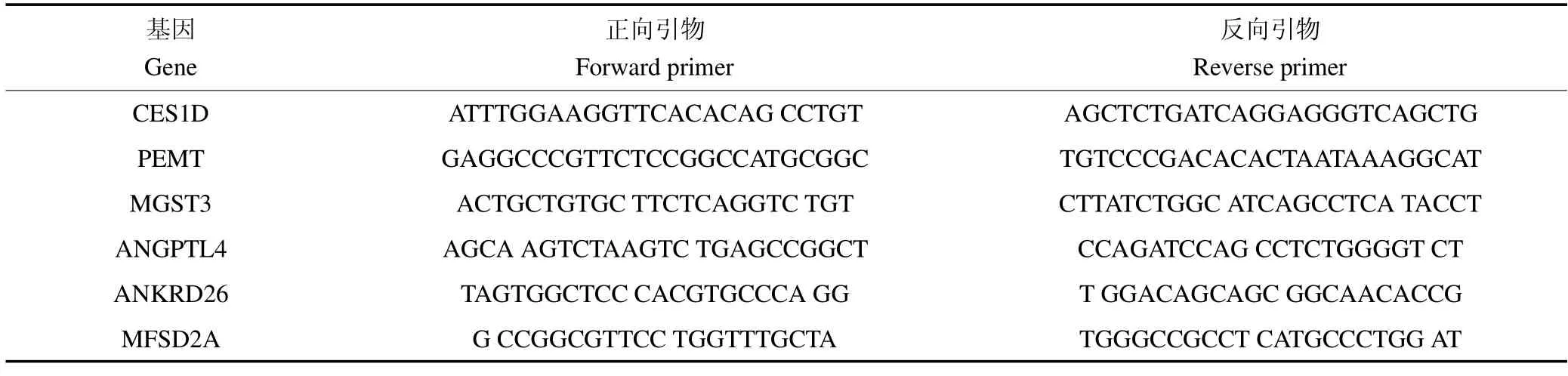
表1 PCR 引物Table 1 PCR primers
1.6 统计学分析方法
采用SPSS25.0 进行统计分析处理。对于连续型变量进行正态性分布检验。对于符合正态性分布的计量数据采用均数±标准差()表示。多组间比较采用单因素方差分析(One-way ANOVA)。方差齐性,组间比较采用Least-significant difference(LSD)检测,若方差不齐,组间比较采用Welch 近似F 检验,P <0.05表示差异有统计学意义。
2 结果
2.1 何首乌提取物对高血脂模型小鼠血脂的影响
与正常对照组相比,高血脂模型对照组小鼠血清中的TC、TG 和LDL-C 水平显著升高(P <0.05),而HDL-C 水平显著降低(P <0.05)。结果提示,高血脂小鼠建模成功。
与高血脂模型组相比,高浓度何首乌组中的TC、TG 和LDL-C 水平显著降低(P <0.05),HDL-C 水平显著升高(P <0.05)。中、低浓度何首乌提取液降脂效果不明显(P >0.05)。这些结果表明,高浓度何首乌提取液能有效降低高血脂模型小鼠血清TC、TG 和LDL-C 水平,提高HDL-C 水平,见表2。
表2 各组小鼠血清TC、TG、HDL-C 和LDL-C 水平(,n=12)Table 2 Levels of TC,TG,HDL-C and LDL-C in mice blood(,n=12) 单位:mmol/L
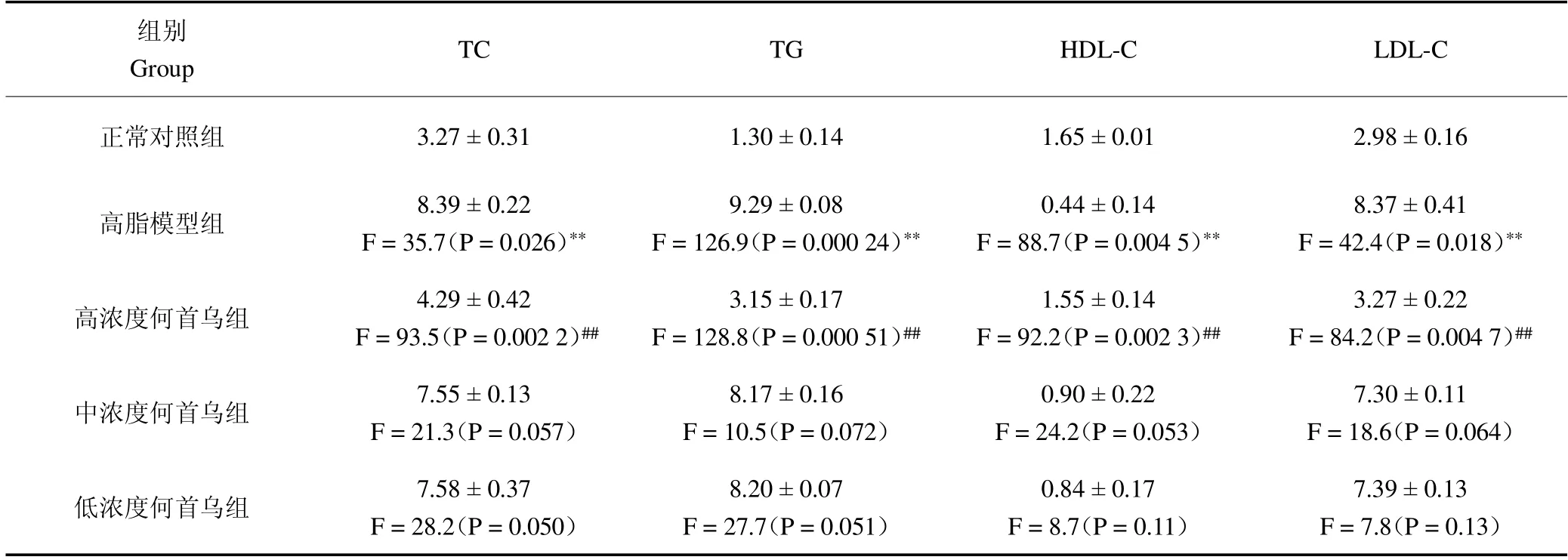
表2 各组小鼠血清TC、TG、HDL-C 和LDL-C 水平(,n=12)Table 2 Levels of TC,TG,HDL-C and LDL-C in mice blood(,n=12) 单位:mmol/L
注:**高脂模型组小鼠血清TC、TG、HDL-C 和LDL-C 水平相比于正常对照组有显著差异(P <0.05)。##何首乌高剂量组小鼠血清TC、TG、HDL-C 和LDL-C 水平相比于高脂模型组有显著差异(P <0.05)。缩写:TC.总胆固醇;TG.甘油三酯;LDL-C.低密度脂蛋白;HDL-C.高密度脂蛋白。Note:**Compared with normal control group,serum TC,TG,HDL-C and LDL-C levels in hyperlipidemic model group were significantly different(P <0.05).##Compared with the high fat model group,the serum TC,TG,HDL-C and LDL-C levels in the high concentration F.multiflora were significantly different(P <0.05).Abbreviations:TC.Total cholesterol;TG.Triglyceride;LDL-C.Low-density lipoprotein;HDL-C.high-density lipoprotein.
2.2 基因差异表达及聚类分析
转录组分析共获得40.73 G 数据。各样本的有效数据量分布在6.67~6.94 G。Q30 碱基分布在94.24%~94.35%,平均GC 含量为50.55%。根据蛋白编码基因在不同样本中的表达量进行差异筛选,共检测到的787个差异基因,其中上调基因260 个,下调基因527 个,见图1 A。其聚类分析结果见图1 B,差异基因的详细情况见火山图,见图1 C。随机选择CES1D、PEMT、MGST3、ANGPTL4、ANKRD26 和MFSD2A 等6 个差异基因进行qRT-PCR 验证,结果显示,差异基因表达的相对趋势与RNA-seq 结果趋势一致,见图1 D。

图1 何首乌干预高血脂小鼠模型肝脏差异表达基因谱Fig.1 Differentially expressed gene profiles in the liver of hyperlipidemia mice induced by
2.3 差异表达基因功能分析
用GO 分析对差异表达基因进行功能分类。差异表达基因富含了532 种细胞组分类别,如丝氨酸-丙酮酸转氨酶复合体、UBC13-MMS2 复合体、ISWI 复合体、RSF 复合体和CHOP-ATF4 复合体。注释基因参与了933 个分子功能,如葡萄糖-1,6-二磷酸合酶活性、质子反向转运体活性和胍基乙酸甲基转移酶活性等;参与了2 869 个生物过程,如短链脂肪酸分解代谢过程、细胞对甘油三酯的反应过程和脂蛋白正向调节代谢过程等,见图2 A。KEGG 富集通路分析表明,何首乌降脂过程参与多条生物通路,如脂质代谢、信号转导和异生化物的生物降解与代谢等通路,见图2 B。
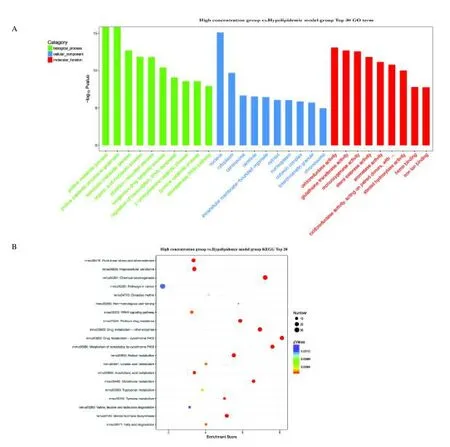
图2 何首乌干预高血脂小鼠模型肝脏差异表达基因GO 和KEGG 分析Fig.2 Analysis of the differentially expressed genes GO and KEGG in the liver of hyperlipidemia mouse model interfered by
2.4 转录因子及其靶基因预测分析
通过比较全部基因和差异基因(上调和下调)的转录因子的分布情况,共找到67 个具有明显差异的转录因子,见图3。转录因子调控的总基因数量从0 到563。转录因子调控的差异基因数量从0 到40。呈上调趋势的差异转录因子有5 个,呈下调趋势的差异转录因子有16 个。
2.5 差异表达基因相关蛋白互作网络分析
为探究差异表达基因编码的相关蛋白质之间的互作关系,本文采用PPI 法进行蛋白互作网络分析。按照互作结合分数从高到低排序,筛选Top300 差异基因的互作关系结果。如图4 A、4 B 所示,Top 300 的蛋白互作网络分析中共有126 个差异表达基因(70 个表达下调,56 个表达上调),其中34 个差异基因为转录因子且表达上调,58 个差异基因为转录因子且表达下调,22 个差异基因为靶基因且表达上调,12 个差异基因为靶基因且表达下调。
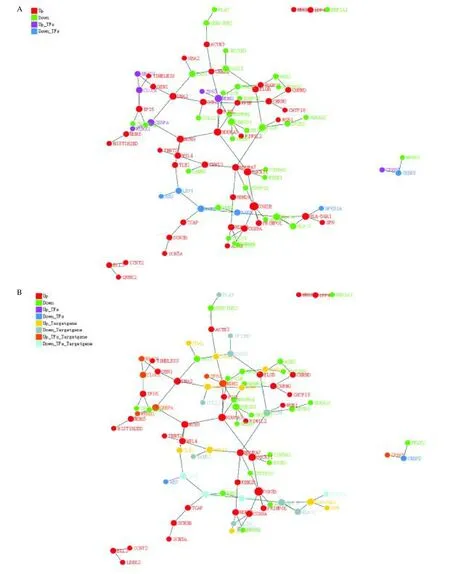
图4 Top300 差异基因的互作关系图Fig.4 Interaction between top 300 differentially expressed genes in the liver of hyperlipidemic mice interfered by
3 讨论
本研究采用何首乌干预高血脂小鼠模型,并发现高浓度何首乌提取液能有效降低TC、TG 和LDL-C水平,提高HDL-C 水平,起降血脂作用。采用转录组测序,结合生物信息学分析方法,发现787 个有显著差异表达的基因,其可能与血脂调控相关。
降血脂机制是一个复杂的过程,它包括机体的各个方面机体功能下降的过程以及机体对环境的适应,如机体的免疫能力下降、神经退行性病变和抗氧化能力减弱等[12]。研究表明,何首乌降脂主要通过直接抑制机体对外源性脂质的吸收及减少肝肠循环中重吸收入血的脂质含量[10]。何首乌能与胆固醇结合,减少胆固醇经肠道的吸收。其所含蒽醌类化合物还能促进肠蠕动,抑制胆固醇在肠道的再吸收,并能促进胆固醇代谢[13]。此外,何首乌的卵磷脂成分进入血液可吸附血管壁上的胆固醇,从而降低血脂[14]。何首乌主要活性物质2,3,5,4'-四羟基二苯乙烯-2-O--D-葡萄糖苷能够抑制胆固醇合成酶并且升高低密度脂蛋白受体的表达[15]。本试验结果证明,高浓度何首乌提取液可以降低高血脂模型小鼠血清中的TC 和TG 水平,提高血清HDL-C 水平,其可能通过抑制外源性TG 和TC的消化吸收发挥作用。然而,具体机制还有待证实。
转录组分析共检测到787 个差异基因,其中上调基因260 个,下调基因527 个。通过KEGG 富集分析表明,差异表达基因多富集于短链脂肪酸分解代谢过程、细胞对甘油三酯的反应过程和脂蛋白正向调节代谢过程等。PEMT基因主要在肝脏组织中表达,激活后可调控与葡萄糖的产生、转运、利用及脂肪代谢的调节相关的基因的表达。研究发现,阻断小鼠体内PEMT途径,小鼠血液中的胆固醇水平明显降低,此外,也能使血液中同型半胱氨酸水平降低一半[16]。本研究发现,经何首乌干预后,小鼠PEMT 基因显著上调,其可能通过调控脂质代谢相关基因表达,影响血脂水平。ANGPTL4 基因主要在脂肪组织和胚胎中表达,参与脂质代谢、糖代谢及血管新生等过程。ANGPTL4 基因的表达受禁食、肥胖、高脂肪饮食和过氧化物体增殖体激活受体(PPARs)调控[17]。此外,ANGPTL4 也可能通过上调脂肪甘油三酯酶而激活脂解[18]。本研究发现,何首乌干预后,ANGPTL4 基因表达显著降低,表明ANGPTL4 基因可能与脂质代谢有关。然而,其参与血脂调控代谢的详细机制尚不清楚,后期重点探究上述基因参与血脂代谢的分子机制。
目前已发现较多与脂质代谢相关的转录因子,包括过氧化物酶体增殖物激活受体(PPARs)、肝X 受体(LXR)、视黄醛受体(RXR)、固醇调节元件结合蛋白(SREBPs)、法尼酯衍生物X 受体(FXR)、糖应答元件结合蛋白(ChREBP)、孕烷X 受体(PXR)及肝细胞核因子4(HNF4)等[19]。PPARs 是配体调节的转录因子,与另外一种RXR 形成异二聚体,结合到靶基因启动子区的特异反应元件(PPRE)上,从而发挥重要的调节基因表达的作用[20]。ChREBP 的靶基因主要是参与糖酵解和脂质合成的一些酶类,ChREBP 的激活可促进葡萄糖向脂质转化[21]。因此,这些类型的转录因子可能参与肝脏脂质代谢过程。
4 结论
本研究证实,高浓度(0.6 g/mL)何首乌能有效降低高血脂小鼠模型血清血脂,其作用机制可能涉及CES1D、PEMT、MGST3、ANGPTL4、ANKRD26、MFSD2A 等基因以及PPARs、RXR、ChREBP 等转录因子的差异表达。本研究可为后续何首乌干预高血脂的机制研究提供新的思路。
