基于网络药理学和实验验证探讨赤芍治疗胆汁淤积性肝炎的分子机制
2024-01-08王文祥唐晓翠李宁杨策陈芸彤陈春宇
王文祥,唐晓翠,2,李宁,杨策,陈芸彤,陈春宇※
(1.重庆三峡医药高等专科学校药学院,重庆 404120;2.重庆文理学院,重庆 402160)
胆汁淤积型肝炎(Cholestatic Hepatitis,CH)又称胆汁淤积性肝病,是由药源性损伤、免疫性疾病和酒精中毒等病因导致的毛细胆管或肝细胞功能异常、胆汁生成、分泌和排泄障碍而导致的肝脏疾病,甚至引发肝硬化、肝衰竭等疾病,临床将1.5 倍血清碱性磷酸酶(Alkaline phosphatase,ALP)数值作为临界判断的指标[1,2]。CH 病因复杂,欧洲肝病学会出版的《胆汁淤积性肝病临床指南》指出CH 病因涉及肝硬化、原发性硬化性胆管炎、妊娠性胆汁淤积、原发性胆汁性胆管炎等[3]。CH 发病隐匿且无有效诊断手段,发病率很难精确统计,可能占总人口的10%~20%[4]。药物治疗及肝移植是治疗CH 的主要方法。熊去氧胆酸(Ursodeoxycholic acid,UDCA)作为首选药物被FDA 批准治疗CH,但疗效欠佳[5]。奥贝胆酸(Obeticholic acid,OCA)是法呢醇X 受体(Farnesyl X receptor,FXR)激动剂,能调节胆汁流速和胆酸盐重吸收,改善CH 症状,作为备选药物用于对UDCA 无应答的患者,但OCA 会增加瘙痒、腹痛等副作用[6]。因此,寻找新的靶点和临床有效且副作用小的药物治疗CH 十分重要。
赤芍[Paeoniae Rubra Radix(PRR)]是毛茛科植物川赤芍(Paeonia veitchii Lynch)或芍药(Paeonia lactiflora Pall.)的干燥根,其味苦,性微寒,有清热凉血等功效[7]。现代药理学研究表明,赤芍具有保肝、抗炎及抑制自身免疫反应等多种药理作用,临床常用来治疗胆汁淤积尤其是重度黄疸,有明显疗效[8]。
然而,对于PRR 治疗CH 的分子机制尚不明确。网络药理学是基于生物信息学、系统生物学及中药药理学等多学科理论和技术,揭示中药及复方治疗疾病的作用机制[9],因此,本研究使用网络药理学及分子对接探讨中药赤芍治疗胆汁淤积性肝炎的分子机制,为赤芍治疗胆汁淤积性肝炎等相关症状的临床研究提供科学依据。
1 材料与方法
1.1 PRR潜在活性成分及靶点的筛选
从TCMSP[10]数据库获得PRR 的化学成分,根据药物代谢(ADME)原理,将筛选条件设置为口服生物利用度(Oral bioavailability,OB)≥30%,类药性(Drug likeness,DL)≥0.18,筛选出PRR 的潜在活性成分。从PubChem 数据库中下载潜在活性成分结构的SDF格式和SMILES 格式文件。通过PharmMapper[11]和Swiss Target Prediction[12]数据库获得潜在活性成分的靶点。每个化学成分选择前20 个靶点,删除重复项,得到潜在活性成分靶点信息。将得到的靶点信息在Uniprot[13]数据库中进行基因名校正。
1.2 CH疾病相关靶点筛选
通过Drugbank[14]、TTD(Therapeutic Target Database)[15]和Genecards[16]数据库,以“Cholestatic”,“Cholestatic Hepatitis”,“Cholestatic liver disease”为检索词,其中在Genecards 数据库取前300 个靶点,去除3 个数据库重复项后,获得CH 疾病靶点信息。
1.3 蛋白互作(Protein protein interaction,PPI)网络构建
将筛选的PRR 潜在活性成分的靶点和胆汁淤积性肝病相关靶点,通过在线工作平台Venny2.1.0 得到PRR 治疗CH 的作用靶点,将其导入STRING[17]数据库,选择物种为“Homo sapiens”,置信度设置为“medium confidence=0.4”,在network display options 中勾选hide disconnected nodes in the network,删除游离节点(GPR35 和AMD1),构建PPI网络。通过Cytoscape3.7.2软件[18]对PPI 网络进行可视化,通过Network Analysis 模块进行网络拓扑学分析,根据degree 值选择PPI 网络中的关键靶点。
1.4 GO功能富集分析和KEGG通路富集分析
通过DAVID[19]数据库进一步研究PRR 治疗CH的生物学过程及代谢通路,Identifier 选择为“OFFICIAL_GENE_SYMBOL”,物种选择为“Homo sapiens”,进行GO 功能富集分析和KEGG 通路富集分析。根据P 值大小,将GO 功能富集分析的前10 个生物过程(Biological process,BP)、细胞组分(Cellular component,CC)、分子功能(Molecularfunction,MF)利用在线分析平台微生信(http://www.bioinformatics.com.cn/)进行可视化分析,将KEGG 通路富集分析的前20 个代谢通路利用Omicshare 在线平台(https://www.omicshare.com/tools/)进行可视化分析。
1.5 成分-靶点-通路网络构建
将PRR 潜在活性成分、潜在活性成分的靶点和前20 个信号通路导入Cytoscape 3.7.2 软件构建成分-靶点-通路网络,分析主要活性成分和核心靶点。
1.6 动物试验验证
1.6.1 试验动物 SPF 级雄性SD 大鼠32 只,体质量180~220 g[湖南斯莱克景达实验动物有限公司,生产许可证号SCXK(湘)2019-004]。动物饲养于重庆三峡医药高等专科学校实验动物观察室,室内光照12 h/黑暗12 h,湿度40%~60%,温度18~22 ℃,自由进食、饮水。
1.6.2 试验药材 赤芍药材(批号:20201203)购于哈尔滨普方药业饮片有限公司,由重庆三峡医药高等专科学校张建海教授鉴定为毛茛科植物川赤芍的干燥根。
1.6.3 动物分组、造模与给药 32 只SPF 级雄性SD大鼠(体重在180~220 g),适应性喂养1 周称重后随机分4 组,每组8 只:(1)空白对照组(Control);(2)模型对照组(ANIT);(3)阳性药组(熊去氧胆酸,60 mg/kg);(4)赤芍提取物组(2.8 g/kg),相当于2倍临床等效剂量。
第1~6 天,阳性药组和赤芍提取物组分别预防性灌胃给药,空白对照组和模型对照组给予0.5% CMCNa溶液灌胃。第7 天上午,阳性药组和赤芍提取物组分别预防性灌胃给药;空白对照组和模型组给予0.5%CMC-Na 溶液灌胃。第7 天下午,阳性药组和赤芍提取物组以及模型对照组灌胃给予ANIT 60 mg/kg 造模[20],ANIT 单次急性造模要求大鼠给药前后都禁食12 h,自由饮水,空白对照组给予等体积橄榄油溶液。第8 天,各组按原剂量继续给药。第9 天,用40 mg/kg戊巴比妥钠麻醉大鼠,以多聚甲醛心脏灌注后,取肝组织于多聚甲醛中固定备用,样本采集前12h禁食不禁水。
1.6.4 免疫组化检测相关蛋白表达 将固定的肝脏组织进行取材、修块、脱水、石蜡包埋,对肝脏组织的石蜡块进行切片,厚约4m,然后对切片进行IHC 染色。经过二甲苯脱蜡、乙醇复水、抗原修复、淬灭、血清封闭、抗体孵育及DAB 显色(镜下观察至棕色)、自来水终止染色,苏木素复染,常规脱水、透明、树胶封片、SPOT(5.0)高级显微技术软件镜下观察。Image-pro Plus 6.0 软件分析蛋白的相对表达水平,以相同的棕黄色作为判断所有照片阳性的统一标准,对每张照片进行分析得出阳性的累积光密度值(IOD)和组织的像素面积(AREA),并求出平均光密度值(Average optical,AO),AO=IOD/AREA,AO 值越大表明阳性表达水平越高。
1.6.5 统计方法 使用GraphPad Prism 8.0 软件处理数据。所有数据均用平均数±标准差表示。两组间比较采用t 检验,多组间比较采用单因素方差ANOVA 分析。P <0.05 视为有显著差异。
2 结果与分析
2.1 PRR潜在活性成分及靶点的筛选
从TCMSP 数据库中检索得到119 个PRR 化学成分,经OB 和DL 筛选后获得28 个潜在活性成分,见表1。
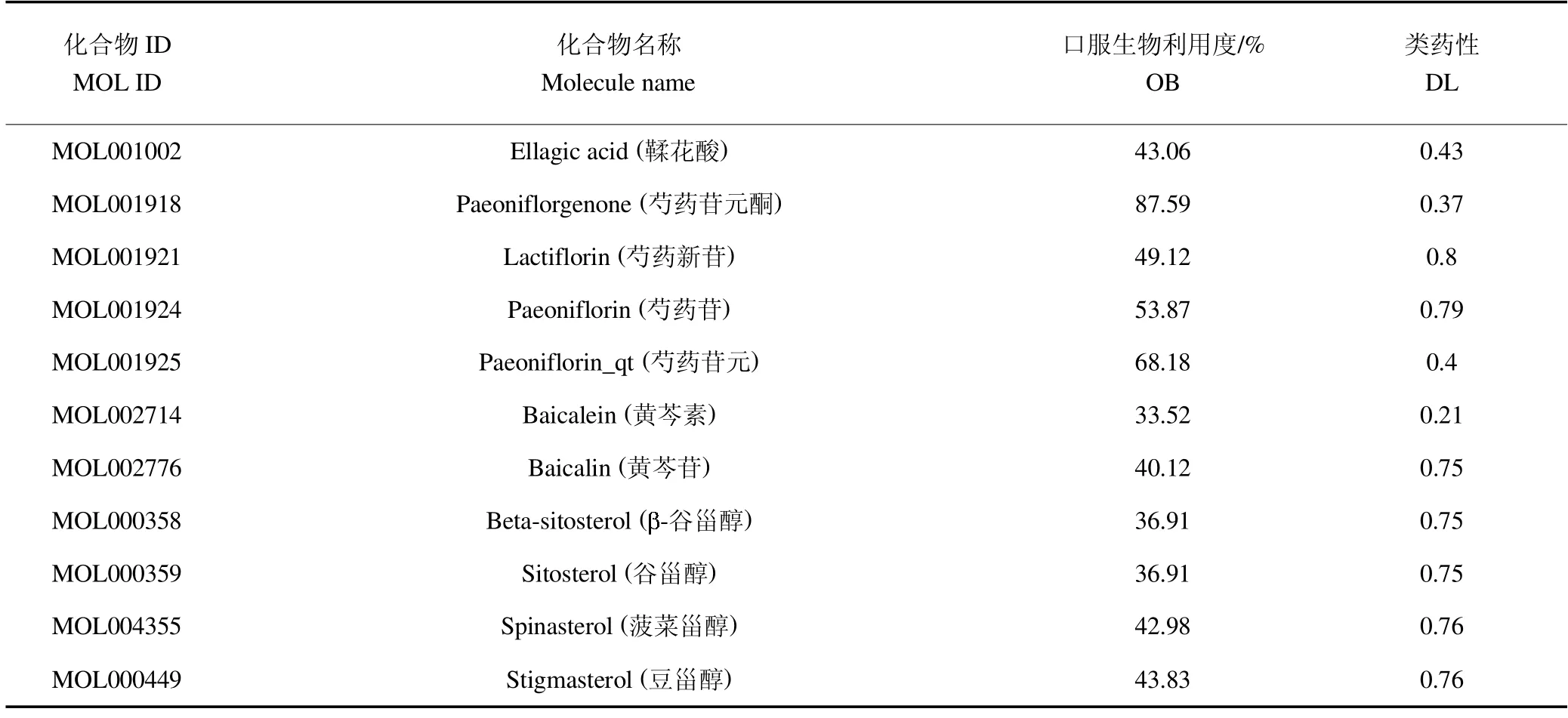
表1 赤芍潜在活性成分Table 1 Underlying active components of PRR
将PRR 活性成分的SMILES 格式文件导入Swiss Target Prediction 数据库中预测PRR 中潜在活性成分的靶点信息,将PRR活性成分的SDF格式导入Pharm Mapper 数据库中预测PRR 中潜在活性成分的靶点信息,整合两个数据库中靶点信息并删除重复项后得到602 个PRR 潜在活性成分的预测靶点。
2.2 CH疾病相关靶点筛选
在DrugBank、TTD和Genecards数据库中以“cholestatis”、“Cholestatic hepatitis”、“Cholestatic liver disease”为关键词进行检索,去除3 个数据库重复项后,获得433 个CH 疾病靶点信息。
2.3 PPI网络构建
通过Venny2.1.0 在线工具筛选出PRR 潜在活性成分的作用靶点和CH 靶基因有34 个交集靶点(图1),这34 个靶基因可能是PRR 治疗CH 的靶点,主要包括白蛋白(Albumin,ALB)、肿瘤坏死因子(Tumor necrosis factor,TNF)、血管内皮生长因子A(Vascular endothelial growth factor A,VEGFA)、表皮生长因子受体(Epidermal growth factor receptor,EGFR)、基质金属蛋白酶(Matrix metallope ptidase 9,MMP9)等,见表2。
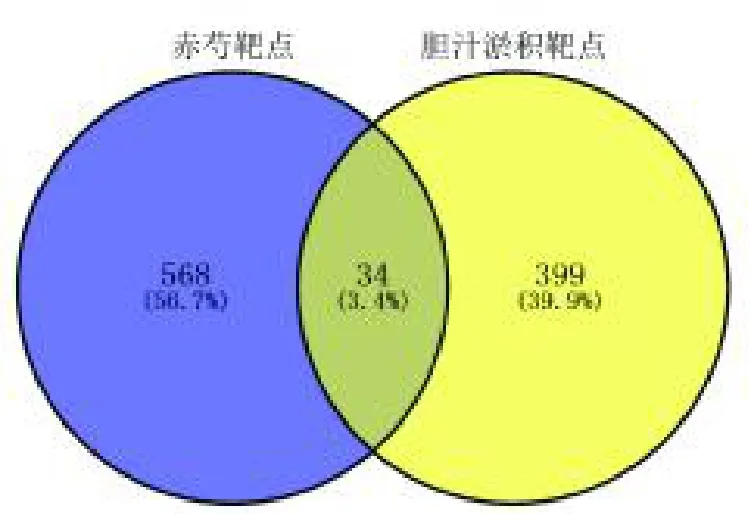
图1 赤芍-胆汁淤积共同靶点的韦恩图Fig.1 Venn diagram of PRR and CH disease targets

表2 赤芍与疾病交集靶点信息Table 2 Common targets of PRR and CH
将筛选得到的交集靶点导入STRING 数据库中,构建PPI 网络,将得到的网络数据文件导入Cytoscape 3.7.2软件对PPI网络进行可视化(图2),通过Network Analysis 模块进行网络拓扑学分析,根据PPI 网络中度值选取关键靶点6 个(表3),依次为TNF、ALB、VEGFA、EGFR、MMP9、ERBB2,以上靶点在PPI 网络中处于关键位置,是PRR 治疗CH 的关键靶点。

图2 PPI 网络Fig.2 PPI network
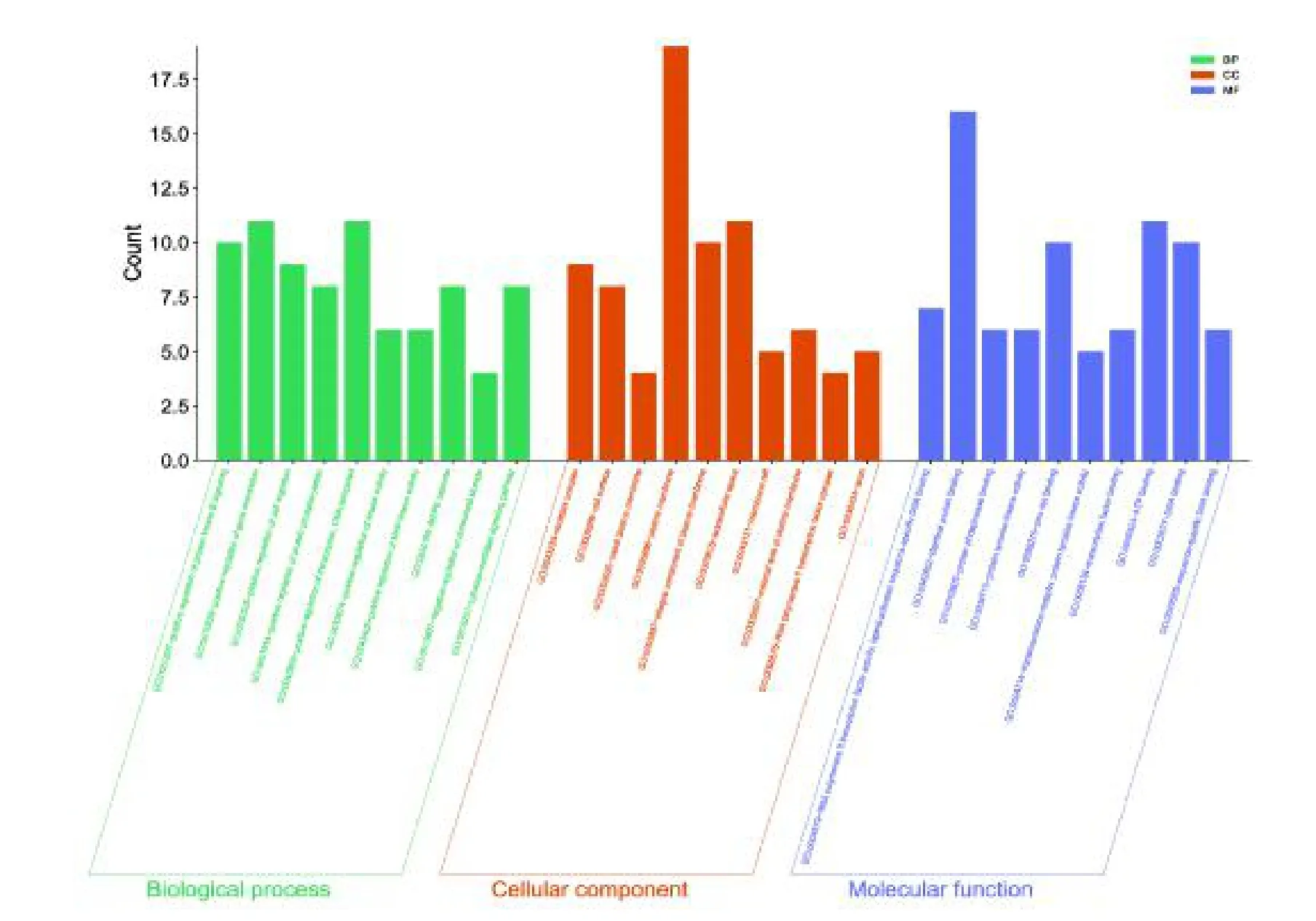
图3 GO 功能富集分析Fig.3 GO function enrichment analysis

表3 PPI 网络中的拓扑学分析Table 3 Topological analysis in PPI network
2.4 富集分析
通过DAVID 数据库对PRR 治疗CH 的潜在作用靶点进行GO 功能富集分析,共富集到306 条生物学过程,其中56 条与分子功能(MF)相关,28 条与细胞组分(CC)相关,222 条与生物过程(BP)相关,根据P Value 值选取各自前10 个条目,通过微生信在线分析平台进行可视化分析。赤芍的潜在活性成分参与众多生物学过程,生物过程主要涉及了转录的正调控DNA 模板、蛋白激酶B 信号的正调控、基因表达的正调控、细胞迁移的正调控等过程;细胞组分主要涉及到质膜、质膜的组成部分、细胞外间隙、受体复合体等;分子功能主要涉及到相同蛋白结合、锌离子结合、ATP结合、DNA 结合等。
通过DAVID 数据库对PRR 治疗CH 的潜在作用靶点进行KEGG 富集分析,共富集得到92 条代谢通路,主要涉及MAPK信号通路、癌症中的蛋白多糖、癌症的通路、松弛素信号通路、肝细胞癌等。根据P 值选取前20 条通路,通过Omicshare 在线平台进行可视化分析得气泡图,见图4。
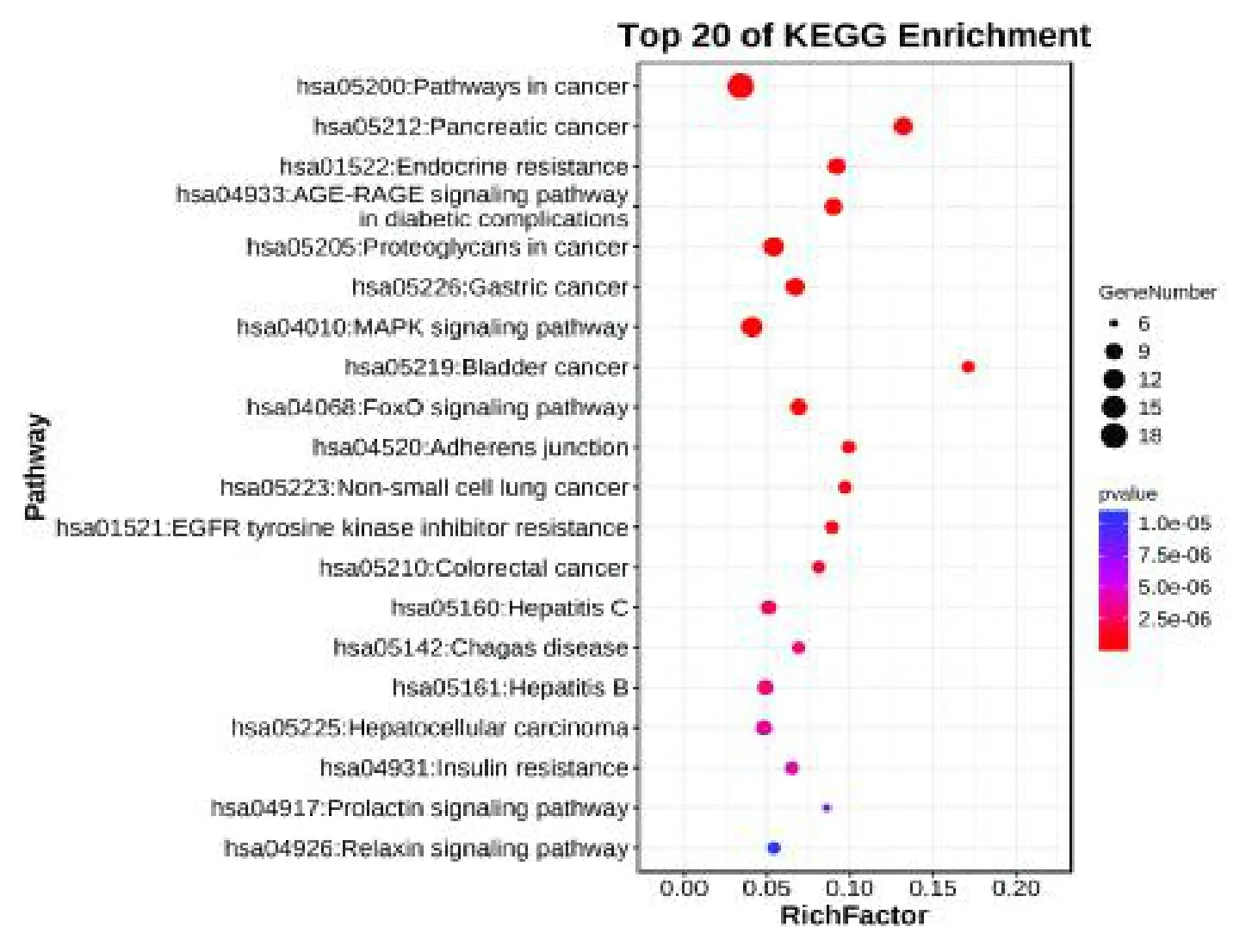
图4 KEGG 通路富集分析Fig.4 KEGG pathway enrichment analysis
2.5 成分-靶点-通路网络构建
根据P 值选取前20 条通路,通过Cytoscape 3.7.2软件构建PRR 治疗CH 的“成分靶点通路”网络(图5),根据Edge Betweenness 值来确定各节点的作用强度,通过Network Analysis 模块进行网络拓扑学分析,根据Degree 值选择网络中的核心成分。由该网络进行分析可以充分体现PRR 治疗CH 符合中药治疗疾病的多成分、多靶点、多通路的特征,说明PRR 是通过多成分、多靶点、多通路对CH 起到治疗作用的。
2.6 动物试验验证
2.6.1 赤芍对ANIT 诱导的胆汁淤积大鼠的药效学评价 TBA、TBIl、DBIL连同肝功能受损异常的ALP、ALT、AST均是反映胆汁淤积性肝炎的常规指标。赤芍提取物对胆汁淤积大鼠血清生化指标检测结果如图6,与空白组相比,模型组AST、ALT、ALP 的活性及TBA、TBIL、DBIL 的含量极显著升高(P <0.01)。与模型对照组比较,赤芍提取物组[2.8 g/(kg·d)]和阳性药组(UDCA)AST、ALT、ALP 的活性及TBA、TBIL、DBIL 的含量显著降低(P <0.05)。

图6 各组大鼠血清中肝功能指标变化(,n=8)Fig.6 Effects of PRR on serum liver function parameters in ANIT-induced cholestasis rats (,n=8)
2.6.2 赤芍对ANIT 诱导的胆汁淤积大鼠的作用机制验证 通过测定各组大鼠肝组织中阳性区域的IOD值进行比较,与空白组相比,模型组肝组织中TNF-、EGFR、VEGFA 蛋白的表达量明显增加(P <0.001);与模型对照组相比,赤芍提取物组与阳性药组肝组织中TNF-、EGFR、VEGFA 蛋白的表达量均显著降低(P <0.05),如图7。
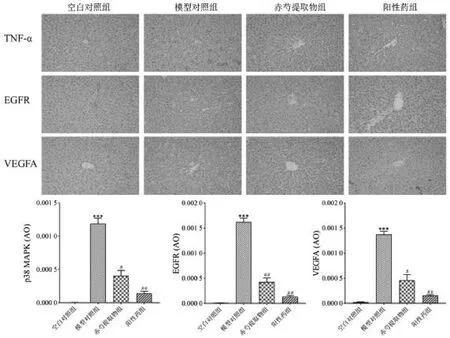
图7 各组大鼠肝脏组织内TNF-、EGFR、VEGFA 蛋白表达的免疫组化分析(,n=8,200)Fig.7 Effects of PRR on immunohistochemical analysis of TNF-,EGFR and VEGFA protein expression in ANIT-induced cholestasis rats(,n=8,200)
3 讨论与结论
胆汁淤积性肝炎是一种临床常见的因胆汁形成、分泌或排泄障碍而引起的症状,主要表现为黄疸、皮肤瘙痒等,肝功明显异常,如ALP、AST、ALT、TBA、TBIL等升高[21]。其发病机制可能与胆汁转运体异常、胆汁调节机制紊乱等有关,继续恶化会演变为肝硬化,甚至死亡。目前,胆汁淤积相关动物模型成熟且多样,ANIT是最常用的模型药物,ANIT诱导的胆汁淤积模型以损伤胆管为主,且生化与病理改变与人胆汁淤积相近[22]。ANIT 造模后,在0~45 min 内大鼠血清中各项肝功生化指标升高,肝细胞变性坏死,大量炎症细胞浸润[23]。寻找新的靶点和临床有效且副作用小的药物治疗HC十分重要。赤芍为毛茛科植物芍药或川赤芍的干燥根,其味苦,性微寒,有清热凉血等功效。现代药理学研究表明,赤芍具有保肝、抗炎等药理作用,临床上用于治疗胆汁淤积性肝炎特别是重度黄疸有明显疗效[24]。
本研究通过网络药理学结合体内试验,明确了赤芍对胆汁淤积性肝炎大鼠的保护作用及可能的作用机制。通过数据库的筛选,得到赤芍的活性成分有28 个,其中芍药苷、芍药新苷等可能是其活性成分,研究证明芍药苷具有抗炎和肝保护作用,可能是通过调节NF-B信号通路,缓解炎症,从而对肝脏起到保护作用[25]。在PPI 网络拓扑结构中显示,TNF、VEGFA、EGFR 等靶点可能是赤芍治疗胆汁淤积性肝炎的核心靶点。肿瘤坏死因子(TNF)是引起细胞凋亡(坏死)的细胞因子,TNF 家族有TNF-,主要是由活化巨噬细胞产生,含有多种调节功能,TNF-在组织发生炎症的发病机制具有重要作用。EGFR 是原癌基因C-erbB-1 的表达产物,研究显示EGFR 能促使肌成纤维细胞产生胶原蛋白进而促进CH 的炎症进程。通过赤芍对ANIT 诱导胆汁淤积性肝炎的药效学评价,应用全自动生化分析仪检测血清肝功指标的含量改变,结果表明,赤芍提取物可以显著降低血清中TBIL、DBIL、TBA 含量及ALP、ALT、AST 酶活性,进而表明赤芍对ANIT 大鼠有明显的保护作用。赤芍治疗胆汁淤积性肝病的通路富集分析结果可以看出,赤芍中主要发挥作用的活性成分是芍药苷、芍药新苷、(2R,3R)-4-甲氧基二苯乙烯等,且主要作用在MAPK8、TNF、VEGFA、EGFR 等多个靶点,调节MAPK、胰岛素抵抗等多条通路,通过多成分 多靶点 多通路来发挥治疗胆汁淤积性肝病的作用。本研究通过免疫组化法检测MAPK 信号通路及PPI 网络中核心靶点TNF、VEGFA、EGFR 在ANIT大鼠肝脏中的表达情况,结果表明赤芍提取物可能是通过下调肝组织TNF、VEGFA 和EGFR 等蛋白的表达,对ANIT 诱导胆汁淤积性肝炎大鼠有明显的保护作用。
综上所述,本研究利用网络药理学及体内试验,系统研究了赤芍治疗胆汁淤积性肝病的作用机制,结果表明,赤芍中的单萜及其苷类对改善胆汁淤积性肝病具有一定的作用。研究结果表明了赤芍治疗胆汁淤积性肝炎具有多成分、多靶点、多通路的特点,可能通过芍药新苷、芍药苷干预TNF、EGFR、VEGFA 等靶点进而调节MAPK 等信号通路发挥治疗胆汁淤积性肝炎的作用,为赤芍治疗胆汁淤积性肝病提供了研究基础和科学依据。
