卡瑞利珠单克隆抗体联合阿帕替尼治疗中晚期肝细胞癌患者疗效及预后分析*
2024-01-07叶萌萌邓泽润
叶萌萌,邓泽润,张 韬
原发性肝癌(primary liver cancer,PLC)是进展快、预后差的癌症,严重危害人类健康,其中肝细胞癌(hepatocellular carcinoma,HCC)约占75%~85%[1],主要危险因素包括病毒性肝炎、饮酒、肥胖和糖尿病等[2]。虽然手术切除和肝移植均可用于治疗HCC患者,但肝叶切除术后肿瘤复发率高,获得根治性治疗的比例低[3]。索拉非尼是治疗晚期HCC的一线靶向药物,可使中位总体生存期(overall survival,OS)达到6.5~10.7个月[4-5]。然而,索拉非尼治疗应答率仍较低,耐药性和疾病进展的风险很高,限制了其长期应用的临床益处[6]。尽管已经开发了其他分子靶向药物,但靶向药物治疗晚期HCC患者的疗效仍然是一个需要不断提高的难题。随着各种程序性死亡(PD)-1/程序性死亡基因配体(PD-L)1抑制剂相继用于治疗晚期HCC患者,研究表明单独应用免疫治疗的客观缓解率(objective response rate,ORR)仅为20%,有必要探索更适当的全身治疗策略以提高免疫疗法的疗效[7]。抗血管生成靶向药物可以改善肿瘤微环境下免疫抑制功能,并通过影响T细胞激活提高免疫检查点抑制剂的抗肿瘤能力,从而为联合治疗提供了强有力的理论基础[8]。阿帕替尼和卡瑞利珠单克隆抗体是我国自主研发的抗肿瘤药物,能够延长HCC患者的生存期。本研究应用卡瑞利珠单克隆抗体联合阿帕替尼治疗中晚期HCC患者,观察了疗效情况,现报道如下。
1 资料与方法
1.1 病例来源 2019年6月~2021年10月新疆医科大学第一附属医院接受治疗的中晚期HCC患者117例,男92例,女25例;年龄为36~69岁,平均年龄为(55.6±8.7)岁。根据《原发性肝癌诊疗指南(2022年版)》的标准诊断,纳入患者为中国肝癌分期方案(China liver cancer staging,CNLC)为Ⅲa或Ⅲb期,或不再适合手术切除或肝动脉化疗栓塞术(transarterial chemoembolization,TACE)治疗的CNLCⅡb期,Child-Pugh A级或B级,体力活动状态(performance status,PS)0分或1分[9]。根据修订后实体瘤临床疗效评价标准(modified response evaluation criteria in solid tumor,mRECIST)[10],经影像学检查至少可见到一个可测量的病灶,应用索拉非尼治疗期间疾病出现进展,再选用卡瑞利珠单克隆抗体联合阿帕替尼或阿帕替尼作为二线治疗。排除标准:(1)合并其他恶性肿瘤;(2)存在心、肾功能不全。
1.2 治疗方案 以患者接受索拉非尼治疗进展后肿瘤特征为基线,更换为卡瑞利珠单克隆抗体(艾瑞卡,江苏恒瑞医药股份有限公司)200 mg静脉滴注,1次/3 w;联合(或)甲磺酸阿帕替尼片(艾坦,江苏恒瑞医药股份有限公司)0.25 g口服,1次/d。当出现药物相关不良事件时,将药物减量或暂停应用,待不良反应减轻后再恢复原剂量,直到疾病进展或死亡。
1.3 观察指标与疗效评价 常规检测血清甲胎蛋白(alpha fetoprotein,AFP)、血常规和肝肾功能等指标;常规行上腹部增强CT或MRI检查,评估靶病灶。根据mRECIST评价肿瘤治疗效果,分为:(1)完全缓解(CR):所有靶病灶均无动脉期增强;(2)部分缓解(PR):靶病灶直径缩小不低于30%;(3)疾病进展(PD):靶病灶直径至少增大20%,或有新生病灶;(4)疾病稳定(SD):靶病灶直径缩小未达到PR,增大未达到PD;(5)ORR=(CR+PR)/(CR+PR+SD+PD)×100%;(6)疾病控制率(DCR)=(CR+PR+SD)/(CR+PR+SD+PD)×100%;(7)无进展生存期(PFS)被定义为患者自治疗开始至肿瘤进展或死亡。所有患者均于治疗后随访12月。

2 结果
2.1 一般资料 两组基线临床资料比较,差异无统计学意义(P>0.05,表1)。
2.2 两组mRECIST评价疗效比较 联合治疗组ORR和DCR显著高于阿帕替尼组,差异具有统计学意义(P<0.05,表2)。
2.3 两组血清AFP水平和血常规指标比较 在治疗3月末,联合治疗组外周血PLT计数显著低于阿帕替尼组,差异具有统计学意义(P<0.05,表3)。
2.4 两组血清肝肾功能指标比较 在治疗3月末,联合治疗组血清TBIL和ALT改善显著优于阿帕替尼组,差异具有统计学意义(P<0.05,表4)。
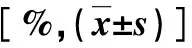
表1 两组基线临床资料比较
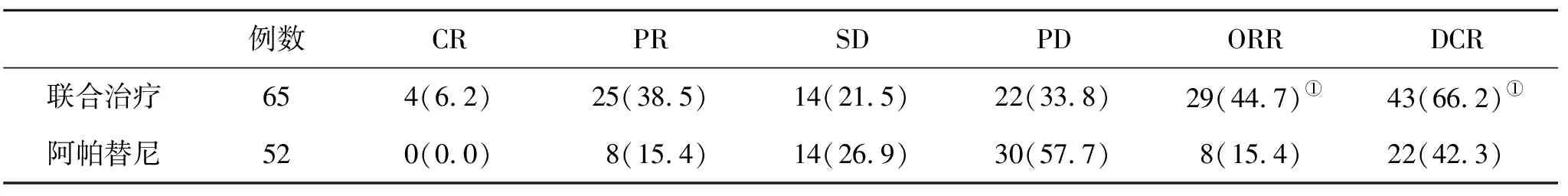
表2 两组mRECIST评价疗效(%)比较
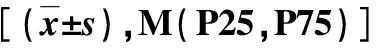
表3 两组血清AFP和血常规指标比较

表4 两组血清肝肾功能指标[M(P25,P75)]比较
2.5 两组PFS比较 随访12月,所有患者未失访。联合治疗组PFS为10.6(95%CI:9.986~11.16)个月,阿帕替尼组为7.9(95%CI:6.84~8.944)个月,两组差异具有统计学意义(Log-rank=12.807,P<0.05,图1)。
2.6 影响PFS的预后因素分析 在影响PFS预后的诸多因素中,经Kaplan-Meier生存分析显示,PS、Child-Pugh评分、CNLC分期、有无肝硬化、门脉癌栓和TACE是PFS预后的影响因素(P<0.05);将单因素分析中筛选出的有统计学意义的因素采用COX多因素分析显示,Child-Pugh B级和伴有门脉癌栓是影响中晚期HCC患者PFS的独立危险因素,而TACE是影响中晚期HCC患者PFS的独立保护因素(P<0.05,表5)。
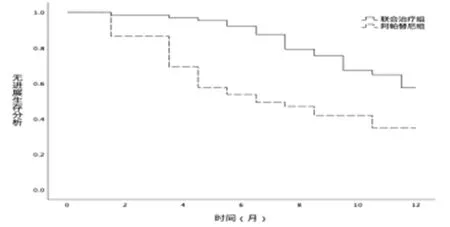
图1 两组PFS比较
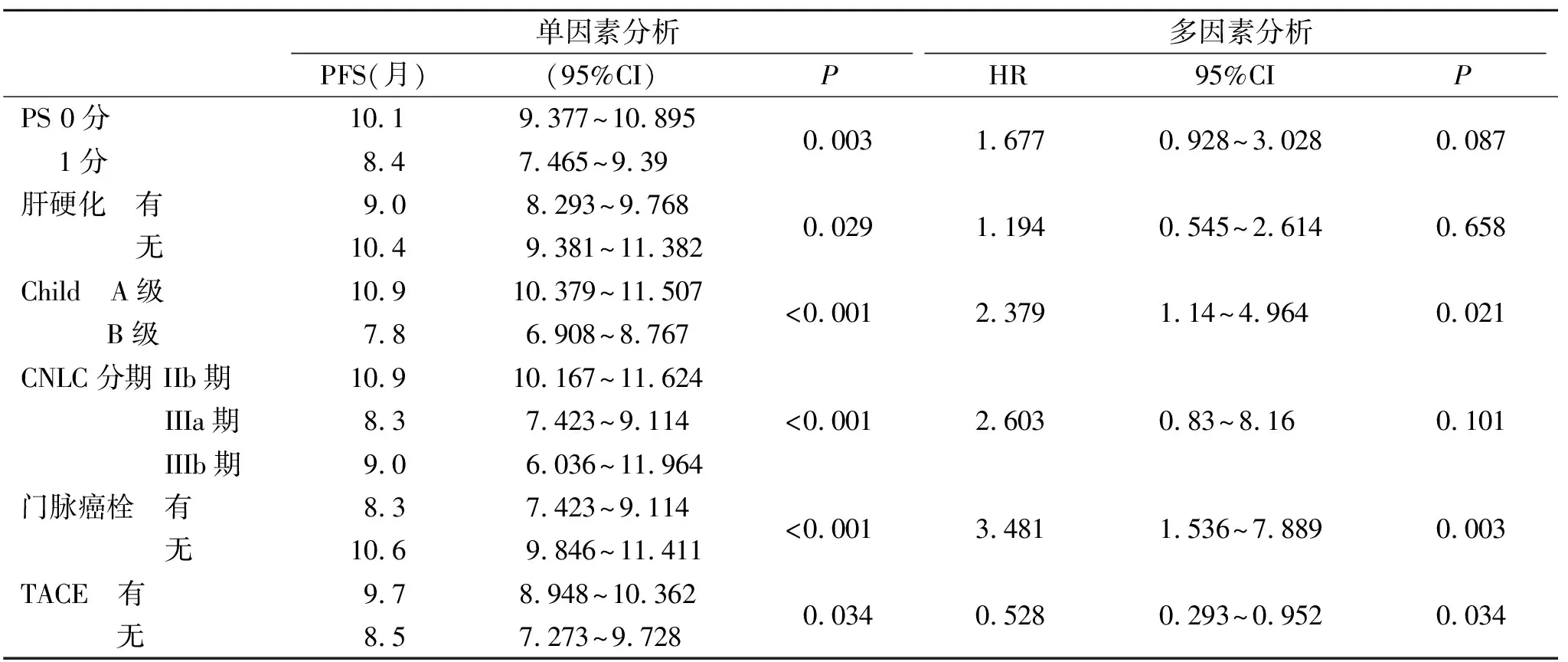
表5 影响PFS的Kaplan-Meier生存分析及COX多因素分析
3 讨论
原发性肝癌是目前我国第4位常见的恶性肿瘤和第2位肿瘤致死病因。大多数肝癌患者确诊时已处于疾病中晚期,5 a生存率很低,约为10%~18%[11,12]。以往,对于中晚期HCC患者的一线治疗药物仅有索拉非尼,但它的生存益处是有限的,肿瘤应答率很低。IMbrave150研究[13]和ORIENT-32研究[14]成果推荐阿替利珠单克隆抗体联合贝伐珠单克隆抗体(AteBev方案)及信迪利单克隆抗体联合贝伐珠单克隆抗体生物类似药(IBI305)用于不可切除的HCC患者的一线治疗,显著改善OS和PFS。这些结果鼓励进一步研究其它潜在的有前景的联合治疗方法,其中卡瑞利珠单克隆抗体联合阿帕替尼方案也受到了重点关注。阿帕替尼是我国研发的小分子酪氨酸激酶抑制剂,卡瑞利珠单克隆抗体是我国首个获批用于治疗晚期HCC的免疫抑制剂。我国开展的卡瑞利珠单克隆抗体联合阿帕替尼治疗晚期HCC的Ⅱ期临床试验(RESCUE)[15]结果显示,作为晚期HCC系统治疗,卡瑞利珠单克隆抗体联合阿帕替尼(“双艾”方案)具有显著的疗效,且安全性可控,为HCC患者带来更多的治疗药物选择。应用卡瑞利珠单克隆抗体联合阿帕替尼一线治疗晚期HCC患者的全球多中心、随机对照Ⅲ期临床试验(SHR-1210-III-310)结果提示“双艾”方案具有显著的临床获益和可耐受的安全性[16]。2022年版CSCO发布的原发性肝癌诊疗指南[17]已将“双艾”方案,即卡瑞利珠单克隆抗体联合阿帕替尼方案,列入HCC的一线治疗方案。
在安全性分析方面,与阿帕替尼治疗比,联合治疗组血小板减少发生率较高,可能与卡瑞利珠单克隆抗体的使用引起免疫相关性血小板减少有关[18-20]。尽管联合方案显示血液学毒性增加,但目前的研究表明,联合方案的副作用总体上是可控和可耐受的。
本研究结果显示,对117例HCC患者治疗后随访12月,联合治疗组PFS为10.6个月,而阿帕替尼组只有7.9个月,表明联合方案能够延缓HCC患者肿瘤进展,延长患者生存时间。生存预后分析能寻找出影响患者生存时间的因素。本研究经多因素COX分析结果显示,Child-Pugh B级和伴有门脉癌栓是影响中晚期HCC患者PFS的独立危险因素,而进行TACE治疗是独立的保护因素,提示联合TACE治疗能使患者获得更好的疗效。TACE采用栓塞剂栓塞肿瘤动脉,同时将化疗药物通过导管注入肿瘤的供血动脉,使肿瘤组织缺血缺氧并产生细胞毒性作用,从而诱导肿瘤细胞坏死,抑制肿瘤生长。TACE术后使肿瘤缺氧,导致肿瘤血管生成,促进肿瘤的进展和转移。靶向药物则是针对阻断信号转导通路,抑制肿瘤新生血管的形成,从而抑制肿瘤复发和转移。TACE术后肿瘤组织坏死,减少了免疫抑制因子的释放,减弱肿瘤对免疫功能的抑制,肿瘤抗原暴露,激活机体抗肿瘤免疫。免疫治疗可提高抗肿瘤免疫效应,使抗肿瘤的效果更好。早期发现HCC患者早期治疗能减少并发症发生,改善预后。疾病进展愈久,肝脏代谢能力越差,所得到的治疗效果也就越差。因此,提高早期HCC诊断率,对高危人群进行HCC普查显得尤为重要。
