超声造影与增强CT检查诊断小肝癌效能比较*
2024-01-07郝永欣孟祥安高美丽
郝永欣,孟祥安,骆 允,高美丽,刘 欢,刘 磊,沈 荣
肝细胞癌(hepatocellular carcinoma,HCC)为最常见的肝脏恶性肿瘤,具有预后差和病死率高等特点。流行病学调查显示[1],HCC患者5 a生存率可能低于10%。但对于直径≤3.0 cm的小肝癌患者,其整体生存率较高,行射频消融或手术切除等治疗后,5 a生存率超过50%[2]。因此,明确诊断小肝癌、尽早治疗,对改善HCC患者整体生存率有重要的意义。目前,增强CT和增强MRI是诊断肝脏局灶性病变的主要方法。在2018年,美国肝病研究协会和欧洲肝病研究协会更新的指南将两者作为诊断HCC的一线检查手段,同时也将超声造影(contrast-enhanced ultrasound,CEUS)列为二线诊断手段[3]。近年研究发现[4,5],CEUS诊断小肝癌的灵敏度较高,且CEUS检查可量化病灶内血流灌注情况,其定量参数可辅助判断肿瘤的病理学分化程度,从而指导临床治疗。CEUS使用的造影剂不会产生放射性损伤,安全性更高[6]。本研究分析了CEUS与增强CT诊断小肝癌的应用价值,现报道如下。
1 资料与方法
1.1 一般资料 2020年1月~2022年6月我院诊治的肝脏小结节患者104例,男性72例,女性32例;年龄为27~78岁,平均年龄为(56.0±8.2)岁。纳入标准:⑴经手术或穿刺组织病理学检查明确诊断;⑵有慢性乙型肝炎或丙型肝炎病史;⑶穿刺活检或手术切除前2周内行CEUS和增强CT检查;⑷初诊患者,影像学检查前未行抗肿瘤治疗;⑸肝内单发病灶,且病灶直径≤3.0 cm。排除标准:⑴合并其他恶性肿瘤;⑵既往有抗肿瘤治疗史;⑶有肝脏外科手术或介入治疗史;⑷存在门静脉癌栓、浸润性肝癌等晚期肿瘤;⑸胆管细胞癌或混合型肝癌、转移性肝癌;⑹对造影剂或对比剂过敏;⑺妊娠或哺乳期妇女。
1.2 CEUS检查 使用迈瑞Resona 7高端彩色多普勒超声诊断仪(探头频率:1.0~5.0 MHz)和注射用六氟化硫微泡(声诺维,意大利Bracco公司)。检查时,患者取仰卧位,先行肝区平扫,明确结节位置、大小、形态等。切换至CEUS模式,固定探头,调整对比频率,经肘静脉团注声诺维与5 mL生理盐水的混合液1.2 mL,嘱患者屏气,连续实时观察病灶强化情况,以肝实质增强为参照,记录开始增强时间、达峰时间和开始廓清时间。
1.3 增强CT检查 使用德国西门子SOMATOM Definition AS 64排螺旋CT,检查前空腹,嘱患者屏气,以减少运动伪影。扫描范围由膈顶至肝脏下缘。扫描参数:管电压120 kV,使用自动管电流技术,螺距0.6 mm,层间距1 mm,重建层厚1 mm。应用碘帕醇注射液(上海博莱科信谊药业有限责任公司,H20073013,300 mg I/mL),用双筒高压注射器经肘静脉注射,4.0 mL/s,再用生理盐水20 mL冲管。应用对比剂自动跟踪触发技术,在触发点CT值达到120 Hu后6 s扫描动脉期,30 s后扫描门静脉期,150 s后扫描延迟期。
1.4 图像分析 超声科和CT室医师采用盲法阅片,应用2018年版肝脏影像报告和数据系统(Liver Imaging Reporting and Data System,LI-RADS)[7]对病灶进行分类。根据动脉期高强化、廓清、包膜强化、超阈值增大等主要征象进行分类,分为肯定良性(LR-1)、可能良性(LR-2)、不确定良恶性(LR-3)、可能HCC(LR-4)、肯定HCC(LR-5)和可能或肯定恶性,但非典型HCC(LR-M)。
1.5 病理学检查 在病理学检查前,所有患者签署纸质知情同意书。行穿刺活检或手术切除获得病灶病理组织标本,行固定、石蜡包埋、切片、染色等常规病理学检查,评估小肝癌细胞分化程度,将其分为高/中分化和低分化组。

2 结果
2.1 CEUS检查情况 典型病例CEUS表现见图1。
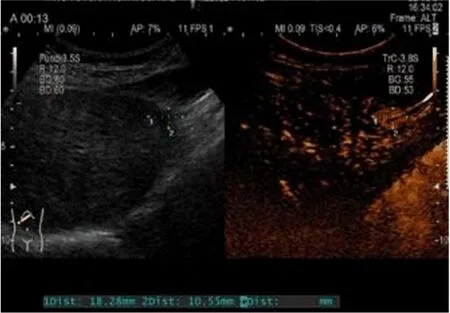
图1 小肝癌患者CEUS表现 动脉期发现肝IV段约18.3 mm×10.6 mm小结节增强影,表现为快进快出
2.2 CEUS与增强CT对肝脏小结节分类判断的一致性情况 本组CEUS与增强CT对肝脏小结节分类有93例(89.4%)一致,一致性良好(Kappa系数=0.749,P<0.05,表1)。

表1 CEUS与增强CT对肝脏小结节分类判断的一致性情况
2.3 CEUS与增强CT对小肝癌的诊断价值情况 在104肝脏小结节患者中,经病理学检查明确诊断为HCC者42例(40.4%),肝脏小良性结节62例(59.6%);Kappa一致性检验显示,CEUS和增强CT诊断小肝癌均有较高的效能(P均<0.05),其中CEUS和增强CT均以LR-4/LR-5为诊断小肝癌的判断标准,其诊断价值更高,而CEUS LR-4/LR-5诊断小肝癌的效能稍优于增强CT检查(Kappa系数为0.861对0.803,表2)。
2.4 不同分化程度的小肝癌患者CEUS定量参数比较 高分化小肝癌患者CEUS达峰时间和开始廓清时间均显著长于低分化者(P均<0.05,表3)。

表2 CEUS与增强CT诊断小肝癌的效能分析

表3 不同分化程度小肝癌患者CEUS定量参数比较
3 讨论
CEUS使用的造影剂微泡具有良好的散射特性,在低声压条件下也能产生强烈的谐波,增强后散射回声,提高病灶与周围组织的回声差异,提高病灶检出率[8]。由于微泡造影剂直径较大,不经血管进入组织间隙,可完全代谢再经肺排出,在肝肾功能不全的患者也能应用,安全性较高[9]。由于早期HCC由肝动脉和门静脉双重供血,CEUS造影剂微泡在动脉期可迅速进入肿瘤微血管,而在门静脉期则缓慢消退,即“快进慢退”表现。随着肿瘤进展,HCC组织毛细血管网形成,滋养血管以肝动脉为主。由于HCC组织存在动静脉瘘特征,造影剂在门静脉期快速消退,故呈“快进快退”现象,故HCC在CEUS具有典型的征象[10]。增强CT作为诊断小肝癌的一线影像学工具,可根据HCC组织与肝实质血供的不同,观察肿瘤与周围肝实质密度差,不仅能诊断HCC,还能辅助评估治疗HCC患者的疗效和预后[11]。随着LI-RADS对肝脏结节分类标准的完善,CEUS和增强CT的诊断更为规范、准确。CEUS的LI-RADS不仅结合结节强化模式,还综合结节大小和包膜等多种因素进行判断。LI-RADS分类由增强程度和模式、廓清,即门静脉期或延迟期呈低增强,密度低于周围肝实质及大小判断性质。增强CT的LI-RADS分类较CEUS多了强化包膜、超阈值增大评估项目,根据各自影像学特征均能明确诊断[12]。本研究发现,CEUS与增强CT对肝脏小结节分类一致性良好,两者有89.4%结节分类判断一致,与有关研究[13]结果不同,后者发现CEUS与增强CT/MRI LI-RADS对直径≤2 cm的肝微小病灶检查的一致性较差,有38.6%病灶判断不一致。本组对肝脏小结节(直径≤3cm)也有超过10%病灶判断不一致,与CEUS与增强CT的特点和分类标准不同有关。本组CEUS将2例小肝癌病灶判断为LR-M,分析其误判的原因可能为CEUS LR-M的分类标准为动脉期环状增强,或1 min内开始廓清,或2 min呈显著廓清,部分低分化的小肝癌可呈早期廓清或显著廓清表现,导致误判[14]。
另据文献报道[15],由于CEUS与增强CT的扫描方式和使用的造影剂不同,CEUS可连续动态观察,增强CT只能间断扫描,使用离子造影剂,造影剂可经肿瘤血管内皮弥散至肿瘤间质,导致门静脉期廓清显示不明,故CEUS动脉期过度增强的敏感性更高,延迟期对造影剂廓清评估也更准确。本研究CEUS和增强CT对小肝癌均有良好的诊断价值,且CEUS的诊断价值整体优于增强CT检查。一般认为,增强CT强化包膜的判断易受一些因素的影响,如一些无明显廓清的小肝癌病灶强化包膜可能并不典型,无法识别[16]。部分1.0 cm以下小肝癌新生血管未发育完全,缺乏动脉期“快进”表现,导致漏诊[17]。另外,CEUS和增强CT均以LR-4/LR-5为判断小肝癌的标准,其诊断效能优于LR-5标准,提示小肝癌以早期肿瘤为主,血供未形成,LR-5的分类标准可能导致一些病灶的漏诊[18]。
此外,本研究还发现,CEUS定量参数对判断小肝癌分化程度有帮助,即高分化肝癌CEUS达峰时间和开始廓清时间均显著长于低分化者(P均<0.05),这也与高分化小肝癌存在肝动脉与门静脉双重血供,其肝动脉供血相对较少,故廓清较慢,造影剂消退时间延长[19,20]。因此,CEUS检查不仅能实时、连续地观察肝脏小结节病灶的强化和廓清特点,还能通过定量参数评估小肝癌的分化程度,有利于指导临床治疗。
