CT和MRI动态增强扫描诊断和评估原发性肝癌患者微血管浸润价值研究
2024-01-07丁建华张波邓国莉
丁建华,张波,邓国莉
原发性肝癌(primary liver cancer, PLC)是来源于肝细胞或胆管细胞的肝癌[1]。据流行病学调查显示,PLC在我国恶性肿瘤中发病率居第四位,致死率位于第二位[2]。早期无明显的症状。随着病情发展,可出现肝区疼痛、食欲减退、消瘦、乏力和低热等症状[3]。目前,外科肝叶或肝段切除和肝移植被认为是治疗PLC患者的最好方法,但术后肿瘤复发是临床关注的热点[4]。有研究认为,PLC患者是否存在微血管浸润(microvascular invasion,MVI)是术后肿瘤复发的重要影响因素[5]。但临床主要依赖于病理学检查判断MVI,为手术后处理提供指导[6]。随着影像学检查手段的不断发展,研究发现CT和MRI动态增强扫描对PLC患者MVI具有一定的诊断价值[7]。故本研究选择我院诊治的经手术病理学检查确诊的肝细胞癌(HCC)患者的临床资料,分析评价了CT和MRI动态增强扫描在判断MVI方面的价值,现报道如下。
1 资料与方法
1.1 一般资料 2020年1月~2023年1月我院诊治的PLC患者50例,男性33例,女性17例;年龄为29~78岁,平均年龄为56.2±7.3岁。参照《原发性肝癌诊疗规范(2017年版)》[8]的标准诊断,经手术组织病理学检查诊断MVI,纳入患者术前未接受过抗肿瘤治疗。排除标准:(1)存在失代偿期肝硬化;(2)存在其他恶性肿瘤或有肿瘤远处转移;(3)精神疾病;(4)全身性严重疾病。本研究经我院医学伦理委员会批准,患者及其家属签署知情同意书。
1.2 影像学检查 取仰卧位,放松腹部,向上举起双臂。使用佳能320 CT机,扫描范围:膈顶到髂嵴。参数:电流240 mA,层厚5 mm,电压120 kV,矩阵512×512。将碘佛醇注射液经外周肘静脉以3.0 ml/s的流速注射90 ml,动脉期、门静脉、平衡期延迟扫描时间分别为28 s、60 s和180 s。增强扫描后重建图像;使用GE 1.5 T磁共振成像仪,体位和扫描范围与CT相同。取钆喷酸葡胺注射液,经肘静脉以3.0 ml/s的流速注射20 ml,动脉期、门静脉和平衡期延迟扫描时间分别为20 s、50 s和150 s。在增强扫描后重建图像,序列包括轴位、冠状位、T1WI:TR Minimum ms、TE 80 ms;T2WI:TR 3000 ms、TE 85 ms。FOV 42 cm×42 cm,层厚5.0 mm。图像叠加处理图像,获得校正后图像,由2名医师阅片。在病变及其周围肝实质区勾画感兴趣区,选择病变最大层面,测量不同b值下感兴趣区的表观弥散系数(apparent diffusion coefficient,ADC)。
1.3 观察指标 观察记录肿瘤边缘模糊征象,如局部外凸结节、局部包膜不完整、多结节融合及瘤内新月征、静脉浸润的双预测因子(two-trait predictor of venous invasion,TTPVI)、门静脉癌栓(portal vein tumor thrombosis,PVTT)和ADC。
1.4 病理学诊断 所有患者接受肝叶切除术治疗。取术后组织行病理学检查。发现中央静脉、门静脉分支和包膜小静脉等微小血管内存在癌栓聚集,或血管内皮层内皮细胞和平滑肌层出现肿瘤细胞,则判定为HCC患者存在MVI。
1.5 统计学分析 应用SPSS 26.0软件进行统计学分析,计数资料以%表示,采用x2检验或Fisher精确概率计算;采用多因素Logistic分析影响HCC患者出现MVI的因素。P<0.05为差异有统计学意义。
2 结果
2.1 典型病例影像学表现 见图1。
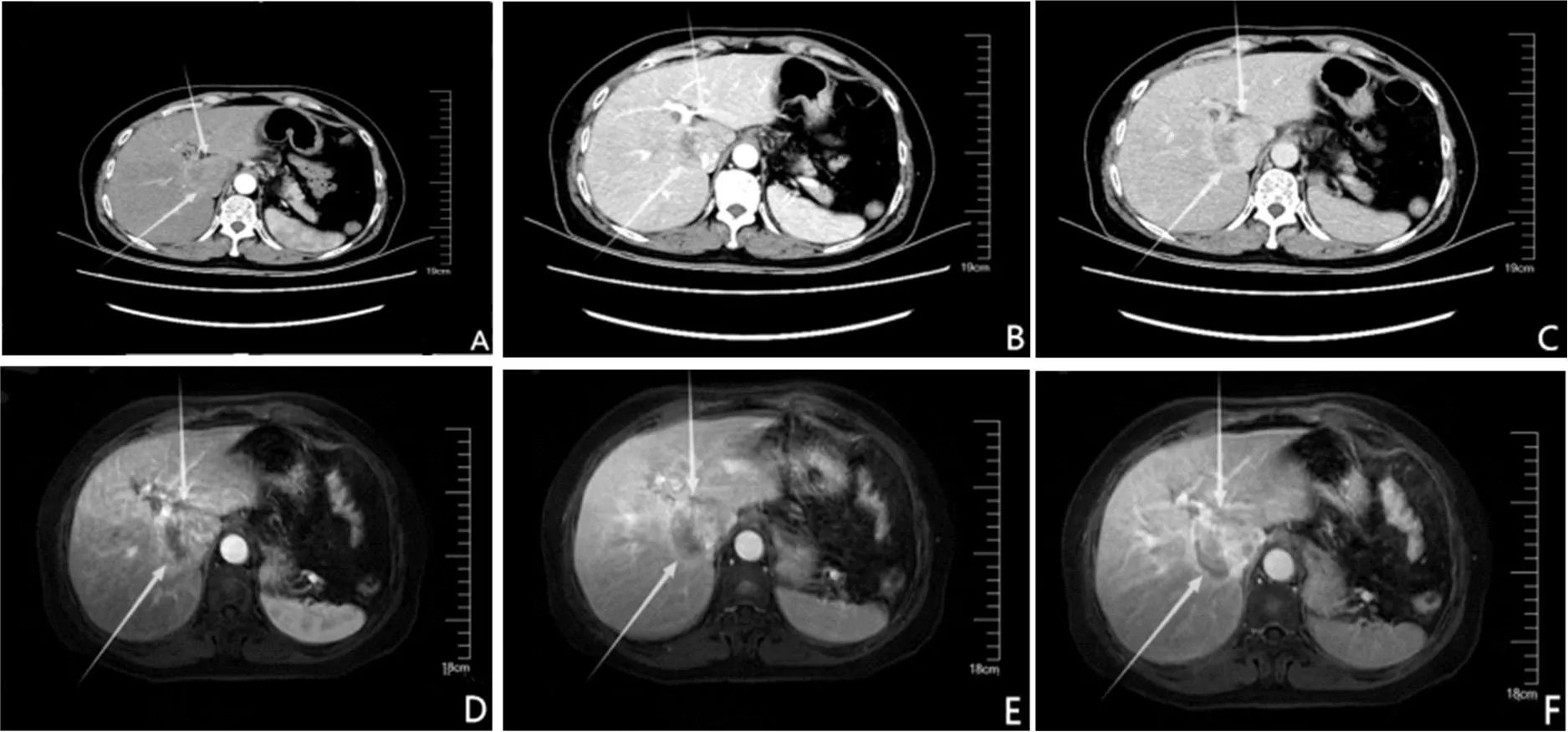
图1 HCC患者腹部影像学表现A:CT动态增强扫描动脉期显示病灶明显不均匀强化,边界清晰,周围肝实质未见强化;B:门脉期显示病灶强化程度迅速降低,内部密度不均匀;C:延迟期显示病灶强化程度进一步降低,低于周围肝实质;D:MRI动态增强扫描动脉期显示病灶明显不均匀强化,呈高信号,边界清晰;E:动态增强扫描门脉期显示病灶内造影剂迅速廓清,内部信号不均匀,病灶边界清晰;F:延迟期显示病灶信号进一步减低,边界清晰
2.2 两组CT和MRI动态增强扫描征象比较 经术后组织病理学检查,在本组50例PLC患者中,诊断肝细胞癌(hepatocellular carcinoma,HCC)32例,胆管细胞癌18例;存在MVI者29例,无MVI者21例;CT检查MVI患者肿瘤边缘模糊、局部外凸结节、局部包膜不完整、多结节融合、瘤内新月征、TTPVI和PVTT等影像学征象占比显著高于无MVI患者(P<0.05);MRI检查MVI患者肿瘤边缘模糊、局部外凸结节、局部包膜不完整、多结节融合、瘤内新月征、TTPVI和PVTT等影像学征象占比显著高于无MVI患者(P<0.05),两组多征象和ADC值比较差异无统计学意义(P>0.05,表1)。
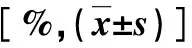
表1 两组CT和MRI动态增强扫描征象比较
2.3 影响PLC患者发生MVI的多因素Logistic回归分析 将病灶边缘模糊、TTPVI和PVTT作为自变量,将MVI作为因变量纳入Logistic回归分析,结果显示,CT和MRI检查发现病灶边缘模糊、TTPVI和PVTT是PLC患者发生MVI的影响因素(P<0.05,表2)。
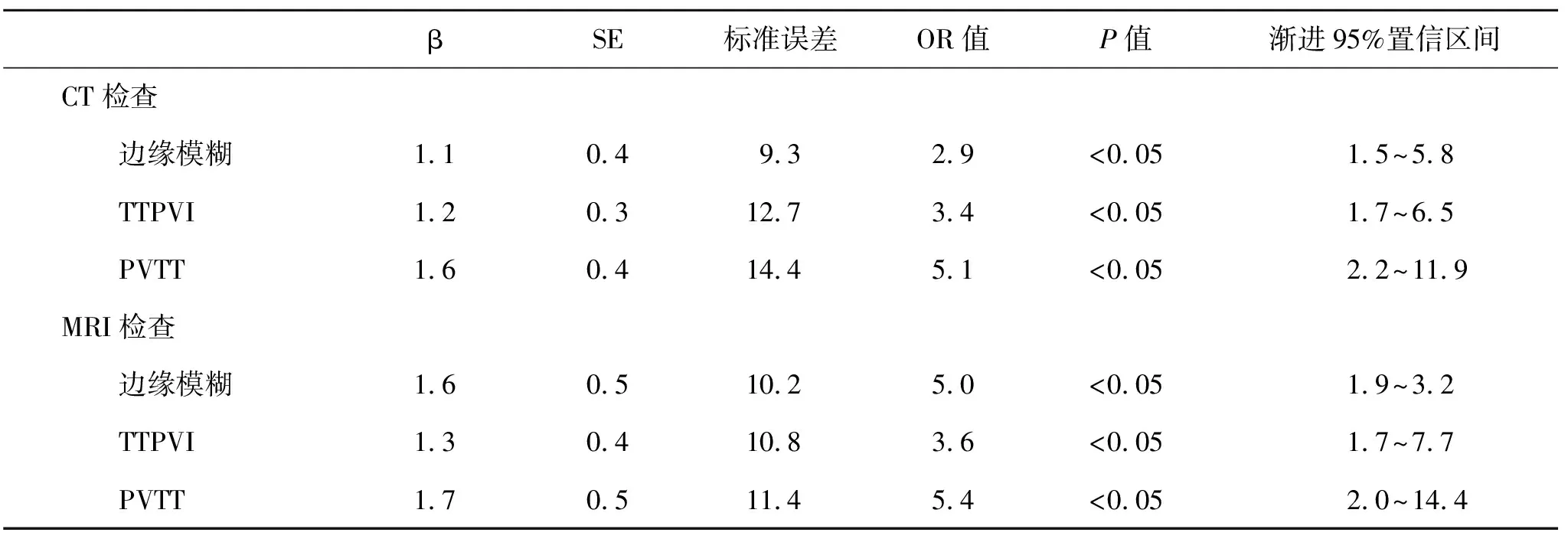
表2 影响PLC患者发生MVI的多因素Logistic回归分析
3 讨论
PLC是临床常见的恶性肿瘤,早期无特异性症状,仅表现为肝区疼痛等。随着疾病进展,可出现肝功能不全、腹水、肝性脑病等,威胁患者生命。目前,常采用手术治疗,通过有效切除肿瘤组织,控制肿瘤进展[9]。但术后存在肿瘤复发,会缩短生存期。据报道,肝段切除后HCC患者5 a肿瘤复发率达到70%[10]。MVI是PLC术后肿瘤复发的原因,合并MVI的PLC患者在手术切除时易残留癌细胞,可增加术后远期肿瘤复发率。故尽早检出MVI对完善手术方案和改善患者预后具有重要的意义[11,12]。
病理学检查是诊断MVI的金标准,但标本的取得是在肝段切除术后或肝移植术后,难以预判PLC治疗方案的选择。影像学检查可在无创条件下观察病变大小、性质,目前临床以CT和MRI检查为主,其中CT通过对肝区扫描后,可获得肝区多层扫描数据,然后注射造影剂增强病变轮廓,以获得更清晰的肝脏病变图像,清晰地显示肝脏病变的解剖结构、形态等征象,有利于判断是否发生了MVI,且在增强扫描过程中静注泛影葡胺注射液可随血液流向病灶位置及其周围组织,清晰地显示血流动力学变化,通过观察泛影葡胺注射液流动情况显示不同肝脏的血供情况,具有成像速度快等特点[13,14]。动脉期病灶显影增强,呈高密度;门静脉期病灶强化降低,为低密度,此阶段有助于判断血管的受损情况;在平衡期,对比剂流出,病灶强化弱,此阶段对病灶识别性不高,可出现误诊,且CT具有辐射,可危害患者身体健康[15-17]。MRI能多层次多方位成像和高软组织分辨率,通过对肝区进行多序列扫描,然后处理肝区显像图,且增强后可获得清晰的血流灌注图像及其瘤体形态变化,进一步加强了肝组织与局部病变组织的对比,可从多个方向观察肝区情况,降低漏诊和误诊率。此外,还可通过观察肝脏肿瘤病灶征象辅助判断患者是否存在MVI[18,19]。本研究结果显示,CT和MRI检查MVI患者的肿瘤边缘模糊、局部外凸结节、局部包膜不完整、多结节融合、瘤内新月征、TTPVI和PVTT等影像学征象占比显著高于无MVI患者,说明CT和MRI影像征象中边缘模糊、局部外凸结节、局部包膜不完整、多结节融合、瘤内新月征、TTPVI和PVTT影像学征象增多可提示HCC患者存在MVI。由于HCC发生MVI后,肝脏肿瘤组织边缘出现了新生血管,有瘤内血管形成,血管壁基底膜不完整,导致包膜不完整,边缘模糊、TTPVI和PVTT等特征[20]。但存在与不存在MVI肿瘤ADC值比较无显著性差异,需扩大样本量进一步分析。多因素Logistic回归分析显示,CT和MRI征象发现的肿瘤边缘模糊、TTPVI和PVTT是PLC患者发生MVI的影响因素,表明肿瘤边缘模糊、TTPVI和PVTT与MVI高度相关,是发生MVI的危险因素。与CT增强扫描对软组织分辨率不高比,MRI动态增强的分辨率更高。在CT和MRI影像征象方面,发现肿瘤边缘模糊、TTPVI和PVTT可大致判定MVI的存在,从而可以帮助临床做出合理的治疗方案。
综上所述,使用CT和MRI动态增强扫描均可对HCC患者MVI具有良好的诊断价值,影像征象发现的肿瘤边缘模糊、TTPVI和PVTT判定存在MVI具有一定的临床应用价值,可为治疗方案的选择和术后疗效预判提供依据。
