水凝胶递送碱性成纤维细胞生长因子对氧糖剥夺后NIH3T3细胞功能的影响
2024-01-05惠文婷宋潼潼
惠文婷, 宋潼潼, 黄 敏, 陈 霞
(1. 吉林大学基础医学院药理学系,吉林 长春 130021; 2. 吉林大学基础医学院人体解剖学系,吉林 长春 130021)
心肌成纤维细胞被认为是心脏中细胞外基质(extracellular matrix, ECM)的主要生产者。心肌梗死后,静止的成纤维细胞被激活,增殖、迁移并分化为病理性肌成纤维细胞表型,活化的肌成纤维细胞通过分泌ECM 蛋白形成纤维化组织且具有防止梗死心脏破裂的作用[1-2]。但ECM 蛋白在梗死区域过度沉积会导致组织僵硬并限制心脏的收缩和舒张功能[3-4]。心肌梗死后,成纤维细胞功能的高效调控成为研究的热点。
成纤维细胞生长因子(fibroblast growth factor,FGF)家族由22 个成员组成,大部分FGF 通过自分泌或旁分泌信号在多个器官和身体发育过程中发挥作用[5-6]。在FGF 家族的成员中,碱性FGF(basic FGF,bFGF) 被认为是心肌收缩时分泌的血管生成因子,具有心脏保护作用[7]。研究[8-10]显示:bFGF 在部分临床试验中对缺血性损伤有益。然而,bFGF 的半衰期较短,全身给药的疗效较差,目前主要致力于开发局部生长因子递送系统,提高药物疗效。
生物材料可用于包封各类化合物,为保留化合物活性提供合适的微环境,在心脏再生方面显示出巨大的潜力。生物材料具有独特的生物活性和生物相容性,且较为稳定,这些特性使其具有应用于心脏修复和再生的可能[11]。水凝胶是一种具有三维网络结构的聚合物生物材料,具有高结合亲和力、低免疫原性、良好的生物相容性和导电性等优点,在药物输送领域具有非凡的潜力[12-13]。基于水凝胶可为受伤区域提供结构支撑并可以提供控释治疗剂的特性,将bFGF 包封于水凝胶内并递送至心肌梗死部位不仅可能改善bFGF 半衰期短和保留率低的缺点,还可能抑制心肌梗死后的过度纤维化,改善心肌不良重塑。
本课题组前期研究[14]显示:负载bFGF 的水凝胶可以调节氧糖剥夺 (oxygen glucose deprivation,OGD)条件下DC2.4 细胞炎症因子的表达和分泌,可能改善心肌梗死后的免疫微环境。本研究探讨在OGD 条件下,使用水凝胶载药系统将bFGF 输送至成纤维细胞中对成纤维细胞向肌成纤维细胞分化和相关蛋白表达的影响,并阐明负载bFGF 的水凝胶对OGD 条件下成纤维细胞氧化应激反应的改善作用。
1 材料与方法
1.1 细胞、主要试剂和仪器小鼠胚胎成纤维NIH3T3 细胞购自上海中乔新舟生物科技有限公司,货号ZQ0096。CCK-8 试剂(B34302)购自上海Bimake 生物科技有限公司,DMEM 高糖培养基(C11995500BT) 和 DMEM 无 糖 培 养 基(11966025) 购自美国赛默飞世尔科技有限公司,重组小鼠bFGF(PRP1011)购自武汉亚科因生物技术有限公司,明胶(10010328)购自上海国药集团化学试剂有限公司,戊二醛(20200415)购自天津福晨化学试剂有限公司,高效放射免疫沉淀测定(radioimmune precipitation assay,RIPA) 组织/快速细胞裂解液(R0010)、 乳酸脱氢酶(lactic dehydrogenase,LDH)活性检测试剂盒(BC0685)、丙二醛(malondialdehyde,MDA) 含量检测试剂盒 (BC0025) 和 超 氧 化 物 歧 化 酶 SOD(superoxide dismutase,SOD) 活性检测试剂盒(BC1075)购自北京索莱宝科技有限公司,兔抗Ⅰ型胶原蛋白抗体(AF7001)、兔抗Ⅲ型胶原蛋白抗体(AF5475)和兔抗α - 平滑肌肌动蛋白(α-skeletal muscle actin,α-SMA)抗体(AF1032)购自美国Affinity公司,小鼠抗GAPDH(HC301-01)抗体和羊抗鼠免疫球蛋白G (immunoglobulin G,IgG) H&L/辣根过氧化物酶 (horseradish peroxidase,HRP) 抗体(HS201) 购自北京全式金生物公司,羊 抗 兔 IgG H&L/HRP 抗 体(bs-40295G-HRP)购自北京博奥森生物技术有限公司,小鼠bFGF 酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA) 试剂盒(LV30045)购自上海爱萌优宁生物技术有限公司。MCO-170AICUVL-PC CO2细胞培养箱购自日本Panasonic 公司,GC-C0626GC-C03 缺氧小室购自黑龙江Maworde 公司,D3024R 台式高速冷冻型微量离心机购自北京大龙兴创实验仪器股份公司,Tanon-4200SF 显影仪购自上海天能科技有限公司,Multiskan FC 型酶标仪购自美国赛默飞世尔科技有限公司。
1.2 负载bFGF 明胶水凝胶制备制备10% 和20%的明胶水凝胶,使用超纯水60 ℃水浴加热,待明胶颗粒完全溶解并搅拌均匀后,将液体迅速转入直径2 mm 和厚度2 mm 的圆形模具中,4 ℃冷凝。凝固后的水凝胶贴片置于常温下用戊二醛熏蒸24 h 和48 h 后,将凝胶于-56 ℃下真空冷冻干燥24 h。按参考文献[1]的方法,通过检测不同浓度水凝胶的溶胀率,确定20%浓度的水凝胶具有更好的溶胀性能,故选择该浓度进行后续实验。将含有1×10-5、1×10-4和1×10-3g·L-1bFGF 的磷酸盐缓冲液(phosphated buffer saline,PBS)通过0.22 μm膜过滤,并在无菌条件下注入水凝胶贴片进行药物吸附,约24 h完成吸附。将凝胶于-56 ℃下真空冷冻干燥24 h[15]。将20%明胶水凝胶和经戊二醛熏蒸后的20%明胶水凝胶分别浸入DMEM培养基中,并于6、12 和24 h 时收集浸出液。
1.3 CCK-8 法检测NIH3T3 细胞活性取生长状态良好的细胞制备细胞悬液,加入96 孔细胞培养板中,每孔100 μL。待细胞贴壁后,取对数生长期的NIH3T3 细胞进行实验。实验分为空白组、20%明胶组和20%明胶+戊二醛组。空白组细胞更换为不含血清的DMEM 高糖培养基,20%明胶组和20%明胶+戊二醛组分别更换对应的浸出液,继续培养24 h。结束培养前 4 h,每孔加入10%培养体积的CCK-8 溶液共孵育,采用酶标仪于波长450 nm 处检测吸光度(A)值,以A 值代表各组细胞活性。
1.4 细胞分组和造模小鼠胚胎成纤维NIH3T3细胞系培养于含10% 胎牛血清和1% 青-链霉素DMEM 高糖培养基中,置于含5% CO2和95%空气、37 ℃培养箱中过夜培养。待细胞生长至密度约80%时,将NIH3T3 细胞分为对照组、OGD 组和OGD+不同质量 bFGF 负载组(OGD+1 ng bFGF 组、OGD+10 ng bFGF 组和OGD+100 ng bFGF 组)进行处理。对照组细胞置于不含血清的DMEM 高糖培养基中;OGD 组造模方法参考文献[16],将细胞置于不含血清的DMEM 无糖培养基中,并于37 ℃、5% CO2和1% O2的低氧小室中培养4 h;OGD+不同质量bFGF 负载组置于Transwell 小室中,小室的上层为NIH3T3 细胞,细胞密度为每孔1×105mL-1,下层放入负载bFGF的水凝胶贴片,置于OGD 组相同条件下培养。
1.5 Western blotting 法检测各组细胞中α-SMA、Ⅰ型和Ⅲ型胶原蛋白表达水平收集各组NIH3T3细胞,采用含蛋白酶抑制剂的RIPA 组织/细胞裂解液提取细胞总蛋白。采用BCA 蛋白质测定试剂盒于4 ℃下测定蛋白浓度,加入适量5×Loading Buffer ,金属浴中加热变性 5 min,迅速置于冰上, -20 ℃保存。 SDS-PAGE 分离后转移至PVDF 膜上, 5%脱脂牛奶室温下封闭2 h,TBST缓冲液洗涤,4 ℃一抗孵育过夜。TBST 缓冲液洗涤,室温二抗孵育1.5 h。采用ECL 化学发光系统检测,采用Image J 软件分析蛋白条带灰度值,以GAPDH 为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.6 试剂盒检测各组细胞中MDA 水平和LDH 及SOD 活性按试剂盒说明书操作,采用酶标仪于波长450 nm、532 nm、560 nm 和600 nm 处测量各组细胞A 值,描制标准曲线,以波长450 nm 处A 值计算样本浓度,计算各组细胞中LDH 活性;以450 nm 处A 值计算各组细胞中SOD 活性;以波长532 nm 和600 nm 处A 值的差值计算各组细胞中MDA 水平。
1.7 ELISA 法检测bFGF 体外释放率负载bFGF 的水凝胶置于PBS 缓冲液中,分别于4 h、12 h 和24 h 后收集浸出液,按照试剂盒说明书操作,采用ELISA 法检测bFGF 体外释放率。采用酶标仪于波长450 nm 处测定A 值。以标准品浓度为横坐标,A 值为纵坐标,绘制标准曲线,计算bFGF 体外释放率。bFGF 体外释放率=各时间点bFGF 含量(ng)/bFGF 初始含量(ng)×100%。
1.8 统计学分析采用Graphpad Prism 9.0 统计软件进行统计学分析。本研究中所有数据均已至少3 个独立实验。各组细胞活性,细胞中α-SMA、Ⅰ型和Ⅲ型胶原蛋白表达水平,细胞中MDA 含量和LDH 及SOD 活性均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用独立样本t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组NIH3T3 细胞活性与空白组比较,不同浸出时间20% 明胶组和20% 明胶+戊二醛组NIH3T3 细胞活性差异无统计学意义(P>0.05),证实本研究制备的水凝胶各成分具有一定的安全性。见表1。
表1 各组NIH3T3 细胞活性Tab. 1 Activities of NIH3T3 cells in various groups(n=6,±s)
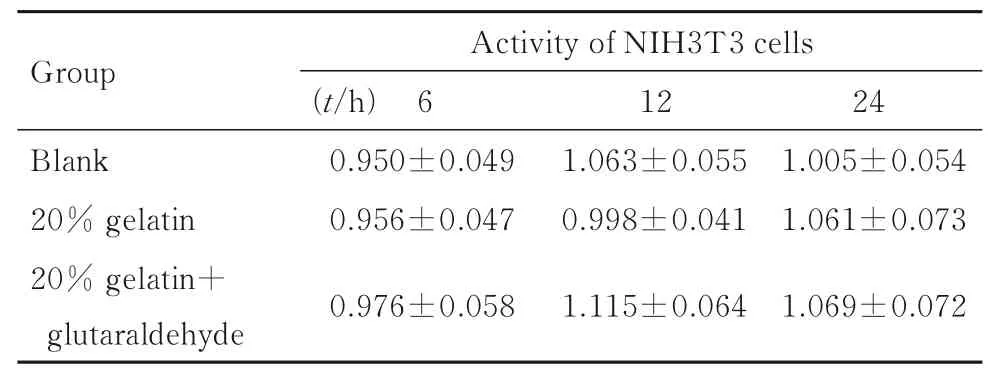
表1 各组NIH3T3 细胞活性Tab. 1 Activities of NIH3T3 cells in various groups(n=6,±s)
?
2.2 各组NIH3T3 细胞中α-SMA、Ⅰ型和Ⅲ型胶原蛋白表达水平与对照组比较, OGD 组NIH3T3 细胞中α-SMA 蛋白表达水平升高(P<0.05),Ⅰ型胶原蛋白表达水平明显升高(P<0.01)。与OGD 组比较,OGD+1 ng bFGF 组、OGD+10 ng bFGF 组和OGD+100 ng bFGF 组NIH3T3 细胞中α-SMA 蛋白表达水平均明显降低(P<0.01),Ⅰ型胶原蛋白表达水平均明显降低(P<0.05 或P<0.01),并呈剂量依赖性。各组NIH3T3 细胞中Ⅲ型胶原蛋白表达水平比较差异无统计学意义(P>0.05)。见图1、图2 和表2。提示负载1 ng bFGF 的水凝胶可有效调控OGD 条件下成纤维细胞的转化和胶原蛋白表达,因此使用负载1 ng bFGF 的水凝胶进行后续实验。
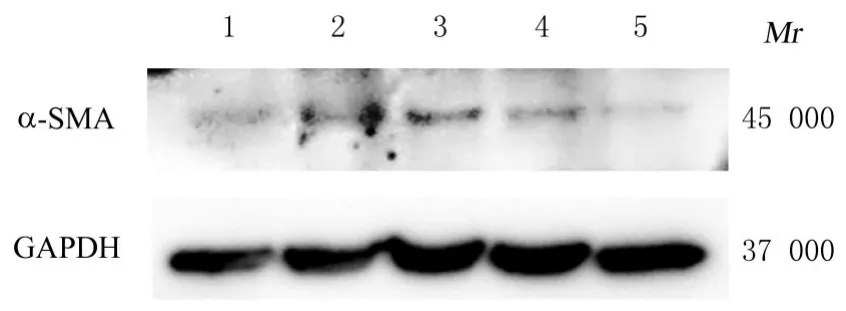
图1 Western blotting 法检测各组NIH3T3 细胞中α-SMA 蛋白表达电泳图Fig. 1 Electrophoregram of expression of α-SMA protein in NIH3T3 cells in various groups detected by Western blotting method
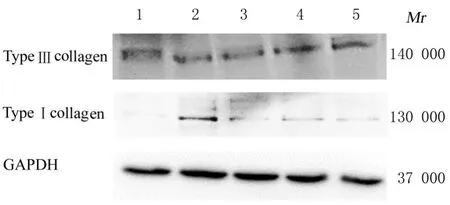
图2 Western blotting 法检测各组NIH3T3 细胞中Ⅰ型胶原蛋白和Ⅲ型胶原蛋白表达电泳图Fig. 2 Electrophoregram of expressions of type Ⅰcollagen and type Ⅲ collagen proteins in NIH3T3 cells in various groups detected by Western blotting method
表2 各组NIH3T3 细胞中α-SMA、Ⅰ型胶原蛋白和Ⅲ型胶原蛋白表达水平Tab. 2 Expression levels of α-SMA,type Ⅰ collagen,and type Ⅲ collagen proteins in NIH3T3 cells in various groups(n=3,±s)
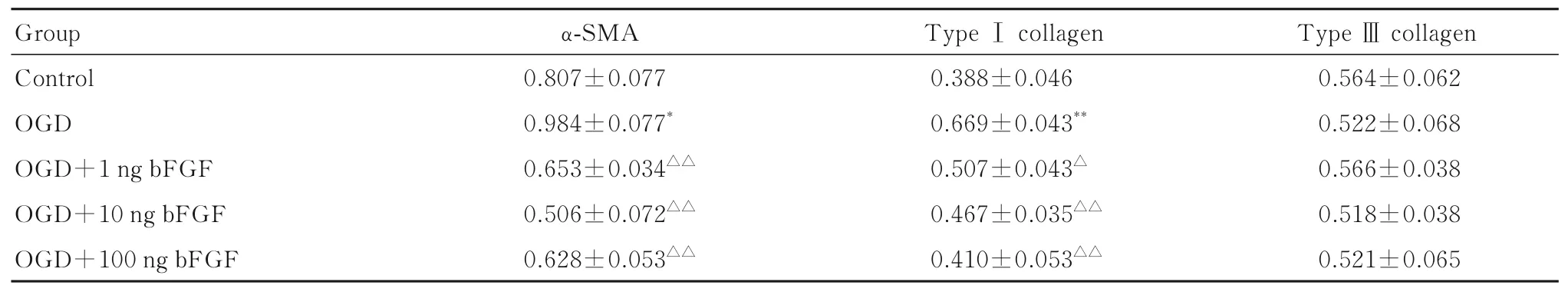
表2 各组NIH3T3 细胞中α-SMA、Ⅰ型胶原蛋白和Ⅲ型胶原蛋白表达水平Tab. 2 Expression levels of α-SMA,type Ⅰ collagen,and type Ⅲ collagen proteins in NIH3T3 cells in various groups(n=3,±s)
*P<0.05 , **P<0.01 vs control group; △P<0.05, △△P<0.01 vs OGD group.
?
2.3 各组NIH3T3 细胞中MDA 水平和LDH 及SOD 活性与对照组比较,OGD 组NIH3T3 细胞中MDA 水平和LDH 活性均升高(P<0.05),SOD 活性降低(P<0.05)。 与OGD 组比较,OGD+1 ng bFGF 组NIH3T3 细胞中MDA 水平和LDH 活性降低(P<0.05),SOD 活性升高(P<0.05)。见表3。
表3 各组NIH3T3 细胞中MDA 水平和LDH 及SOD 活性Tab. 3 Levels of MDA and activities of LDH and SOD in NIH3T3 cells in various groups(n=3,±s)
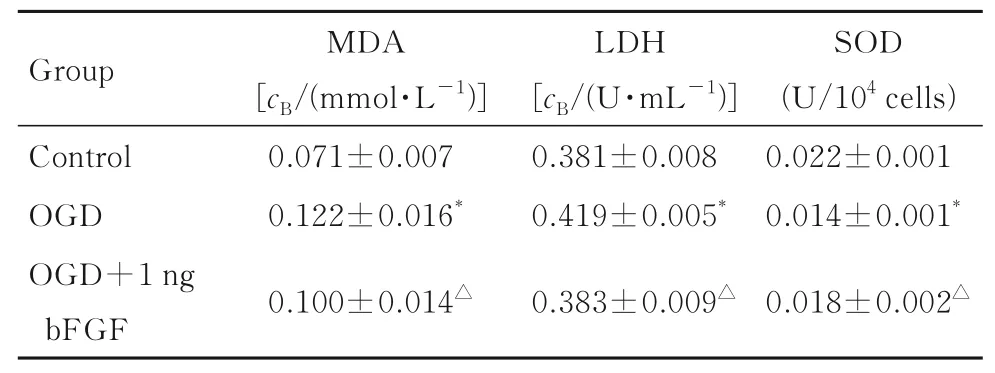
表3 各组NIH3T3 细胞中MDA 水平和LDH 及SOD 活性Tab. 3 Levels of MDA and activities of LDH and SOD in NIH3T3 cells in various groups(n=3,±s)
*P<0.05 vs control group;△P<0.05 vs OGD group.
?
2.4 负载bFGF 水凝胶体外释放速率在4 h 内,约10% bFGF 由水凝胶中释放;在12 h 内,约15% bFGF 由水凝胶中释放;在24 h 内,约21%bFGF 由水凝胶中释放。见图3。
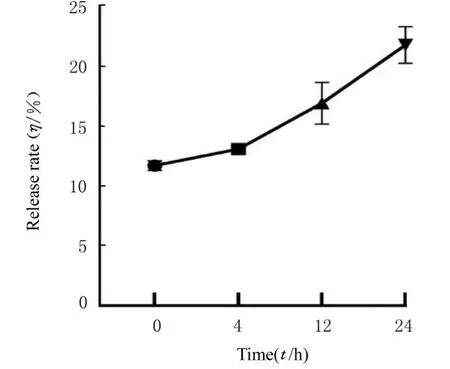
图3 ELISA 法检测负载bFGF 水凝胶体外释放率Fig. 3 In vitro release rate of loaded bFGF hydrogel detected by ELISA method
3 讨 论
水凝胶由于其高含水量、柔软的机械性能、良好的生物相容性和与生物组织的物理相似性可作为药物和细胞递送载体广泛应用于生物医学领域[17]。其不仅可以作为功能性物质的传递平台,还可以为受损的心室壁提供机械支持,提高心肌壁的顺应性。研究[18]证实:水凝胶有益于心肌梗死修复。本研究结果显示:水凝胶制备过程中使用明胶和戊二醛均对NIH3T3 细胞活性无明显影响。
心肌梗死发生后,成纤维细胞分化为成熟的肌成纤维细胞。肌成纤维细胞通过分泌大量ECM 蛋白维持心室壁的完整性[19]。但心肌过度纤维化和心肌内肌成纤维细胞的持续存在可导致左心室硬度增加,抑制心脏收缩。此外,过量ECM 的存在可能会降低心肌细胞氧气和营养可用性,可致使细胞死亡,从而导致不良的心脏重塑[20-21]。
成纤维细胞中Ⅰ型胶原蛋白和Ⅲ型胶原蛋白是ECM 的主要成分,其中Ⅰ型胶原蛋白提供具有拉伸强度的粗纤维,Ⅲ型胶原蛋白提供具有弹性的细纤维,Ⅰ型胶原蛋白和Ⅲ型胶原蛋白的不平衡沉积会导致心肌僵硬[22-23]。本研究结果显示:负载bFGF 的水凝胶抑制OGD 条件下成纤维细胞转化为肌成纤维细胞过程中标志蛋白α-SMA 的表达,并下调成纤维细胞Ⅰ型胶原蛋白的表达,提示该载药系统可能对心肌梗死的心肌纤维化具有一定的调控作用。
缺血性心脏病常伴有线粒体能量代谢受损和氧化应激[24]。LDH 在细胞氧化还原过程中具有重要作用,氧化应激会使细胞中LDH 活性明显升高[25];MDA 是脂质与氧自由基反应形成的产物,其水平代表脂质过氧化的程度;SOD 是一种生物体内清除超氧阴离子自由基重要的抗氧化酶,可以保护细胞免受氧自由基的损害。以上指标均为评估心肌梗死后氧化应激反应和细胞损伤的常用指标[26]。本研究结果显示:负载bFGF 的水凝胶可以明显改善OGD 条件下NIH3T3 细胞的氧化应激反应,可降低细胞上清中LDH 活性和MDA 水平,升高细胞中SOD 活性,对细胞具有保护作用。
综上所述,基于水凝胶载药系统在24 h 内可持续释放bFGF,对细胞发挥长效的保护作用,可在临床中避免多次手术干预,对患者的侵入性较小,进而可能增强bFGF 的治疗效果。
