小亚璃眼蜱吸血前后组织形态比较观察
2024-01-04李晓森罗亭祥杨德鹏石文玉张华聪艾则麦提艾合买提苏蓓琪玛合力亚马合木提胡政香呼尔查
李晓森,罗亭祥,杨德鹏,伍 军,石文玉,张华聪,艾则麦提·艾合买提,苏蓓琪,玛合力亚·马合木提,胡政香,呼尔查,3
(1. 新疆农业大学动物医学学院,新疆乌鲁木齐 830052;2. 新疆农业大学草业学院,新疆乌鲁木齐 830052;3. 新疆农业大学兽医学博士后流动站,新疆乌鲁木齐 830052)
小亚璃眼蜱(Hyalommaanatolicum)是一种具有重要医学意义的硬蜱,在我国主要分布于西北地区,其寄生宿主种类较多,包括骆驼、牛、马、绵羊等家畜[1]。小亚璃眼蜱是多种病原微生物的传播媒介,可传播多种人兽共患传染病,对畜牧业发展造成的经济损失居高不下[2]。
小亚璃眼蜱以宿主动物血液为唯一的营养来源,因此需要寄生在不同的宿主动物体表吸血生存[3]。该蜱须经过虫卵、幼虫、若虫及成虫4 个阶段来完成完整的生活史[4]。成虫阶段是小亚璃眼蜱最容易被识别的阶段,以每年的3—5 月多见,此时其主要寄生于骆驼、牛、羊等较大体形的牲畜体表[5]。硬蜱在宿主体表需要连续多天不间断吸血,经过慢速吸血期和快速饱血期后,体形迅速膨大,各组织器官形态也随之发生巨大变化[6]。本试验选择人工饲养的小亚璃眼蜱虫株进行组织切片形态观察,并首次采用糖原PAS 染色法观察了小亚璃眼蜱雌蜱在不同状态下的糖原分布情况,以期为了解吸血期硬蜱器官的变化提供重要参考。
1 材料与方法
1.1 材料
1.1.1 样品及试验动物 新西兰大白兔1 只,体质量2.1 kg,雌性,购自新疆医科大学实验动物中心。本试验所用的小亚璃眼蜱,为新疆农业大学动物医学学院在实验室条件下(气温25 ℃± 2 ℃、相对湿度85% ± 5%、光照周期15 h 昼/9 h 夜)保存的人工饲养虫株。整个试验过程均在新疆农业大学动物医院实验动物房内进行,动物房气温为25 ℃± 2 ℃,相对湿度为40% ± 10%,光照周期为15 h 昼/9 h 夜。试验兔在金属刷漆的兔笼中独立饲养,对其饲喂商品化兔粮,供应充足的凉开水。
1.1.2 小亚璃眼蜱样本准备 本试验所用的切片样本状态为饥饿、半饱血和饱血雌蜱。饥饿雌虫样本,为在实验室条件下饲养了6 个月未吸血的雌蜱;半饱血雌蜱(从叮咬吸血开始第5 天的雌性虫体)和饱血雌蜱(完全吸饱血后自行脱离宿主的雌性虫体),为在试验兔体表获得的寄生虫体。人工饲养过程如下:首先使试验兔熟悉饲养环境,在实验动物房饲养5 d,无应激反应后,在试验兔耳朵上固定透气材质的布料耳套[7];然后将在实验条件下人工饲养的成虫以2:1 的雄雌比例置于耳套内吸血,第5 天时取下半饱血雌蜱,第6~10 天时收集饱血雌蜱。
1.2 方法
1.2.1 组织切片制作 将待制作切片的虫体样本在实验室条件下保存24 h 后,置入Bouin 氏组织固定液中静置48 h,准备制作组织切片。首先将组织固定液中的饥饿、半饱血以及饱血雌蜱取出,用酒精梯度脱水除去雌蜱体内的水分;再将雌蜱置于二甲苯中透明化,将透明化的雌蜱置于溶化的石蜡中,放入溶蜡箱保温;待石蜡完全浸入后完成石蜡包埋,在切片机上完成不同状态雌蜱样本的冠状面组织切片。
1.2.2 PAS 糖原染色 糖原PAS 染色切片的制作步骤:将石蜡切片脱蜡,然后将切片放入二甲苯20 min,无水乙醇5 min,75%乙醇5 min,以自来水洗;将切片置于高碘酸染液中染色15 min,以自来水洗后再用蒸馏水洗两遍;将切片置入雪弗(Schiff)染色液中避光静置30 min,以流水冲洗5 min;将切片置入苏木素中染色1~3 min,以自来水洗,用1%盐酸乙醇水溶液分化数秒,以自来水洗,再用氨水溶液返蓝15 min,以自来水洗;将切片依次放入无水乙醇5 min,75%乙醇5 min,50%乙醇5 min,二甲苯5 min,以中性树胶封片。最后再将切片正置于光学显微镜Nikon Eclipse E100上,采用Nikon DS-U3 成像系统采集分析图片。
2 结果
2.1 整体切片观察
小亚璃眼蜱雌蜱整虫糖原PAS 染色结果(图1)显示,饥饿蜱体形与半饱血和饱血蜱相比明显偏小,糖原含量相对较低,而半饱血和饱血雌蜱体内糖原含量则较高。图1 以虫体尾部在左边,头部在右边的方式,展示了3 个样本的冠状面切片。整虫切片的样本显示出对称的组织器官形态。
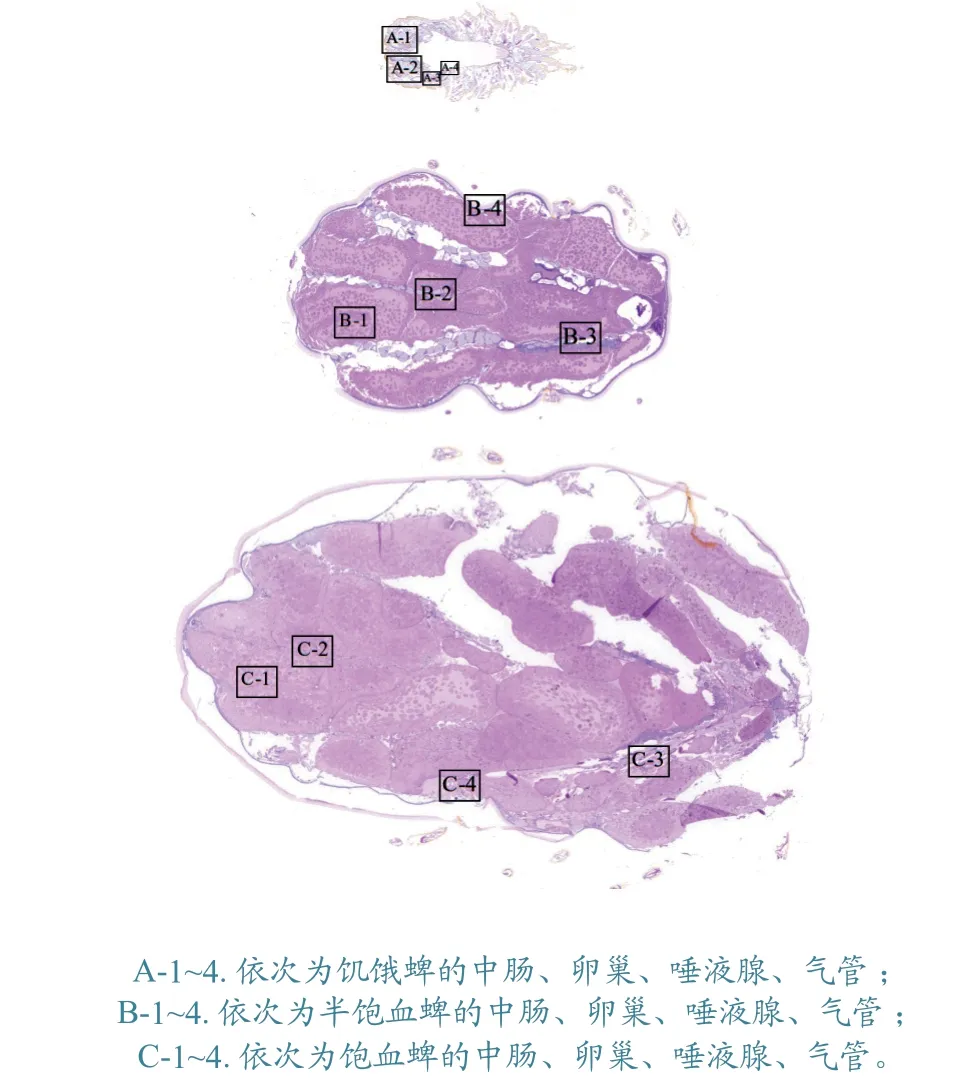
图1 小亚璃眼蜱雌蜱糖原PAS 切片整体对比观察结果
2.2 蜱类器官形态观察
2.2.1 中肠组织 局部组织器官放大画面显示,肠组织在饥饿蜱体内占比相对较小,中肠腔内容物较少,几乎没有红细胞可见,且中肠腔内未观察到脱离中肠壁的完整消化小体,糖原深染部位集中在中肠基底膜周围(图2-A);中肠在半饱血和饱血蜱体内明显膨大,占据蜱体内大部分体积,中肠腔内充满宿主血液细胞成分,同时有大量深染的消化小体游离于肠内容物中,中肠上皮细胞内含有大量糖原类深染物质(图2-B、C)。
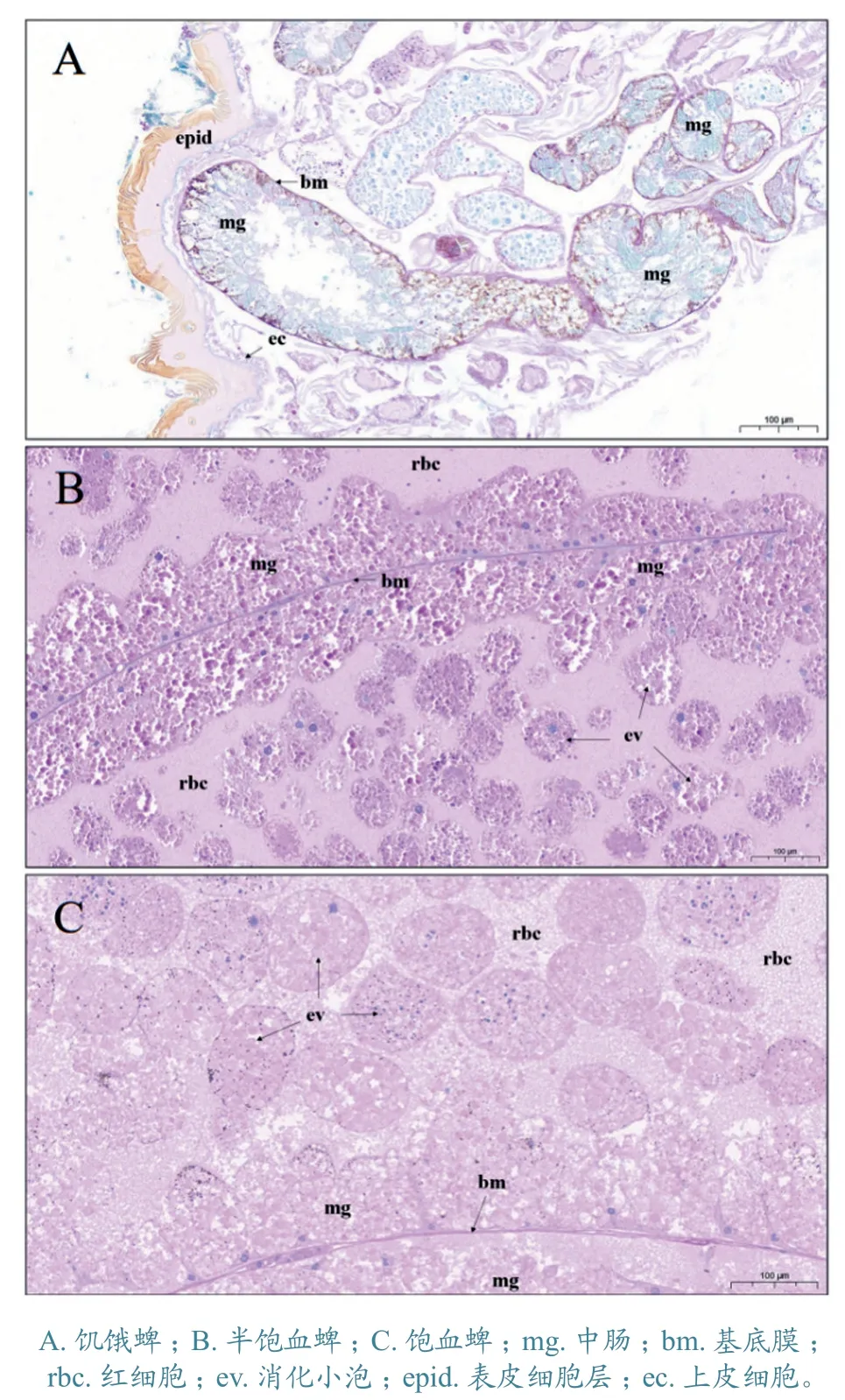
图2 小亚璃眼蜱雌蜱糖原PAS 切片中肠对比观察结果
2.2.2 卵巢组织 不同状态下雌蜱卵巢组织表面均含有深染的糖原物质。饥饿蜱卵巢较小(图3-A),半饱血与饱血雌蜱卵巢之间并未表现出明显的形态差异,饱血蜱的胚胎间距有所增大(图3-C)。半饱血和饱血蜱体内的组织器官间隙相比于饥饿蜱较小。
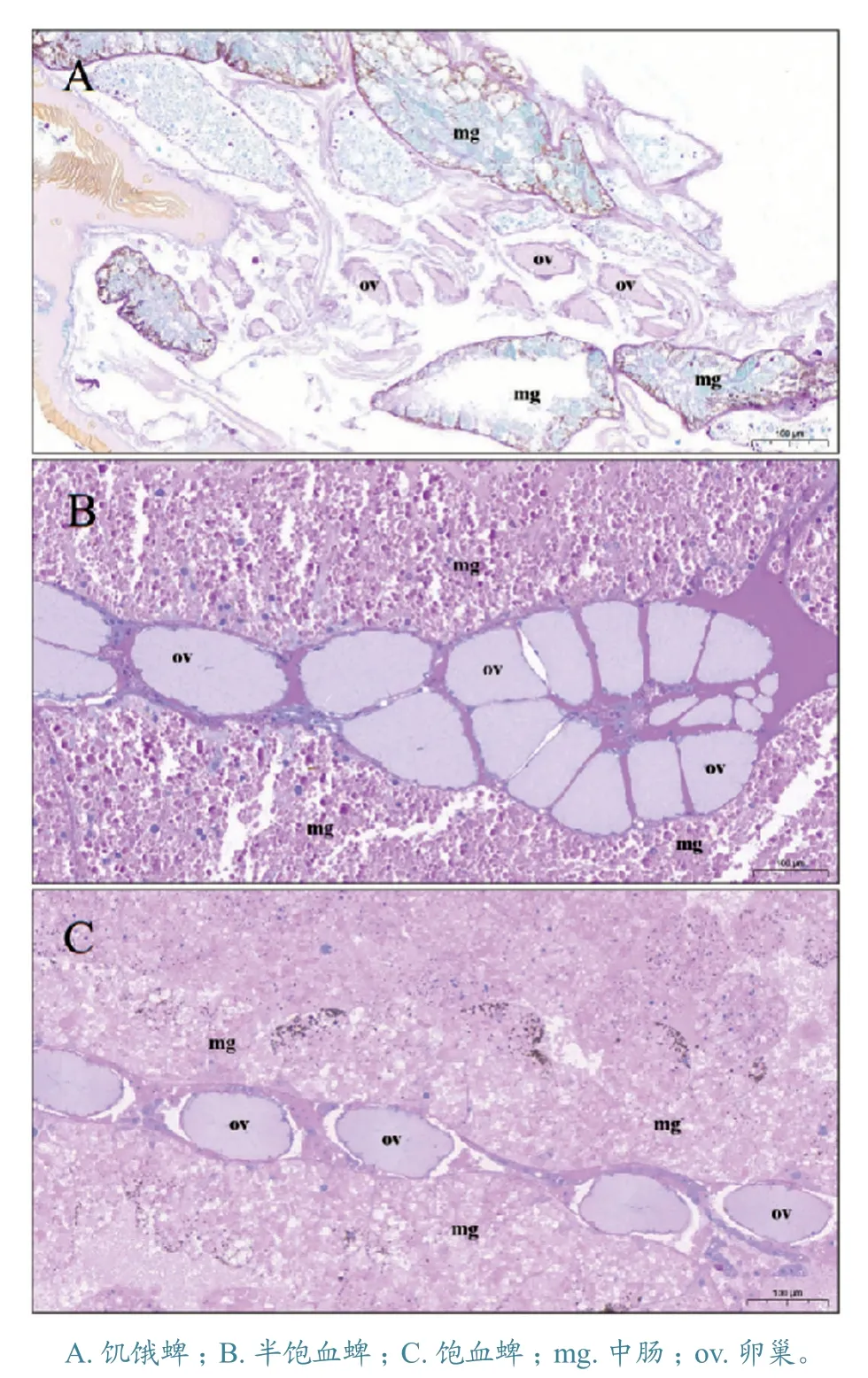
图3 小亚璃眼蜱雌蜱糖原PAS 切片卵巢对比观察结果
2.2.3 唾液腺 3 种状态雌蜱唾液腺的形态差异较大。饥饿蜱唾液腺较小,形态特征不明显(图4-A),半饱血蜱的唾液腺细胞清晰可见(图4-B),然而饱血蜱唾液腺细胞出现了萎缩,整体数量也明显减少(图4-C)。饥饿和半饱血蜱唾液腺周围糖原深染的组织较多,特别是半饱血蜱的唾液腺导管内出现密度较大的深染团块,且该深染形态也可从半饱血雌蜱整体切片的头部区域发现(图1-B)。

图4 小亚璃眼蜱雌蜱糖原PAS 切片唾液腺对比观察结果
2.2.4 气管 不同状态小亚璃眼蜱雌蜱气管部分的形态变化不大。气管主要集中在蜱体两侧靠近气门板的区域(图1)。饥饿蜱体内的气管密度较半饱血和饱血蜱大一些,气管形态均以圆形、半圆形和长管状呈现。糖原染色较其他组织较浅(图5)。

图5 小亚璃眼蜱雌蜱糖原PAS 切片气管对比观察结果
3 讨论
通过本次组织切片染色镜检观察,发现小亚璃眼蜱成蜱在不同状态下,其组织器官的形态差异较大。中肠组织在饥饿状态下萎缩,其肠壁基底膜周围存在较多糖原深染部位,但相比半饱血至饱血过程的雌蜱,其糖原物质远远不足,然而饥饿雌蜱体内最能体现能量物质的糖原主要集中在中肠周边。中肠染色切片另一突出特点是,消化小泡和中肠基底层部位出现棕色点状深染物质,推测该物质是蜱类消化宿主血液后残留的血红素结晶。研究[8]表明,篦子硬蜱(Ixodesricinus)血红素在HE 染色切片中呈散在的点状深棕色汇集。本试验切片观察结果显示,血红素以棕色点状汇集于中肠内。蜱类基因组研究[9]表明,硬蜱不仅缺少合成血红素的相关基因,还缺乏血红素加氧酶(heme oxygenase,HO)基因,而HO 是分解血红素的关键功能蛋白。因此,血红素无法被硬蜱进一步分解,只能在中肠内以结晶的形式汇集。蜱类需要将宿主血液消化后产生的多余血红素通过排泄或者其他途径排出体外。
在不同状态下,雌蜱唾液腺的形态变化较大。经过6 个月未吸食血液,饥饿雌蜱体内储存的脂肪和糖类大量消耗,虫体形态从饱满钝圆变为棱角突出,腹部向背部凹陷,从而在切片中心位置出现了较大空白处。然而通常情况下,硬蜱唾液腺分布在虫体背部以下的体腔内。本次饥饿蜱切片中唾液腺组织并不明显,推测原因可能是冠状面组织切片的位置偏向虫体腹侧所致。唾液腺组织在半饱血蜱体内非常发达,蜱类在这一时期仍需要持续从宿主体内大量吸食血液,其唾液腺导管内含有的生物活性物质经口器注入叮咬部位,从而使宿主动物被叮咬处血液凝固性降低,炎症反应被抑制,从而有利于蜱虫持续吸血。此外,蜱类可有效利用唾液腺分解获得所需的营养物质[10]。相比于半饱血蜱,饱血蜱的唾液腺组织出现了一定程度萎缩。有研究[11]表明,雌蜱饱血后唾液腺细胞凋亡相关基因的转录水平显著上升,导致唾液腺细胞发生凋亡从而出现萎缩。
在半饱血和饱血状态下,小亚璃眼蜱雌蜱气管和卵巢未表现出明显的形态差异。雌蜱饱血后不久(通常为5~15 d)将产卵。试验[12]表明,产卵量可达雌蜱饱血体质量的80%,产卵过程需要消耗大量的营养和能量。本试验取样时间为雌蜱脱离宿主体表后24 h,在这一时间点,饱血蜱和半饱血蜱卵巢并未出现显著形态差异,提示卵巢发育变化仍需更多动态试验观察。相比其他状态,饥饿蜱卵巢则明显偏小,这是由于蜱类长期潜伏在自然环境中,需要将营养和能量用于适应环境,待过冬后再继续完成体表寄生[13]。
综上,本试验对小亚璃眼蜱雌蜱糖原PAS 组织切片观察发现,糖原物质主要集中在蜱虫的唾液腺细胞、唾液腺导管、中肠上皮细胞、卵巢上皮细胞层以及吸血后蜱血淋巴细胞。本试验可为进一步研究蜱类营养代谢与防控提供研究基础。
