基于 HPLC 指纹图谱和化学模式识别的黄芩汤制备过程质量评价研究
2024-01-03袁星陈卓平何沁蔓郑夏杰郑勇凤
袁星,陈卓平,何沁蔓,郑夏杰,郑勇凤
中药复方制剂是以中医理论为基础,按照“君臣佐使”的组方原则,由两味及以上药组成,根据临床用药需求,匹配适宜的制备及成型工艺制作而成的一类制剂。中药复方不仅一定程度体现了中医辨证施治的思想,代表了传统中医药学的精华,还融合了现代生产技术,已成为中药现代化发展中不可或缺的一部分。但因药味繁多、成分复杂、有效成分种类和含量不够清晰,对中药复方的质量控制和评价研究随应用的日益广泛而愈发重要。目前中药复方的质量评价存在标准不科学、溯源性差等技术瓶颈[],且制剂过程是影响复方质量评价的重要环节。如何做到“遵古而不泥古”,即既要以古代医籍文献的记载为基础,同时还需考虑现代制剂的科学性和合理性,实现古法制备与现代工艺之间的转化,是中药复方质量研究的关键[]。指纹图谱的发展、“一测多评”方法的应用、中药质量标志物的提出,建立以关键质量属性辨识为核心的过程质量控制体系,为中药复方制剂的质量评价带来了新思路。
黄芩汤,始载于张仲景《伤寒论》,由黄芩、芍药、甘草、大枣4味药组成,仲景原文记载以“黄芩三两、甘草(炙)二两、 芍药二两、大枣十二枚,水一斗(今2000毫升),煮取三升(今600毫升),去滓”制得,具有清热止痢、和中止痛之功效[],是治疗热性痢疾的祖方。现临床广泛用于溃疡性结肠炎[]、胃癌[]、肝癌[1]、结肠癌[]等消化系统疾病的治疗,组方精简,效专力宏,具备较好的开发前景。目前,关于黄芩汤的研究多集中于药效学机制研究和临床疗效观察,其制备过程的质量控制研究报道较少。故本文在古籍溯源和遵古宜今的思路下,建立3组各12批不同制备方法、不同产地批次黄芩汤样品的指纹图谱,结合化学模式识别探讨煎煮次数和冷冻干燥对黄芩汤质量的影响,并挖掘影响其质量的标志性差异物质,为其制备过程质量控制的指标选择和二次开发奠定基础。
1 材料
1.1 仪器
LC-16岛津高效液相系统(赛默飞世尔科技有限公司);DL-720D数控超声波清洗器(上海之信仪器有限公司);SCIENTZ-10N冷冻干燥机(宁波新芝生物科技有限公司);UPK-I-10T优普系列超纯水器(四川优普超纯科技有限公司);SHB-IIIA循环水式真空泵(北京中兴伟业有限公司);DD5台式大容量低速离心机(湖南赫西仪器装备有限公司)。
1.2 试药
对照品黄芩苷(批号wkq21030302,质量分数≥98%),黄芩素(批号wkq21030203,质量分数≥98%),芍药苷(批号wkq21041203,质量分数≥98%),甘草苷(批号wkq21021901,质量分数≥98%),甘草酸(批号wkq21012606,质量分数≥98%);乙腈、磷酸为色谱纯,购自西格玛奥德里奇贸易有限公司。
试验药材购自康美药业有限股份公司,4种药材经成都中医药大学中药鉴定方向刘晓芬老师鉴定,黄芩为唇形科黄芩属黄芩Scutellaria baicalensis Georgi.的干燥根经净制和切制而成,白芍为毛茛科芍药属芍药Paeonia lactiflora Pall.的干燥根经净制和切制而成,甘草为豆科甘草属甘草Glycyrrhiza uralensis Fisch.的干燥根和根茎经净制、切制和蜜炙而成,大枣为鼠李科枣属枣Ziziphus jujuba Mill.的干燥成熟果实经净制而成。经4因素3水平的正交试验设计,得到12批药材混合投料情况如表1所示。黄芩经净制和切制而成黄芩片,白芍经净制和切制而成白芍片,甘草经净制、切制和蜜炙而成甘草片,大枣经净制而成大枣饮片,用于煎煮。

表1 黄芩汤药材混合投料批次表Table 1 Batch table of Huangqin Decoction pieces
2 方法与结果
2.1 溶液制备
2.1.1 供试品溶液的配制 参考《伤寒论》原文记载及近现代度量衡换算(黄芩:芍药:甘草:大枣=3∶2∶2∶2),称取饮片黄芩30 g、芍药20 g、甘草20 g、大枣20 g、加8倍量水浸泡30 min。查阅文献[7-10],按下述操作制备3组各12批黄芩汤供试品溶液。
A组(一次煎煮组):沸腾后武火煎煮25min,转文火煎煮35min,滤过后取滤液4 mL以超纯水稀释到10mL(生药含量0.2 g/mL),4000 r/min离心20 min,按表1饮片产地批号组合制得A1~A12,共12批次样品。
B组(二次煎煮组):沸腾后武火煎煮25 min,转文火煎煮35 min,滤过,滤液备用。重复上述煎煮操作,取二煎滤液液4 mL与一煎滤液4 mL混合,加超纯水稀释定容至10 mL(生药含量0.2 g/mL),4000 r/min离心20 min,按表1饮片产地批号组合制得B1~B12,共12批次样品。
C组(冷冻干燥组):取B组试液5 mL于10 mL西林瓶中预冻48 h,于冷冻干燥机中冻干48 h。冻干粉加超纯水溶解并定容至5 mL(生药含量0.2 g/mL)。上清液0.22 μm微孔滤膜滤过,与B1~B12对应制得C1~C12,共12批次样品。
2.1.2 对照品溶液的配制 精密称取黄芩苷、黄芩素、芍药苷、甘草苷、甘草酸对照品,于5个容量瓶中,加甲醇配制成质量浓度依次为2.013、0.608、0.448、0.413、0.429 mg/mL的对照品储备液。
2.1.3 混合对照品溶液的配制 取2.1.2项下5种对照品储备液适量,加入10 mL容量瓶中,加甲醇使溶解并稀释至刻度,摇匀,制得含黄芩苷、黄芩素、芍药苷、甘草苷、甘草酸质量浓度依次为0.4026、0.1520、0.0896、0.0826、0.0858mg/mL的混合对照品溶液。
2.2 色谱条件及系统适应性实验
色谱柱为Diamonsil C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.1%磷酸水溶液,梯度洗脱:0~13 min,6%~17%乙腈;13~15 min,17%~20%乙腈;15~50 min,20%~30%乙腈;50~60 min,30%~38%乙腈;60~70 min,38%~45%乙腈;70~80 min,45%~70%乙腈;体积流量为1.0 m L/min;柱温为35 ℃;进样量为20 μL;检测波长276 nm。
取“2.1.1”项下供试品溶液、“2.1.3”项下混合对照品溶液及溶剂各适量,分别按“2.2”项下色谱条件进样20 uL测定,记录色谱图。5个成分的色谱峰分离度均较好,空白溶液无干扰,理论塔板数大于3000,系统适应性良好,结果见图1。
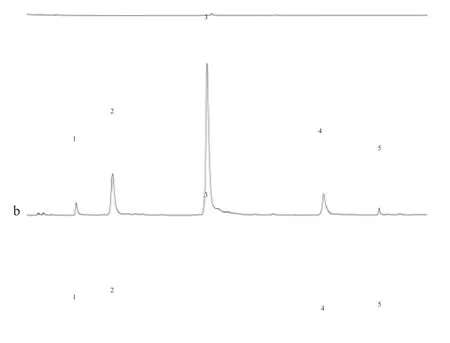
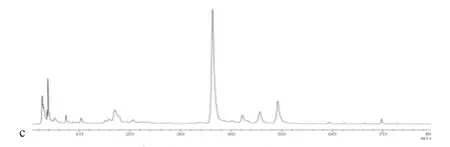
图1 a:空白溶剂对照 b:混合对照品 c:样品1:芍药苷 2:甘草苷 3:黄芩苷 4:黄芩素 5:甘草酸Fig 1 A: Blank solvent control B: Mixed reference C: sample1: paeoniflorin 2: licorice 3: baicalin 4: baicalein 5: glycyrrhizic acid
2.3 方法学考察
2.3.1 精密度实验 取第1批次药材组合制得的同一供试品溶液按“2.2”项下色谱条件连续进样,测定6次。记录峰面积和保留时间,6次连续实验测得各峰保留时间及峰面积的RSD均小于1.00%,表明仪器精密度良好。
2.3.2 稳定性实验 取第1批次药材组合制得的同一供试品溶液按“2.2”项下色谱条件分别在0、2、4、8、16、24 h进样,测得各时间点各峰保留时间及峰面积的RSD均小于2.00%,表明供试品在24h内稳定。
2.3.3 重复性实验 取第1批次药材组合制得的供试品溶液6份,按“2.2”项下色谱条件进样,6份平行制备样品测得各峰保留时间及峰面积的RSD均小于2.00%,表明该方法具有可重复性。
2.4 指纹图谱的建立及相似度计算
按“2.1.1”项下方法制备3组各12批次共36个样品的供试品溶液,按“2.2”项下色谱条件于高效液相色谱系统中进样检测,生成色谱图分组导入“中药色谱指纹图谱相似度评价系统(2012版)”软件。A、B、C各组样品指纹图谱信息如图2。采用中位数法,时间窗设置为 0.1 min,经多点校正和Mark峰匹配生成对照图谱,共标定13个共有峰。通过与混合对照品色谱比对,指认5个特征峰,分别为4号峰(芍药苷)、5号峰(甘草苷)、8号峰(黄芩苷)、12号峰(黄芩素)、13号峰(甘草酸)。以出峰稳定分离度较好的黄芩苷峰为参照,计算各共有峰峰面积平均RSD值介于8.79~19.78(表2)。以生成的对照图谱为比照,计算各图谱相似度介于0.881~0.997(表3),各共有峰平均RSD值,不同产地批次黄芩汤样品之间质量存在差异但不显著。计算各组共有峰总面积,B组与C组面积相近,且均大于A组。B组与A组质量差异较大,而与C组差异较小,说明冷冻干燥过程较好地保留了主要物质群(表4)。
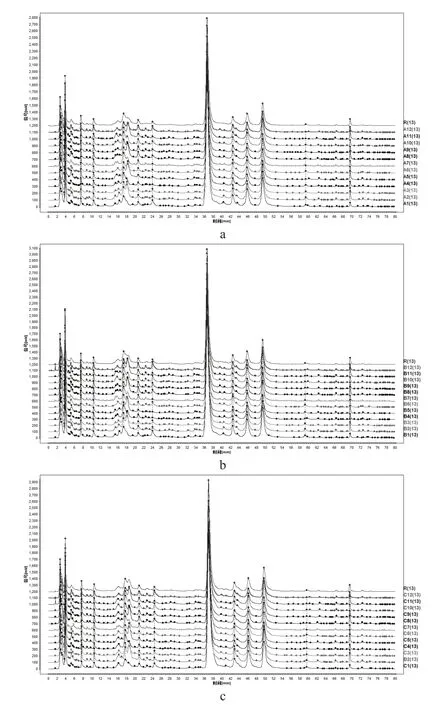
图2 a:一次煎煮组 b:二次煎煮组 c:冷冻干燥组Fig 2. A: one-time decocting group B: Two-time decocting group C:Freeze-drying group

表2 黄芩汤3组样品共有峰平均峰面积RSD值Table 2 Average peak area RSD values of common peaks of the three groups of samples in Huangqin Decoction
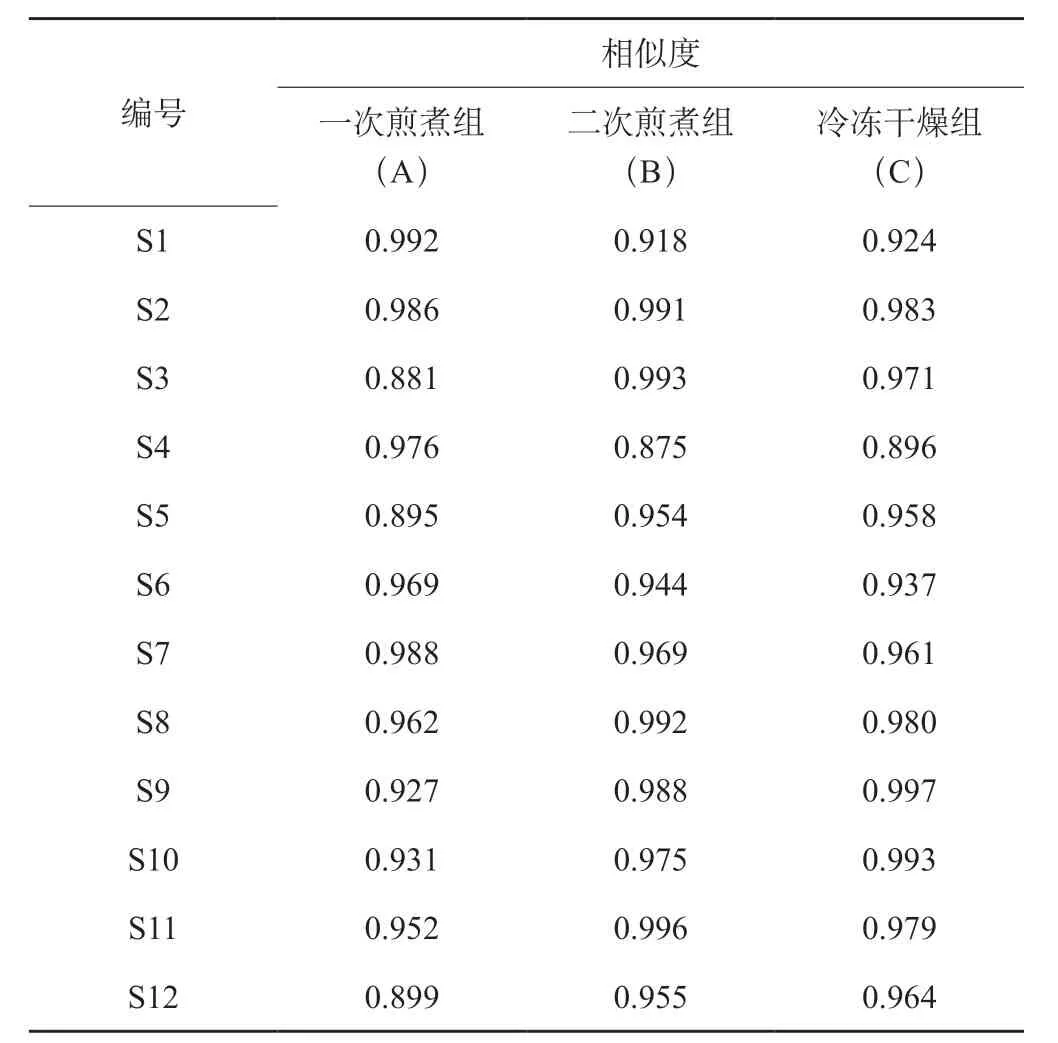
表3 黄芩汤3组样品指纹图谱相似度计算结果Table 3 Fingerprint similarity calculation results of three groups of samples of Huangqin Decoction
表4 黄芩汤3组样品共有峰面积总和Table 4 Total peak areas of three groups of samples of Huangqin Decoction
2.5 化学模式识别研究
2.5.1 系统聚类分析(HCA) 将黄芩汤样品共有峰面积量化处理后,生成36×13的阶数据矩阵,导入SPSS 24.0软件,采用组间连接方法,以平方欧氏距离为测量区间,Z得分作为标准化转换值,对A、B、C 3组36个样品进行系统聚类分析,结果以谱系图表示(图3)[]。当平方欧氏距离为25时,36批黄芩汤样品可分为2类,A1~A12为一类,B1~B12、C1~C12为一类,说明煎煮次数对质量的影响大于药材产地批次的影响。

图3 系统聚类分析谱系图Fig 3 Pedigree of systematic cluster analysis
2.5.2 主成分分析(PCA) 将样品13个共有峰面积阶数据矩阵导入SPSS 24.0软件,检验KMO值为0.805,大于0.5,模型可靠,各变量相关性好。基于特征值大于1作降维分析,提取3个主成分,输出碎石图(图4)。第一、二、三主成分斜率较大,提取的主成分可最大程度地代表黄芩汤样品的整体质量;以最大方差法旋转相关矩阵,输出旋转后矩阵图及各变量对因子贡献率图表(表5、6,图5)。3个主成分的累积方差贡献率为81.831%,可以代表指纹图谱中13个共有峰的大部分信息。主成分1主要反映5、8、9、10号峰的信息,主成分2主要反映1、2、3、4、6、13号峰的信息,主成分3主要反映7、11、12号峰的信息。量化数据导入SIMCA 14.1软件,建立PCA模型并绘制主成分PCA得分图(图6),分类结果与主成分分析一致[]。
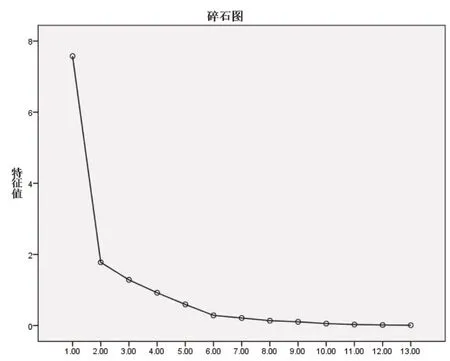
图4 公因子碎石图FIG. 4 Common factor lithotripsy diagram
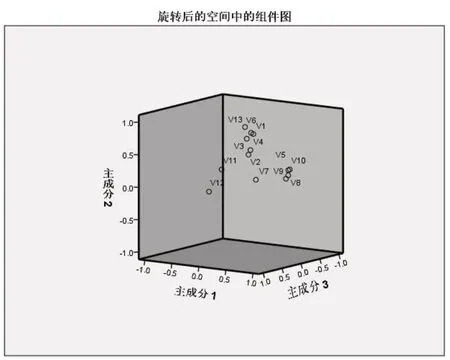
图5 旋转后主成分空间图Fig. 5 Principal component space map after rotation
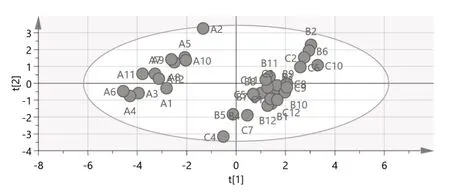
图6 PCA得分图Fig. 6 PCA score
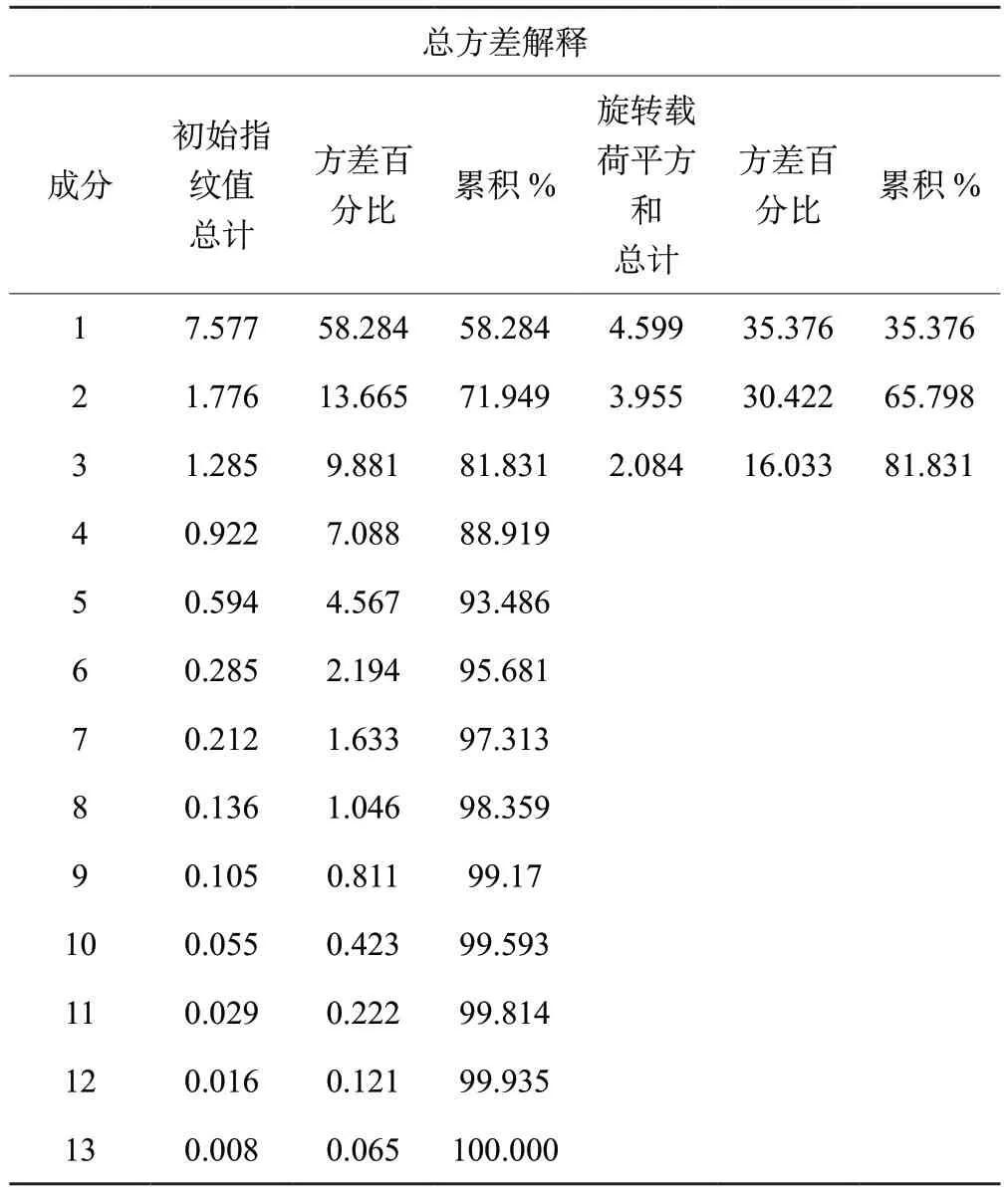
表5 主成分指纹值及方差贡献率Table 5 Principal component fingerprint value and variance contribution rate
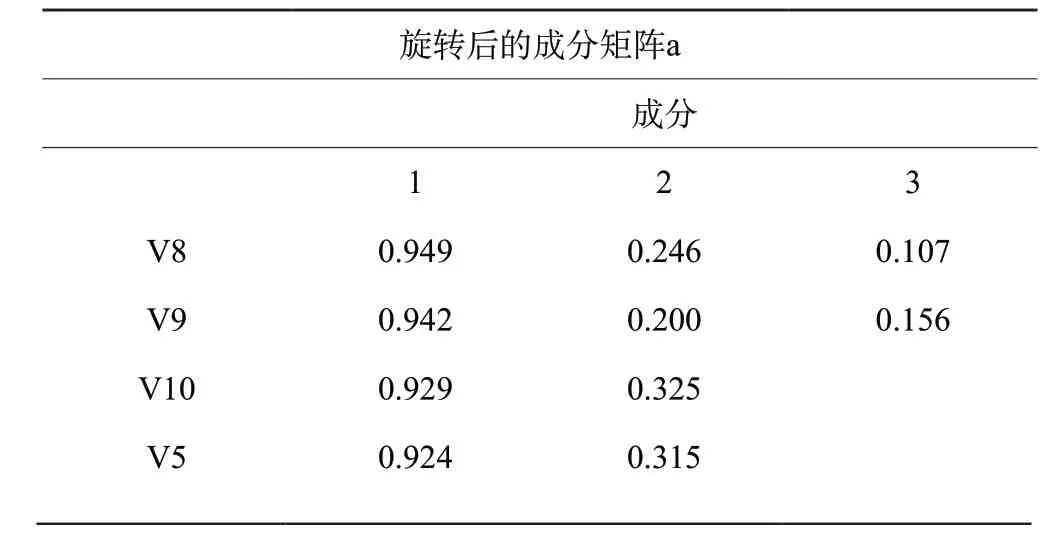
表6 旋转后因子载荷矩阵Table 6 Factor loading matrix after rotation
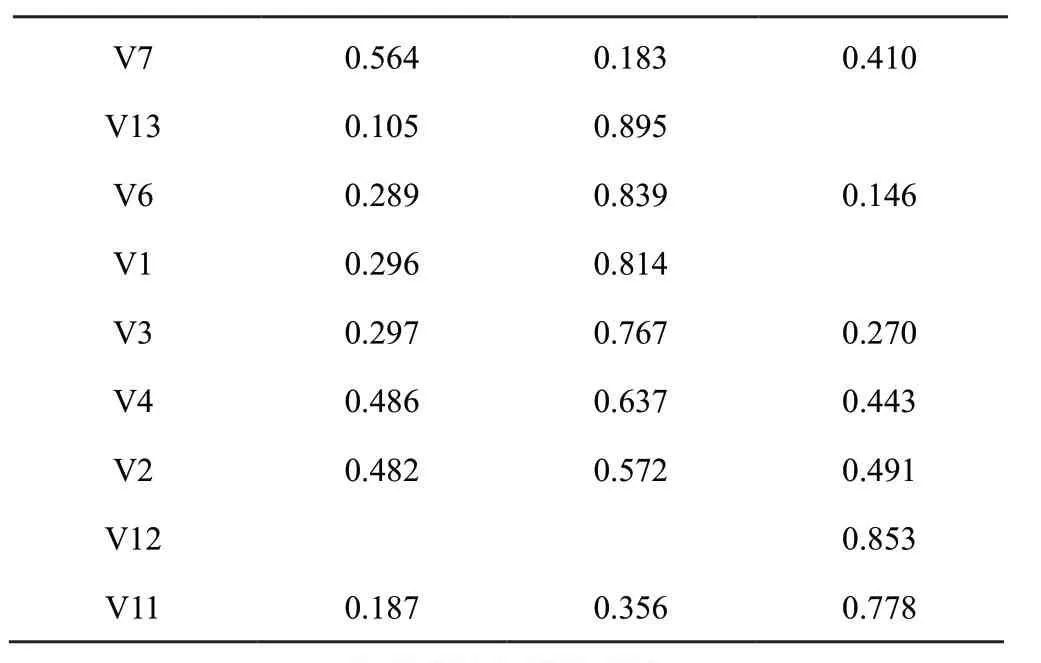
V70.5640.1830.410 V130.1050.895 V60.2890.8390.146 V10.2960.814 V30.2970.7670.270 V40.4860.6370.443 V20.4820.5720.491 V120.853 V110.1870.3560.778
2.5.3 偏最小二乘法-判别分析(PLS-DA) 将样品共有峰面积阶数据矩阵导入SPSS 24.0软件,建立PLS-DA模型[]。累计模型预测能力参数Q2=0.564,大于0.5;累计解释能力参数R 2 X=0.7 4 2、R2Y=0.669,大于0.5,模型稳定可靠。输出PLS-DA得分图级载荷图(图7、8),36个黄芩汤样品被分为2类,其中B1~B12和C1~C12为一类,A1~A12为一类,分类结果与HCA及PCA分析一致。变量重要性投影(VIP)值是筛选差异性成分的重要指标,VIP值越高,成分对组间差异的影响越大。VIP值>1的共有峰有4个(图9),其大小相近,依次为10号峰、5号峰(甘草苷)、8号峰(黄芩苷)、9号峰,说明这4种成分可能为引起黄芩汤样品组间差异及质量稳定性差异的主要因素,在制备过程中应重点关注。
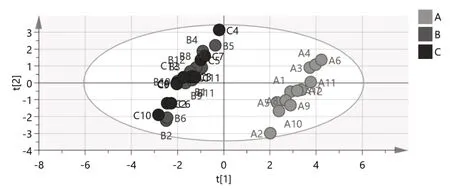
图7 PLS-DA得分图Fig7 PLS-DA score diagram
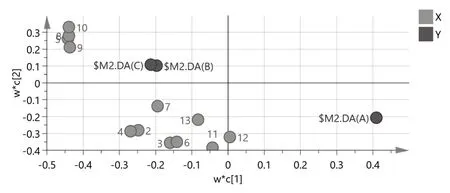
图8 PLS-DA载荷图Fig. 8 PLS-DA loading diagram

图9 变量重要性投影图Fig 9. Variable importance projection
2.5.4 综合得分评价 以提取得的3个主成分为新变量,以综合得分表达式
综合得分=58.284/81.831*FAC1_1+13.665/81.831*FAC2_1+9.881/81.831*FAC3_1,
得到36批样品综合得分排序表(表7)。B组及C组整体得分高于一次煎煮组[]。提示黄芩汤在制备过程中煎煮2次较为适宜,且冷冻干燥能较好地保留煎液中的有效成分。

表7 样品综合得分排序表Table 7 Sample comprehensive score ranking table

C41.21084-1.23108 -0.601780.588 B41.01162-0.62363 -0.338310.589 B120.8975-0.15914 -0.319170.5710 B60.42318-0.167842.429980.5711 C80.723880.7463-0.634110.5612 C90.788920.40054-0.627430.5513 C30.71659-0.342510.426790.514 C20.377350.956670.174840.4515 C70.81093-0.19649 -0.822150.4516 B90.63280.35026-0.52790.4517 B20.145341.159651.096280.4318 B50.80529-0.39115 -0.856220.419 B80.608780.50128-1.062440.3920 B110.241381.68865-1.075390.3221 C110.264841.60843-1.12770.3222 C50.532830.43508-1.129170.3223 B70.54240.19189-0.896190.3124 A1-0.8363-1.092611.6175-0.5825 A10-1.264810.337980.69083-0.7626 A3-0.98609 -0.795230.17148-0.8127 A5-1.362050.90672-0.1336-0.8328 A12-1.184950.08717-0.07972-0.8429 A2-1.711520.792311.84871-0.8630 A4-1.08712 -0.727280.16942-0.8831 A8-1.378460.86587-0.38914-0.8832 A9-1.464490.520960.01699-0.9533 A6-1.19817-0.76130.11026-0.9734 A7-1.387870.29908-0.3999-0.9935 A11-1.485150.68983-0.77584-1.0436
3 讨论
课题组前期研究对比了分别以乙腈-0.1%磷酸、乙腈-0.5%磷酸、乙腈-1.0%磷酸作为流动相的实验结果,显示乙腈-0.1%磷酸的分离效果和峰形最佳;比较了不同柱温(30 ℃、35 ℃、40 ℃)对结果的影响,最终选定柱温为35 ℃;考察了不同波长(254 nm、260 nm、270 nm、276 nm、280 nm),结果显示检测波长为276 nm时,出峰数量多,峰面积大且峰形较好;并对分段梯度进行了优化以改善各成分的分离度。
煎煮次数是影响中药汤剂质量的关键因素之一。文献资料整理可知秦汉时期汤剂均为煎煮1次,至晋代《肘后备急方》始载二煎。黄芩汤出处《伤寒论》载汤剂102首,所有汤剂煎煮次数均为1次[]。而现代汤剂煎煮工艺中除具备特殊理化性质的药材外,则多为煎煮2次[]。《医疗机构中药煎药室管理规范》[2]及《方剂学》教材[]中建议每剂药煎煮2次,将头煎、二煎兑合服用。相关文献报道,一煎煎出率约为30%,二煎40-50%,两次合并约为70-80%[]。为了探讨二煎之法是否有违古人之意,能否提高有效成分在黄芩汤煎液中的溶出率,本研究对黄芩汤就一次煎煮及二次煎煮进行了比较,初步证实了二次煎煮的合理性及冷冻干燥法对二煎合并液成分的保留效果。诚然,在制备过程中影响复方质量的因素还有很多,如饮片炮制方法、煎煮时间等具体参数的优化、单煎与合煎的合理性比较、过滤与浓缩的方法选择等,后期将设置试验一一进行探讨。
指纹纹图谱相似性分析及峰面积RSD值计算显示产地对黄芩汤质量有一定影响,为今后黄芩汤制备的药材选择提供参考;聚类分析清晰将样品划为2类,冷冻干燥组及二次煎煮组同为一类,一次煎煮组单独为一类,故煎煮次数对黄芩汤的质量影响较产地更为直接;冷冻干燥组与二次煎煮组指纹图谱较高的相似度提示冷冻干燥对黄芩汤化学物质群的影响较小,故对贮藏时间有要求的前提下可优先选择冷冻干燥制备黄芩汤冻干粉备用。后续将进一步对比从饮片到煎液到冻干粉各成分的保留与损失。
PLS-DA是找出导致药材及复方质量差异因素的常用方法。本研究通过变量投影重要值筛选的4个差异标志物(5号峰、8号峰、9号峰、10号峰)因其特殊理化性质引起样品的批间差异,是影响黄芩汤质量稳定性的关键性成分,可作为黄芩汤制备过程质量评价的指标。其中,8号峰(黄芩苷)是方中君药黄芩抗炎、止泻、抑菌等药理作用的主要成分[],5号峰(甘草苷)则是甘草抗炎、保肝、调和诸药等药理作用的主要成分[]。根据中药质量标志物的基本条件“5要素”[](特有性、可测性、有效性、传递性、中医药理论关联性),初步可确定为黄芩汤的质量差异标志物,将结合血清药物化学、网络药理学等技术予以验证。因实验周期限制,未能明确9号峰及10号峰的化学成分信息。根据文献查阅及物质极性大小推测,可能为去甲汉黄芩素(9号峰)、千层纸素A-苷(10号峰)[],后续将采取UPLC-Q/TOFMS/MS等技术进一步辨识其质控关键成分。
近年来,我国颁布了《中华人民共和国中医药法》,形成了《古代经典名方目录》(第一批)《古代经典名方关键信息考证》《中药注册分类及申报资料要求》等代表性政策法规文件,进一步规范经典名方的研究。然而经典名方研发中制剂过程的质量控制等关键环节仍面临许多挑战。黄芩汤作为组方精炼、疗效明确、有一定现代研究基础的中药复方,具备经典名方再开发的潜力。然而其系统深入的研究较少、低水平重复的研究较多是黄芩汤制剂过程研究中存在的普遍现象。以质量控制为核心,以全过程质量控制为导向,以“精细制造”为宗旨,开展芍药基原考证和甘草饮片炮制研究,明确活性成分、关键质量属性和关键工艺参数,积极开展功效成分群相关研究,加强制剂安全性研究,以保证成药质量的均一、稳定、可控。
综上所述,本课题建立了黄芩汤的指纹图谱,结合化学模式识别研究与多成分含量测定对黄芩汤制备过程的质量控制与评价进行了初步探讨。课题组后期将对制备工艺的参数进行更具体的优化,完善本草考证、饮片炮制与量值传递研究,并结合血清药物化学、转录组学与代谢组学等进一步分析黄芩汤的关键质量属性。
