基于裁剪适配体的纳米金比色法用于金黄色葡萄球菌肠毒素A的可视化检测
2024-01-03崔丽伟常惟丹岳晓禹许文涛
崔丽伟,魏 荣,常惟丹,岳晓禹,许文涛,2,
(1.河南牧业经济学院食品与生物工程学院,河南 郑州 450046;2.中国农业大学营养与健康系,食品精准营养与质量控制教育部重点实验室,北京 100191)
金黄色葡萄球菌肠毒素A(staphylococcal enterotoxin A,SEA)所引起的食物中毒事件频发,是影响食品安全和人类生命安全的重大隐患。当食品中SEA的含量超过18 μg/100 g时,会引起呕吐、腹泻等症状,严重时会导致休克。据报道,2017—2020年间我国有15.2%的食物中毒事件是由金黄色葡萄球菌肠毒素造成[1-3]。因此,实现SEA的快速定量分析检测极为重要,是保障食品安全的一道重要防线。
现有的SEA检测方法主要有分子生物学[4-5]、免疫学[6-7]、色谱法[8-9]、生物传感器[10-12]等。这些方法均可以实现SEA的定量分析测定,但大多具有样品前处理繁琐、易出现假阳性、测定成本高、测定时间长、需要昂贵的仪器和专业技术人员等局限性。近年来,适配体由于其具有易合成、成本低的显著特点,其作为识别原件的生物传感器受到广大研究者的青睐。核酸适配体是与靶标具有高特异性、高亲和力的单链DNA或RNA,常通过指数富集的配基系统进化技术(systematic evolution of ligands by exponential enrichment,SELEX)筛选获得,但所得到的适配体往往序列冗长,存在无效碱基,出现合成成本增加、亲和力低等问题,所以还需进一步优化以满足分析测定需求[13-14]。常见的适配体优化策略主要有截短、突变和化学修饰,其中,截短为适配体优化的首选策略。为了确定截断后的序列与靶标具有较高的特异性、亲和性和稳定性,常常根据适配体的二级结构进行反复实验。有研究显示,利用分子模拟的方法能够直接获得结合位点,从而特异性地针对结合位点进行截短或突变优化[15-17]。例如,颜志超等[18]在分子模拟指导下对SELEX筛选所得的河鲀毒素核酸适配体进行连续优化,得到了亲和力较高的河鲀毒素适配体。Hu Bo等[19]利用分子模拟研究DNA适配体与海葵毒素的结合机制,并获得了较其他SELEX筛选结果亲和力更高的适配体。
本研究拟利用分子对接和分子动力学模拟的方法对SEA适配体进行截短指导和结果预测,再利用纳米金显色的方法验证模拟结果,以优化得到亲和力高、稳定性好、特异性强的SEA适配体,将其作为分子识别原件,构建一种可视化的SEA快速检测分析方法。
1 材料与方法
1.1 材料与试剂
猪肉购自当地超市。
氯金酸四水合物、柠檬酸三钠、氯化钠(均为分析纯)国药集团化学试剂有限公司;SEA、肠毒素B(staphylococcal enterotoxin B,SEB)、肠毒素C(staphylococcal enterotoxin C,SEC)由本实验室提供;黄曲霉毒素B1(aflatoxin B1,AFB1)、玉米赤霉烯酮(zearalenone,ZEN)、赭曲霉毒素(ochratoxin A,OTA)青岛普瑞邦生物工程有限公司。
适配体均由生工生物工程(上海)股份有限公司合成,Apt1:5′-ATCTGCTGACGTTGGTCGTCATTG GAGTATC-3′;Apt2:5′-AACGTCAGCATCTGCTG ACGTTGGTCGTCATTGGAGTATC-3′;Apt3:5′-CG TCAGCATCTGCTGACGTTGGTCGTCATTGGAGTA TC-3′;Apt4:5′-CCTAACCGATATCACACTCACAG TATACCGCTCCACCAGTGTGATATCGGGATCTGC TGACGTTGGTCGTCATTGGAGTATC-3′[20];Apt5:5′-ATCTGCTTTGGTCGTCATTGGAGTA-3′;Apt6:5′-ATCTGCTTTGGTGTATTGGAGTA-3′。
1.2 仪器与设备
UV-1900PC紫外-可见光分光光度计 上海美析仪器有限公司;PL-9602G酶标仪 北京普朗新技术有限公司;HR-T16MM台式高速冷冻离心机 湖南赫西仪器装备有限公司。
1.3 方法
1.3.1 分子对接模拟
对核酸适配体的结构建模,适配体的二级结构通过IDT网站(https://sg.idtdna.com)进行预测,设置折叠温度为25 ℃,离子条件为50 mmol/L Na+溶液。选择能量最小的二级结构导入RNA Compser在线预测网站(http://rnacomposer.ibch.poznan.pl),将胸腺嘧啶改为尿嘧啶后生成RNA三级结构,随后将其导入分子可视化程序(Visual Molecular Dynamics,VMD)软件中,将尿嘧啶改为胸腺嘧啶,从而得到适配体的三级结构。同时,从蛋白质数据库(Protein Data Bank,PDB)中获取SEA晶体结构(ID:1ESF),随后使用HDOCK Web服务器(http://hdock.phys.hust.edu.cn/)进行分子对接,适配体为受体,SEA为配体,对接完成后,选择能量最稳定的复合物,使用GROMACS软件进行分子动力学模拟。分子动力学自发结合模拟方法可以预测适配体与SEA的结合区域。选择蛋白质/核酸通用力场,Tip3p水模型,复合物置于水立方体中心,水立方体表面距离复合物最小距离为10 Å,先进行预平衡,再进行成品模拟,模拟时间为10 ns。动力学结束后,修正复合物运动轨迹后,计算复合物分子模型的均方根偏差(root mean square deviation,RMSD)以评估构象稳定情况[14,19,21]。
1.3.2 纳米金显色分析
采用柠檬酸钠还原氯金酸法制备纳米金[22]。向每个酶标板中分别加入50 μL金纳米粒子溶液,再加入50 μL 0.3 μmol/L的适配体溶液,在酶标板振荡器中以37 ℃孵育10 min;加入50 μL不同质量浓度的SEA溶液,37 ℃孵育10 min;最后加入25 μL 0.3 mol/L的氯化钠溶液,37 ℃显色5 min。使用紫外分光光度计进行光谱扫描,扫描波长在480~700 nm之间,记录其在650 nm波长处与520 nm波长处吸光度的比值(A650nm/A520nm),同时以无菌水代替不同质量浓度的SEA溶液,做空白实验,扣除空白后,吸光度比值记作ΔA650nm/A520nm。
1.3.3 实验条件的优化
为了提高方法的准确度以及灵敏度,在SEA质量浓度为250 ng/mL时,采用单因素试验分别测定盐溶液浓度(0.1、0.15、0.2、0.25、0.3、0.35、0.4 mol/L)、适配体浓度(0.05、0.1、0.2、0.3、0.4、0.5 μmol/L)、反应时间(2、4、6、8、10、12、14 min)对ΔA650nm/A520nm的影响,获得最佳的反应体系。
1.3.4 特异性实验
为了验证本方法检测SEA的特异性,分别选用质量浓度均为100 ng/mL的SEB、SEC、AFB1、OTA和ZEN进行特异性验证,SEA质量浓度为100 ng/mL。操作同1.3.2节,将SEA分别用上述毒素代替。
1.3.5 实际样品检测
取25 g搅碎后的猪肉样品,加入一定量的SEA,然后再加入225 mL无菌水均质,使样品中的SEA终质量浓度为50、100、200 ng/mL。取均质液在90 ℃加热10 min,2 000 r/min离心5 min,取上清液进行测定。参照1.3.2节方法进行测定,每个浓度进行3 组平行实验,同时做空白实验。
1.4 数据处理
采用SPSS 22.0软件进行数据处理及分析(P<0.05,差异显著),采用Origin 8.5软件绘制图表。
2 结果与分析
2.1 适配体筛选
2.1.1 适配体设计及分子模拟结果
根据6 条适配体的二级结构对最长链适配体进行裁剪[23],裁剪过程如图1所示,Apt4具有82 个碱基,具有较长的链,将其与SEA进行分子模拟后,发现SEA和Apt4结合区域在其3′端,又由于适配体与靶标结合区域大多在其茎环部位[24-25],所以对其进行裁剪,得Apt1。为了验证Apt1中与SEA作用的关键碱基序列,一方面在其5′端分别增加多余冗长碱基9 个和7 个,得Apt2和Apt3;另一方面,对其5′端的小茎环进行裁剪,得Apt5和Apt6。将6 条适配体分别与SEA进行10 ns分子动力学模拟,得到二者结合后的三维结构图(图2A)以及RMSD值曲线(图2B)。Apt6从图2A可以看出适配体弯曲折叠,SEA在其空间“口袋”内,相交处为两者相互作用区域。RMSD值是评价构象稳定的重要指标,其值越小,说明构象与原始构象越相近,在分子模拟时,随时间的波动,RMSD值越小,说明系统越接近于平衡状态。如图2B所示,6 条适配体与SEA结合后,三级结构均发生不同程度的变化。其中,Apt1和Apt4波动最明显,其次为Apt2和Apt3,而Apt5和Apt6相对稳定。波动程度越大,说明复合物空间构象越不稳定,越容易发生变化。分子模拟结果显示Apt5和Apt6稳定性较好,推测可能是核酸适配体与SEA的核心结合区,适合用于生物传感器构建。
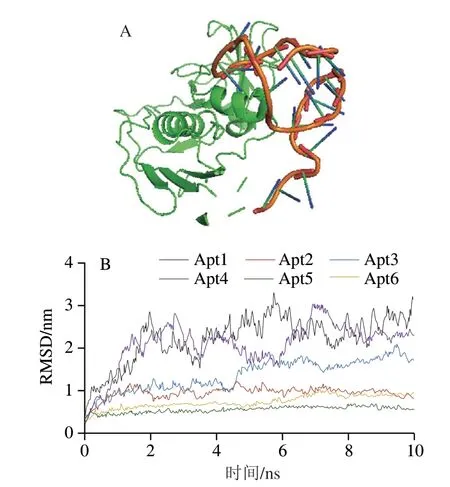
图2 适配体Apt6与SEA分子模拟结果(A)及不同裁剪适配体与SEA分子动力学后的RMSD值(B)Fig.2 Molecular simulation results of Apt6 and SEA (A) and RMSD values obtained in molecular dynamics simulation of different tailored aptamers and SEA (B)
2.1.2 纳米金显色结果
利用纳米金的盐效应实现SEA定量测定的可能性进行验证,结果如图3A所示。分散状态下的纳米金溶液呈现酒红色(曲线a),加入盐后,溶液颜色变为蓝色,520 nm波长处的吸光度下降,650 nm波长处的吸光度上升(曲线b),盐的加入引起纳米金粒子聚集,造成颜色改变。当纳米金溶液中存在适配体时,由于静电吸附作用,适配体吸附在纳米金颗粒表面,盐效应减弱(曲线c),溶液颜色变化不明显。当纳米金溶液中同时存在适配体和靶标时,由于二者发生特异性结合,使得纳米金粒子失去适配体的“保护”,引起粒子聚集,靶标质量浓度越大,盐效应越明显(曲线d和e,A650nm/A520nm比值分别为1.28和1.31)。纳米金溶液的A650nm/A520nm值与SEA含量呈正相关,可通过溶液颜色的变化实现SEA的定量检测。
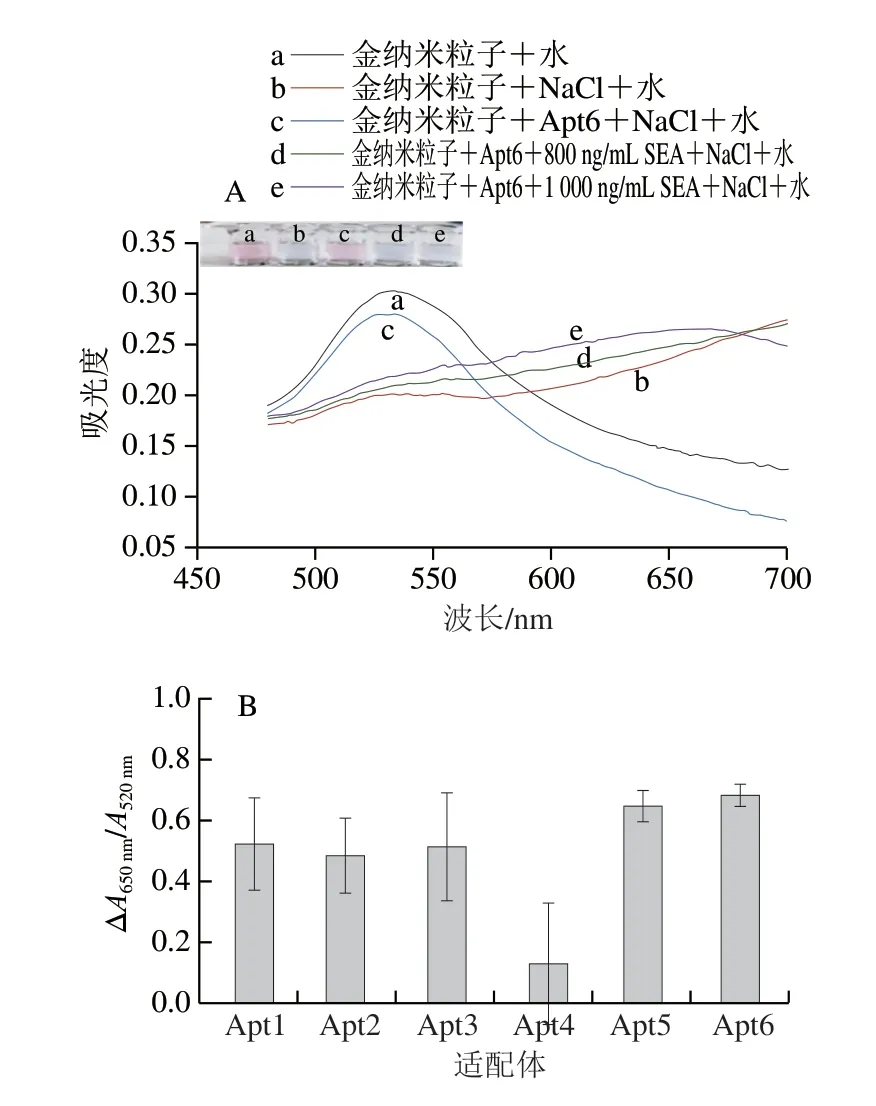
图3 不同体系下溶液的吸收光谱图(A)以及不同适配体和SEA的纳米金显色结果(B)Fig.3 Absorption spectra of different systems (A) and color development results of gold nanoparticles in the presence of different aptamers and SEA (B)
对6 条适配体(0.5 μmol/L)和SEA(250 ng/mL)的亲和性和稳定性进行探究,平行测定6 次,结果如图3B所示。与其他适配体相比,Apt4亲和力较弱且不稳定,这可能是由于其碱基数量较多、链较长引起。经过裁剪和改造后的Apt1、Apt2和Apt3,亲和力得到明显提高,Apt2和Apt3亲和力无明显差别,这说明:一方面,裁剪效果明显,有效碱基得到保留;另一方面,在一定程度上增加碱基数量,对亲和力影响较小。与Apt1相比,经过再次裁剪的Apt5和Apt6,亲和力得到进一步提高,且稳定性较好,说明裁剪策略正确,有效碱基得到保留,链的缩短使得适配体空间结构趋于稳定。上述结果与分子模拟结果一致,根据实验结果和测定成本综合考虑,选择Apt6用于后续测定。
2.2 实验条件的优化
2.2.1 盐浓度
当体系中盐溶液浓度小于0.3 mol/L时,ΔA650nm/A520nm值随着盐浓度的增大而升高,当盐浓度大于0.3 mol/L时,其比值趋于水平。说明盐浓度小于0.3 mol/L,纳米金粒子不能得到有效聚集,盐效应较小,而当盐溶液浓度大于0.3 mol/L时,纳米金聚集现象明显,适配体保护能力减弱,呈现稳态。因此,0.3 mol/L为最佳盐浓度。
2.2.2 适配体浓度
在适配体浓度小于0.3 μmol/L时,ΔA650nm/A520nm值不断下降,当适配体浓度大于0.3 μmol/L时,ΔA650nm/A520nm值趋于水平,如果适配体的浓度过低,则体系中的适配体无法完全保护金纳米粒子,低浓度的氯化钠就会使金纳米粒子发生聚集,此时无论体系中是否有SEA存在,金纳米粒子都是聚集的状态,无法对溶液中的SEA进行检测。如果适配体的浓度过高,一部分适配体吸附在纳米金表面,另一部分游离在溶液中,当靶标存在时,优先与游离的适配体结合,然后再与吸附在金纳米粒子表面的适配体结合,这样会大大降低方法的灵敏度。当反应体系的氯化钠浓度不变时,金纳米粒子团聚的程度随着适配体浓度的升高而不断降低,在0.3 μmol/L处达到最低后趋于水平,表明适配体的浓度为0.3 μmol/L时,可以完全保护金纳米粒子不发生聚集,且体系中的SEA更容易被识别、灵敏度最高。因此,最优适配体浓度为0.3 μmol/L。
2.2.3 反应时间
金纳米粒子的团聚程度和反应时间有关,结果显示,当反应时间小于10 min时,ΔA650nm/A520nm值随着反应时间的延长而增大,在10 min达到最大后趋于水平,说明10 min时体系反应完全,吸光度比值达到平衡,因此,最优的反应时间为10 min。
2.3 标准曲线的建立
在优化实验条件下,绘制纳米金溶液与不同质量浓度SEA反应后的吸收光谱图,结果如图4A所示。随着SEA溶液质量浓度的增加,体系在520 nm波长处的吸光度不断下降,在650 nm波长处的吸光度不断上升,体系颜色从酒红色逐渐变为蓝色(图4A内插图)。以ΔA650nm/A520nm值为纵坐标,SEA溶液质量浓度为横坐标,绘制二者相关性曲线,如图4B所示,在SEA质量浓度为5~250 ng/mL内,线性回归方程为Y=0.001 7X+0.452 3,相关系数为0.984 7,检出限为4.32 ng/mL(RSN=3)。说明该方法可实现SEA的快速可视化检测。与报道的方法相比,本研究建立的方法操作简单,检测速度快,检测限较低,具有一定优势(表1)。
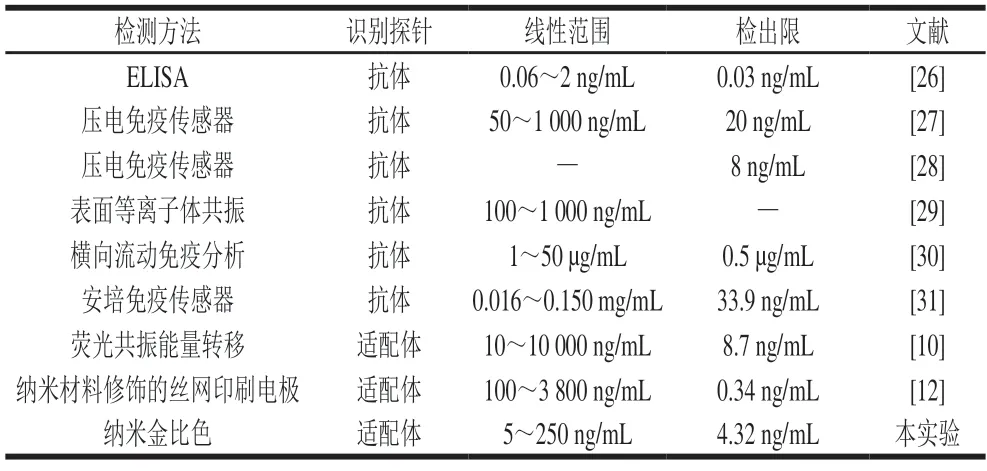
表1 不同肠毒素A检测方法的对比Table 1 Comparison of different methods for detection of SEA
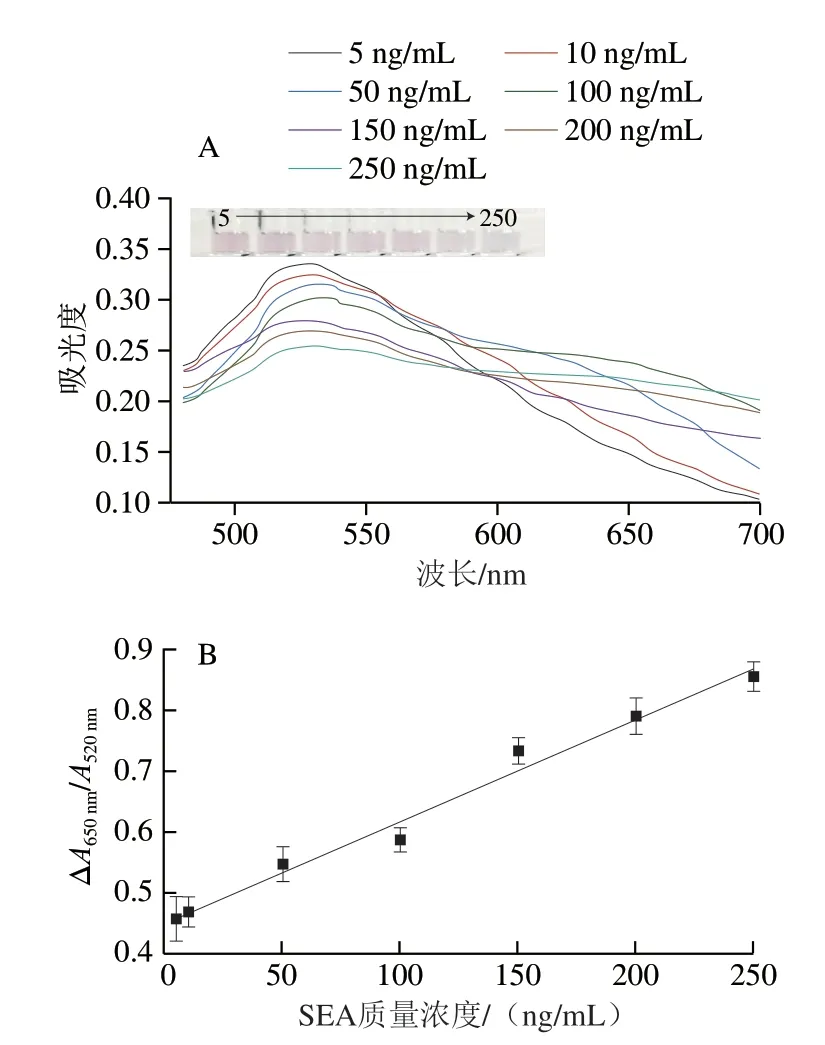
图4 不同质量浓度的SEA吸收光谱图(A)和线性拟合图(B)Fig.4 Absorption spectra of SEA at different mass concentrations (A) and linear relationship between absorbance ratio and SEA mass concentration (B)
2.4 特异性实验
选用不同毒素对方法的特异性进行研究。结果如图5所示,发现裁剪前后的适配体对SEA、SEB和SEC均有响应,这可能是因为SEA与SEB、SEC具有40%~60%序列同源性,适配体对该共同结构域具有识别位点[1];但对于其他的微生物代谢的小分子毒素如ZEN、AFB1、OTA几乎没有响应。说明本方法对于肠毒素的检测具有一定的广谱性优势,对于其他毒素,具有良好的特异性。
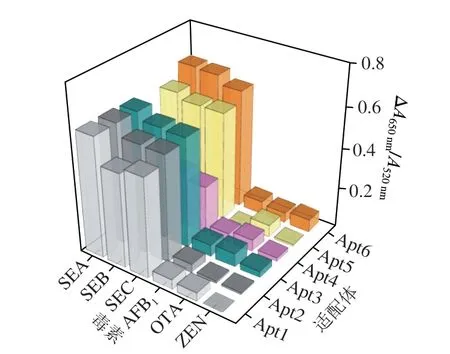
图5 不同裁剪适配体的特异性分析Fig.5 Specificity analysis of different tailored aptamers
在相同条件下,连续7 d用所构建的传感器测定质量浓度为250 ng/mL 的SEA,重复测定3 次,测定结果相对标准偏差(relative standard deviation,RSD)值小于5%,说明该传感器具有良好的稳定性。
2.5 实际样品检测
以猪肉作为实际样品,通过测定加标回收率验证本方法的准确性,进行3 次重复,结果如表2所示,猪肉样品中SEA的加标回收率在84.00%~93.62%之间,RSD值为5.24%~6.63%。由此得出,该生物传感器检测的准确性高、数据可靠,可以对猪肉中的SEA进行筛选甄别。
3 结论
本实验通过分子模拟,指导适配体裁剪,预测适配体与SEA作用区域,筛选出目标适配体,提高适配体筛选效率,获得长度更短、亲和力更好、特异性更高、稳定性更好的核酸适配体。将筛选得到的适配体作为信号识别原件,利用纳米金的盐效应,构建了一种SEA的高灵敏度、高特异性的可视化检测方法。本方法具有操作简单、灵敏度高、特异性强的特点,为基于适配体的SEA快速检测试剂盒的研发提供了一定理论基础。
