基于复合纳米材料比色/荧光双信号的黄曲霉毒素B1检测
2024-01-03陈丽叶谢新辉吴家浩石星波
李 阳,鲁 迨,周 州,陈丽叶,谢新辉,吴家浩,赵 倩,,石星波
(1.湖南农业大学食品科学技术学院,食品科学与生物技术湖南省重点实验室,湖南 长沙 410128;2.湖南省产商品质量监督检验研究院,湖南 长沙 410007)
黄曲霉毒素是主要由黄曲霉和寄生霉产生的有毒次生代谢物,结构为二呋喃环和香豆素环组成的二呋喃酮萘酮的衍生物[1]。黄曲霉毒素B1(aflatoxin B1,AFB1)毒性最大、致癌性最强,已被世界卫生组织列为I类致癌物[2-3]。为了保障食品安全,开发准确检测食品中AFB1含量的方法尤其重要,常用的检测方法主要有薄层色谱法[4]、高效液相色谱(high performance liquid chromatograpy,HPLC)法[5]、免疫化学检测法[6]等。色谱法灵敏度高、稳定性好,但仪器设备昂贵和需要专业技术人员。免疫化学检测法中酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)应用最为广泛,但ELISA依赖昂贵的抗体[7]和酶,而天然酶具有制备成本高、耐酸碱性低、稳定性差、储存不便的缺陷[8],同时单一信号输出容易出现假阳性。因此,构建新型ELISA传感策略以实现对AFB1的高灵敏便携检测至关重要。
纳米材料的引入为开发新型的ELISA带来了机遇,如可作为载体负载识别分子或者酶用于信号放大、作为纳米酶偶联抗体用于信号调节以及作为底物用于信号输出[9]。石墨烯量子点(graphene quantum dots,GQDs)是一种零维碳纳米材料,制备简单且具有很强的荧光特性[10-11],可以作为底物实现荧光信号输出,同时提高ELISA检测的灵敏度。二氧化锰纳米颗粒(MnO2nanoparticles,MnO2NPs)比表面积大、具有较宽的光吸收性能[12],可以作为能量受体有效地猝灭荧光物质的荧光,此外其还具有优异的模拟酶性能[13],可以催化酶底物3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-tetramethylbenzidine,TMB)显色[14],实现比色信号输出。若将两种材料组合,则可实现比色/荧光信号同时输出,为构建双模信号ELISA提供选择[15]。
核酸适配体(aptamer,Apt)作为一种新型识别元件,亲和力和特异性高、免疫原性低,已广泛应用于食品安全检测中[16-17]。真菌毒素等小分子分子质量小、抗原表位单一,不能同时结合两个抗体,一般使用竞争ELISA对其进行检测[18],特异性不够好。将抗体与Apt组合对目标物的识别表现出了较好的特异性,可以实现小分子“三明治”夹心ELISA检测[19]。
本实验基于GQDs与MnO2NPs构建了一种比色/荧光双信号输出平台用于AFB1的高灵敏便携式检测。使用SiO2纳米颗粒(SiO2nanoparticles,SiO2NPs)为载体,将谷胱甘肽(glutathione,GSH)和AFB1-Apt富集在SiO2NPs上制备SiO2NPs@GSH@Apt识别探针。使用MnO2NPs偶联GQDs的复合纳米材料MnO2NPs@GQDs为底物,基于荧光共振能量转移(fluorescence resonance energy transfer,FRET),MnO2NPs有效猝灭GQDs的荧光,同时MnO2NPs@GQDs能有效地催化TMB氧化为蓝色氧化态TMB。SiO2NPs@GSH@Apt识别探针与AFB1抗体共同识别目标物AFB1,形成夹心型结构。GSH具有很强的还原性,能将MnO2NPs还原成Mn2+[20],MnO2NPs@GQDs的类过氧化物酶能力减弱,而GQDs被猝灭的荧光不断恢复,通过底物荧光强度以及TMB颜色的变化对实现对AFB1的可视化及荧光检测。
1 材料与方法
1.1 材料与试剂
柠檬酸、氢氧化钠、30% H2O2、硫酸 国药集团化学试剂有限公司;高锰酸钾 衡阳市凯信化工试剂有限公司;聚丙烯胺盐酸盐(poly(allylamine hydrochloride),PA H)、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydro,EDC)上海阿拉丁生化科技股份有限公司;N-羟基丁二酰亚胺(N-hydroxy succinimide,NHS)、磷酸盐缓冲溶液(phosphate buffer saline,PBS)北京索莱宝科技有限公司;牛血清白蛋白(bovine serum albumin,BSA)上海源叶生物科技有限公司;AFB1标准品 山东美正生物科技有限公司;二氧化硅纳米颗粒 天津均益佳科技有限责任公司;谷胱甘肽 合肥博美生物科技有限责任公司;TMB 西格玛奥德里奇(上海)贸易有限公司;AFB1-Apt序列(5′-3′)GTT GGG CAC GTG TTG TCT CTC TGT GTC TCG TGC CCT TCG CTA GGC CC[21]生工生物工程(上海)股份有限公司。所有试剂均为分析纯。
1.2 仪器与设备
BSA124S电子天平 赛多利斯科学仪器有限公司;SPARK 20M多功能酶标仪 瑞士帝肯公司;Zetasizer Nano ZS90纳米粒度电位仪 马尔文帕纳科公司;Heraeus Pico 17离心机 美国赛默飞世尔科技公司;TCS-10金属恒温振荡器 杭州瑞诚仪器有限公司;JEM-2100F透射电子显微镜 日本电子光学公司;F-7000荧光分光光度计 日本日立公司。
1.3 方法
1.3.1 GQDs的制备
参考文献[22]采用直接热解法。称取2 g柠檬酸,200 ℃反应30 min,得到橙色液体时标志GQDs形成。将GQDs逐滴加入到100 mL(0.25 mol/L)的NaOH溶液中,随后调节溶液pH值至7.0得到GQDs溶液。将其放入干燥箱中60℃烘干至质量恒定后称量,得到所制备的GQDs质量浓度为19.8 mg/mL。
1.3.2 MnO2NPs的制备
参考文献[23]的方法用PAH将高锰酸钾还原成MnO2NPs。称取35 mg高锰酸钾溶于40 mL去离子水中,加入5 mL 40 mg/mL的PAH溶液,在超声的辅助下反应15 min,随后透析48 h(3 000 Da)得到纯化的MnO2NPs。将其放入干燥箱中60 ℃烘干至质量恒定后称量,得到所制备的GQDs质量浓度为3.7 mg/mL。
1.3.3 MnO2NPs@GQDs复合底物的合成及性质
取5 mL 198 μg/mL的GQDs溶液与5 mL质量浓度为7.4、18.5、37、74、185、370 μg/mL的MnO2NPs室温反应得到不同质量浓度的MnO2NPs@GQDs复合材料,将未加入与加入MnO2NPs的GQDs的荧光强度分别记为F0、F1,以F0与F1差值ΔF1为参考确定底物合成最佳的MnO2NPs质量浓度。接下来探究底物合成所需的时间,在GQDs溶液加入MnO2NPs后,每隔10 min测量其荧光强度,确定最佳反应时间。
考察MnO2NPs、GQDs、底物以及底物在引入GSH后的类过氧化物酶特性和荧光特性的变化,分别配制4 种溶液:1)MnO2NPs溶液:250 μL MnO2NPs+750 μL H2O;2)GQDs溶液:250 μL GQDs+750 μL H2O;3)MnO2NPs@GQDs 溶液:500 μL MnO2NPs@GQDs+500 μL H2O;4)MnO2NPs@GQDs+GSH溶液:500 μL MnO2NPs@GQDs+500 μL GSH。将4 种溶液置于45 ℃反应40 min,待反应完成后各取200 μL液体测定荧光光谱,同时各取50 μL液体加入50 μL TMB和50 μL H2O2,室温反应45 min,加入50 μL 1 mol/L的H2SO4溶液终止反应,测定紫外-可见吸收光谱并记录在450 nm波长处的吸光度A450nm。
1.3.4 SiO2NPs@GSH@Apt探针的制备及优化
对探针上的GSH浓度进行优化,将1 mL表面氨基化的SiO2NPs溶液(0.1 mg/mL)与1 mL不同浓度(0、0.5、2.5、5、7.5、10、12.5、15 mmol/L)的GSH溶液室温反应1 h,随后将1 mL 100 nmol/L用4 mmol的EDC和1 mmol的NHS活化后的Apt加入其中室温反应1 h。接着8 000 r/min离心3 min,重复3 次得到纯化的探针。400 μL不同GSH浓度的探针与400 μL底物45 ℃反应40 min,测定同1.3.3节。将有、无GSH的探针加入到底物后的荧光值分别记为F2、F3,以F2与F3荧光差值ΔF2和A450为参考得到最佳GSH浓度。对SiO2NPs表面富集GSH的温度与时间进行优化,考察SiO2NPs在不同温度下(15、25、35、45、55、65 ℃)以及不同反应时间下(10、20、30、40、50、60、70、80 min)对GSH富集情况,以ΔF2和A450nm为参考得到最优反应温度与反应时间。
1.3.5 基于SiO2NPs@GSH@Apt探针和MnO2NPs@GQDs底物对AFB1的检测
基于探针和底物构建了基于夹心法ELISA用于AFB1的检测,具体操作步骤如下:1)AFB1抗体包被:将100 μL 0.01 mg/mL AFB1抗体加入96微孔板中,4 ℃孵育12 h。2)封闭:取出微孔板,弃去液体,PBS洗涤3 次后加入100 μL 0.01 mg/mL BSA,37 ℃孵育1 h。3)连接抗原:取出微孔板,弃去液体,PBS洗涤3 次后加入100 μL不同质量浓度AFB1,37 ℃孵育1 h。4)弃去液体,PBS洗涤3 次后加入100 μL探针,25 ℃反应1 h。5)弃去液体,PBS洗涤3 次后加入100 μL底物,45 ℃反应40 min。测定同1.3.3节。
1.3.6 可行性分析
将100 μL同浓度的SiO2NPs、SiO2NPs@GSH、SiO2NPs@Apt、SiO2NPs@GSH@Apt分别加入到铺好AFB1抗原的微孔板中,25 ℃反应1 h,弃去液体,PBS洗涤3 次后加入100 μL底物,45 ℃反应40 min。测定同1.3.3节。
1.3.7 反应条件优化
将200 μL探针加入到200 μL底物中,考察其在不同温度下(15、25、35、45、55、65 ℃)以及不同反应时间下(10、20、30、40、50、60 min)的荧光强度和类过氧化物酶特性变化,确定最优反应温度与反应时间。
1.3.8 特异性分析
为验证本方法检测AFB1的特异性,选择黄曲霉毒素B2(aflatoxin B2,AFB2)、黄曲霉毒素M1(aflatoxin M1,AFM1)、赭曲霉毒素(ochratoxin A,OTA)、T-2毒素(trichothecenes,T-2)、棒曲霉毒素(Patulin)、伏马毒素(fumonisin B1,FB1)、脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)以及混合毒素进行特异性验证,其中单一毒素质量浓度为10-8g/mL,混合毒素中的干扰毒素质量浓度为10-8g/mL、AFB1质量浓度为10-9g/mL。操作同1.3.5节,将AFB1分别用上述毒素代替。
1.3.9 实际样品中AFB1的检测
使用商业化的ELISA试剂盒和HPLC检测牛奶、大米、麦片、酱油、白醋5 种实际样品中的AFB1含量,验证本方法的准确性。检测前需对所选的样品进行预处理,步骤如下:1)牛奶:取1 mL样品加入3 mL去离子水混合均匀。2)大米、麦片、酱油:将样品粉碎后取5 g样本加入60%甲醇溶液25 mL,振荡10 min;取液体于4 000 r/min离心5 min;取上清液1 mL加入4 mL去离子水混合均匀。3)白醋:取1 mL样品加入60%甲醇溶液5 mL,振荡均匀;取液体1 mL加入4 mL去离子水混合均匀。操作同1.3.5 节,将AFB1分别用上述预处理过的实际样品代替。
选择牛奶样品作为加标样品进行加标回收的检测。分别取1 mL待测液加入AFB1标准品溶液,使AFB1的终质量浓度分别为1×10-9、1×10-10、1×10-11g/mL,计算得到加标回收率。
1.4 数据处理
所有实验均重复3 次,从酶标仪和荧光分光光度计中导出数据,利用Excel进行数据处理,使用Origin 2021软件绘图。
2 结果与分析
2.1 检测原理
检测原理如图1所示,使用SiO2NPs作为载体富集GSH和AFB1-Apt构建SiO2NPs@GSH@Apt识别探针,MnO2NPs偶联GQDs的复合纳米材料MnO2NPs@GQDs为底物。在聚苯乙烯微孔板上包被AFB1抗体,当有目标物AFB1存在时,探针上的AFB1-Apt和抗体共同识别并捕获AFB1,形成夹心结构,以GSH控制底物荧光及比色信号的输出。底物具有MnO2NPs类过氧化物酶的特性,能够有效地催化酶底物TMB显色,且MnO2NPs具有较宽的光吸收性能,能有效猝灭GQDs的荧光。但由于探针上的GSH具有很强的还原性,能将MnO2NPs还原成Mn2+,此时底物的类过氧化物酶特性消失,不能催化TMB氧化变色,但底物中GQDs被猝灭的荧光恢复。当目标物AFB1浓度越高,溶液的荧光信号逐渐增强,比色信号逐渐减弱,通过底物荧光强度以及TMB颜色的变化对AFB1进行定量及可视化检测。

图1 比色/荧光双模信号检测AFB1原理图Fig.1 Schematic illustration of the dual-mode signal for colorimetric and fluorescence detection of AFB1
2.2 GQDs、MnO2NPs和MnO2NPs@GQDs制备及表征
如图2A所示,GQDs的最大激发波长为370 nm,最大发射波长为465 nm,在紫外灯照射下发出了很强的蓝色荧光。对MnO2NPs紫外-可见吸收光谱进行测定,其在250~600 nm波长处有比较宽的吸收范围。由图2B可以看到,MnO2NPs为球状,且分散性较好。随机选取100 个MnO2NPs进行粒径分析,结果表明该尺寸分布在1.2~3.4 nm之间,平均粒径为2.2 nm。由图2C可以看出,GQDs也为球状结构。GQDs粒径分布在2.7~6.7 nm之间,平均粒径为3.75 nm。
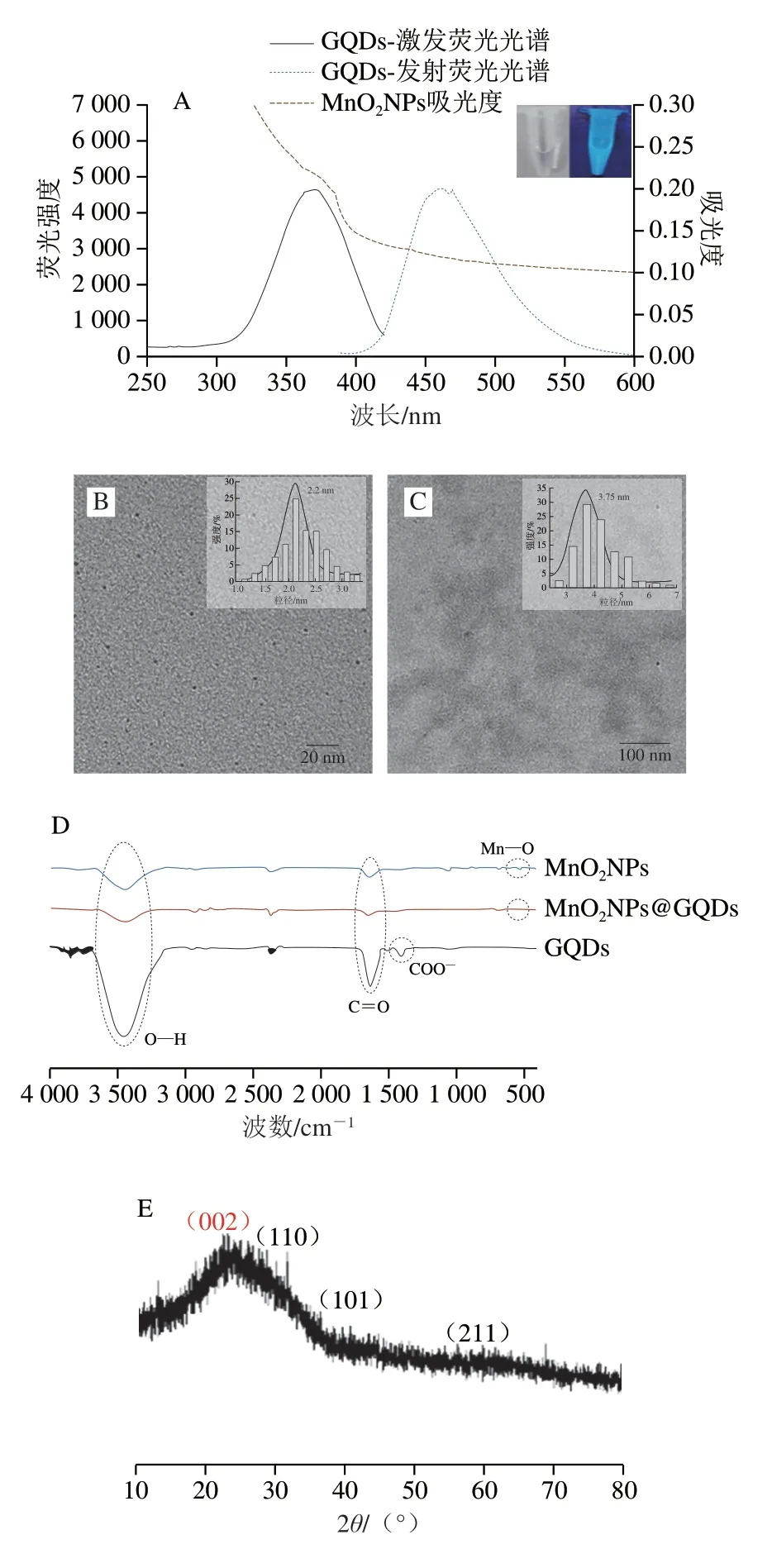
图2 GQDs、MnO2NPs和MnO2NPs@GQDs的表征Fig.2 Characterization of GQDs,MnO2NPs and MnO2NPs@GQDs
为考察MnO2NPs@GQDs复合纳米材料是否成功合成,通过红外光谱图分析MnO2NPs、GQDs及MnO2NPs@GQDs表面功能基团,如图2D所示,1 600 cm-1是C=O的不对称伸缩振动,3 500 cm-1为O—H的面内弯曲振动[22],GQDs表现出了对羧基和羟基的吸收,表明其含有—COOH基团;MnO2NPs表现出了对羰基和羟基的吸收,且Mn—O的伸缩振动导致MnO2NPs在527 cm-1处出现小的特征峰;复合纳米材料在527 cm-1处也有小的特征峰[24],对羰基和羟基也表现出吸收,说明MnO2NPs与GQDs偶联形成了MnO2NPs@GQDs复合纳米材料。通过X射线衍射仪对MnO2NPs@GQDs进行晶体结构分析,如图2E所示,2θ为28.7°、37.3°、56.7°时出现的特征峰与β-MnO2的110、101、211晶面匹配[25],2θ=24°附近出现的宽峰对应于石墨的002平面,来源于GQDs的石墨结构[26]。从3 种材料的电位表征图(图2F)可见,GQDs带负电,MnO2NPs带正电,由于静电吸附作用MnO2NPs与GQDs结合得到MnO2NPs@GQDs复合纳米材料,MnO2NPs@GQDs带正电,提示MnO2NPs@GQDs的成功合成。
对底物的类过氧化物酶特性和荧光特性进行探究。由图3A所示,MnO2NPs具有类过氧化物酶特性,能将TMB氧化成蓝色产物,在硫酸终止下变成黄色;而GQDs没有类酶活性,在GQDs中加入TMB与H2O2以及终止液后溶液呈无色状态;MnO2NPs@GQDs底物在加入TMB与H2O2以及终止液后溶液呈黄色,说明底物也具有类过氧化物酶特性;在加入GSH后,GSH将MnO2NPs还原成Mn2+,底物的类酶活性消失,插图为MnO2NPs、GQDs、MnO2NPs@GQDs、MnO2NPs@GQDs+GSH四种溶液加入TMB与H2O2以及终止液后的颜色图片。如图3B所示,MnO2NPs不发荧光;而GQDs具有很强的荧光特性,在465 nm处具有很高的荧光发射峰;MnO2NPs与GQDs复合形成MnO2NPs@GQDs底物后,基于FRET,GQDs的荧光被MnO2NPs猝灭导致底物荧光强度很低;加入GSH后,MnO2NPs还原成Mn2+,MnO2NPs对GQDs荧光的猝灭效果减弱,底物荧光逐渐恢复。插图为MnO2NPs、GQDs、MnO2NPs@GQDs、MnO2NPs@GQDs+GSH四种溶液在360 nm紫外灯下的图片,可以清楚看到4 种溶液的荧光强度变化。
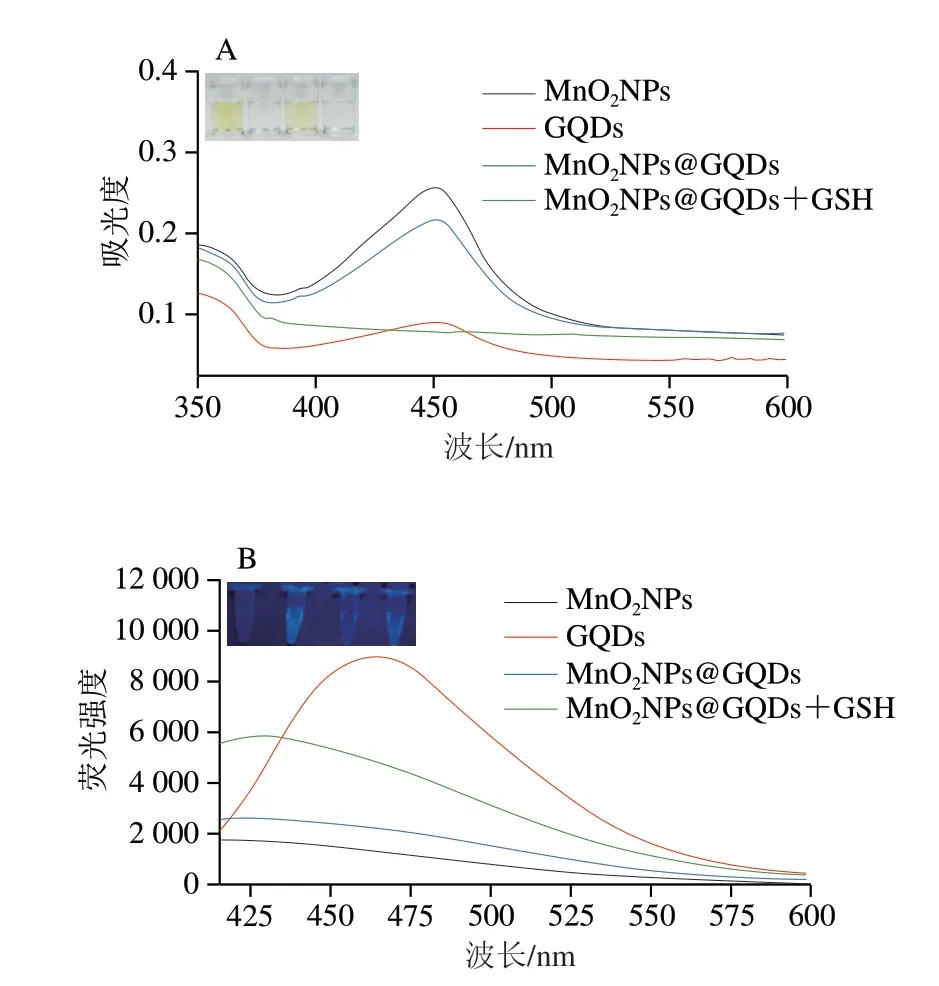
图3 GSH加入前后MnO2NPs@GQDs的类过氧化物酶特性(A)及荧光特性(B)Fig.3 Peroxide-like properties (A) and fluorescence intensity (B) of MnO2NPs@GQDs before and after adding GSH
2.3 MnO2NPs@GQDs底物条件优化
如图4A所示,随着MnO2NPs质量浓度不断的增大,GQDs的荧光不断被猝灭,当质量浓度达到74 μg/mL时ΔF1最大,所以以此为最佳质量浓度。对MnO2NPs与GQDs的孵育时间进行优化,从图4B可以看出,ΔF1随着时间的延长而增加,在90 min后趋于稳定,因此选择最佳孵育时间为90 min。

图4 底物制备时MnO2NPs质量浓度(A)和反应时间(B)条件的优化Fig.4 Optimization of concentration of MnO2NPs (A) and reaction time (B) for substrate preparation
2.4 SiO2NPs@GSH@Apt探针制备及条件优化
SiO2NPs@GSH@Apt探针是通过氨基修饰的SiO2NPs首先与GSH羧氨结合、接着与羧基化的Apt静电吸附偶联而成。对探针进行Zeta电位表征,如图5A所示,氨基修饰的SiO2NPs带正电,加入GSH后由于缩合反应SiO2NPs@GSH正电位值增加,但加入羧基化Apt后,SiO2NPs@GSH@Apt正电位值减少,说明GSH、Apt已成功富集在SiO2NPs表面,证实了SiO2NPs@GSH@Apt探针的成功合成。

图5 SiO2NPs@GSH@Apt的表征及制备条件优化Fig.5 Characterization of SiO2NPs@GSH@Apt and optimization of its preparation conditions
对探针制备过程中GSH浓度及SiO2NPs富集GSH温度与时间进行优化。如图5B所示,随着探针上的GSH浓度不断增大,底物的荧光强度逐渐增强,对TMB的氧化效果逐渐减弱。当GSH终浓度为5 mmol/L时,底物的荧光强度恢复接近稳定,但底物与TMB反应得到的TMB氧化产物吸光度很低,为了实现比色及荧光的双模信号同时输出,选择终浓度为2.5 mmol/L的GSH进行后续实验。如图5C所示,在35 ℃条件下底物的荧光强度恢复最多且对TMB的氧化效果最弱,说明此温度下SiO2NPs表面富集的GSH最多,所以选择35 ℃作为最佳反应温度。如图5D所示,反应时间到60 min时底物的荧光强度恢复接近稳定且对TMB的氧化效果也趋于稳定,说明此时SiO2NPs表面的GSH富集达到饱和,因此SiO2NPs富集GSH的时间选择为60 min。
2.5 可行性验证及反应条件优化
将SiO2NPs、SiO2NPs@GSH、SiO2NPs@Apt、SiO2NPs@GSH@Apt分别加入到底物中,对底物的比色/荧光信号输出进行探究。从图6A、B可以看到,SiO2NPs两种信号与空白响应值相差不大,没有识别目标物和与底物反应的功能;SiO2NPs@GSH对两种信号都有轻微的响应,但其缺少对目标物的识别功能;SiO2NPs@Apt具备识别功能,但其没有信号响应;SiO2NPs@GSH@Apt具备识别功能且比色与荧光信号明显响应,这说明基于SiO2NPs@GSH@Apt探针与MnO2NPs@GQDs底物构建检测AFB1的方法可行。
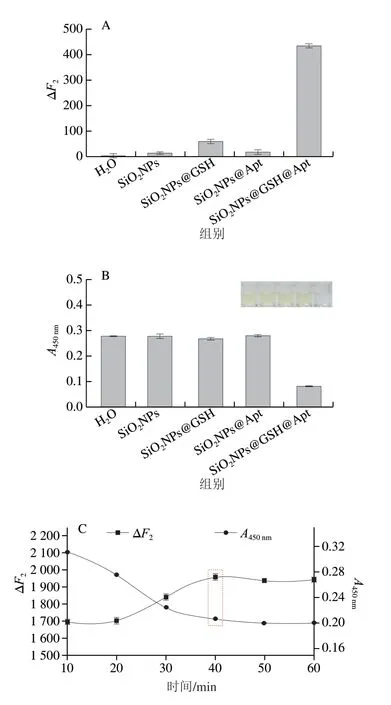
图6 AFB1检测可行性研究及反应条件优化Fig.6 Feasibility of AFB1 detection and optimization of reaction conditions
对探针与底物的反应时间与温度进行优化。如图6C所示,随着反应时间延长,探针上的GSH与底物不断反应使MnO2NPs还原成Mn2+,到40 min底物的荧光及类过氧化物酶活性趋于稳定,因此后续实验中探针与底物反应时间选择为40 min。由图6D可以看到,在45 ℃条件下底物的荧光和类过氧化物酶活性效果最好,所以选择此温度作为探针与底物最佳反应温度。
2.6 AFB1检测灵敏度及特异性分析
在最优条件下,向检测体系中加入AFB1标准溶液(10-12~10-6g/mL),以底物荧光差值∆F(∆F=F4-F5,F4、F5分别为加入毒素和超纯水后底物的荧光值)和TMB显色的吸光度差值∆A(∆A=A1-A0,A1、A0分别为加入毒素和超纯水后底物与TMB反应后的A450nm)作为信号输出,建立标准曲线。如图7A所示,随着AFB1质量浓度不断增大,GQDs的荧光不断恢复,恢复的荧光强度∆F与AFB1质量浓度在10-12~10-6g/mL范围内呈明显正相关,得到荧光信号的线性方程为∆F=928.733+71.779lgC,R2=0.990 2,检出限计算为1.667×10-12g/mL。检出限的定义如下:3S0/S(3为置信水平为99%的因子,S0为空白测量的标准偏差(n=3),S为标准曲线的斜率)。由图7C可以看到,随着AFB1质量浓度不断增大,TMB氧化产物在450 nm波长处的吸光度逐渐减低,以AFB1质量浓度(C)为横坐标,∆A为纵坐标,在10-12~10-6g/mL范围内得到了比色信号的线性方程为∆A=-0.275-0.021lgC,R2=0.998 9,计算得到检出限为2.732×10-12g/mL。此外,通过AFB1检测方法与其他方法比较(表1)表明,本研究所得结果具有较宽的线性范围和更低的检出限,对AFB1具有良好的检测性能,可实现对AFB1的高灵敏便携检测。

表1 不同AFB1检测方法的比较Table 1 Comparison of different methods for the determination of AFB1
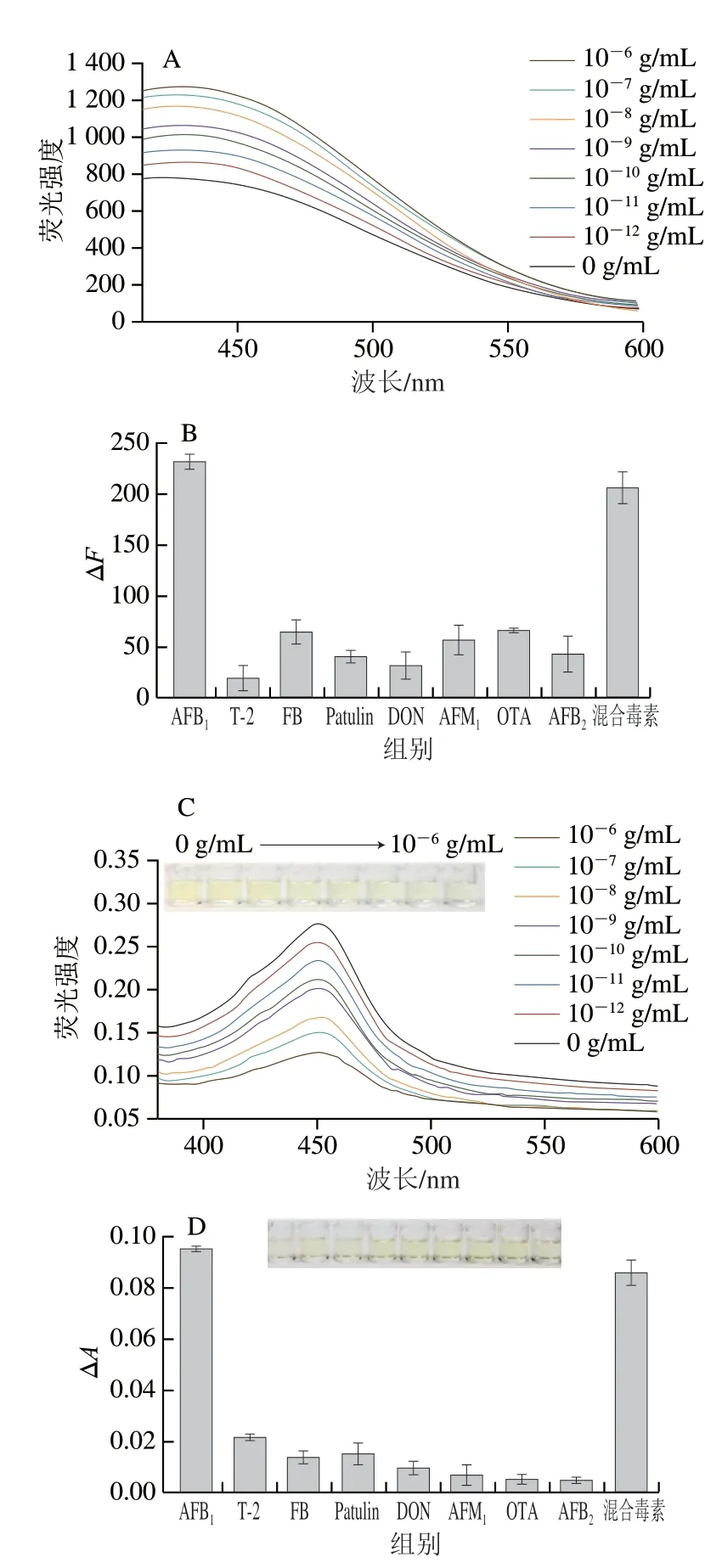
图7 AFB1检测灵敏度及特异性Fig.7 Sensitivity and specificity of AFB1 detection
探讨该方法对检测AFB1的特异性,选择与AFB1结构类似的毒素AFB2、AFM1、OTA、T-2毒素、Patulin、FB1、DON以及混合毒素进行验证。如图7B所示,只有AFB1和混合毒素才有明显的荧光信号响应,说明荧光信号有良好的特异性。如图7D所示,TMB氧化产物的颜色在有AFB1存在时最浅,说明比色信号对AFB1也具有良好的特异性。
2.7 实际样品中AFB1的检测分析
使用本方法对牛奶、大米、麦片、酱油和白醋共5 种实际样品中的AFB1进行检测,根据标准曲线计算得到样品中AFB1的含量,同时与商业化的ELISA试剂盒和HPLC进行方法对比,结果如表2所示。商业化的ELISA试剂盒检出了大米与酱油两种样品,含量分别为0.111、3.41×10-2μg/kg,相对标准偏差(relative standard deviation,RSD)分别为2.7%、1.5%。HPLC只检出了大米一个样品,含量为0.100 μg/kg。本方法中比色信号检出了大米与酱油两种样品,而荧光信号检出了大米酱油和麦片3 种样品,比色信号检出大米、酱油中的AFB1含量分别为0.114、3.44×10-2μg/kg,RSD分别为2.2%、0.8%;荧光信号检出大米、酱油与麦片中的AFB1含量分别为0.108、3.26×10-2、1.94×10-3μg/kg,RSD分别为2.4%、1.2%、0.9%。两种信号的检测结果与ELISA试剂盒和HPLC所测得的结果保持在同一水平,且RSD均小于3%,说明检测结果具有一定的准确性。此外,两种信号能测出ELISA试剂盒和HPLC未能检出的样品,说明本方法能有效地检测出实际样品中的AFB1含量并且比传统方法的灵敏度更高。两种信号得到的结果可以看到本方法中荧光信号的灵敏度更高。

表2 不同方法检测实际样品中AFB1的含量Table 2 Comparison of results of AFB1 detection in real food samples by different methods
为进一步验证本方法的实际应用性能,在牛奶中添加不同含量的AFB1标准液制备不同质量浓度的AFB1牛奶加标样品进行加标回收率实验。如表3所示,比色信号与荧光信号均有效检出,并与加标含量几乎持平。其中比色信号的加标回收率为96.03%~112.27%,荧光信号回收率为91.50%~117.20%,两种信号的RSD均小于3%,说明本方法具有很好的准确性和特异性,可用于牛奶等相关实际样品中AFB1的检测。

表3 牛奶样品中AFB1加标回收率Table 3 Recoveries of AFB1 in spiked milk samples
3 讨论
将GSH和AFB1-Apt富集在SiO2NPs表面制备了SiO2NPs@GSH@Apt识别探针,MnO2NPs与GQDs偶联复合成MnO2NPs@GQDs信号读出底物,Apt和抗体组合识别目标物AFB1。在聚苯乙烯微孔板上,基于探针上GSH与底物的反应设计了一种具有比色/荧光双信号的AFB1检测方法,实现了AFB1的可视化比色及荧光信号高灵敏检测。两种信号得到的结果互相佐证,避免了单信号输出时容易出现假阳性的后果。Apt与抗体共同识别捕获目标物,避免其他毒素干扰,具有良好的特异性,且相较2 个抗体组合使用的成本更低。与商业化ELISA试剂盒和HPLC相比,本方法具有更高的灵敏度,可用于痕量检测AFB1,为食品安全快速、灵敏检测提供了技术支撑。
