利用微载体系统规模化生产鸡成肌细胞
2024-01-03刘屹森蔡佳琦李石磊李莹莹王守伟胡海娟刘文婷李雨爽董圣艳陈嘉璇
刘屹森,蔡佳琦,李石磊,李莹莹,王守伟,杨 峰,胡海娟,刘文婷,李雨爽,董圣艳,陈嘉璇,梁 俊,
(1.天津科技大学 省部共建食品营养与安全国家重点实验室,天津 300457;2.中国肉类食品综合研究中心,肉类加工技术北京市重点实验室,北京食品科学研究院,北京 100068)
细胞培育肉又称作细胞培养肉、生物培育肉、培育肉等[1],是利用动物细胞体外培养的方式控制其快速增殖、定向分化并收集加工而成的一种新型肉类食品[2],该技术被认为是未来缓解环境污染、可持续发展、解决全球公共健康和动物福利等问题的潜在方案[3]。细胞培育肉的生产需要借助细胞大规模体外培养实现[4],然而细胞贴壁培养所需相对较大的表面空间,从而限制了细胞培育肉工业化生产的规模。贴壁生长的细胞能否有效地附着取决于细胞的特性、细胞与载体表面之间的有效接触面积及微载体材料本身的生物相容性水平[5-8]。长期以来,传统的Dish培养皿适合于基础科学研究,然而,对于大规模的细胞培养,Dish培养皿的比表面积利用率已成为“瓶颈”。因此,为提升细胞大规模培养效率,研究人员将重点转向了可用于细胞3D培养的微载体开发以及生物反应器相关培养工艺的开发领域[9],通过不断提升微载体的比表面积利用率和生物相容性,从而提高细胞的综合培养效率、不断降低细胞培养所需空间体积。
如今微载体得到了广泛研究,其材料主要包括壳聚糖[10]、水凝胶[11]、海藻酸盐[12]、胶原[13]、透明质酸[14]和聚苯乙烯等。微载体的实用性主要反映在它们的机械性能[15]、生物相容性[16]、沉降系数[17]、能否降解以及物理和化学刺激。在大规模细胞培养中,微载体的培养效率因研究目的、细胞类型和培养环境的不同而有所差异[18]。微载体的选择按细胞直径分类:胚胎干细胞为50~100 μm,间充质干细胞为100~300 μm,多细胞混合物为200~600 μm,在使用过程中也依据细胞的类型进行选择[19]。优化基于微载体的细胞培养条件对于其大规模应用非常重要[20-22]。一种常用方法是利用微载体、生物反应器、细胞和培养基构建细胞微生态系统,旋转烧瓶反应容器被广泛用于细胞培养,因为它可以提供均匀的培养环境[23],在培养过程中,细胞也受外界因素的影响,例如培养条件、转瓶的转速和微载体的类型[24-26]。目前为止,有关成肌细胞大规模培养用于细胞培育肉生产的研究鲜有报道。
本研究对Cytodex 1和3D TableTrixTM两种微载体进行对比,筛选出更为适合大规模培养成肌细胞的微载体。以3D TableTrixTM微载体为研究对象,探讨起始搅拌条件、细胞接种密度、微载体质量浓度、搅拌速率、不同补料方式、血清、珠对珠转移等因素对细胞大规模培养的影响,并采用单因素变量法优化细胞三维培养的重要参数。通过珠对珠转移进行细胞更大规模的培养,并将带有细胞的微载体进行冻存和复苏,对比观察带有细胞的微载体和解冻细胞之间的增殖状况和形态差异,旨在为大规模细胞培养提供理论基础和探索性实践,为细胞培育肉的工业化生产提供前提条件。
1 材料与方法
1.1 材料与试剂
3D TableTrixTM北京华龛生物科技有限公司;Cytodex 1美国Sigma公司。
DMEM高糖培养基、0.25%胰蛋白酶消化液、杜氏磷酸缓冲盐溶液(Dulbecco’s phosphate-buffered saline,DPBS)、4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-pheny lindole,DAPI)溶液、异硫氰酸荧光素(fluorescein isothiocyanate isomer,FITC)标记鬼笔环肽溶液、二甲基亚砜(dimethyl sulfoxide,DMSO)、MTT噻唑蓝、台盼蓝染色液 北京索莱宝科技有限公司;胎牛血清 美国Gibco公司;50 mg/dL和100 mg/dL谷氨酸-葡萄糖标准液 山东省科学院生物研究所;3D FloTrixTMDigest 北京华龛生物科技有限公司。
1.2 仪器与设备
3D FloTrix™ mini SPIN单通道生物反应器 北京华龛生物科技有限公司;真空冻干机 德国Christ公司;生物传感分析仪 山东省科学院生物研究所;pH计 奥豪斯仪器有限公司;荧光倒置显微镜 日本Nikon公司;扫描电子显微镜 捷克Tecan公司;自动细胞计数器 美国Thermo Fisher公司;多探测器酶标仪 美国BioTek公司。
1.3 方法
1.3.1 微载体的预处理
Cytodex 1:称量干燥的微载体置于玻璃瓶中,加入DPBS进行水合,4 h后去除上清液,加入新鲜的DPBS(50 mL/g),121 ℃高温灭菌,放置在4 ℃冰箱备用;3D TableTrixTM:将微载体直接加入培养基水合使用即可。
1.3.2 微载体的结构测定
1.3.2.1 扫描电子显微镜
将Cytdex 1 粉末样品镀金后上机观察。将3D TableTrixTM片剂溶于去离子水并置于10 cm培养皿中,在-20 ℃下冷冻2 h,真空冷冻干燥5~6 h,得到粉末状3D TableTrixTM微载体样品,镀金后上机观察。
1.3.2.2 粒径分析
使用光学显微镜观察Cytodex 1和3D TableTrixTM两种微载体的结构,并使用显微镜自带的软件测量微载体的孔径大小。
1.3.3 成肌细胞的平皿培养
细胞取自25 日龄鸡胚。在细胞提取中,将肌肉组织剪碎,0.25%胰酶消化30 min,每隔10 min观察一次,之后加入2 倍体积的培养基(含10%胎牛血清)以终止消化。收集消化液,1 500 r/min离心5 min,去上清液,将细胞重新悬浮在新的培养基中,并转移到培养皿中培养,24 h后更换培养基,观察细胞生长情况,细胞覆盖度达到80%后传代。
1.3.4 成肌细胞在3D TableTrix™和Cytodex 1两种微载体的增殖效率测定
将3D FloTrix-mini SPIN平台安装在细胞培养箱内,并与旋转速率控制器相连,将125 mL转瓶中的磁叶轮调整到适当高度,将转瓶高压灭菌,并在65 ℃烘箱中干燥后使用。
将3D TableTrixTM和Cytodex 1以质量浓度2 mg/mL加入125 mL无菌转瓶中,从培养皿中收获细胞,在转瓶中加入适当数量的细胞悬液,将培养基加至最终体积为100 mL。单独设置一个微载体混合培养组,将3D TableTrixTM和Cytodex 1分别以质量浓度1 mg/mL混合加入125 mL无菌旋转烧瓶中,培养条件与上述相同。将旋转烧瓶放置在3D FloTrix-mini旋转平台上,设置转瓶转速为40 r/min,每48 h从转瓶中吸取1 mL样品,对样品进行荧光染色并计数,观察对比细胞在两种微载体上的贴附情况。
1.3.5 基于微载体的成肌细胞最佳培养条件的测定
1.3.5.1 最佳起始条件的确定
取成肌细胞置于普通培养皿中,使用0.25%胰酶消化5 min,加入2 倍体积的细胞培养基终止消化。收集细胞于15 mL离心管中,1 000 r/min离心3 min,弃上清液,加入培养基使细胞重新悬浮。将3D TableTrixTM加入到含10 mL培养基的转瓶中,最后把细胞悬液加入到转瓶中,使细胞与微载体充分混合。搅拌速率设置为0(静止)、40 r/min(连续搅拌)和24 个周期(40 r/min×10 min和0 r/min×50 min)(间隔搅拌)。接种24 h后,搅拌速率恒定为40 r/min。从转瓶侧臂取1 mL样品,监测细胞生长情况,对样品染色和计数。为确保采样均匀,在吸取微载体样品时保持40 r/min的持续搅拌。通过测定接种后2、12 h和24 h样本上清液中的细胞数评估细胞贴附效率。
1.3.5.2 最佳细胞接种数量的确定
3D TableTrixTM用量为2 mg/mL,培养基体积为100 mL,转速为40 r/min。细胞接种数量分别为1×104、5×104、1×105、2×105个/mL。将细胞接种到转瓶中,在37 ℃培养箱中搅拌悬浮培养,每隔48 h采集1 mL样品监测细胞生长情况,对样品进行染色和计数,绘制细胞在微载体上的生长曲线,筛选出细胞的最佳接种数量。
1.3.5.3 最佳微载体质量浓度的确定
3D TableTrix™以0.5、1、2、4 mg/mL 4 个不同质量浓度接种到转瓶中,细胞接种数量为1×105个/mL,培养基体积为100 mL。将细胞接种到转瓶中,在37 ℃培养箱中搅拌悬浮培养,每隔48 h采集1 mL样品,监测细胞生长情况,对样品进行染色和计数并绘制细胞在微载体上的生长曲线,确定3D TableTrix™的最佳使用量。
1.3.5.4 最佳搅拌速率的确定
将细胞接种于转瓶中,细胞接种密度为1×105个/mL,微载体质量浓度为2 mg/mL,培养基体积为100 mL,24 h间隔搅拌后,细胞基本完全贴附在微载体上,分别设置转速为20、40、60 r/min 3 种搅拌速率进行持续搅拌培养,每隔48 h观察细胞在3D TableTrixTM上生长情况并计数,确定最佳搅拌速率。
1.3.5.5 血清对细胞悬浮培养的影响
首先将10 片微载体和一定数量细胞转移到转瓶中,加入血清体积分数为5%、10%和20%的培养基将细胞重悬,并转移到转瓶中,加入培养基使最终体积均为100 mL,同时以40 r/min的速率进行搅拌,每次搅拌10 min后,静置50 min。在循环第2、12、24次后,吸取转瓶中上清液并测定其中的细胞数,评估血清体积分数对细胞贴附微载体效率的影响,并使用DAPI染液对细胞在不同血清体积分数下培养24 h后吸取的样品进行染色观察,每隔48 h采集1 mL样品观察细胞在微载体上的生长情况,并绘制细胞生长曲线,以血清体积分数10%的培养基作为对照,分析血清含量对细胞增殖效率的影响。
1.3.5.6 补料方式对细胞悬浮培养的影响
取细胞接种于转瓶中,细胞接种数量为1×105个/mL,接种微载体质量浓度为2 mg/mL,使用含20%胎牛血清(V/V)的DMEM培养基为初始培养基,接种24 h后加入相同体积的无血清培养基稀释为含有10%胎牛血清的DMEM培养基,使得培养基最终体积为100 mL。分别采用每天更换20%培养基、接种后隔天更换50%培养基、接种后每3 d更换80%培养基3 种不同补料策略进行培养,每隔48 h取样观察细胞在微载体上的生长状况,并绘制细胞生长曲线。
1.3.5.7 珠对珠转移
将细胞接种于两个转瓶中,细胞接种数量为1×105个/mL,接种微载体质量浓度为2 mg/mL,培养基体积均为100 mL。细胞在37 ℃、5%的CO2环境中培养8 d,第8天分离转瓶中携带细胞的微载体,加入至一个新的125 mL转瓶中,该瓶内有10 片新鲜的3D TableTrixTM,加入培养基至最终体积为100 mL,另一个转瓶培养微环境保持不变,细胞在40 r/min的恒定搅拌速率下继续培养6 d。每48 h对细胞进行计数,采用细胞的荧光染色量化细胞生长。
1.3.5.8 基于微载体的细胞培养过程中葡萄糖和乳酸浓度的变化
从普通培养皿中收获成肌细胞,转瓶中的细胞接种数量为1×105个/mL,微载体质量浓度为2 mg/mL,培养基最终体积为100 mL。将细胞在37 ℃、5%的CO2环境中培养,每隔12 h,从转瓶中吸取上清液1 mL,将吸取的上清液用生化分析缓冲液稀释5 倍,加入到生物传感分析仪中,记录所取上清液中葡萄糖和乳酸的浓度。
1.3.5.9 细胞转瓶培养体系的扩大
按1.3.5.7节方法,将1×107个细胞在100mL培养基中培养8 d,将载有细胞的微载体从转瓶中分离出来,用于珠对珠转移到1 L转瓶中。将90 片新鲜的3D TableTrixTM、载有细胞的微载体和1 L培养基通过容器的侧臂添加到2 L转瓶中,每96 h取样并进行细胞计数,观察细胞在更大规模的转瓶中的生长情况。
1.3.5.10 微组织的冻存和复苏
从转瓶中取出含有细胞的微载体样品,离心去上清液,加入含10% DMSO、20%血清和70% DMEM的1 mL冷冻保存剂,将冻存样品封装到冻存管中,并将冻存管置于冻存盒内存放到-80 ℃冰箱中冷冻24 h,之后转移到液氮中长期储存。
将冻存盒中的微组织从液氮中取出,立即浸入37 ℃的水浴中2 min,轻轻晃动冻存管以促进解冻。解冻完全后,转移至15 mL离心管中,缓慢加入10 mL培养基,1 000 r/min离心5 min,沉淀微组织,弃上清液。从解冻的微组织中获取细胞,并对冻存3、7、14、30 d的细胞进行活性检测。使用显微镜对从解冻后微组织中获取的细胞和普通细胞进行观测,并使用MTT法对其增殖效率进行对比。
1.3.5.11 细胞的收获和计数
吸取携带细胞的微载体到EP管中,微载体沉降后去除上清液。3D FloTrixTMDigest裂解液以0.15 mL/mg微载体的比例加入,37 ℃孵育30 min,用台盼蓝染色法通过自动细胞计数器对细胞计数,根据式(1)计算细胞回收率,式(2)计算细胞存活率:
2 结果与分析
2.1 Cytodex 1和3D TableTrixTM的结构分析
2.1.1 Cytodex 1和3D TableTrixTM的外观表征
3 D Table TrixTM是一种新型的大孔明胶微载体,这种微载体以固定质量的片剂状态存在,厚度为(1.57±0.01)mm,直径为(8.01±0.05)mm(图1A1)。而Cytodex1是一种带正电、无孔的聚乙烯微载体,以粉末状态存在(图1B1),经常用于在搅拌式生物反应器中培养细胞[27]。图1A2、A3和图1B2、B3分别显示了3D TableTrixTM片剂和Cytodex 1粉末在显微镜以及扫描电镜下的放大图像。3D TableTrixTM是一种表面多孔且孔隙较大的不规则球体,这种多孔结构为细胞在微载体上的附着和生长提供了较大的可用面积。Cytodex 1是一种表面光滑的球体,无大孔结构。

图1 3D TableTrix™片剂(A)和Cytodex 1粉末(B)目测及其微观图Fig.1 Visual measurement and electron microscopic images of 3D TableTrix™ (A) and Cytodex 1 powder (B)
2.1.2 微载体的粒径分布
通过显微镜测量相同质量的两种微载体水合后的粒径分布情况,结果如图2所示,Cytodex 1的平均粒径为265 μm,明显高于平均粒径为195 μm的3D TableTrixTM,而且3D TableTrixTM的粒径大小相比Cytodex 1更加不均匀。

图2 微载体的粒径分布Fig.2 Particle size distribution of microcarriers
2.2 细胞在两种微载体的生长情况分析
2.2.1 细胞在两种微载体的增殖效果分析
基于微载体的细胞生长曲线如图3a所示,在接种最初的24 h内,大部分细胞都贴附在微载体上。基于两种微载体培养的细胞均在第2天进入指数期,在第7天进入平台期,细胞生长曲线之间的生长趋势没有区别,均呈S型曲线。然而,细胞在微载体上的分布不同,从细胞附着在微载体上生长的第4天开始,细胞在两种微载体上的增殖效率有显著差异(图3b),并且随着时间的延长,细胞数量在两种微载体上的差异越来越大。最终细胞的收获量如图3b所示,3D TableTrixTM显著高于Cytodex 1,为8.97×105个/mL,细胞在3D TableTrixTM比Cytodex 1有更高的增殖效率。

图3 细胞生长曲线(a)和差异性分析(b)Fig.3 Cell growth curves (a) and difference analysis (b)
2.2.2 细胞在两种微载体的附着效果分析
细胞在微载体上附着48 h后,通过使用DAPI和FITC标记的鬼笔环肽两种染液对微载体进行染色观察,图4A1~A4表明细胞可以较好附着在Cytodex 1上,图4B1~B4表明细胞同样可以附着在3D TableTrixTM上。将两种微载体以相同质量与细胞混合培养,培养4 d后,取混合液染色观察,结果发现,细胞在两种微载体上的附着有显著差异(图4C1~C4)。
2.2.3 细胞在两种微载体的存活率和回收率分析
Cytodex 1由于其表面刚性强,不容易被裂解,因此,使用差速离心法对Cytodex 1附着的细胞进行收集;3D TableTrixTM可以通过用其特定的裂解试剂3D FloTrixTMDigest实现完全裂解,并且裂解后细胞的收获效率更高。在显微镜下观察到,3D TableTrixTM在30 min内完全溶解(图5),细胞回收率达到(98.6±0.1)%,细胞存活率维持在(94.2±0.1)%。虽然Cytodex 1可以通过差速离心法实现对细胞的收集,但在胰酶消化和离心过程中对细胞的收获效率存在很大影响,而3D TableTrix™通过其特定的裂解液实现对细胞的高效回收。综合来看,3D TableTrixTM相比Cytodex 1更适合进行成肌细胞的大规模培养,后续实验对3D TableTrixTM微载体细胞培养体系进行优化和完善。
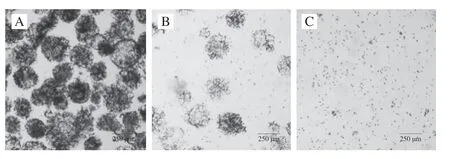
图5 3D TableTrixTM溶解的明场图Fig.5 Bright field images of cells during the dissolution of 3D TableTrixTM
2.3 搅拌方式对细胞转瓶培养体系的影响
本研究测定了3 种不同的搅拌模式(即静止(不搅拌)、持续搅拌和间隔搅拌)在接种的前24 h内对细胞附着的影响,结果如图6a所示。2、12 h和24 h细胞的贴附率并没有显著差异(P>0.05)。对吸取的样品进行染色观察结果见图6b~d,发现细胞悬浮培养24 h后,间隔搅拌使细胞在微载体上的分布更加均匀,有利于细胞的增殖。有研究发现,细胞接种后在高速和低速之间(或搅拌和非搅拌周期的间隔)间隔搅拌,可最大限度地提高细胞与微载体的相互作用,促进细胞均匀分布,同时在低速搅拌或不搅拌期间将细胞贴附在微载体上[28-30]。因此,采用间隔搅拌用于后续实验,以促进细胞均匀贴附在微载体上。

图6 搅拌方式对细胞转瓶培养体系的影响Fig.6 Effects of stirring methods on cell culture in spinner flasks
2.4 细胞接种密度对细胞培养结果的影响
为了探索适合微载体培养的最佳细胞接种密度,本实验使用固定质量浓度的微载体,并将不同数量的细胞与微载体混合,以探索适合微载体细胞培养的细胞数量。结果表明在细胞增殖过程中,不同数量接种的细胞生长有显著差异(P<0.05)(图7A)。接种数量为1×104个/mL的细胞在培养10 d后未能进入指数期。按照其增殖趋势,细胞进入指数期需要较长时间,不利于细胞大规模培养。当接种数量为5×104个/mL时,细胞正常增殖进入指数期,达到有效增殖,其扩增倍数明显高于其他细胞接种的密度,但第10天细胞生长曲线尚未到达平台期(图7B)。虽然5×104个/mL可以实现细胞的大规模培养,但所需时间较长,效率较低。相比之下,1×105个/mL和2×105个/mL两组效果好于其他组。由于接种数量的差异,1×105个/mL组在第8天达到平台期,2×105个/mL在第6天达到平台期。但是2×105个/mL组因为接种数量较多,其扩增倍数相较于其他几组比较低,同时细胞在微载体上出现大量聚团,导致细胞大量脱落死亡(图7F2)。接种数量为1×105个/mL时,细胞呈现良好增殖,细胞微载体聚团较少(图7E2)。因此,细胞接种数量为1×105个/mL适合细胞的大规模培养。
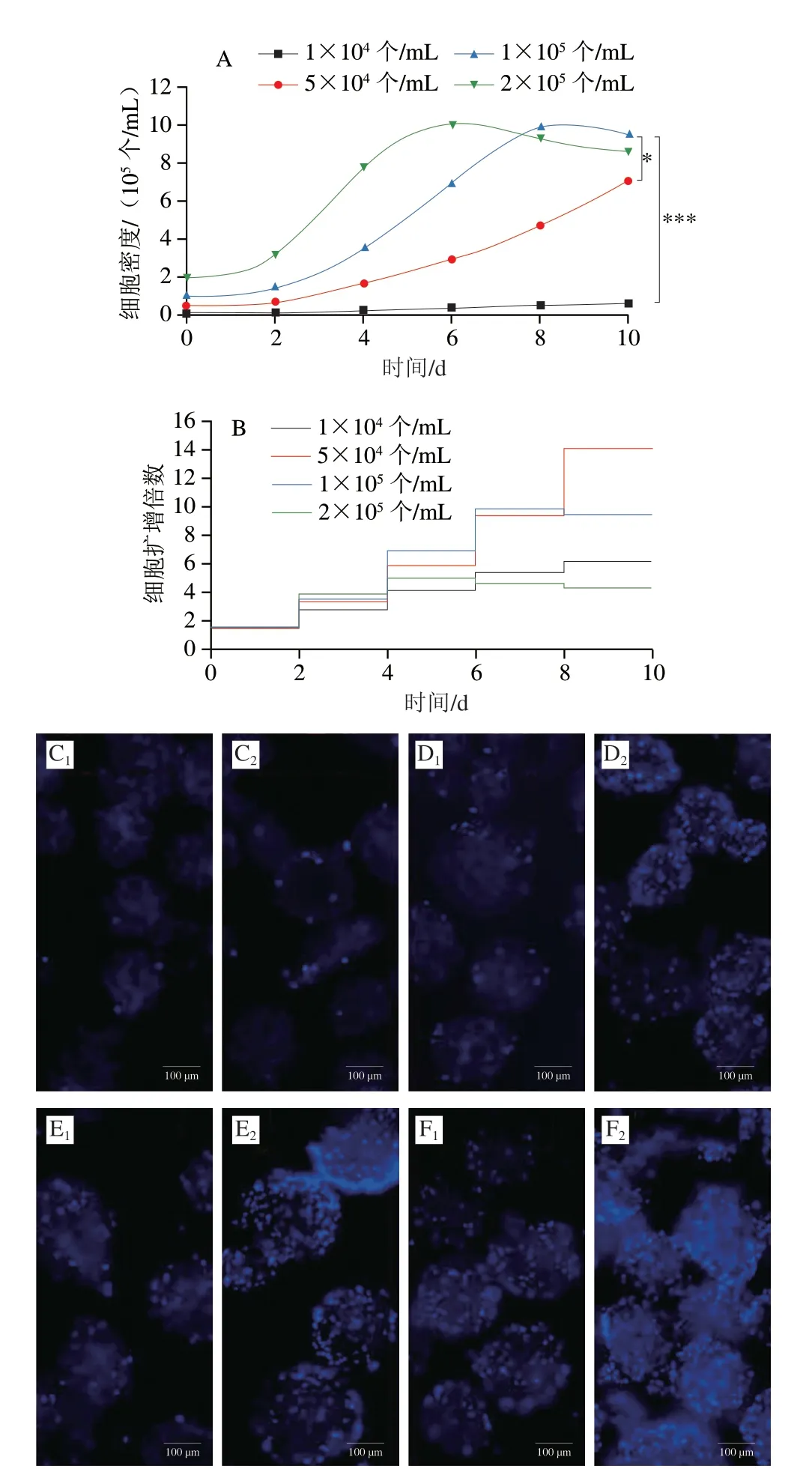
图7 细胞接种数量对细胞培养结果的影响Fig.7 Effect of inoculation amount on cell culture
2.5 微载体质量浓度对细胞培养结果的影响
在细胞生长过程中,不同微载体质量浓度环境下的细胞生长有着较大差异。如图8A所示,0.5 mg/mL组微载体质量浓度较低,细胞在贴附微载体后,在第4天达到平台期,细胞数量和细胞扩增倍数相比其他组少(图8B),不适于细胞的大规模培养。4 mg/mL组,由于微载体质量浓度比较高,大量微载体空载(图8F2),导致细胞在微载体上生长效率较低,考虑到细胞接种到生长抑制的周期为7 d,因此,4 mg/mL也不适于细胞的大规模培养。1 mg/mL和2 mg/mL组细胞在微载体上生长情况好于其他两组,通过图8A发现2 mg/mL组细胞数量显著高于1 mg/mL组。因此,确定最佳微载体质量浓度为2 mg/mL。

图8 微载体质量浓度对细胞培养结果的影响Fig.8 Effect of microcarrier concentration on cell culture
2.6 搅拌速率对细胞培养结果的影响
为了评估搅拌速率对细胞增殖的影响,在转瓶中以20、40 r/min和60 r/min进行培养。当搅拌速率为20 r/min时,细胞生长较快,最大细胞数量为8.91×105个/mL,但在转瓶培养过程中,微载体无法实现悬浮失重,在显微镜下观察细胞在微载体上生长分布不均匀且细胞微载体聚团较多,因此在20 r/min搅拌速率下不利于细胞在转瓶中实现大规模培养。搅拌速率为40 r/min和60 r/min时,细胞最大数量分别为9.86×105个/mL和7.92×105个/mL。搅拌速率为60 r/min时,细胞数量从1×105个/mL增加到第8天的7.92×105个/mL,显著低于其他两组(图9),而且细胞增殖速率较慢,同时观察到部分细胞从微载体上脱落。提高转瓶的转速可以增加细胞与微载体的接触率,然而这一过程也会增加剪切力,降低细胞活力[31],并且不利于细胞与微载体的贴附。因此,采用40 r/min为细胞培养的最佳搅拌速率。
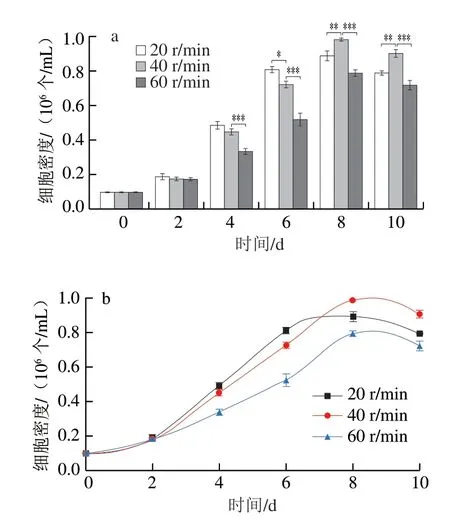
图9 不同转速下细胞数量的差异性分析(a)和生长曲线(b)Fig.9 Differential analysis of cell number at different rotation speeds (a) and cell growth curves (b)
2.7 补料方式对细胞培养结果的影响
在细胞转瓶培养体系中,为避免吸出微载体导致细胞的损失,无法进行100%培养基的交换。本研究中采用每天更换20%培养基、隔天更换50%培养基以及第3天一次性更换80%培养基3 种不同的补料方式,细胞的生长曲线如图10所示。在整个培养过程中,3 种补料方式最终所收获细胞密度差异较为显著。其中每天更换20%培养基的补料方式获得的细胞密度最低,收获细胞数量为7.41×105个/mL;第3天一次性更换80%培养基略优于每天更换20%培养基的补料方式,其获得的细胞数量为7.79×105个/mL;隔天更换50%培养基的补料方式获得了最多的细胞数,细胞收获数量达8.84×105个/mL,并且收获的细胞密度显著高于其他两组,其他两组因为在细胞培养过程中产生了更多有害的代谢物质,因此,选择隔天更换50%培养基为最优补料方式。

图10 不同补料方式下细胞的生长差异性分析(a)和生长曲线(b)Fig.10 Effect of different feeding methods on cell growth
2.8 血清体积分数对细胞培养结果的影响
在体外培养中,血清中必须含有大量的生长因子才能维持细胞活力,促进细胞生长[32]。较高的血清体积分数可维持细胞的良好状态,促进细胞增殖[33]。细胞使用含5%、10%、20%血清的培养基进行培养,分析不同血清体积分数对细胞的影响,以此来探索合适的培养方法。图11a表明,随着初始血清含量的增加,细胞在微载体上的贴附率显著增加,细胞生长状况有了明显改善,从图11c细胞的染色结果中也可以发现,随着血清含量的增加,每个微载体上的平均细胞贴附数量也显著增加,20%血清组细胞贴附率显著好于其他两组(P<0.05)。根据细胞贴附数量的不同,20%初始血清是较优方案。而在之后细胞培养过程中,在达到细胞最大浓度之前,虽然细胞生长速率随着血清体积分数的增大而加快,但是10%血清和20%血清两组间细胞密度无显著差异(P>0.05)(图11b),分别为9.1×105个/mL和9.25×105个/mL。在细胞培养过程中,较高的血清体积分数可以有效地确保细胞的活性和增殖能力[34],但成本会相应增加。通常情况下,细胞培养过程使用血清体积分数为10%的培养基。一方面,初始培养过程中高血清含量提高了细胞和微载体之间的生物相容性;另一方面,增加了细胞的活力,促进了细胞贴壁的效率。在本实验中,当大多数细胞在24 h内贴附在微载体上时,逐渐增加培养基,将血清稀释到10%,降低培养成本的同时又可以提高细胞贴附和增殖效率。

图11 血清体积分数对细胞培养结果的影响Fig.11 Effect of serum volume fraction on cell culture
2.9 珠对珠转移
细胞增殖与其生长所需的表面积息息相关,为促进细胞增殖以获得更高的产量,提供更大的表面积至关重要。在常见的单层培养中需从培养皿消化收集细胞,再接种到更多的新培养皿中,而微载体培养是在适当时间提供新的微载体,从而扩大细胞生长所需的表面积,实现细胞连续扩增,不需要采集细胞和重新接种,这种扩增效果需要珠对珠转移技术的应用,该技术可使细胞在培养过程中转移到新的微载体上[35]。本研究的珠对珠转移效果如图12a所示,加入了新的微载体后细胞开始进一步生长。由于细胞在微载体间的转移,细胞的染色图像出现了细胞桥(图12c4)。添加新微载体后隔天的染色图像可以进一步证实这种转移(图12c1~c3)。同时利用珠对珠转移实现了细胞的连续扩大培养,由图12b可以看到,当微载体质量浓度为2 mg/mL时,最大细胞数量可达到7.42×105个/mL;微载体质量浓度为4 mg/mL时,最大细胞数量可达到1.08×106个/mL;而当微载体质量浓度增加到6 mg/mL时,最大细胞数量可达1.74×106个/mL,利用珠对珠转移实现了细胞的连续扩增培养。

图12 珠对珠转移对细胞转瓶培养的影响Fig.12 Effect of bead-to-bead transfer on cell culture
2.10 细胞转瓶培养过程中的生长和代谢分析
在细胞转瓶培养过程中,培养基中葡萄糖和乳酸浓度的变化直接反映了细胞在微载体上增殖的代谢情况[36]。基于上述优化后的细胞转瓶培养体系进行代谢分析,主要代谢产物的变化如图13所示,细胞的代谢产物质量浓度随着细胞培养的进程而变化。由图13可知,在细胞贴附微载体的初期,葡萄糖的消耗量较低,同时乳酸的累积量也很低,在细胞进入活跃的指数增长期后,葡萄糖的消耗量增大,产生的乳酸量也快速升高,培养120 h后随着细胞在微载体表面生长密度的增加细胞生长进入平台期,这时虽然细胞的密度不再增加,但葡萄糖的消耗和乳酸的分泌在更新培养基后仍然呈现快速变化,这说明动物细胞的葡萄糖代谢与细胞的数量之间呈现正相关,葡萄糖代谢不仅可以为细胞生长提供所需的能量和原料,也可以维持细胞的正常生命活动,因此,在培养过程中调控这两者间的平衡对于提高葡萄糖的综合利用至关重要。

图13 转瓶培养中细胞的葡萄糖代谢情况Fig.13 Glucose metabolism of cells in spinner flask culture
2.11 微载体转瓶培养体系的扩大
通过对3D TableTrixTM进行珠对珠转移的可行性验证,进行更大规模的培养。将1×107个细胞和10 片(0.2 g)微载体加入到125 mL的转瓶中,培养8 d后一共收获9.81×107个细胞(9.81 倍扩增)。将含有9.81×107个细胞的微载体接种到100 片(2 g)微载体上,置于2 L转瓶中继续培养。最终获得的细胞总数达到1.07×109个,存活率达到95%以上(图14)。因此,在24 d内细胞实现了107 倍的扩张。

图14 细胞在2 L转瓶中的生长曲线Fig.14 Growth curves of cells in 2 L spinner flasks with 3D TableTrixTM
2.12 显微组织的冷冻保存
在冷冻保存3、7、14 d和30 d后解冻,细胞仍保持80%以上的存活率(图15a),使用解冻微载体后的细胞(微组织)也成功进行了细胞扩增,这与正常解冻细胞作为开始扩增的种子细胞增殖状况(图15b)和形态(图1 5 c1、c2)没有显著差异(P>0.0 5),3 D TableTrixTM可与传统的冷冻保存技术兼容,细胞复苏后仍然附着在微载体上(图15c3、c4),从而证明了将微组织冻存作为后续大规模培养中种子细胞的可行性。

图15 微组织冻存对细胞的影响Fig.15 Effect of microtissue cryopreservation on cell survival
3 结论
鸡成肌细胞是生产细胞培育肉的细胞来源,将细胞培养应用于细胞培育肉中,需要大量细胞,因此细胞的大规模培养至关重要。本研究分析了细胞在Cytodex 1和3D TableTrixTM两种微载体上的生长情况,筛选出3D TableTrixTM作为成肌细胞大规模培养的微载体。3D TableTrixTM是一种可分散、可溶解的多孔微载体片剂,操作简单,可通过珠对珠的转移消除细胞传代过程中的酶解离过程,极大简化了成肌细胞扩增的流程。此外,细胞可以在3D TableTrixTM微载体上冷冻保存,解冻后仍具有高活力且保留了3D宏观结构。微载体作为种子细胞在后续批次的培养中进行珠对珠转移,可用作植入性载体进行细胞培养。然而,微载体Cultispher-G和3D TableTrixTM具有相似的化学组成和宏观结构。3D TableTrixTM相比Cultispher-G主要优势如下:1)3D TableTrixTM孔隙更大,细胞生长更多;2)细胞在3D TableTrixTM相比Cultispher-G生长效率更高[37-38];3)3D TableTrixTM可以通过特定的裂解液3D FloTrixTMDigest进行裂解,从而实现细胞的高效回收。因此,在符合生产质量管理规范下,使用这种高效的微载体,以工业化规模生产成肌细胞产品(如细胞培育肉)成为一种可能。
微载体通常在搅拌式生物反应器中使用,因为微载体具有高的表面积-体积比,所以细胞的增殖效率高,同时微载体的沉降系数也很关键,微载体既要在一定时间实现沉降,又要在生物反应器的一定转速下实现悬浮。相比于无孔球形微载体,使用大孔微载体可以提供更高的表面积-体积比,从而获得更高的细胞密度,对3D TableTrixTM的研究可支持这一理论,即多孔微载体更能促进细胞培养,这为细胞培育肉的生产提供了新思路,将微载体用于细胞培育肉的有3种可能情况:1)作为支持细胞增殖的临时载体,之后细胞被取出并进一步加工;2)被溶解或降解以释放细胞的临时载体;3)与最终产品相结合的可食用载体。目前为止,专为细胞培育肉行业开发的商用微载体尚无,该领域有很大的需求和潜力,开发可食用的或可被降解和溶解的微载体至关重要。
