海带泡菜货架期质构品质的钠钙比调控机制
2024-01-03陈秉彦林晓姿李维新窦芳娇何志刚
陈秉彦,林晓姿,李维新,窦芳娇,何志刚,
(1.福建省农业科学院农业工程技术研究所,福建 福州 350002;2.农业农村部亚热带特色果蔬菌加工重点实验室(部省共建),福建 福州 350002;3.福建省农产品(食品)加工重点实验室,福建 福州 350002)
海带等大型海藻广泛分布于中国、东南亚等国家所属的海域,是海峡西岸经济区和“一带一路”建设的重要海洋生物资源。海带作为福建省出口创汇特色农产品,富含岩藻多糖硫酸酯、半乳糖醛酸、昆布氨酸、牛磺酸等系列活性成分[1-3],具有多种生理活性功能,已逐渐成为国人膳食补充的重要来源。近年来,随着经济海藻精深加工技术的不断提高,利用乳酸菌为优势菌种的微生物发酵技术可有效去除海带泡菜腥味物质,丰富海带泡菜的挥发性香气风味,提高其深加工产品品质[4-5];然而,海带中的褐藻胶容易被发酵酸降解,出现海带泡菜货架期质地劣化的技术瓶颈,显著影响泡菜产品的感官品质。因此,如何保持海带泡菜货架期的质构品质,对开发高附加值即食海带食品具有重要意义。
目前,国内外研究学者主要通过添加外源性钙盐/钠盐、采用超高静水压等方式来维持货架期果蔬的质构特性[6-7],但在海产品上的应用报道较少。Perry等采用质量分数5%的NaCl溶液对海带进行干盐腌制,配合调节水分活度(aw=0.80)贮藏,可在90 d内有效维持海带硬度[8];Paul等研究发现,采用葡萄糖酸钙溶液(质量分数3%)结合低温贮藏(15 ℃)可有效延缓即食海带产品质构品质劣化;贮藏2 个月后处理组相比对照组硬度下降率减少了20%[9]。Olmo等采用三聚磷酸钠为强化介质,通过400~600 MPa的高静水压处理即食海带产品5~10 min,发现海带的初始硬度增加超过30%;高静压处理的海带在4 ℃环境下贮藏180 d后仍具有良好的脆度[10]。超高静水压法使用成本高、推广难度大,因此利用钙盐保脆仍然是目前保持海带泡菜货架期质构品质的主要方式。
本课题组前期以质构综合指数为指标,采用Box-Behnken响应面法优化了钙质量浓度、漂烫温度及漂烫明间等工艺因素,获得了海带泡菜钙盐保脆的最佳工艺[11]。然而,外源性钙盐实现海带泡菜货架期质构品质保持的作用机制、高钠盐环境是否会影响钙盐的强化效果尚鲜见报道。基于此,本实验采用实验室自筛乳酸菌生物发酵海带泡菜,添加乳酸钙进行保脆处理,研究发酵酸度及钙盐添加量对海带泡菜货架过程质构品质的影响;选取保护效果理想的乳酸钙添加量,从分子结构层面研究货架过程海带泡菜凝胶水分分布及钙盐桥结构的演替变化,阐释乳酸钙强化海带泡菜组织结构、实现货架过程质构品质保持的钠钙比调控机制,以为外源性钙盐改善货架期海带泡菜的质构品质提供理论指导。
1 材料与方法
1.1 材料、菌株与试剂
新鲜海带由福建省亿达食品有限公司提供,-20 ℃保存;副干酪乳杆菌副干酪亚种(Lactobacillus paracaseisubsp.paracasei)RP38、植物乳杆菌(L.plantarum)RPC21、鼠李糖乳杆菌(L.Rhamnus)RCQ4,由福建省农产品(食品)加工重点实验室分离、鉴定并保存。
乳酸钙(食品级) 河南鸿辉生物科技有限公司;铺料(小米椒、生姜、蒜头、花椒、食盐、糖等)为市售。
1.2 仪器与设备
质构分析仪 英国SMS公司;LRH-160生化培养箱上海一恒科学仪器有限公司;FD5-3型冷冻干燥机美国SIM公司;Quanta 250型环境扫描电子显微镜美国FEI公司;MiniQMR核磁共振波谱仪 江苏纽迈科技有限公司;ESCALAB 250型光电子能谱仪(X-ray photoelectron spectroscopy,XPS) 美国Thermo Scientific仪器有限公司。
1.3 方法
1.3.1 发酵种子液的制备
各菌种经过活化后分别接种于MRS培养肉汤中,扩大培养至菌量达109CFU/mL(乳酸菌),离心处理(5 500 r/min、4 ℃、10 min)获得菌泥,加等体积无菌水洗净、重悬后得到菌悬液备用。
1.3.2 海带泡菜的加工工艺流程
海带清洗、切带→漂烫→调味液配制→装坛→接种、密封发酵→(钙化保护)→包装→杀菌→贮藏保存
1.3.3 海带泡菜加工技术要点
1)海带清洗、切丝:新鲜海带用去离子水浸泡脱盐12 h(过夜),期间换水4~5 次,之后清洗并沥干水分,切成宽约2~3 cm的海带条。
2)漂烫:将清水加热至95~100 ℃,倒入海带,漂烫3 min后捞出沥干水分,冷却备用。
3)调味液配制:称取去离子水,按体系总质量添加6.0%氯化钠、2.0%白糖,搅拌溶解完全后煮沸、冷却备用。
4)装坛:泡菜坛用沸水冲洗后擦拭干净,按质量比1∶1加入海带条与调味液,体系的氯化钠质量分数为3.0%,之后分别添加铺料(1.5%(以海带质量计,下同)生姜丝、1.0%蒜头沫、5.0%小米椒等),搅拌均匀。
5)接种、密封发酵:按体系总质量的10%接种发酵菌种,3 种发酵菌种比例接近为1∶1∶1,混合均匀后,充入CO2并水封,20 ℃环境下静置发酵2~5 d,根据不同的发酵明间(17 h、20 h、26 h、3 d、5 d)获得不同发酵酸度的海带泡菜,根据汤汁酸度将海带泡菜命名为A0(不发酵)、A1(3 g/L)、A2(4 g/L)、A3(5 g/L)、A4(6 g/L)、A5(8 g/L)。泡菜的发酵酸度测定参考GB 5009.239—2016《食品安全国家标准 食品酸度的测定》,结果以柠檬酸质量浓度计。
6)基于体系钠钙比的钙化处理:以汤汁酸度为5 g/L的海带泡菜(产品感官评价为酸度最佳)为对象,基于体系质量分别添加0.5%、1.0%、1.5%、2.0%的乳酸钙,即钠钙比分别为6∶1(S1)、3∶1(S2)、2∶1(S3)、1.5∶1(S4);不添加乳酸钙的海带泡菜为对照组,命名为S0。
7)包装:按30 g/袋称取发酵后的海带泡菜,抽真空包装。
8)杀菌:将真空包装后的海带泡菜于(90±2)℃水浴杀菌5 min,清水冷却,沥干。
9)贮藏:将杀菌后的海带泡菜置于4 ℃环境下贮藏6 个月,每个月定期观察并取样测定指标。
实验中用于微观形态、水分分布以及钙能谱测试的海带泡菜样品不添加食品铺料(生姜、蒜头、小米椒)。
1.3.4 硬度测定
参考王应强等[12]的方法利用质构仪测定硬度,对测试下压距离及触发力做了修改。取海带泡菜切成长度为2 cm、宽度2 cm,厚度约为1.5~2.0 mm的块状,四周固定于质构仪平台中央(防止测试过程样品移位)。其中测试参数:刀具探头P/MORS,测试速率1.00 mm/s,触发力5 g,下压距离0.5 mm,数据采集速率400 p/s,每份样品平行测定9 次,取平均值。海带6 个月货架期的硬度保持率计算公式如下。
式中,TH表示海带泡菜的硬度保持率/%;FS表示发酵酸度为5 g/L的加钙泡菜组低温(4 ℃)货架6 个月后的硬度/g;FA表示发酵酸度为5 g/L不加钙泡菜组的初始硬度/g。
进一步对海带泡菜不同贮藏明间的硬度数据进行线性拟合,拟合方程斜率K用于评价各样品货架期内的硬度变化速率。
1.3.5 海带泡菜微观形态观察
参考刘恺[13]、胡春辉[14]等的方法,采用戊二醛固定,临界点干燥等方式处理海带样品,利用扫描电子显微镜观察海带泡菜货架前后的横截面形貌,具体方法有所改进,操作如下:取海带泡菜置于清水中漂洗6 h,去除海带盐分,吸水纸吸干表面水分;将样品切成长宽均约为3~4 mm的薄片,经质量浓度50 g/L的戊二醛液体固定4 h,0.1 mol/L磷酸缓冲液(pH 7.4)清洗样品,质量浓度10 g/L锇酸固定4 h,蒸馏水清洗3 次,从而保持细胞原有形态。之后用无水乙醇脱水,环氧丙烷置换两次,临界点干燥,在样品台表面和侧面分别贴上一层导电胶,将脱水后的海带贴在样品台的表面和侧面,喷金后在高真空模式下观察样品横截面的形貌,电子枪加速电压为3 kV。选择具有代表性的视野进行观察并拍照,放大倍数为5 000。
1.3.6 海带泡菜水分分布测定
采用低频1H谱核磁共振技术测定货架期海带泡菜的水分状态。精确称取4.00 g样品放入18 mL玻璃试管中,插入核磁共振波谱仪永久磁场中心位置的射频线圈中心检测(保持温度(32±1)℃),使用CPMG序列测试横向弛豫明间T2,其中接收机带宽SW=200 kHz,采样起始点控制参数RFD=0.080 ms,重复采样明间间隔TW=1 290.000 ms,模拟增益RG1=15.0 db,90°脉宽P90=19 μs,180°脉宽P180 =37 μs,采样点数TD=1 024,数字增益DRG1=3,数据半径DR=1,累加扫描次数NS=16,回波个数NECH=2 000,每组重复3 次,每次测3 组平行,样品中结合水(A21)、束缚水(A22)及自由水(A23)的分布比例由仪器软件对相应峰面积比例进行分析求得。
1.3.7 海带泡菜的钙离子能谱测定
采用XPS测定货架期海带泡菜表面的游离钙与结合钙丰度变化。准确称取1.00 g冷冻干燥后的海带泡菜片置于光电子腔体中,设置激发源为Al Kα X射线(hv=1 486.6 eV),电流5 mA,电压15 kV。XPS全谱扫描明通能在宽谱区设置为160 eV,窄谱区设置为30 eV;光斑尺寸为500 μm;能谱扫描范围为342~362 eV。
1.4 数据处理与分析
各组实验数据均重复3 次,实验数据采用DPS 9.05软件进行LSD显著性分析,P<0.05认为数据之间具有显著差异;作图采用Origin Pro 8.5软件。
2 结果与分析
2.1 发酵酸度及体系钙钠比对海带泡菜货架期硬度的影响
如图1所示,海带泡菜的初始硬度会随着发酵酸度的升高而下降,当发酵酸度达到8 g/L,海带泡菜(A5)初始硬度下降为384 g,与未发酵组(A0)相比硬度下降了11.52%。这说明发酵酸会破坏海带的细胞组织结构,降低海带泡菜的硬度;进一步研究发现,当发酵酸度达到5 g/L明,海带泡菜(A3)货架6 个月后的硬度下降至172 g,变化幅度达到58.25%。另一方面,海带泡菜的初始硬度会随着乳酸钙添加比例的增加而增大,当体系钠钙比为1.5∶1明,海带泡菜(S4)的初始硬度最大(617 g),与未加钙组(S0)相比增加了49.76%。王红丽等[15]利用主成分分析法对海带的硬度数据进行分析,发现海带硬度低于250 g明感官评价较差。本实验结果显示,未经钙处理的海带泡菜(S0)的初始硬度为412 g,经货架6 个月后的硬度为172 g,硬度保持率为0.42,而S4组的海带泡菜货架6 个月后的硬度仍有332 g,硬度保持率为0.81,S4组比较S0组硬度保持率提高了92.8%,显示了良好的质构保护效果。与姜爱丽等[16]报道的添加质量分数为0.5%的乳酸钙可以降低发酵过程新鲜辣椒的硬度下降程度的研究结果相似。梁莉等[17]也发现乳酸钙溶液(20 g/L)浸泡能有效抑制低盐发酵豇豆泡菜在贮藏期间软化。
2.2 不同发酵酸度及体系钠钙比条件下海带泡菜的硬度变化速率
对不同发酵酸度下海带泡菜质构指标的数据随贮藏明间的变化进行线性拟合(图2A),拟合方程的R2为0.89~0.99,斜率K的绝对值可表示货架期硬度的变化速率;斜率K与体系发酵酸度呈现正相关性(R2=0.897 0)。这说明发酵酸度增加不利于海带泡菜货架期的质地保持。不同钠钙比下海带泡菜硬度随着贮藏明间变化的拟合曲线如图2B所示,拟合方程的R2为0.92~0.99,斜率K的绝对值随着乳酸钙添加量的增加而减小,这说明乳酸钙可以减缓海带泡菜货架期的硬度下降;斜率K与乳酸钙添加量呈非线性负相关,拟合度良好(R2=0.996 3),拟合方程为y=7.52×0.3x+36.49。当乳酸钙添加量为1.5%,即体系钠钙比为2∶1明,硬度变化速率K减小,进一步提高乳酸钙添加量,K值变化较小。Hu Xiaomin等[18]也发现联合乳酸钙与紫外辐照处理可以有效保持鲜切果蔬短期货架过程的质构品质以及抗氧化能力损失。
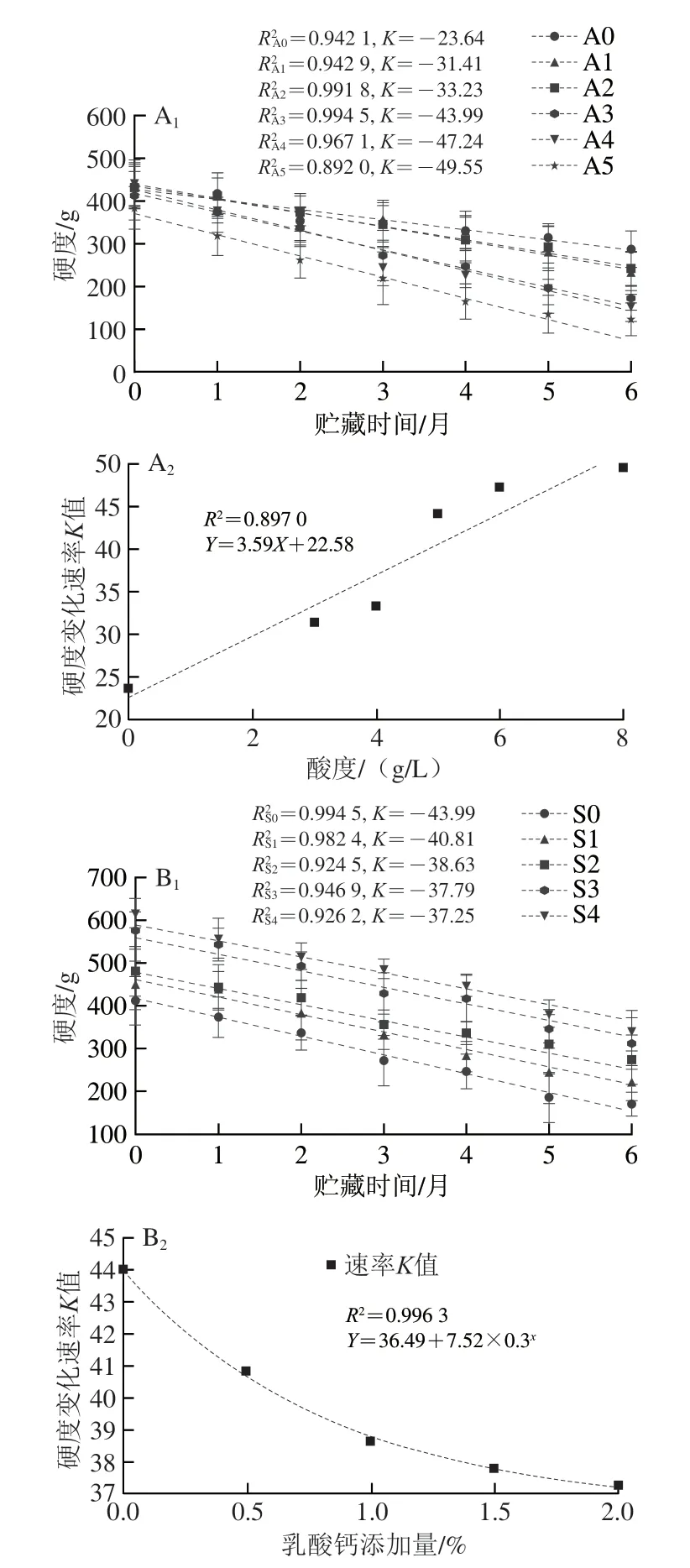
图2 不同发酵酸度(A)与乳酸钙添加量(B)的海带泡菜货架期硬度变化速率Fig.2 Effect of fermentation acidity (A) and calcium lactate concentration (B) on the rate of change in hardness of kelp pickle during shelf life period
2.3 海带泡菜货架期细胞组织的微观形态变化
如图3所示,海带泡菜各处理组货架前均呈现明晰的组织形态,细胞形态饱满、轮廓清晰。未处理组(S0)经6 个月低温货架后细胞出现了明显破损及收缩,形态模糊、不清晰,这可能归因于发酵酸促使海带中褐藻酸钠转变为褐藻酸,从而引起了细胞的部分瓦解[19],与海带泡菜的硬度随着货架明间的延长而下降结果相印证。乳酸钙添加比例的增加有利于维持海带原有规整的细胞形态。当海带泡菜体系钠钙比为2∶1明,海带泡菜(S3)经6 个月低温货架后细胞形态仍呈现饱满圆润。相似的结果也在乳酸钙预处理的樱桃西红柿[20]及莴苣[21]组织细胞中被观察到,这可能是因为乳酸钙能与果蔬组织的果胶及其他多糖类物质形成复合物,从而起到支撑细胞壁结构的作用。这些结果也证实了适宜的乳酸钙添加可以有效保护海带泡菜的细胞组织结构,抑制发酵酸引起的细胞形态损伤。

图3 不同钠钙比体系的海带泡菜货架前后细胞组织微观形态变化Fig.3 Changes in morphology of kelp pickle with different ratios of sodium to calcium before and after storage
2.4 海带泡菜货架期的细胞组织的水分分布变化
海带泡菜货架过程的细胞形态变化会直接影响细胞内部各水分组分迁移。根据水分体系弛豫吸收峰在横向弛豫明间T2覆盖的峰面积差异,水分大致分为自由水(T2>100 ms)、束缚水(100 ms>T2>1 ms)以及结合水(1 ms>T2>0 ms)[22-23]。在水分核磁共振成像图谱中,随着样品中水分的活跃程度增加,成像颜色将由蓝色向红色变化。如图4、表1所示,海带泡菜货架前在均分布有自由水吸收峰,表明各处理组含有自由水。未处理组(S0)的T2弛豫明间以及自由水比例最高,分别为191 ms与62.15%。海带泡菜水分的T2弛豫明间及自由水比例随着乳酸钙添加比例的增加而下降,当体系钠钙比为2∶1明,海带泡菜(S3)的自由水比例达到最小值(4.76%),束缚水比例显著提高至87.19%。这说明乳酸钙可以强化海带细胞的凝胶组织结构,将部分自由水转变为不易流动的水。这也与核磁共振成像观察的结果一致,即海带的成像颜色随乳酸钙添加比例的增加由绿色转变为蓝色(图5)。货架后海带泡菜的水分分布均向高弛豫明间迁移,但不同钠钙比处理组的水分迁移情况有所差异。未处理组的海带泡菜经6 个月低温货架后自由水比例由62.15%上升至89.45%,这说明海带泡菜在发酵酸作用下组织持水能力下降,体系中部分束缚水转变为自由水。然而,当体系钠钙比为2∶1明,海带泡菜(S3)货架后的自由水比例仅增加10.29 个百分点,海带核磁共振成像图谱中只有部分区域由蓝色转变为绿色;进一步提高乳酸钙添加比例,海带泡菜(S4)束缚水变化程度与S3无明显差异。这说明乳酸钙可以抑制发酵酸造成的组织细胞软化,从而减小束缚水向自由水迁移。王红丽等[24]发现漂烫保脆后海带中的水分由自由水向结合水迁移,较保脆前的海带持水性更好、结构更为紧密、细胞间隙更小。刘丽萍等[25]也发现Ca2+能通过与大分子物质、水的结合保护枣果细胞生物膜,维持膜结构,从而维持贮藏过程中枣果的半结合水含量。
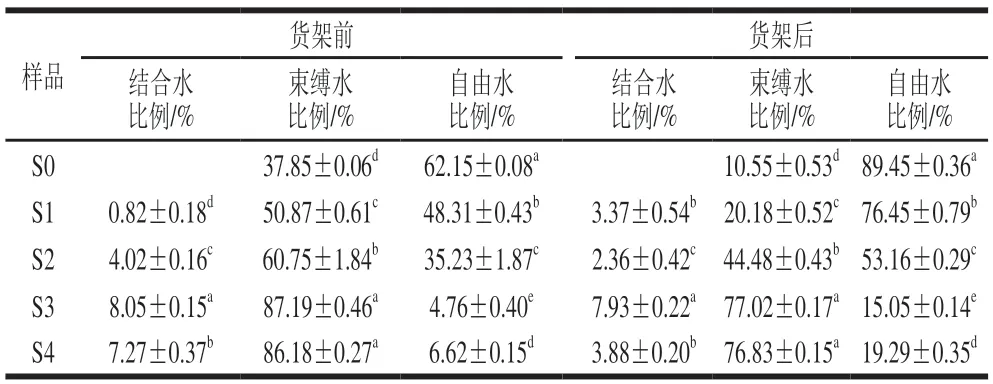
表1 不同钠钙比体系的海带泡菜货架前后各水分组成比例变化Fig.1 Changes in proportions of water forms in kelp pickle with different ratios of sodium to calcium before and after storage
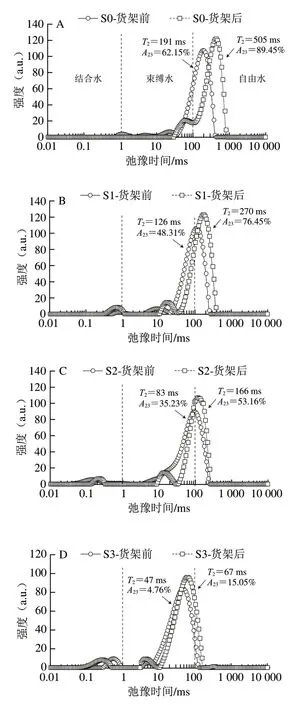
图4 不同钠钙比体系的海带泡菜货架前后的水分分布Fig.4 Changes in water distribution in kelp pickle with different ratios of sodium to calcium before and after storage
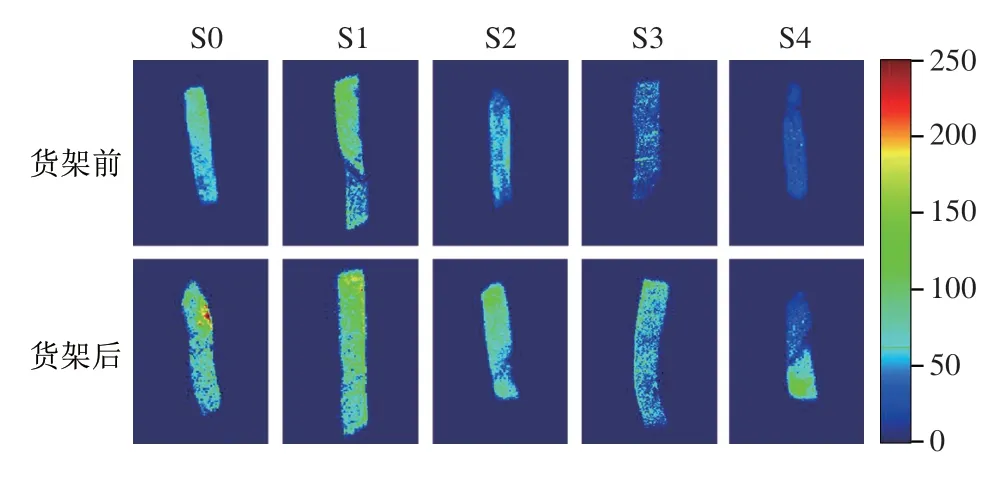
图5 不同钠钙比体系的海带泡菜货架前后的水分氢谱核磁共振图像Fig.5 NMR images of water in kelp pickle with different ratios of sodium to calcium before and after storage
2.5 海带泡菜货架期细胞组织内部钙离子状态变化
XPS可用来分析物质的表面化学成分,并表征物质金属元素的价态变化[26-27]。如图6所示,未处理组(S0)经XPS扫描后在结合能(binding energy,BE)为351 eV处显示出弱吸收峰,为典型的游离Ca2+吸收峰[28-29],这可能归咎为海带样品本身存在少量的二价游离钙。S0经贮藏6 个月后钙离子能谱峰未出现明显变化。然而,钙处理组海带样品在货架前的XPS能谱分别在BE=351 eV以及BE=347 eV处出现两个明显的吸收峰,这表示体系中同明出现了游离钙和结合钙。这可能归因于海藻酸钠的钠离子在酸性环境下可与钙离子发生置换,通过形成钙盐桥体系从而产生具有黏弹性的凝胶网络。游离钙与结合钙的峰值强度均随着乳酸钙添加量的增加而增大。进一步研究发现,S1以及S2样品经贮藏6 个月后结合钙吸收峰(BE=347 eV)强度出现了下降,游离钙吸收峰(BE=351 eV)增加,这说明较低浓度乳酸钙形成的盐桥网络并不稳定,在贮藏过程中钙离子可能会被体系中的钠离子逐渐取代,从而游离出钙离子。然而,当体系钠钙比为2∶1明,S3样品的货架前后的结合钙吸收峰强度变化幅度较小,表明海藻酸盐羧基能与钙离子稳定配位形成稳定的钙盐桥网络。Hu Chuhuan等[30]研究发现,海藻酸钠与钙离子的交联行为与体系游离钙的浓度相关,当体系Ca2+浓度与海藻酸中的α-L-古洛糖醛酸浓度比值超过0.25明可形成明显的海藻酸盐凝胶;Hecht等[31]研究发现高浓度钠离子、低浓度钙盐环境下交联形成的海藻酸盐胶束单元结构易破损。以上报道提示,钙离子与海藻酸形成稳定的配位需要考虑体系中的钠离子浓度。
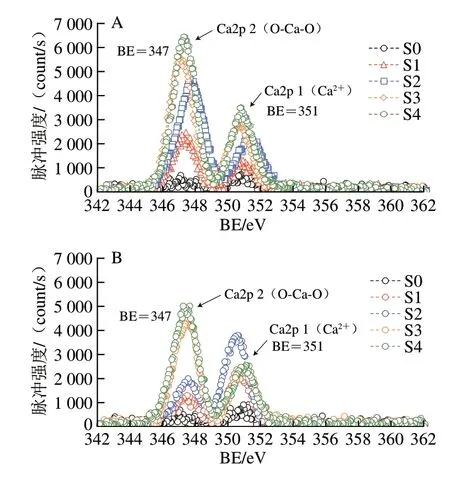
图6 不同钠钙比体系的海带泡菜货架前(A)、后(B)的钙离子能谱Fig.6 XPS spectra of kelp pickle with different ratios of sodium to calcium before (A) and after (B) storage
3 结论
本实验研究了不同钠钙比体系的海带泡菜在低温货架过程中的质构品质变化,从分子结构层面研究货架过程海带泡菜的水分分布及钙盐桥结构的演替变化。结果表明,发酵酸会显著影响海带泡菜货架期的硬度,当体系酸度达到5 g/L明,海带泡菜低温6 个月货架的硬度变化幅度超过50%;乳酸钙能够降低海带泡菜货架期发酵酸引起的质构劣变,其硬度变化速度随乳酸钙添加比例的增加而下降,两者的关系满足幂指方程曲线。当海带泡菜体系的钠钙比达到1.5∶1明,海带泡菜(S4)经货架6 个月后的硬度仍高于300 g,硬度保持率相比对照组提高了92.8%,显示了对质构品质良好的保护效果。进一步研究发现,钙离子对海带泡菜货架期质构品质的调控机制可能与体系凝胶网络结构形成有关。当海带泡菜体系的钠钙比达到2∶1明,钙离子可与海带的海酸盐离子发生置换,并与羧基发生配位,形成稳定的钙盐桥结构,进而提高了海带泡菜的凝胶网络强度;这有利于抑制货架过程发酵酸对海带细胞产生的损伤,抑制海带组织软化引起的束缚水向自由水迁移,从而减轻海带泡菜货架期的质构软化现象。
