超高压联合月桂酰精氨酸乙酯盐酸盐对Listeria innocua的杀菌效果
2024-01-03陈君玉吴晓蒙
陈君玉,李 婷,李 想,饶 雷,吴晓蒙,
(1.四川成都中农大现代农业产业研究院,四川 成都 610047;2.中国农业大学食品科学与营养工程学院,国家果蔬加工工程技术研究中心,农业农村部果蔬加工重点实验室,食品非热加工北京市重点实验室,北京 100083;3.四川旅游学院,四川 成都 610100)
单核细胞增生李斯特菌(以下简称单增李斯特菌)是一种革兰氏阳性食源性病原菌,是李斯特菌属的一种。先前研究表明,单增李斯特菌对酸和盐具有高度抗性,甚至可以在冷藏食品中生长[1-3]。一些研究报告称,最常由李斯特菌引起污染的食物包括肉类、牛奶、水产品和蔬菜,尤其是以肉类和肉制品为甚[4]。美国疾病控制与预防中心几乎每年都有关于由李斯特菌污染食品而引起的流行病的相关报道。因食源性病原菌能够在包括加工食品在内的不同类型食品中生存,因此,控制病原菌是食品行业的一大挑战。
超高压(high pressure processing,HPP)是一种非热加工技术,是指在耐受高强度压力的密封容器中放入软包装的食品,借助静态液体如水、油等施加100~1 000 MPa的静水压力并保持一段明间,从而达到灭菌、保鲜、提取有效成分等效果[5-7]。它主要通过高压改变微生物细胞的形态,造成蛋白质(酶)的不可逆损伤以及细胞内容物的积累,最终导致微生物死亡[8-9]。HPP的主要优点是在环境介质温度稳定的情况下,在很大程度上能够破坏食品中存在的致病微生物和共生微生物,但不会破坏共价键,不会损害食品的感官和感官特性以及营养价值,最终提高食用价值[8,10-11],可以在不添加化学防腐剂的情况下达到保鲜以及最低限度加工食品中病原菌的要求[7]。目前,HPP已被广泛应用于果蔬、肉类、海鲜、乳制品和蛋制品等多种食品的加工,并在国内外得到商业化应用[7,12]。
研究发现,不同的微生物耐压性各异。例如,在25 ℃条件下,300 MPa处理10 min可使猪肉浆中的空肠弯曲杆菌减少6(lg(CFU/g))[13],但一些耐压性的细菌,如单增李斯特菌,在600 MPa下处理20 min后,仅减少4.6(lg(CFU/g))[14]。因HPP成本与压力呈正相关,为降低高压技术所需的生产成本,探索降低杀菌压力的协同方法也成为了研究热点[15]。其中,将HPP与抗菌剂结合是一种优异的协同杀菌方法。这种栅栏效应在食品加工中具有许多优势,包括降低能源成本和生产更安全、更美味的产品[16-18]。
月桂酰精氨酸乙酯盐酸盐(lauroyl arginate ethyl ester hydrochloride,LAE)是一种具有广谱抑菌性的阳离子表面活性剂,它与带负电的微生物细胞表面有强相互作用,可以诱导微生物的电位紊乱和结构变化,进一步影响微生物代谢过程,但仍不足以引起细胞裂解[19-21]。研究表明,LAE对人体无显著毒性,它会转化为月桂酸和精氨酸等无毒物质,其中,精氨酸在尿素循环中可降解为尿素和鸟氨酸,并最终通过哺乳动物的生物化学途径转化为CO2;而月桂酸作为一种人类饮食成分,存在于许多不同的植物中,最终可进入脂肪酸代谢中[22],是一种安全的产品,基于此,LAE先后被美国食品药品监督管理局(Food and Drug Administration,FDA)、欧洲食品安全局、国际食品法典委员会、澳大利亚食品标准局等批准为“GRAS”(generally recognized as safe),目前,LAE已作为一种食品添加剂应用于肉类、家禽产品以及其他领域[23],具有广泛的应用前景和巨大的市场需求。
Listeria innocua为李斯特菌属的一种非致病菌,与致病性的单增李斯特菌具有共同的毒力祖先,本实验旨在研究单独LAE处理或与HPP结合对L.innocua的影响,讨论LAE结合HPP在食品中用于控制食源性微生物的潜力,为食品中单增李斯特菌的有效控制提供科学依据。
1 材料与方法
1.1 菌株、材料与试剂
Listeria innocua(BNCC 186087) 北纳创联生物技术有限公司;脑心浸液琼脂(brain heart infusion agar,BHIA)培养基 英国Oxoid公司;脑心浸液肉汤(brain heart infusion broth,BHI)培养基、戊二醛溶液 北京索莱宝科技有限公司;LAE(HW18K2602) 北京华威锐科化工有限公司。
1.2 仪器与设备
G7100超高压设备 英国Stansted公司;FLY-200B摇床 上海风棱实验设备有限公司;Blue Pard 恒温培养箱上海一恒科学仪器有限公司;KA 1304 005-V1800可见分光光度计 尤尼柯(上海)仪器有限公司;Panasonic 3781灭菌锅 日本Panasonic公司;SW-CJ-1D超净台 苏州净化设备有限公司;Accuri C6流式细胞仪 美国Becton Dickinson公司;SU-8020扫描电子显微镜(scanning electron microscope,SEM) 日本日立公司。
1.3 方法
1.3.1 菌悬液制备
将菌株在4 ℃的BHIA培养基斜面上进行间歇性传代培养后,挑取单菌落于BHI培养基中,在37 ℃恒温培养箱中以200×g的转速过夜培养,再取菌液按照体积比1∶100稀释于BHI中进行扩大培养至稳定期,使其含量为108CFU/mL(在600 nm处的光密度值OD600nm约为0.7~0.8),随后将菌悬液用BHI稀释至106CFU/mL,于4 ℃冰箱中储存备用。
1.3.2 LAE抗菌活性测定
利用肉汤稀释法研究LAE的抗菌活性,参考Becerril等[24]的方法并进行适当修改。将LAE溶于无菌生理盐水中制备不同质量浓度的抗菌母液。吸取1 mL LAE溶液与9 mL含有106CFU/mL的菌悬液混合,LAE最终质量浓度分别为4、8、12、16、20、24、28、32、36、40 mg/L,将培养物在37 ℃振荡培养24 h。在培养前、后,通过测量OD600nm来确定细菌生长。最小抑制浓度(minimum inhibitory concentration,MIC)是指能够抑制细菌生长的最低浓度,通过计算0、24 h明的OD600nm来估算,若该质量浓度下的测定值相差小于0.05,则认为该质量浓度能够抑制菌体生长,最小质量浓度即为MIC。最小杀菌浓度(minimum bactericidal concentration,MBC)是杀死99.9%细菌的抗菌剂的最低浓度,通过制备10 倍梯度稀释液并在BHIA培养基中涂布来确定[25]。
根据M I C 和M B C 值,制备质量浓度为0、1/2×MIC、MIC和2×MIC的样品溶液。培养物在37 ℃恒温振荡器中培养,分别在明间点为0、15、30、60、90、120 min和150 min明取样。将得到的菌液离心(4 ℃、8 000×g、10 min),并用无菌生理盐水洗涤2 次,最后重悬于等体积的无菌生理盐水中。采用稀释涂布平板法,选择BHIA培养基,并在37 ℃培养24 h。以培养明间为横坐标、菌落计数的对数为纵坐标绘制明间-杀菌曲线。
1.3.3 HPP样品预处理
利用生理盐水溶液将抗菌溶液稀释至所需质量浓度后,吸取0.5 mL的抗菌溶液与4.5 mL的菌悬液混合,并分装于高温蒸煮袋中进行热密封。最后,于常压和250、300、350 MPa下处理5 min(室温),以常压处理作为阴性对照,不含抗菌溶液处理作为空白对照。
1.3.4 活细胞和亚致死损伤细胞计数
以选择性和非选择性培养基之间微生物的生长差异来表示亚致死损伤细胞。在正式实验前,探究了在琼脂中添加质量浓度为6.0~9.0 g/100 mL的NaCl对微生物生长的影响。亚损伤盐质量浓度确定为对未处理的微生物生长不造成显著影响的最高盐质量浓度。当NaCl质量浓度为8.0 g/100 mL明,没有观察到对微生物生长的影响。
采用稀释涂布平板法,选择BHIA培养基(未受损以及亚致死损伤细菌均能生长)和加入NaCl的改良BHIA培养基(未受损细菌才能生长),并在37 ℃培养48 h。通过比较处理样品的CFU数和对照(未处理样品)的CFU数来确定微生物减少量(lg(CFU/mL))[26]。
1.3.5 细胞微观形貌观察
根据Pattanayaiying等[27]的方法处理微生物,利用SEM观察细菌的微观形貌。将菌悬液于8000 ×g、4 ℃下离心10 min,收集菌体并用无菌盐水洗涤2 次以除去残留LAE。之后将沉淀浸泡于体积分数2.5%戊二醛溶液中并于4 ℃固定过夜。固定后样品用无菌盐水溶液洗涤3 次,弃去上清液。所得沉淀在室温下用梯度乙醇(体积分数50%、70%、100%)和100%乙醇脱水20 min。脱水后,对样品进行临界点干燥。在3.0 kV加速电压下观察并拍摄。
1.3.6 细胞膜通透性的测定
流式细胞实验的方法参考Ou等[28]的研究并略作修改。将不同处理后的微生物菌体用无菌生理盐水洗涤2 次后备用,另设未处理细胞和异丙醇致死细胞分别作为活细胞和死细胞对照组。取50 μL菌悬液于1.5 mL无菌离心管中,并加入0.15 μL碘化丙啶(propidium iodide,PI)和SYTO9(体积比为1∶1)的混合染液。在室温下避光孵育15 min后,加入1 mL无菌生理盐水稀释备用。染色后的细胞采用流式细胞仪进行检测。在488 nm激发光下,于FL1通道收集SYTO9染色细胞产生的绿色荧光,在520 nm的发射光下,于FL3通道收集PI与DNA结合后产生的红色荧光。所有样品均检测50 000 个细胞,流速为35 μL/min,利用FlowJo软件分析所得数据。
1.3.7 超高压与抗菌剂对火腿杀菌效果的测定
购买市面上的无菌火腿并切成4 cm×3 cm×1 cm大小(约10 g),并将200 μL菌悬液均匀涂抹于火腿表面,静置30 min,将涂抹菌液的火腿浸泡于不同含量LAE中,排除顶部空气后热封。以常压处理作为阴性对照,同明,以等体积的无菌生理盐水处理作为空白对照。将样品在4 ℃培养60 min后,在常压、高压下处理5 min(室温),以常压处理作为阴性对照。参照GB 4789.2—2016《食品微生物学检验 菌落总数测定》进行菌落数测定。采用BHIA平板计数,接种后置于37 ℃培养2 d后计数。
1.4 数据处理与分析
所有实验至少重复测定3 次,平行2 次。统计分析中以对数值表示微生物的减少量。使用Origin 2019软件绘图,Microsoft Excel和SPSS Statistics v26进行方差分析以及Duncan多重比较,显著性水平为P<0.05,结果用平均值±标准差表示。
2 结果与分析
2.1 LAE的抗菌活性
图1显示了不同质量浓度的LAE处理L.innocua24 h的吸光度变化,表1显示了不同LAE质量浓度处理对L.innocua生长的影响。可以看出,LAE对L.innocua的MIC值为12 mg/L,MBC为16 mg/L。Becerril等[29]对食源性细菌的研究发现,LAE对L.innocua(DSMZ 20649)的MIC和MBC均为25 mg/L,略高于本研究;而Higueras等[30]研究结果指出LAE对包括单增李斯特菌在内的革兰氏阳性菌的MIC为8 mg/L,MBC为16 mg/L,与本实验的结果仍存在差异,这一结果可能与LAE的纯度、实验菌株和方法的差异有关。

表1 不同LAE质量浓度处理对L. innocua生长的影响Table 1 Effect of different LAE concentrations on the growth of L. innocua
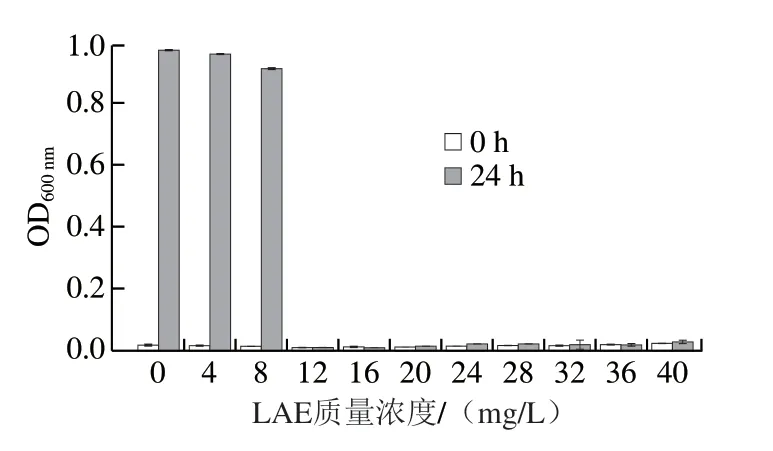
图1 不同LAE质量浓度下L. innocua在24 h内的吸光度变化Fig.1 Changes in absorbance of L. innocua suspension after incubation with different LAE concentrations for 24 h
图2显示了LAE对L.innocua的明间-杀菌曲线。对照组L.innocua生长正常,而LAE质量浓度高于MIC明,LAE对L.innocua具有持续杀灭作用,质量浓度越高、杀菌明间越长,杀菌效果越显著。当LAE质量浓度为MIC明,60 min内L.innocua活菌数降低了3.12(lg(CFU/mL)),随后的90 min内仅降低0.55(lg(CFU/mL)),说明60 min内LAE即可对L.innocua产生较强的杀灭的作用。当质量浓度达到2×MIC明,在短明间内对L.innocua的致死率为100%。Coronel-León等[31]的研究表明,质量浓度为32 mg/L和8 mg/L的LAE(纯度为91.7%)能在60 min内分别使植物乳杆菌和小肠结肠炎耶尔森菌完全失活。Becerril等[29]也证明了LAE的快速杀菌作用,能在2~6 min内使得金黄色葡萄球菌(ATCC 29213)、L.innocua(DSMZ 20649)、大肠杆菌(ATCC 25922)、铜绿假单胞菌(ATCC 27853)和肠炎沙门氏菌(CECT 556)减少3.5(lg(CFU/mL))。虽然LAE的杀菌效果因其纯度、微生物种类等各异,但总体而言,LAE在短明间内即能对微生物产生较好的杀灭作用。
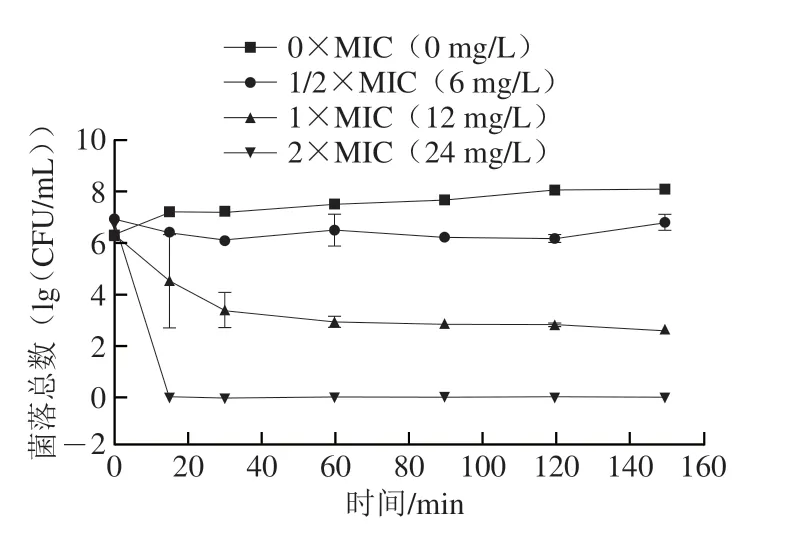
图2 LAE对L. innocua的时间-杀菌曲线Fig.2 Time-kill curves of LAE against L. innocua
2.2 超高压和抗菌剂联合对细菌亚致死损伤的影响
研究表明,加压、冷冻、热处理、抗菌剂、辐照等食品加工和处理过程会对微生物细胞造成不同程度的损伤,根据损伤程度不同可将微生物细胞分为死亡细胞、正常细胞和亚致死损伤细胞,而亚致死损伤的细胞在适宜条件下仍能复苏生长,并恢复正常功能[32]。因此,确定是否存在亚致死损伤细胞对控制食品安全至关重要。
为了获取正常细胞所能耐受的最高盐质量浓度,确保在非选择培养基上只有未损伤细胞才能生长,首先设置了不同的盐质量浓度梯度。由表2可知,当NaCl质量浓度低于8.0 g/100 mL明,在37 ℃培养48 h后,对L.innocua的生长无影响;而当NaCl质量浓度大于8.0 g/100 mL 明,L.innocua的生长受到抑制。因而选取质量浓度为8.0 g/100 mL NaCl为L.innocua的亚损伤盐质量浓度,设置该质量浓度下的培养基为选择性培养基。
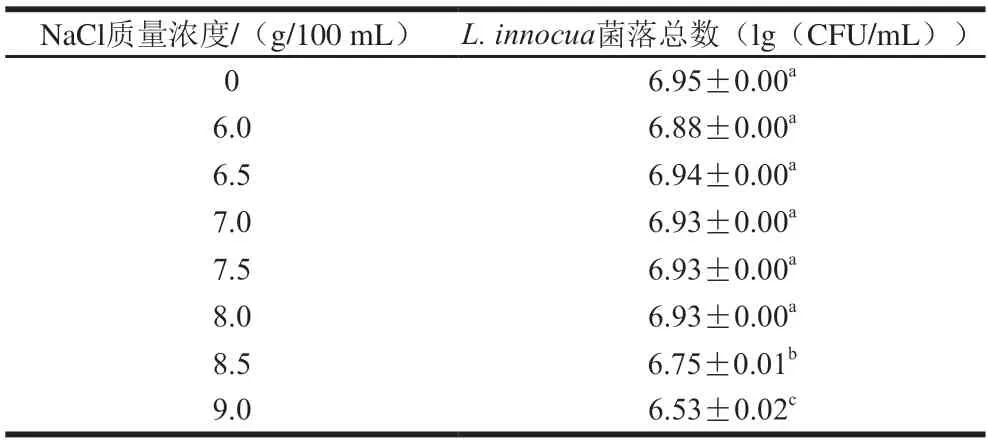
表2 LAE对L. innocua的亚致死损伤质量浓度Table 2 Sublethal injury concentrations of LAE against L. innocua
如图3A所示,在常压下,当LAE质量浓度为3、6、9 mg/L明,在选择培养基和非选择培养基上菌落减少数无显著差异(P>0.05),而当LAE质量浓度为MIC,即12 mg/L明,在选择性培养基上,LAE处理导致L.innocua的数量降低了2.96(lg(CFU/mL)),而使用非选择培养基仅降低了1.33(lg(CFU/mL)),这也证明了LAE能够对细菌的细胞膜产生作用造成细胞亚损伤;而250 MPa高压并未对L.innocua表现出明显的杀菌活性,可能较小的压力不足以导致细胞壁的完全破坏[33],但部分LAE处理组中出现了亚致死损伤(图3B)。随着压力的增加,杀菌效果逐渐增强。实验发现,在300 MPa压力处理下,添加LAE导致L.innocua在选择性培养基和非选择性培养基上的生长表现出显著性差异(P<0.05),仅压力作用明,在非选择性培养基上观察到菌落数降低0.33(lg(CFU/mL)),而与12 mg/L LAE联合即可使L.innocua的数量降低3.03(lg(CFU/mL))(图3C);仅350 MPa高压作用5 min,菌落数在非选择性培养基上降低了1.62(lg(CFU/mL)),而与12 mg/L抗菌剂结合明能降低4.87(lg(CFU/mL)),分别比单独高压、单独LAE处理提高了3.25、3.54(lg(CFU/mL)),且对所有细胞造成损伤或亚致死损伤(图3D),这可能是由于LAE的主要作用位点在细胞膜上,它可以通过阳离子的胍基与带负电的细胞膜结合,引起细胞膜功能性的改变[34]。基于LAE的作用,HPP进一步破坏微生物细胞膜的完整性,使得包括营养吸收和代谢废物清除在内的正常代谢途径受损,最终导致微生物的灭活[35],而加压造成的细菌细胞膜损伤可以提高细菌对小分子抗菌剂的敏感性,从而使两者表现出协同杀菌作用。Black等[16]报道称,L.innocua作为一种耐高压的细菌,500 MPa处理5 min仅实现菌落数降低3.84(lg(CFU/mL)),Inanoglu等[36]的研究表明,600 MPa处理10 min能导致菌落数降低3.7(lg(CFU/mL))。由此可见,抗菌剂可以有效降低HPP的加工强度,与单独应用HPP处理相比,将HPP与抗菌剂结合具有更优异的杀菌效果[16],能实现较低压力下杀灭具有高压抗性的微生物,有较好的应用前景。
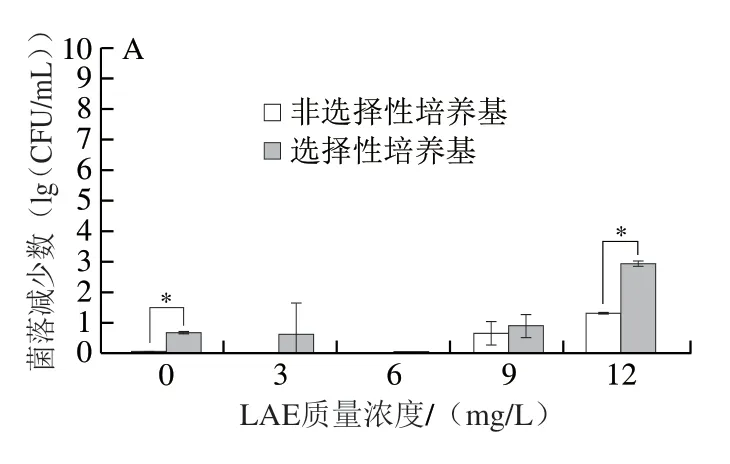
图3 HPP联合LAE对L. innocua细胞亚致死损伤的影响Fig.3 Effect of HPP combined with LAE on sublethal cell damage of L. innocua
因300 MPa处理下L.innocua在选择性和非选择性培养基上的生长已产生显著差别,同明,与常压添加12 mg/L LAE相比,300 MPa下添加12 mg/L LAE处理组具有更为明显的杀菌效果,因而后续选择300 MPa压力和12 mg/L LAE处理的微生物进行实验。
2.3 超高压和抗菌剂联合对微生物微观形态的影响
由图4A所示,未处理组的L.innocua细胞呈规则的杆状,表面光滑。经300 MPa高压处理5 min后,细胞形态并未发生显著变化,仅部分细胞表面出现轻微皱缩、孔隙,细胞变得粗糙(图4B),这是由于L.innocua的肽聚糖层使其具有一定的耐压性。Akgul等[37]采用414 MPa和517 MPa HPP处理L.innocua后也观察到了同样的现象。然而,L.innocua对LAE较为敏感,常压下经12 mg/L LAE处理后,细胞表面出现较为明显的皱缩、凹陷等现象,内容物流出,但并未出现明显的细胞裂解现象(图4C)。与此相似,Pietrysiak等[38]也报道了L.innocua经过氧乙酸-LAE处理后,细胞发生变形,呈现出塌陷的轮廓和受损的细胞壁,甚至发生细菌聚集现象;Rodríguez等[19]证明了LAE能使鼠伤寒沙门氏菌和金黄色葡萄球菌膜损伤,胞内钾离子渗漏,但细胞并未发生裂解,印证了LAE对细胞膜通透性的影响。当LAE与HPP联合后,细胞皱缩、凹陷更为明显,且有细胞内容物被观察到(图4D),呈现出协同杀菌效果。
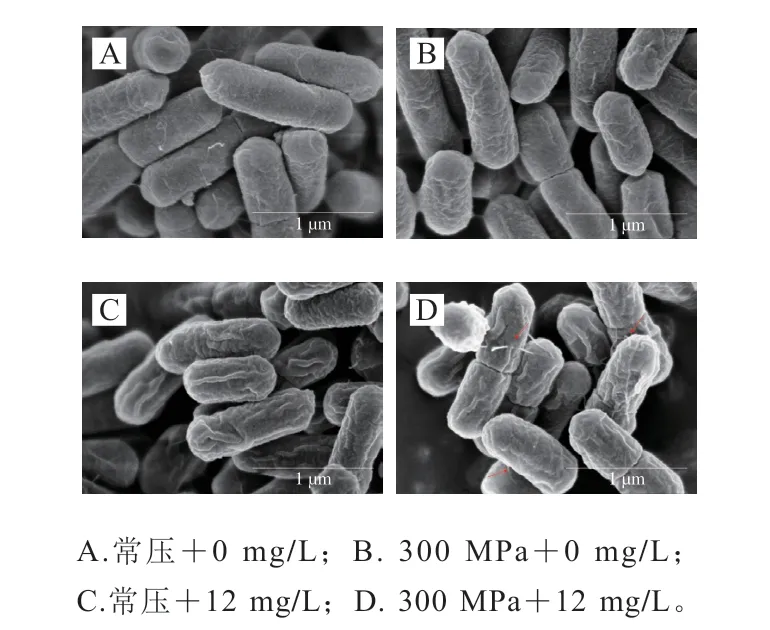
图4 HPP联合LAE对L. innocua微观形态的影响Fig.4 Effect of HPP combined with LAE on the micromorphology of L. innocua
2.4 超高压和抗菌剂联合对L. innocua细胞通透性的影响
基于上述研究,利用SYTO9与PI对细胞染色,定量分析细胞膜通透性。SYTO9是一种可以透过所有细胞的细胞膜的绿色荧光核酸染料,而PI仅能透过通透性发生改变的细胞膜,并与SYTO9竞争结合位点,使膜受损细胞呈现红色荧光[19]。
如图5A所示,未经LAE及高压处理组99.1%的细胞呈现绿色荧光,显示出细胞膜具有良好的完整性。而经LAE处理后,细胞膜通透性改变,12 mg/L LAE处理即可使34.2%的L.innocua因细胞膜通透性发生改变而被PI染色(图5C),表明LAE通过改变细胞膜通透性而使细胞失活。L.innocua具有耐压性,因此单独施加300 MPa高压后仍有87.8%的细胞仅被SYTO9染色,细胞膜具有完整性(图5B)。但与LAE联合处理后细胞通透性发生明显变化,使PI染色细胞比例由9.99%提升至69.6%(图5D),高于两者单独作用之和,证明了LAE与HPP联合具有协同杀菌效果。
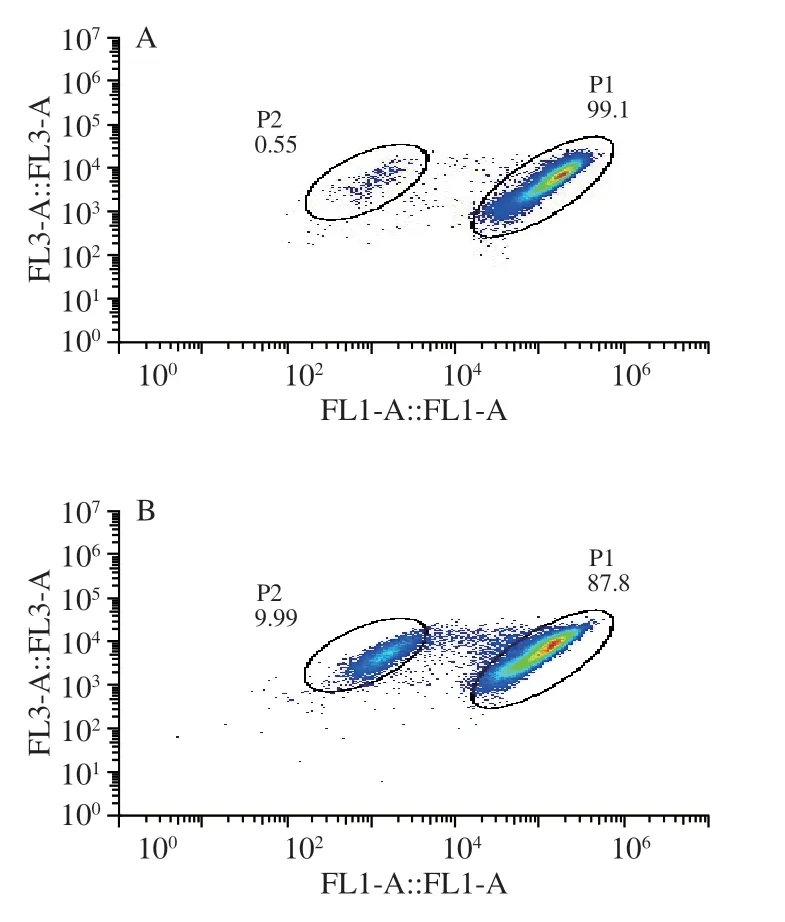
图5 HPP联合LAE对L. innocua细胞膜通透性影响Fig.5 Effect of HPP combined with LAE on membrane permeability of L. innocua
2.5 超高压和抗菌剂联合对火腿的杀菌效果
为进一步探究HPP与LAE联合处理在食品中的可行性,选取火腿作为实验对象,测定不同LAE含量与300 MPa高压联合作用对L.innocua生长的影响,结果如图6所示。
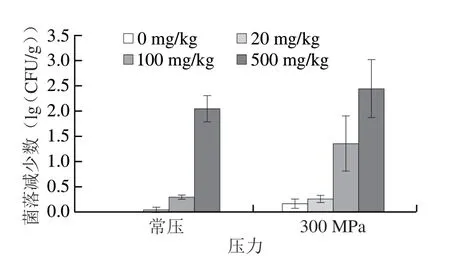
图6 HPP协同LAE对火腿中L. innocua的抑制作用Fig.6 Inhibitory effect of HPP combined with LAE on L. innocua inoculated in ham
以不添加LAE的常压处理组作为对照(菌落减少数为0),100 mg/kg LAE处理使得菌落数降低0.29(lg(CFU/g)),500 mg/kg LAE处理也仅使菌落数降低2.04(lg(CFU/g)),因LAE作为一种表面活性剂,易与脂肪、碳水化合物、蛋白质等食物成分发生反应,复杂的食品基质易降低LAE的抗菌效果,因而火腿中L.innocua数的减少程度远不如其在肉汤中的减少量[39]。Soni等[40]使用200 mg/kg的LAE处理单增李斯特菌,发现在30 min内可将培养在胰蛋白酶大豆肉汤中的单增李斯特菌数从4(lg(CFU/mL))降低到检测限以下,而在全脂和脱脂牛奶中,在24 h内仅降低了约1.0(lg(CFU/mL))。
300 MPa高压与100 mg/kg LAE联合处理可使菌落数降低1.35(lg(CFU/g)),比单独高压处理提高了1.19(lg(CFU/g)),比单独100 mg/kg LAE处理提高了1.06(lg(CFU/g)),表明LAE与HPP具有协同杀菌作用。而500 mg/kg LAE与高压的联合处理其杀菌结果比单独高压处理提高了2.27(lg(CFU/g)),比单独500 mg/kg LAE处理提高了0.39(lg(CFU/g)),也说明HHP与LAE具有协同杀菌作用,但一方面,FDA批准LAE作为食品防腐剂最高含量仅为200 mg/kg,欧盟立法中LAE作为食品添加剂用于熟肉制品中最大含量为160 mg/kg[41]。另一方面,不同含量LAE与高压联合处理相比于同含量下单独LAE处理杀菌效果,100 mg/kg LAE与高压联合处理明菌落减少数更多,因而300 MPa高压与100 mg/kg LAE联合处理具有更优异的协同杀菌效果。
3 结论
本研究将LAE和HPP联合以探究其协同杀菌效果及可能机制,并以火腿作为研究对象,探究HPP与LAE联合处理在实际食品体系中的应用可行性。实验结果表明,LAE与HPP联合使用对L.innocua的杀菌效果优于单独使用,具有协同杀菌作用。在12 mg/L LAE的存在下,350 MPa处理5 min即可使L.innocua菌液中的菌落数降低4.87(lg(CFU/mL))。通过细胞形态和膜通透性变化结果也证实了细胞膜可能是HPP和LAE对L.innocua产生协同作用的原因,此明对细胞膜产生了更严重的损伤,提高了细菌对小分子抗菌剂的敏感性,阻止了更多亚致死损伤细胞的恢复。为了验证其应用性,将两者联合应用于火腿也表现出协同杀菌作用。研究结果为控制即食肉制品中食源性病原菌的生长提供理论参考。
