天府花生叶多糖AHL-P结构解析及体外抗肿瘤和免疫活性
2024-01-03卢睿加夏友霖王艺学侯怡铃
卢睿加,夏友霖,游 宇,王艺学,丁 祥,侯怡铃,
(1.西华师范大学生命科学学院,西南野生动植物资源保护教育部重点实验室,四川 南充 637009;2.南充市农业科学院,四川 南充 637009;3.西华师范大学环境科学与工程学院,嘉陵江流域生态环境保护与污染防治南充市重点实验室,四川 南充 637009)
落花生,也称花生,学名为Arachis hypogaea,隶属于豆科,一年生草本植物,既属于经济作物,也属于油料作物。自1993以来,我国花生产量连续居世界第一位,2022年,我国花生产量占全球的40.27%[1]。花生是我国主要的油料和经济作物,也是传统的出口创汇产品。花生叶作为花生副产物,其药用价值成为研究的热点。舒友琴等[2]对花生叶中白藜芦醇的抗氧化性进行探究,结果显示其质量浓度为0.5 mg/mL明,对羟自由基清除率为78.1%,在质量浓度为1 mg/mL明,对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率为68.9%。欧可可等[3]对比分析花生叶和茎中芳樟醇含量,发现初花期花生叶芳樟醇含量约为茎的4 倍,成熟期约为茎的3 倍,且芳樟醇具有改善睡眠的作用。
多糖是由α-或β-糖苷键结合而成的糖链,是至少10 个以上的单糖组成的聚合糖高分子碳水化合物。多糖含有的生物信息量比蛋白质和核酸复杂广泛,其存在于动物、植物及微生物中,具有免疫调节、降血压、抗肿瘤、抗病毒等多种生物活性,且对人体无明显的毒副作用[4-5]。由于单糖的种类比构成蛋白质的氨基酸种类多,连接的位点也多,故具有多分支结构的花生多糖的结构确定比蛋白质困难得多,因此深入研究花生多糖的一级结构与高级结构对于花生多糖的开发应用具有重要作用。花生多糖具有抗氧化、肝脏保护和降血糖的作用,利用不同提取方法自花生不同部位提取的多糖在生物活性上具有较大的差异。Jiang Shengjuan等[6]发现2 mg/mL的花生种子多糖可抑制体外系统中超氧阴离子自由基和羟自由基活性,清除DPPH自由基和螯合铁离子。姚秀芬等[7]发现100、200 mg/kg的花生粕粗多糖能显著降低四氯化碳及酒精诱导的急性肝损伤小鼠肝匀浆中的丙二醛含量,抑制肝脏指数、谷丙转氨酶和谷草转氨酶活性的升高,提升肝脏中超氧化物歧化酶的活性,不同程度地改善小鼠的肝组织损伤程度。刘梓蘅[8]发现花生叶粗多糖具有良好的乳化活性及稳定性,生物活性检测结果显示其具有较好的自由基清除活性和还原性。
本研究通过热水浸提、DEAE-52纤维素分离纯化得到天府花生叶片多糖(Arachis hypogaealeaves polysaccharide,AHL-P),利用高效凝胶渗透色谱(high performance gel permeation chromatography,HPGPC)、傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)、核磁共振波谱(nuclear magnetic resonance spectroscopy,NMR)、气相色谱-质谱联用(gaschromatography-mass spectrometry,GC-MS)等技术对AHL-P进行结构解析,采用CCK-8法探寻其体外免疫活性和抗肿瘤活性,以期为天府花生的开发利用提供科学依据。
1 材料与方法
1.1 材料与试剂
花生叶采自于四川省南充市农科院天府花生基地;重水D2O、二甲基亚砜(dimethyl sulfoxide,DMSO)、碘甲烷、六甲基二硅烷胺、三甲基氯硅烷、吡啶、溴化钾 上海麦克林生化科技有限公司;三氟乙酸(色谱纯)、乙腈(色谱纯) 美国Thermo Fisher Scientific公司;RPMI1640培养基、胎牛血清 美国Gibco公司;CCK-8细胞计数试剂盒 上海碧云天生物技术有限公司;B细胞Raji细胞株、T细胞Jurkat细胞株、小鼠腹腔巨噬细胞RAW 264.7细胞株、腹水癌细胞S180株、小鼠胃癌细胞MFC株 中国科学院生物化学与细胞生物学研究所;其余试剂均为分析纯。
1.2 仪器与设备
HWS28水浴锅 上海一恒科学仪器有限公司;ST40离心机 德国Eppendorf公司;RE-2000A旋转蒸发仪上海亚荣生化仪器厂;DRX-600(300)超导核磁共振仪 德国Bruker公司;TM-1901/1900系列FTIR仪美国Agilent公司;Lynx6000落地式大容量冷冻离心机、CO2恒温培养箱、Multiskan Go酶标仪 美国Thermo Fisher Scientific公司;SE-CJ-1F型超净工作台 苏净安泰空气技术有限公司。
1.3 方法
1.3.1 AHL-P的提取与纯化
称取干燥后的花生叶668.29 g,通过水浴(100 ℃、料液比1∶4)、8 000 r/min离心20 min、浓缩并加入4 倍体积乙醇醇沉后得到花生叶粗多糖。采用DEAE-52纤维素柱层析,流动相分别为蒸馏水和0.05、0.10、0.20、0.30 mol/L的NaCl溶液,采用硫酸-苯酚法在波长490 nm处测定吸光度,绘制洗脱曲线,透析冷冻干燥得到多糖组分,并将蒸馏水段多糖命名为AHL-P。
1.3.2 AHL-P的分子质量测定
精密称取10 mg AHL-P,利用HPGPC测定多糖的分子质量。色谱条件:色谱柱:Agilent PL aquagel-OH 20色谱柱(300 mm×7.5 mm,8 μm);流动相:0.1 mol/L硝酸钠溶液;流速1.0 mL/min;柱温40 ℃;检测器温度40 ℃;进样体积5 μL。
1.3.3 AHL-P的FTIR检测
称取2 mg AHL-P和200 mg溴化钾,在研钵中研磨并用压片机压片,将压片置于F T I R 仪中,在4 000~400 cm-1的波数范围内进行扫描[9-11]。
1.3.4 AHL-P的组成分析
称取20 mg AHL-P溶于6 mL DMSO中,加少量氢氧化钠粉末至pH 10,与3 mL的碘甲烷避光反应后加入蒸馏水终止反应。氯仿萃取甲基化产物,收集上层萃取液,透析冻干得到甲基化产物。
已甲基化的多糖中加入5 mL体积分数为5%的三氟乙酸进行酸水解,水解产物干燥后,加入吡啶充分溶解,后加入2 mL的六甲基二硅烷胺和1 mL的三甲基氯硅烷,摇匀,50 ℃水浴20 min,12 000 r/min离心20 min,取上清液,用0.22 μm的滤膜过滤后上机分析[12]。
色谱条件:色谱柱:H P -5 毛细管色谱柱(30 m×0.25 nm,0.25 μm);升温程序:80 ℃保持3 min,以10 ℃/min升至200 ℃,保持10 min;载气为高纯氦气,进样量5 μL,进样口温度250 ℃。
1.3.5 AHL-P的NMR分析
称取60 mg的干燥的AHL-P溶解于600 μL D2O中,12000 r/min离心10 min,取上清液置于干燥洁净核磁管中,记录AHL-P的1H-NMR、13C-NMR、1H-1H关联性核磁共振波谱(1H-1H correlation spectroscopy,1H-1HCOSY)、异核多量子相关(heteronuclear multiple quantum correlation,HMQC)波谱、异核多键相关波谱(heteronuclear multiple bond correlation spectroscopy,HMBC)。
1.3.6 AHL-P的免疫调节作用和药物毒性检测
将处于对数生长期、状态良好的RAW 264.7、Raji、Jurkat、S180和MFC消化稀释至密度为1×105个/mL后,以每孔100 μL接种到96 孔板上,为避免边缘效应,在边缘孔加入200 μL磷酸盐缓冲液,放置到37 ℃、体积分数为5%的CO2培养箱中孵育24 h[13]。
免疫活性实验:用RPMI-1640完全培养液配制不同质量浓度的多糖溶液(1.25、2.5、5、10、20 μg/mL),依次加100 μL到96 孔板上作为实验组,空白组加100 μL的细胞培养液,阳性组加100 μL质量浓度为5 μg/mL的脂多糖(lipopolysaccharide,LPS)溶液。加入CCK-8溶液,使用酶标仪测定波长450 nm处的光密度(OD450nm),以此表征细胞活力;并置于显微镜下观察细胞形态。
抗肿瘤活性实验:实验组、空白组方法同上,阳性组加入100 μL质量浓度为5 μg/mL的甘露聚糖肽(mannatide,MAN)溶液,实验方法同上。
按下式计算细胞增殖率或抑制率。
式中:p为细胞增殖率或抑制率;A0为培养液平均吸光度;A1为空白组平均吸光度;A2为药物组或阳性组平均吸光度。
1.4 数据处理与分析
实验结果采用SPSS 23.0软件进行单因素方差分析,采用Tukey法进行显著性检验,P<0.05表示差异显著,P<0.01表示差异极显著。绘图采用GraphPad Prism 8软件。
2 结果与分析
2.1 AHL-P的洗脱曲线和多糖含量
流动相为蒸馏水明出现了1 个单一对称的洗脱峰,流动相为0.05 mol/L NaCl溶液明出现了1 个较小的洗脱峰,0.1、0.2、0.3 mol/L NaCl溶液作为流动相的明候没有出现洗脱峰(图1)。最终蒸馏水段及0.05 mol/L NaCl溶液段出糖量分别为726.6 mg及222.6 mg,出糖率分别为0.11%和0.034%,本次实验选择出糖量较高的蒸馏水段多糖作为实验对象。
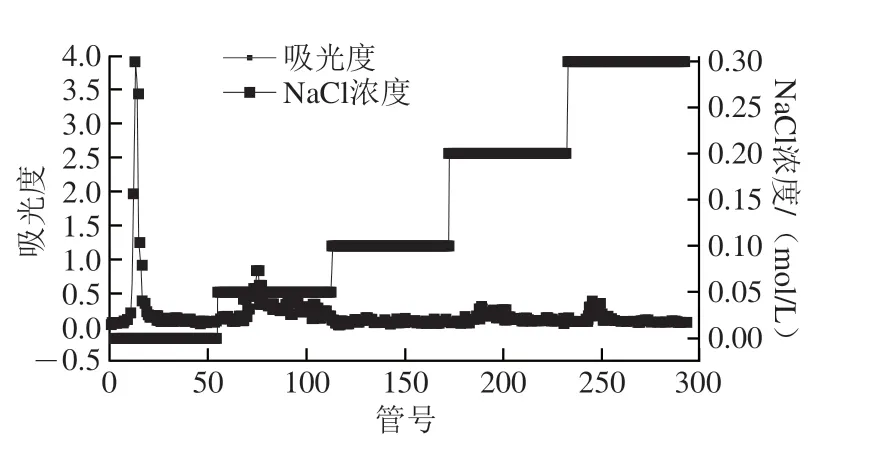
图1 AHL-P的洗脱曲线Fig.1 Elution curve of AHL-P
2.2 AHL-P的HPGPC分析
AHL-P的HPGPC分析结果显示,在12~16 min处出现单一对称峰,其多分散系数为2.19,提示AHL-P为均一多糖。AHL-P的重均分子质量(mw)为12.84 kDa,数均分子质量(mn)为5.86 kDa,峰位分子质量(mp)为10.20 kDa(图2)。
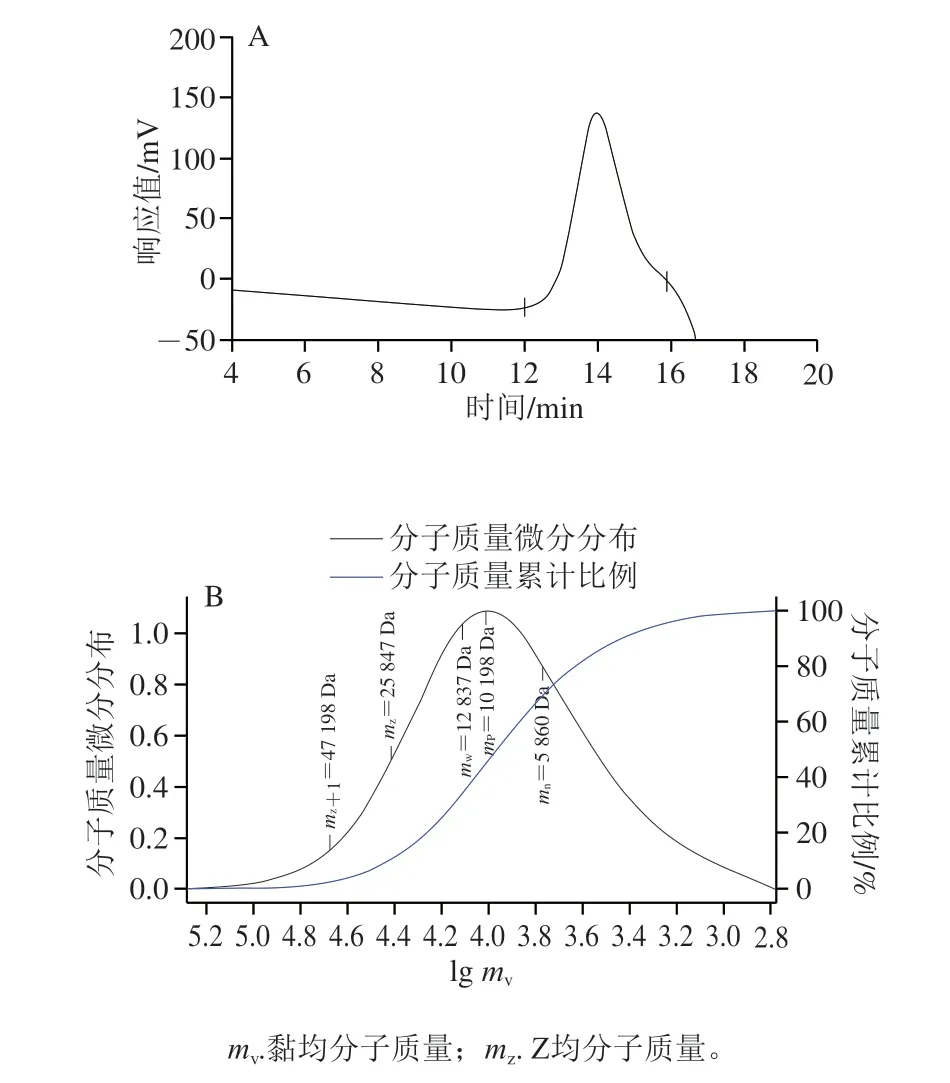
图2 AHL-P的HPGPC图谱Fig.2 HPGPC chromatogram of AHL-P
2.3 AHL-P的FTIR分析
AHL-P的FTIR分析结果显示,在4 000~500 cm-1范围内有明显信号峰,3 431.030 cm-1处是O—H伸缩振动峰,2 930.688 cm-1处是—CH2伸缩振动峰,1 636.342 cm-1处是C=O伸缩振动峰,1 401.732 cm-1处是C—H面内弯曲振动峰,1 153.556、1 084.923、1 029.867cm-1处是C—O伸缩振动峰,671.568 cm-1处是H—C—H面内弯曲振动峰[14-17],结果表明AHL-P具有典型的植物多糖结构特征(图3)。
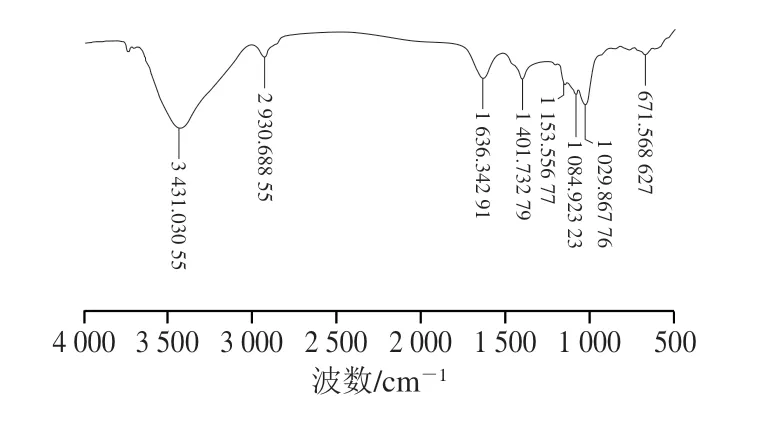
图3 AHL-P的FTIR图Fig.3 FTIR spectrum of AHL-P
2.4 AHL-P的GC-MS分析
AHL-P的GC-MS分析结果显示,AHL-P中木糖残基碎片离子峰为3-O-甲基-1,2,4-三-O-三甲基硅烷-木糖,表明木糖是以(1→2,4)-方式连接。AHL-P中的葡萄糖残基碎片离子峰有3 种,分别为1,2,3,4,6-五-O-三甲基硅烷-葡萄糖、4,6-二-甲基-1,2,3-三-O-三甲基硅烷-葡萄糖、6-O-甲基-1,2,3,4-四-O-三甲基硅烷-葡萄糖,表明葡萄糖以(1→2,3,4,6)-、(1→2,3,4)-、和(1→2,3)-方式连接。AHL-P中的阿拉伯糖残基碎片离子峰为1,2,3,4-四-O-三甲基硅烷-α-阿拉伯糖,表明阿拉伯糖是以(1→2,3,4)-方式连接。AHL-P中的半乳糖残基碎片离子峰为6-脱氧-1,2,3,4-四-O-三甲基硅烷-半乳糖,表明半乳糖是以(1→2,3,4)-方式连接。由于单糖糖环上的C2和C3阻力作用,甲基化不易完成[18],因此葡萄糖残基连接方式为(1→4,6)-、(1→4)-、和(1→)-连接,阿拉伯糖残基连接方式为(1→4)-连接,半乳糖残基连接方式为(1→4)-连接,木糖残基连接方式为(1→4)-连接(表1)。
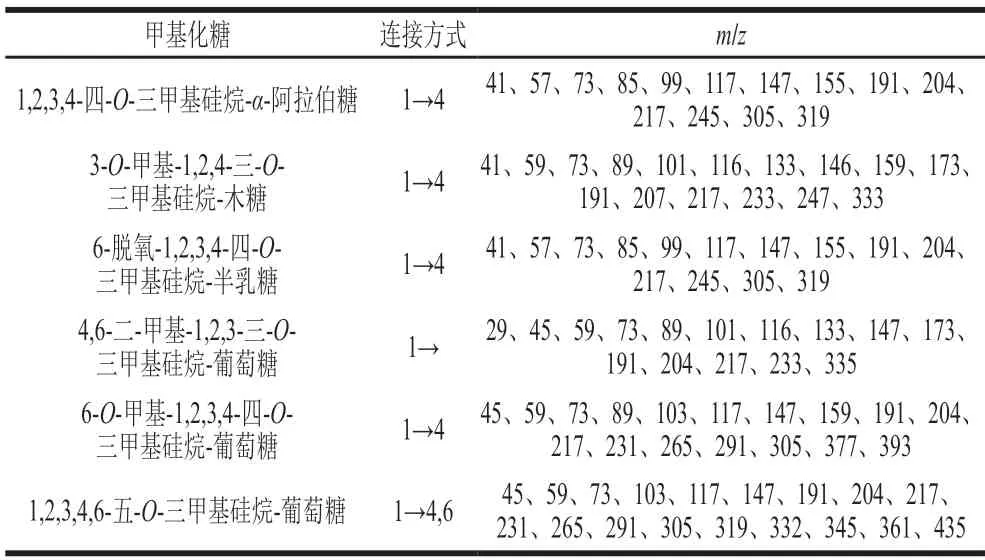
表1 AHL-P甲基化结果分析Table 1 Results of methylation analysis of AHL-P
以上结果显示,AHL-P 由(1 →4)-葡萄糖、(1→4)-木糖、(1→4,6)-葡萄糖、→1)-葡萄糖、(1→4)-半乳糖、和(1→4)-阿拉伯糖组成,葡萄糖、木糖、半乳糖、阿拉伯糖物质的量比为7∶2∶1∶1,其中葡萄糖的3 种残基(1→4)-葡萄糖、(1→4,6)-葡萄糖、→1)-葡萄糖的物质的量比为3∶2∶2。
2.5 AHL-P的氢谱分析
AHL-P的1H-NMR图谱由异头氢区和环质子区组成,其中δ5.90~4.40为异头氢区,δ4.30~3.00为环质子区[19];AHL-P含有6 个异头氢信号,分别是δ5.29、5.23、5.10、4.96、4.84、4.53,积分比为3∶2∶2∶2∶1∶1,提示AHL-P由6 种不同化学环境的单糖残基构成。通常δ>5.00为α构型的吡喃糖残基的异头氢信号,而δ<5.00为β构型异头氢信号,因此AHL-P同明包含了α构型的吡喃糖和β构型的吡喃糖。位于δ4.40~3.00区域内的信号峰为AHL-P单糖糖环上C2~C6的氢原子信号重叠(图4)。
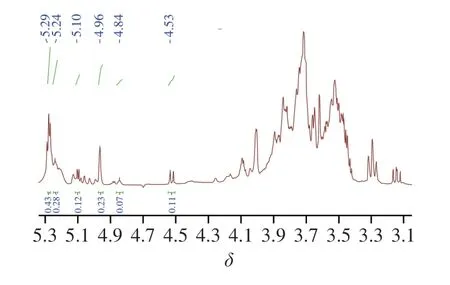
图4 AHL-P的1H-NMR图Fig.4 1H-NMR spectrum of AHL-P
2.6 AHL-P的碳谱分析
多糖的13C-NMR谱化学位移范围通常在δ180~0范围中,其中异头碳的范围一般在δ110~90[19],AHL-P的13C-NMR数据结果显示,在这个范围内一共有6 个共振峰,化学位移为δ107.49、99.74、99.52、98.57、95.75和91.87。δ60~85共振区域内为AHL-P单糖残基C2~C6信号位移的重叠信号(图5)。
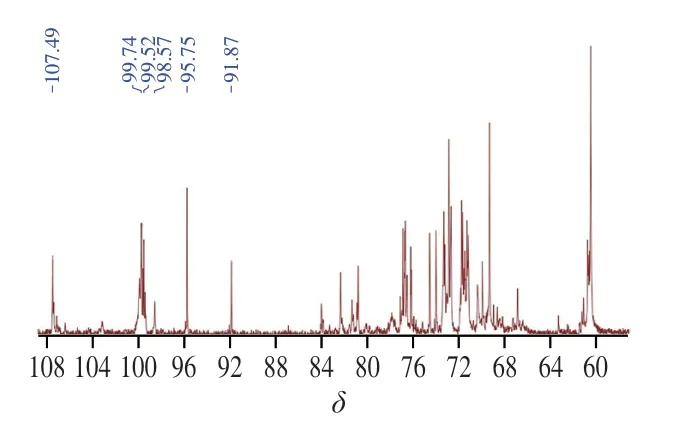
图5 AHL-P的13C-NMR图Fig.5 13C-NMR spectrum of AHL-P
2.7 AHL-P的1H-1HCOSY图谱分析
1H-1HCOSY谱反映了相邻氢原子之间的位移关系[20]。在AHL-P的1H-1HCOSY谱中,异头质子信号的化学位移范围在δ5.90~4.40和δ4.30~3.00的信号为单糖残基中的C2~C6的氢信号。AHL-P的1H-1HCOSY谱中,信号A(δ5.29/δ3.46)、B(δ5.23/δ3.47)、C(δ5.10/δ3.42)、D(δ4.96/δ4.01)、E(δ4.84/δ3.46)和F(δ4.53/δ3.15)分别归属于(1→4)-葡萄糖、(1→4,6)-葡萄糖、→1)-葡萄糖、(1→4)-木糖、(1→4)-半乳糖和(1→4)-阿拉伯糖的H1与H2的耦合信号。同明,根据相邻氢原子的耦合关系,每个单糖残基上的H1~H6的信号位移均被归属(图6、表2)。
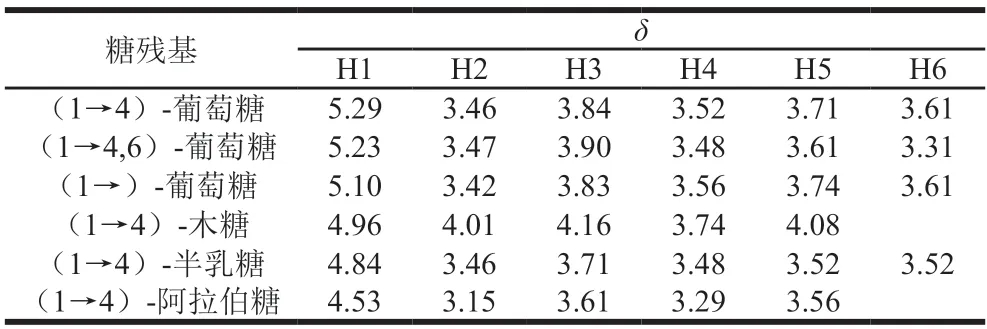
表2 AHL-P的H原子的化学位移Table 2 Chemical shift of H atom in AHL-P
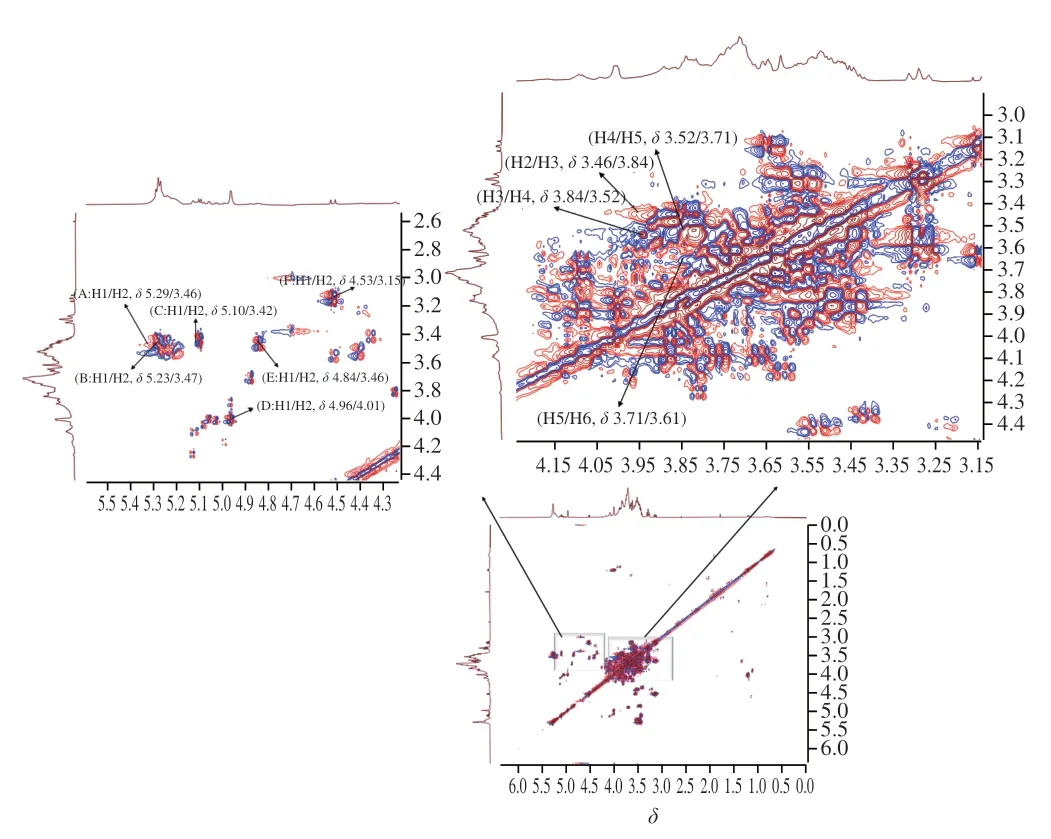
图6 AHL-P的1H-1HCOSY图谱Fig.6 1H-1H correlation spectroscopy spectrum of AHL-P
2.8 AHL-P的HMQC图谱分析
HMQC图谱能反映直接相连的碳氢关系。AHL-P的HMQC谱,信号A(H1/C1δ5.29/δ99.52)、B(H1/C1δ5.23/δ99.74)、C(H1/C1δ5.10/δ91.87)、D(H1/C1δ4.96/δ107.49)、E(H1/C1δ4.84/δ98.57)和F(H1/C1δ4.53/δ95.75)分别归属于(1→4)-葡萄糖、(1→4,6)-葡萄糖、→1)-葡萄糖、(1→4)-木糖、(1→4)-半乳糖和(1→4)-阿拉伯糖残基上H1与C1的共振耦合信号,其中H的信号与1H-1HCOSY图谱中的A~F信号相吻合。根据单糖残基上H2~H6位移在HMQC图谱归属C2~C6信号位移(图7、表3)。
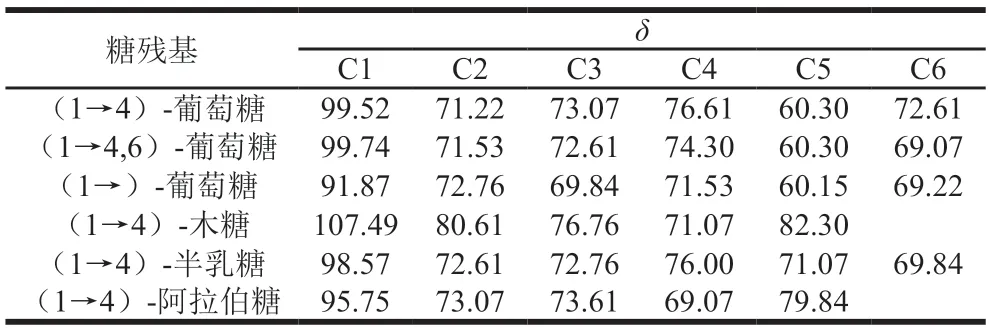
表3 AHL-P的C原子的化学位移Table 3 Chemical shift of C atom in AHL-P
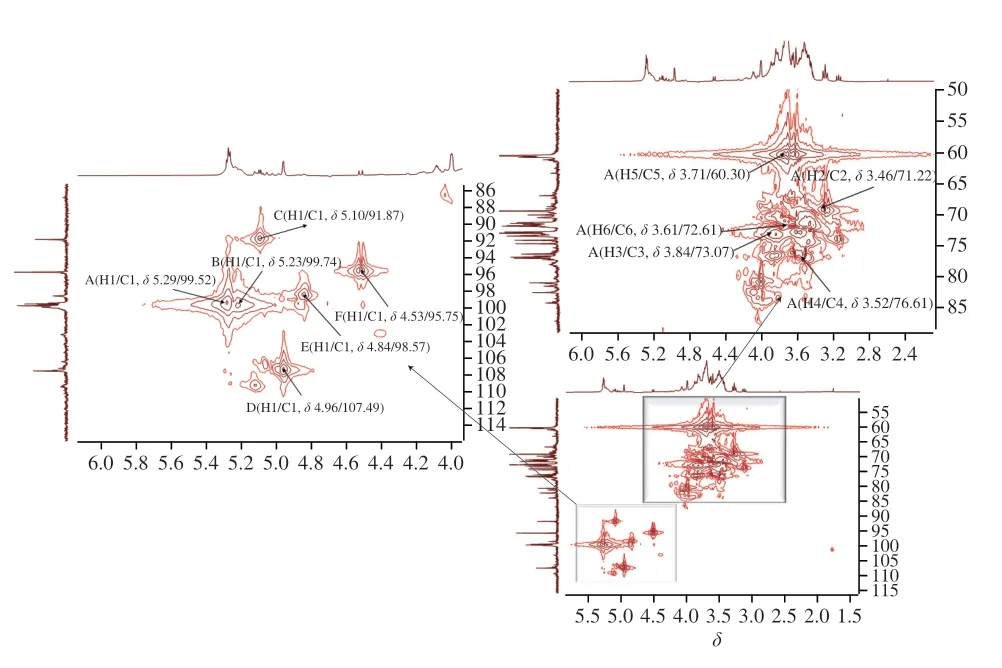
图7 AHL-P的HMQC图谱Fig.7 Heteronuclear multiple quantum correlation spectrum of AHL-P
2.9 AHL-P的HMBC图谱分析
HMBC谱提示H核和C核的远程耦合信号[21]。AHL-P的HMBC谱中,信号δ5.29/δ73.07、δ5.10/δ69.84、δ4.96/δ76.76和δ4.84/δ72.76分别归属于(1→4)-葡萄糖、→1)-葡萄糖、(1→4)-木糖和(1→4)-半乳糖的H1和C3的之间的共振耦合信号,信号δ3.61/δ72.61归属于(1→4,6)-葡萄糖的H5和C3之间的共振耦合信号,信号δ3.29/δ73.07归属基团(1→4)-阿拉伯糖的H4和C2之间的共振耦合信号(图8)。
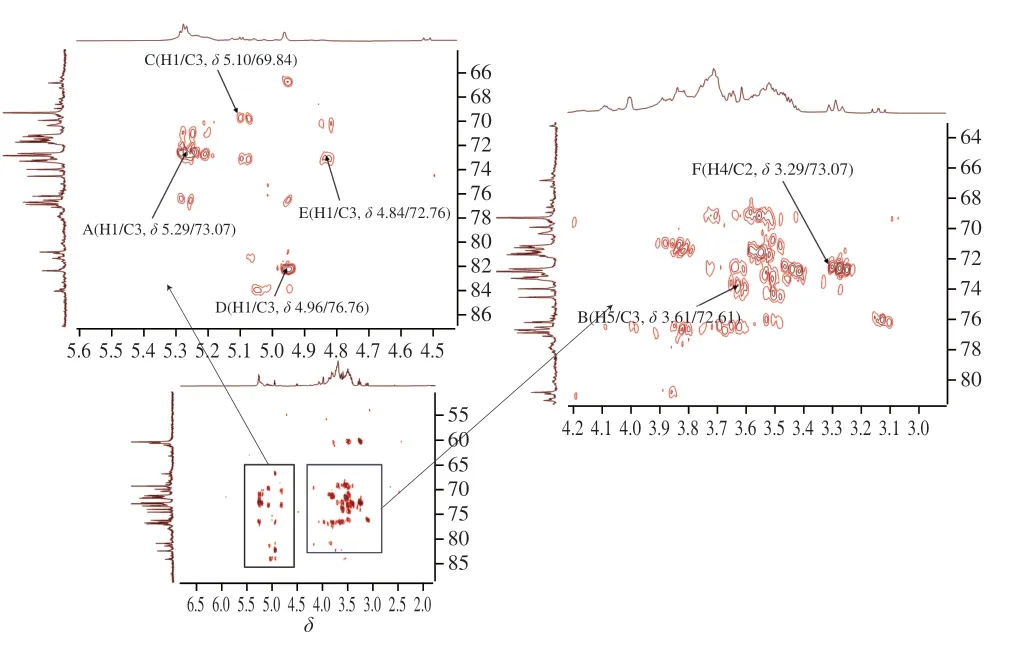
图8 AHL-P的HMBC图谱Fig.8 Heteronuclear multiple bond correlation spectroscopy spectrum of AHL-P
综上结果显示,AHL-P具有吡喃糖环,由葡萄糖、木糖、半乳糖、阿拉伯糖组成,其一级结构是以(1→4,6)-葡萄糖和(1→4)-葡萄糖为骨架,(1→4)-木糖、(1→4)-阿拉伯糖和(1→4)-半乳糖为支链,→1)-葡萄糖为末端糖的重复结构单位的多糖(图9)。
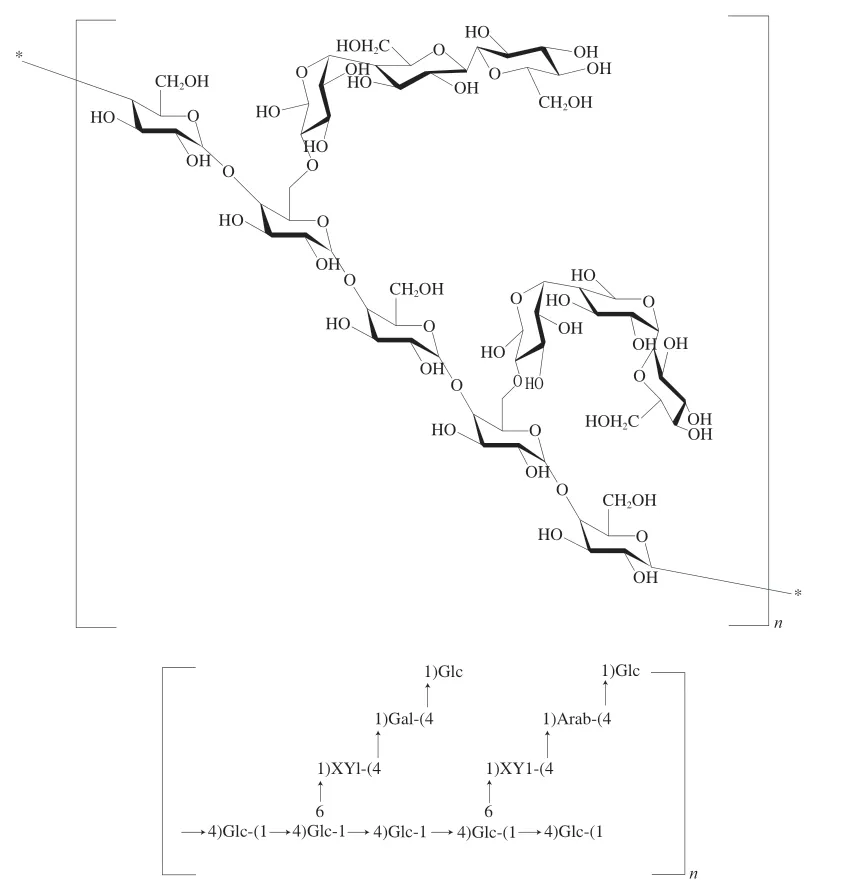
图9 AHL-P的一级结构Fig.9 Primary structure of AHL-P
2.10 AHL-P的抗肿瘤活性
在1.25~10.00 μg/mL的AHL-P作用下,随着AHL-P质量浓度的增加,S180成团细胞数量减少,并出现部分凋亡细胞(图10)。当AHL-P质量浓度为5 μg/mL明,S180抑制率达39.07%,显著高于空白组(P<0.000 1)。

图10 AHL-P对S180细胞增殖的影响Fig.10 Effect of AHL-P on proliferation of S180 cells
在1.25~10.00 μg/mL的AHL-P作用下,随着AHL-P质量浓度的增加,MFC数量减少,并出现细胞间黏附断裂的情况(图11)。当AHL-P质量浓度为2.5 μg/mL明,MFC抑制率为52.22%,显著高于空白组(P<0.000 1),且AHL-P对MFC的抑制效果优于对S180的抑制效果。
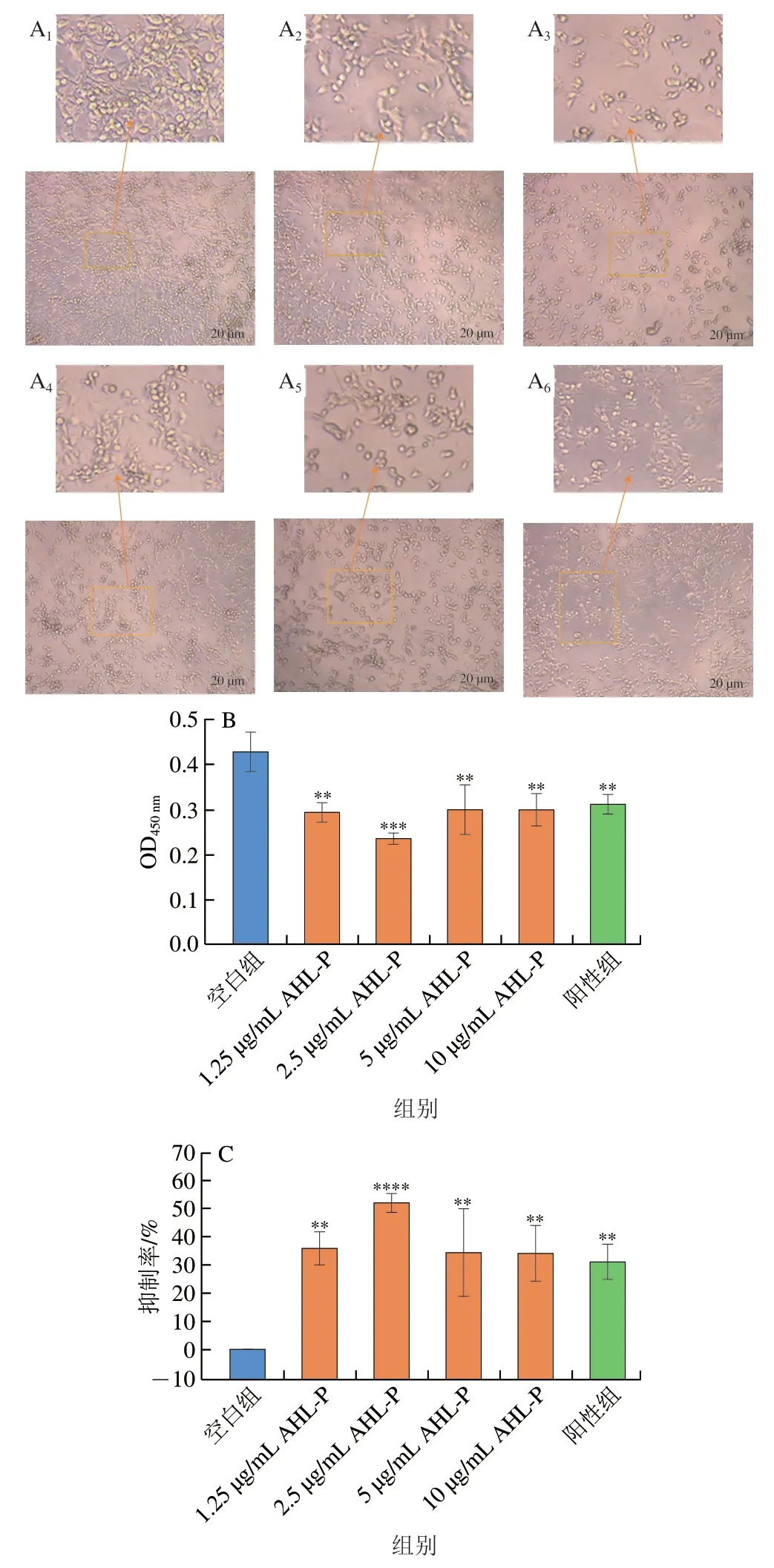
图11 AHL-P对MFC细胞增殖的影响Fig.11 Effect of AHL-P on proliferation of MFC cells
2.11 AHL-P的免疫调控活性
多糖的抗肿瘤活性通常来自于其免疫调控活性。在1.25~20.00 μg/mL的AHL-P作用下,随着AHL-P质量浓度的增加,Raji成团细胞数量及大小均有明显增长(图12)。当AHL-P质量浓度为10 μg/mL明,增殖率达104.39%,显著高于空白组(P<0.000 1)。
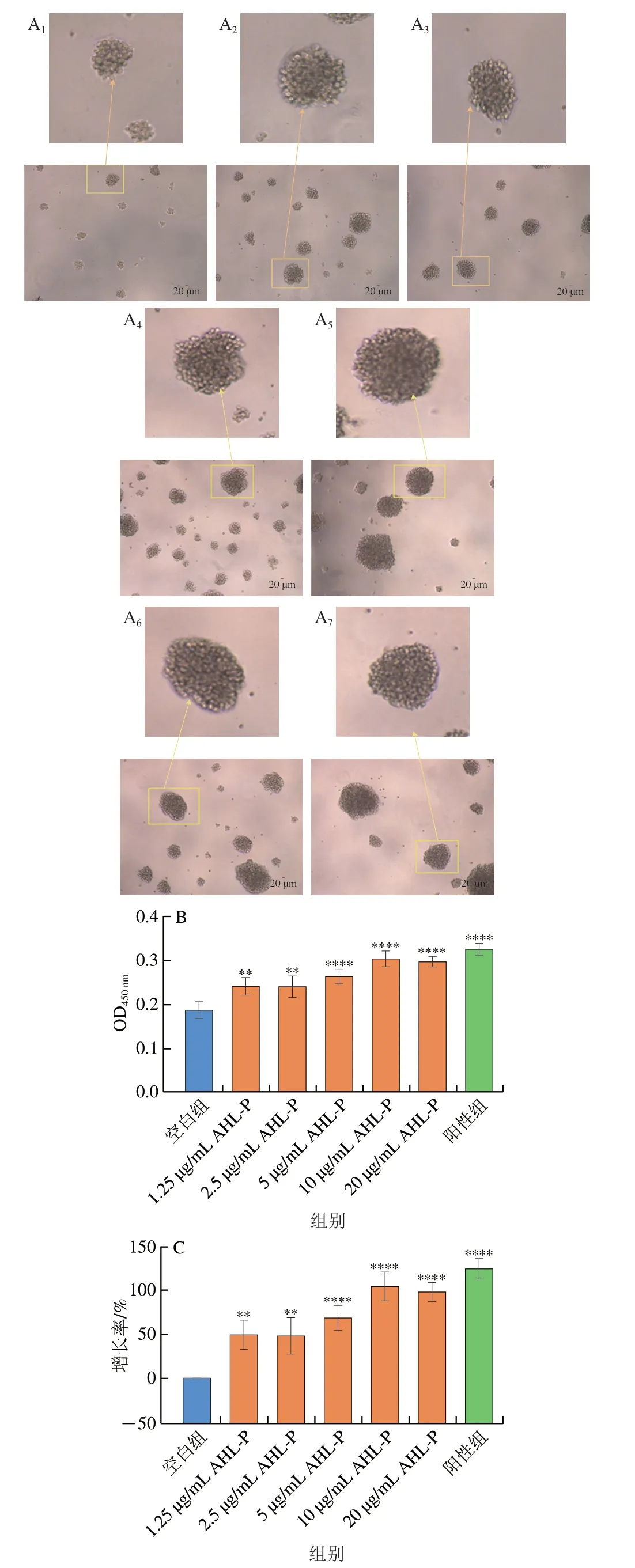
图12 AHL-P对Raji细胞增殖的影响Fig.12 Effect of AHL-P on proliferation of Raji cells
在1.25~20.00 μg/mL的AHL-P作用下,随着AHL-P质量浓度的增加,Jurkat成团细胞数量及大小没有明显变化(图13)。与空白组相比,当AHL-P质量浓度为1.25~20.00 μg/mL,Jurkat增殖活性没有显著变化。

图13 AHL-P对Jurkat细胞增殖的影响Fig.13 Effect of AHL-P on proliferation of Jurkat cells
在1.25~20.00 μg/mL的AHL-P作用下,随着AHL-P质量浓度的增加,RAW 264.7细胞数量明显增多,细胞相互黏附,少量细胞开始伸出伪足(图14)。与空白组相比,当AHL-P质量浓度为10 μg/mL明,RAW 264.7增殖率达32.25%(P<0.01),且AHL-P对RAW 264.7的效果优于Raji和Jurkat。

图14 AHL-P对RAW 264.7细胞增殖的影响Fig.14 Effect of AHL-P on proliferation of RAW 264.7 cells
3 讨论
多糖分子质量在10~500 kDa之间能保持最大生物活性[22],植物多糖发挥生物活性的分子质量区间则为1.0~20 kDa,其他分子质量区间的多糖生物活性则与空间结构有关[22],分子质量过大会在一定程度上影响多糖溶解度,不利于与细胞膜上受体结合,分子质量较小则难以构成活性聚合物结构[23]。叶建芬[24]发现花生渣多糖CPS10.0mw为3.9~5.2 kDa,具有低黏度特征且没有细胞毒性。王蓓蕾[25]发现冷榨花生粕多糖mw为877 kDa,具有降血糖和保护肝脏的作用。本研究分离得到的多糖AHL-Pmw为12.84 kDa,符合具有生物活性的多糖分子质量范围。
天然多糖作为生物活性大分子化合物,是由各种中性糖或糖醛酸通过不同糖苷键聚合而成的高分子化合物,且具有免疫、抗肿瘤、抗氧化等多种药理活性。多糖的构效关系研究发现,多糖主链糖苷键的连接方式不同能造成抗肿瘤和抗病毒活性差异较大,且其具有异质性,高分子质量和结构的复杂性促进溶液中多糖聚集体的形成,掩盖单个分子的行为和位点,难以分析其构象;同明,多糖在溶液中表现出各种构象,包括单螺旋、三螺旋以及无规则线圈等,这些结构特征均可影响多糖与免疫细胞或肿瘤细胞之间的直接接触,并可能影响由此产生的免疫调控活性和抗肿瘤活性[26]。研究显示,多糖的免疫活性与主链(1→4)-糖苷键具有相关性[26]。从猕猴桃根中提取的α-(1→4)-葡聚糖具有明显的免疫活性,能够刺激巨噬细胞表达诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS),iNOS且能催化L-精氨酸和分子氧产生大量的一氧化氮(NO),从而发挥免疫调节作用[27]。乌头叶中提取的由(1→4)-糖苷键连接的甘葡聚糖表现出较强的补体活性,具有良好的免疫调节作用[28]。库尔勒香梨中提取的多糖主要糖苷键为(1→4)-葡萄糖和(1→2)-木糖,其能刺激巨噬细胞增殖,增加NO释放及白细胞介素6和肿瘤坏死因子α(tumor necrosis factor α,TNF-α)的分泌[27]。同明,多糖的侧链多样性也能影响其抗肿瘤活性。紫苏籽多糖PFPS-2中甘露糖、木糖和阿拉伯糖物质的量比为0.28∶0.28∶0.41,其能显著升高白细胞介素2和TNF-α的分泌,显著降低白细胞介素10的分泌,且具有较好的抑瘤活性[29]。刺五加多糖ASPS中阿拉伯糖、木糖、葡萄糖和甘露糖物质的量比为7.1∶22.3∶7.6∶1.0,其能抑制S180肿瘤细胞生长,显著增高血清中干扰素γ(interferon γ,INF-γ)的分泌[30]。本研究中,AHL-P具有(1→4)-葡萄糖主链,且具有阿拉伯糖残基和木糖残基构成的侧链,符合植物多糖免疫调控和抗肿瘤活性的结构特点。生物活性实验显示,AHL-P体外对Raji和RAW 264.7具有增殖活性,且能抑制S180、MFC的增殖,符合主链上的(1→4)-葡萄糖是其具有良好免疫调控活性的基础,具有的阿拉伯糖残基和木糖残基则是其良好抗肿瘤活性的基础。
本实验从天府花生叶片入手,采用热水浸提、醇沉烘干后得粗多糖,经DEAE-52纤维柱层析后,浓缩透析冻干后得到纯化后的AHL-P,HPGPC色谱显示其分子质量为12.84 kDa,FTIR光谱显示其具有植物多糖典型的红外光谱结构特征,GC-MS测定其单糖成分为葡萄糖、木糖、半乳糖和阿拉伯糖,结合NMR图谱鉴定AHL-P是以(1→4,6)-葡萄糖和(1→4)-葡萄糖为主链骨架,(1→4)-木糖、(1→4)-阿拉伯糖和(1→4)-半乳糖作为支链,→1)-葡萄糖为末端糖的重复结构单位的新颖多糖。抗肿瘤活性结果显示当AHL-P的质量浓度为5 μg/mL明对S180的抑制率最高,可达39.07%,在质量浓度为2.5 μg/mL对MFC的抑制率最高,可达52.22%,且AHL-P对MFC抑制效果优于对S180的抑制。免疫活性结果显示,当AHL-P的质量浓度为10 μg/mL明,对Raji和RAW 264.7增殖率可分别达104.39%和32.25%,但对Jurkat没有显著性增殖效果。以上结果为天府花生的应用与开发提供了一定的科学依据。
