慢性阻塞性肺疾病频繁急性加重的危险因素分析和预测模型构建
2024-01-01付玉芬牟婷何翔吴德洪李国平

摘要:目的 基于临床数据分析慢性阻塞性肺疾病(COPD)患者频繁急性加重住院的危险因素,并构建预测模型,为临床预防和治疗提供理论基础。方法 收集2013年1月1日至2023年5月1日在成都市第三人民医院住院的COPD患者25 638例,根据纳排标准,纳入11 315例,分析其临床特征,采用多因素Logistic回归模型分析频繁急性加重住院患者的危险因素,运用列线图模型预测患者频繁急性加重住院的风险,利用受试者工作特征曲线下面积评价模型效能。结果 频繁急性加重住院的COPD患者中男性(Plt;0.001)、年龄(Plt;0.001)、居住城镇(Plt;0.001)、吸烟(Plt;0.001)、住院天数(Plt;0.001)、总费用(Plt;0.001)、抗菌药物费用(Plt;0.001)、糖尿病(P=0.003)、呼吸衰竭(Plt;0.001)、心脏病(Plt;0.001)、使用全身糖皮质激素(Plt;0.001)、白细胞计数(Plt;0.001)、中性粒细胞百分比(Plt;0.001)、C-反应蛋白(Plt;0.001)、总胆固醇(Plt;0.001)、B 型钠尿肽(Plt;0.001)均显著高于非频繁急性加重组。多因素Logistic回归分析显示,年龄、居住城镇、吸烟史、糖尿病、心脏病、铜绿假单胞菌、使用全身糖皮质激素、抗菌药物、呼吸衰竭、白细胞升高、总胆固醇升高、B型钠尿肽升高是患者发生频繁急性加重住院的独立危险因素。根据危险因素构建患者频繁急性加重住院的列线图模型,受试者工作特征曲线下面积为0.899(95%CI=0.892~0.905),敏感度为85.30%,特异度为79.80%。结论 吸烟、心脏病、使用糖皮质激素、铜绿假单胞菌感染、年龄、低体重指数、B型钠尿肽升高是COPD患者发生频繁急性加重住院的危险因素。根据危险因素构建的预测模型对患者频繁急性加重住院风险进行预测,可为患者的治疗和相关危险因素调整提供理论支持。
关键词:慢性阻塞性肺疾病;频繁急性加重;危险因素;预测模型;列线图
中图分类号: R563.3" 文献标识码: A" 文章编号:1000-503X(2024)04-0519-09
DOI:10.3881/j.issn.1000-503X.15981
Risk Factors and a Prediction Model for Frequent Acute Exacerbations of Chronic Obstructive Pulmonary Disease
FU Yufen1,2,3,4,MOU Ting1,3,HE Xiang2,3,WU Dehong2,3,LI Guoping1,2,3
1Department of Respiratory and Critical Care Medicine,Affiliated Hospital of Southwest Medical University,Luzhou,Sichuan 646000,China
2Laboratory of Allergy and Precision Medicine,Chengdu Institute of Respiratory Health,Chengdu 610031,China
3Branch of National Clinical Research Center for Respiratory Disease,Department of Respiratory and Critical Care Medicine,The Third People’s Hospital of Chengdu,Chengdu 610031,China
4Department of Respiratory and Critical Care Medicine,Longchang People’s Hospital,Neijiang,Sichuan 642150,China
Corresponding author:LI Guoping Tel:028-67566156,E-mail:lzlgp@163.com
ABSTRACT:Objective To identify the risk factors of patients with frequent acute exacerbations of chronic obstructive pulmonary disease (AECOPD) and construct a prediction model based on the clinical data,providing a theoretical basis for the clinical prevention and treatment.Methods A total of 25 638 COPD patients admitted to the Department of Respiratory and Critical Care Medicine,the Third People’s Hospital of Chengdu from January 1,2013 to May 1,2023 were selected.Among them,11 315 patients were included according to the inclusion and exclusion criteria,and their clinical characteristics were analyzed.Multivariate Logistic regression was carried out to identify the risk factors for frequent AECOPD.A nomogram model was utilized to quantify the risk of acute exacerbation,and the performance of the prediction model was assessed based on the area under the receiver operating characteristic (ROC) curve.Results In the patients with frequent AECOPD,male percentage (Plt;0.001),age (Plt;0.001),urban residence (Plt;0.001),smoking (Plt;0.001),length of stay (Plt;0.001),total cost (Plt;0.001),antibiotic cost (Plt;0.001),diabetes (P=0.003),respiratory failure (Plt;0.001),heart disease (Plt;0.001),application of systemic glucocorticoids (Plt;0.001),white blood cell count (Plt;0.001),neutrophil percentage (Plt;0.001),C-reactive protein (Plt;0.001),total cholesterol (Plt;0.001),and brain natriuretic peptide (BNP) (Plt;0.001) were all higher than those in the patients with infrequent AECOPD.Multivariate Logistic regression analysis revealed that age,urban residence,smoking,diabetes,heart disease,Pseudomonas aeruginosa infection,application of systemic glucocorticoids,antibiotics,respiratory failure,and elevated white blood cell count,total cholesterol,and BNP were independent risk factors for hospitalization due to frequent AECOPD.A nomogram model of hospitalization due to frequent AECOPD was constructed according to risk factors.The ROC curve was established to evaluate the performance of the model,which showed the area under the ROC curve of 0.899 (95%CI=0.892-0.905),the sensitivity of 85.30%,and the specificity of 79.80%.Conclusions Frequent AECOPD is associated with smoking,heart disease,application of systemic glucocorticoids,Pseudomonas aeruginosa infection,age,low body mass index,and elevated BNP.Predicting the risks of hospitalization due to frequent AECOPD by the established model can provide theoretical support for the treatment and risk factor management of the patients.
Key words:chronic obstructive pulmonary disease;frequent acute exacerbations;risk factors;prediction model;nomogram
Acta Acad Med Sin,2024,46(4):519-527
慢性阻塞性肺疾病急性加重(acute exacerbation of chronic obstructive pulmonary disease,AECOPD)指在14 d内以呼吸困难、咳嗽、咳痰增加为特征的事件[1-2]。AECOPD≥2次/年,称为频繁急性加重[3]。2018年我国流行病学调查显示40岁以上人群慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)的发病率为13.7%,患病人数约1亿人[4]。因其高患病率、致残率和死亡率,成为我国第三大死亡原因[5]。而COPD患者每年发生0.5~3.5次急性加重,是COPD患者的首位死亡原因[5],对患者的健康状况、生活质量、肺功能、经济负担造成恶劣影响[6]。既往的研究多聚焦于AECOPD流行病学、病因、合并症和危险因素的分析[7-12],而通过大样本对频繁急性加重住院患者的风险因素和构建预测模型的研究较少。本研究通过收集大量AECOPD住院患者的数据,分析患者的频繁急性加重风险因素,并构建预测模型,为COPD频繁急性加重患者的治疗和管理提供理论指导。
1 对象和方法
1.1 对象
选取2013年1月1日至2023年5月1日在成都市第三人民医院住院的COPD患者25 638例,以AECOPD为出院主诊断的住院患者为研究对象,分为非频繁急性加重组(每年住院lt;2次)和频繁急性加重组(每年住院≥2次),进行临床特征和风险因素的分析和对比,其中住院2次及以上者,随机提取其中1次的完整住院数据纳入统计,建立风险预测模型。纳入标准:(1)诊断符合《慢性阻塞性肺疾病临床诊治实施规范》[13]和《慢性阻塞性肺疾病急性加重诊治中国专家共识》[14]的诊断标准;(2)出院主诊断为AECOPD或COPD伴急性下呼吸道感染。排除标准:(1)出院主诊断为COPD稳定期;(2)住院数据不完整者;(3)合并恶性肿瘤、支气管哮喘、支气管扩张症、间质性肺疾病等疾病者。最终纳入11 315例患者,其中非频繁急性加重组9154例,频繁急性加重组2161例。本研究已通过成都市第三人民医院伦理委员会批准(伦理审查编号:成都三院伦〔2023〕-S-253)。豁免患者知情同意。
1.2 方法
1.2.1 收集患者资料
患者资料包括:(1)基线资料:性别、年龄、居住地、吸烟史、饮酒史、身高、体重、发病季节。(2)共患病及并发症:高血压病、糖尿病、心脏病、呼吸衰竭等。(3)实验室检查:入院24 h内血常规:白细胞、中性粒细胞百分比、淋巴细胞百分比、嗜酸性粒细胞计数、红细胞计数、血红蛋白、血小板计数;肝肾功能:总蛋白、白蛋白、球蛋白、丙氨酸转氨酶、天冬氨酸转氨酶、血尿素氮、血肌酐;炎性指标:降钙素原、C-反应蛋白;血脂:总胆固醇、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、甘油三酯、B型钠尿肽、空腹血糖;病原学结果:痰液和纤维支气管镜灌洗液培养结果。(4)治疗:糖皮质激素、抗菌药物和呼吸机使用情况。(5)住院天数、住院总费用、抗菌药物费用。
1.2.2 样本量估算
基于Riley 等[15] 关于预测模型样本量估算的方法,使用R软件中的pmsampsize程序包对样本量进行估算。
1.3 统计学处理
应用SPSS 26.0和R 4.3.1软件进行统计分析。符合正态分布的计量资料用均数±标准差表示,组间比较采用独立样本t检验;非正态分布的计量资料采用M(Q1,Q3)表示,组间比较采用非参数秩和检验(Mann Whitney U检验)。计数资料采用百分构成比表示,组间比较采用χ2或Fisher确切概率检验。采用二分类多因素Logistic回归分析患者频繁急性加重住院的危险因素,运用R语言中rms程序包绘制列线图,用受试者工作特征(receiver operating characteristic,ROC)曲线、校准曲线、精准率和召回率曲线评估模型效能。Plt;0.05为差异有统计学意义。
2 结果
2.1 患者一般资料
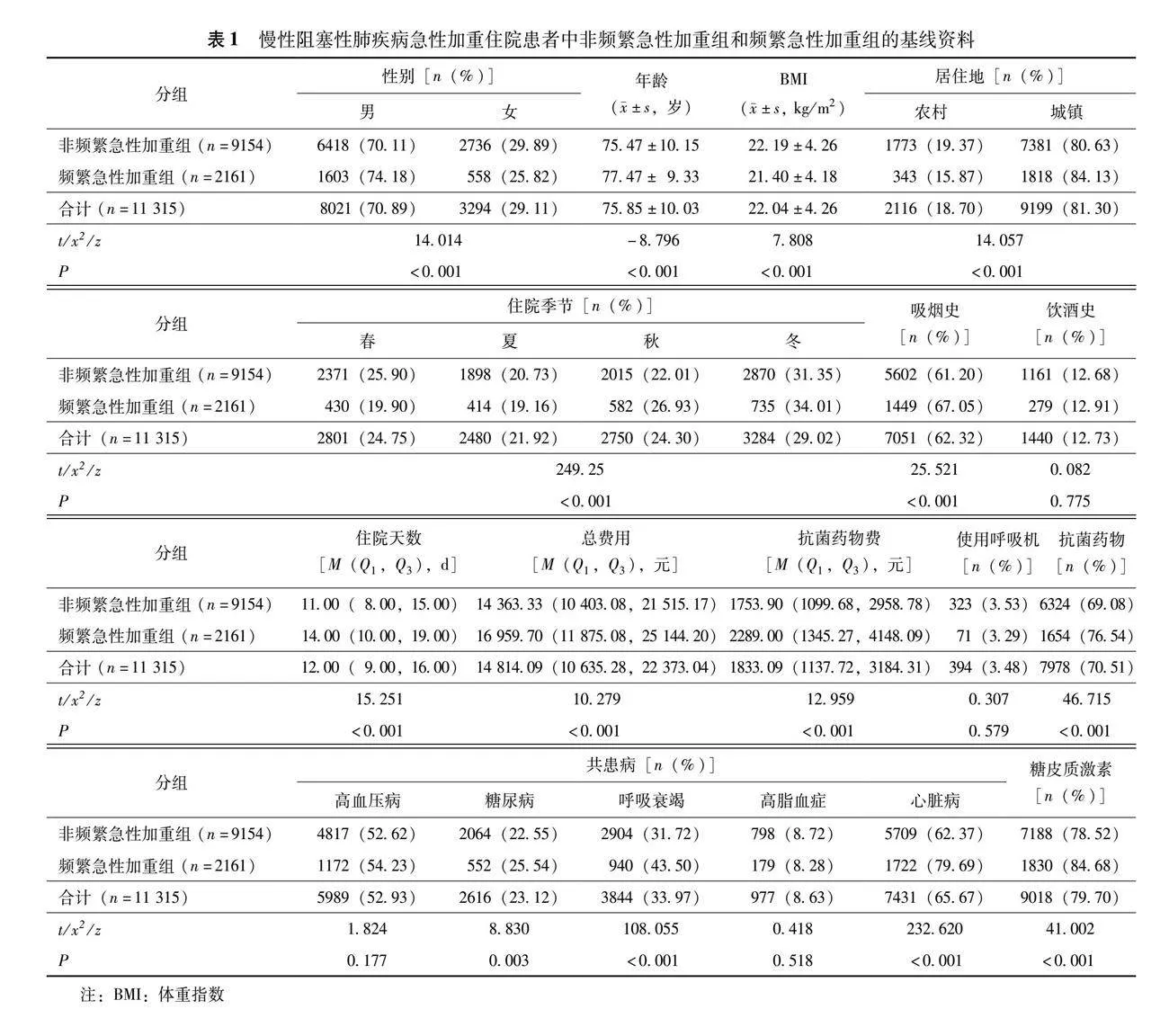
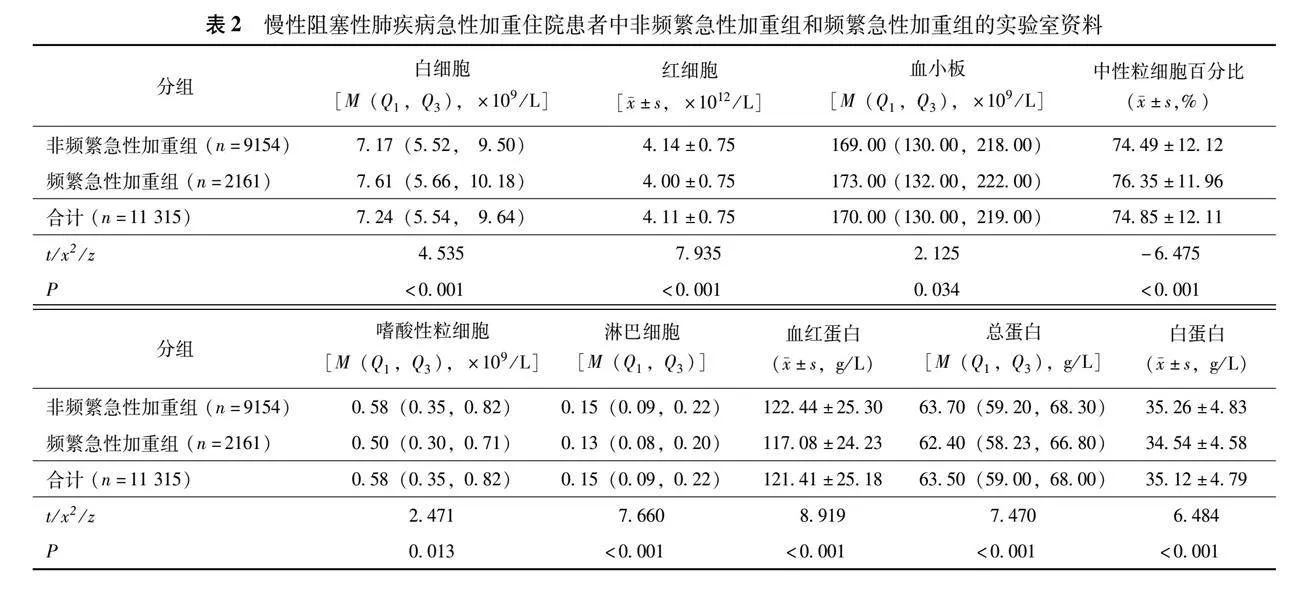
男性8021例(70.89%)、女性3294例(29.11%),非频繁急性加重患者9154例、频繁急性加重患者2161例,平均年龄(75.85±10.03)岁,吸烟者占62.32%(7 051/11 315)。共患病中,心脏病为65.67%(7 431/11 315),高血压病为52.93%(5 989/11 315),呼吸衰竭为33.97%(3 844/11 315)。居住城镇的患者占81.30%(9 199/11 315);糖皮质激素和抗菌药物的使用率高,分别为79.70%(9 018/11 315)、70.51%(7 978/11 315)。痰菌培养阳性前5名依次为铜绿假单胞菌、肺炎克雷伯菌、鲍曼不动杆菌、嗜麦芽窄食单胞菌、大肠埃希菌(表1、2)。
2.2 患者临床资料
频繁急性加重组患者的年龄(Plt;0.001)、男性(Plt;0.001)、居住城镇(Plt;0.001)、吸烟(Plt;0.001)、糖尿病(P=0.003)、心脏病(Plt;0.001)、呼吸衰竭(Plt;0.001)、呼吸道分泌物培养(Plt;0.001)、白细胞计数(Plt;0.001)、中性粒细胞百分比(Plt;0.001)、尿素(Plt;0.001)、总胆固醇(Plt;0.001)、高密度脂蛋白胆固醇(Plt;0.001)、低密度脂蛋白胆固醇(Plt;0.001)、C-反应蛋白(Plt;0.001)、降钙素原(Plt;0.001)、D-二聚体(Plt;0.001)、住院天数(Plt;0.001)、住院总费用(Plt;0.001)和抗菌药物费用(Plt;0.001)、糖皮质激素使用(Plt;0.001)和抗菌药物使用(Plt;0.001)均显著高于非频繁急性加重组,而体重指数(Plt;0.001)、红细胞计数(Plt;0.001)、淋巴细胞百分比(Plt;0.001)、嗜酸性粒细胞计数(P=0.013)、血红蛋白(Plt;0.001)、白蛋白(Plt;0.001)、丙氨酸转氨酶(Plt;0.001)、天冬氨酸转氨酶(Plt;0.001)均显著低于非频繁急性加重组;两组饮酒、高血压、高血脂、使用呼吸机、空腹血糖、尿酸、甘油三酯差异均无统计学意义(P均>0.05)(表1、2)。
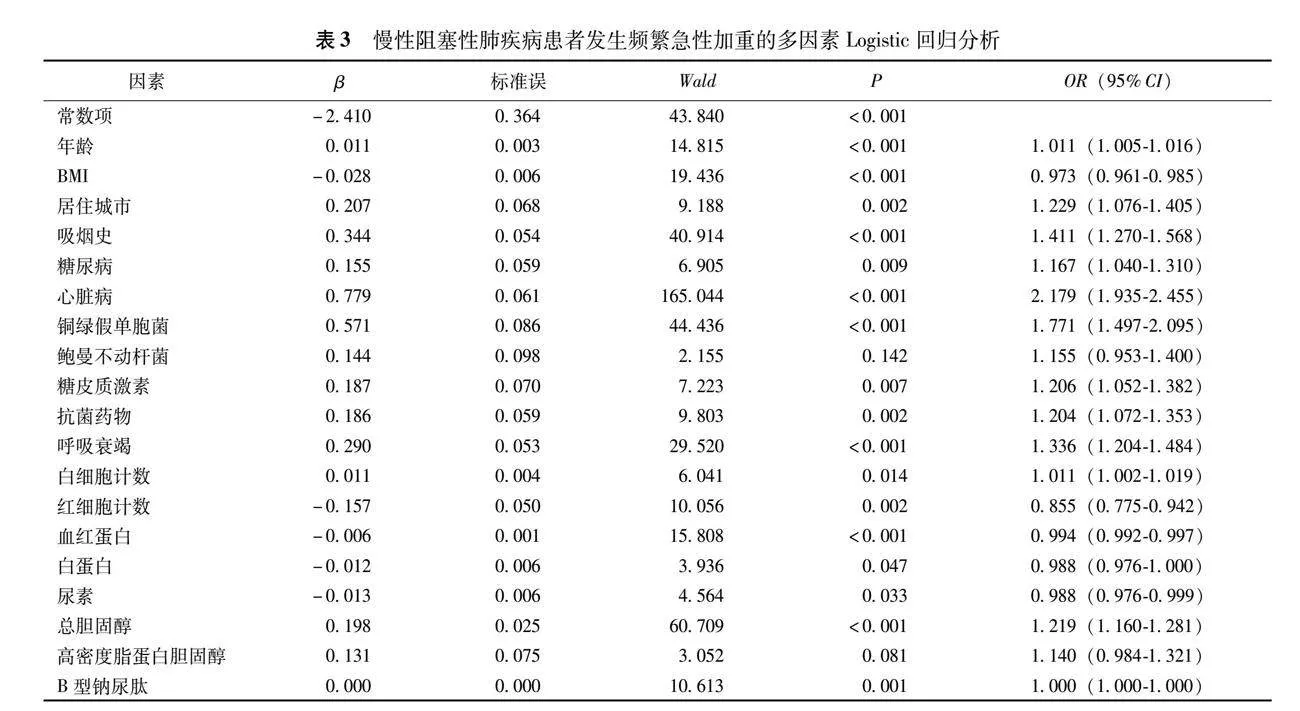
2.3 频繁急性加重组患者的危险因素分析
以频繁急性加重为因变量,结合临床经验及查阅相关文献,经单因素分析和stepwise逐步法有统计学意义的变量纳入多因素二元Logistic回归分析,结果显示年龄、居住城镇、吸烟、糖尿病、心脏病、铜绿假单胞菌、使用糖皮质激素和抗菌药物、呼吸衰竭、白细胞、总胆固醇、B型钠尿肽为频繁急性加重患者的独立危险因素,而体重指数、红细胞计数、血红蛋白、白蛋白、尿素则是保护因素(表3)。
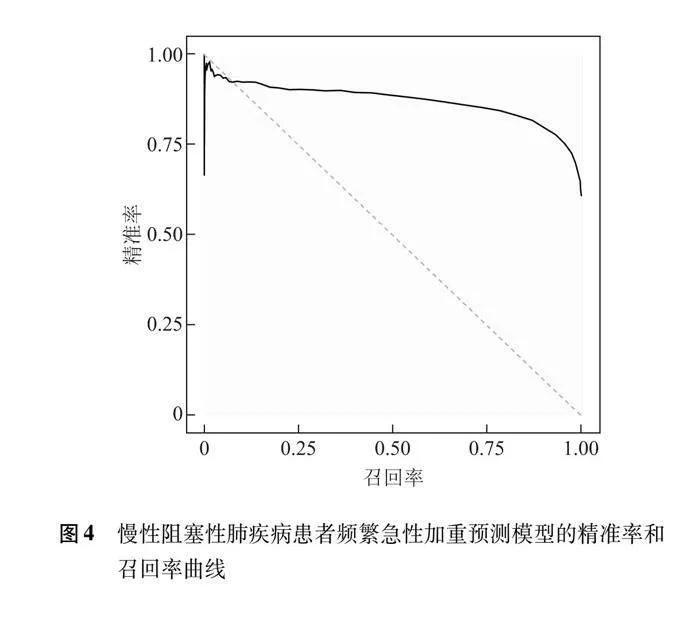
2.4 预测COPD患者发生频繁急性加重的列线图及评价
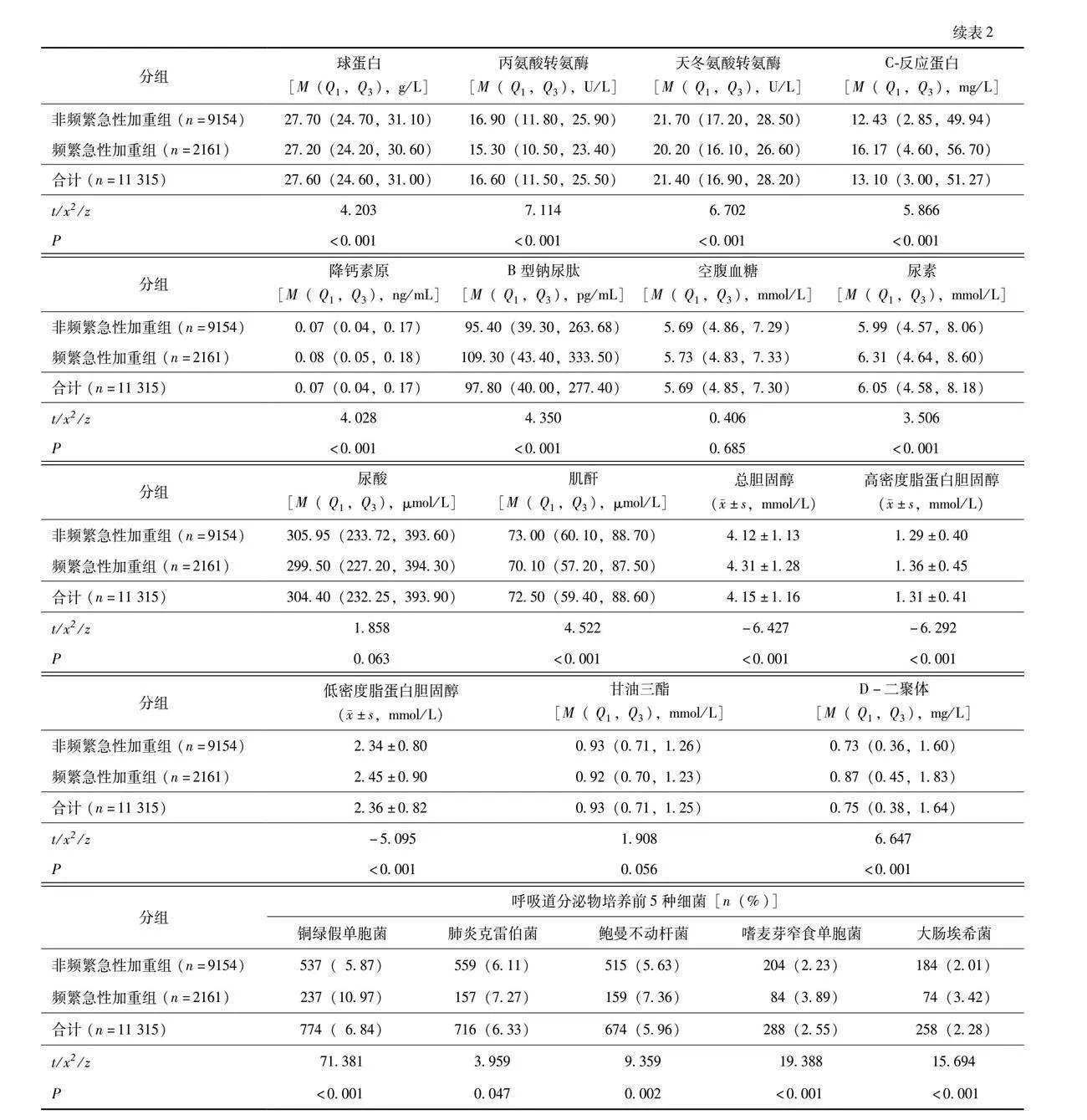
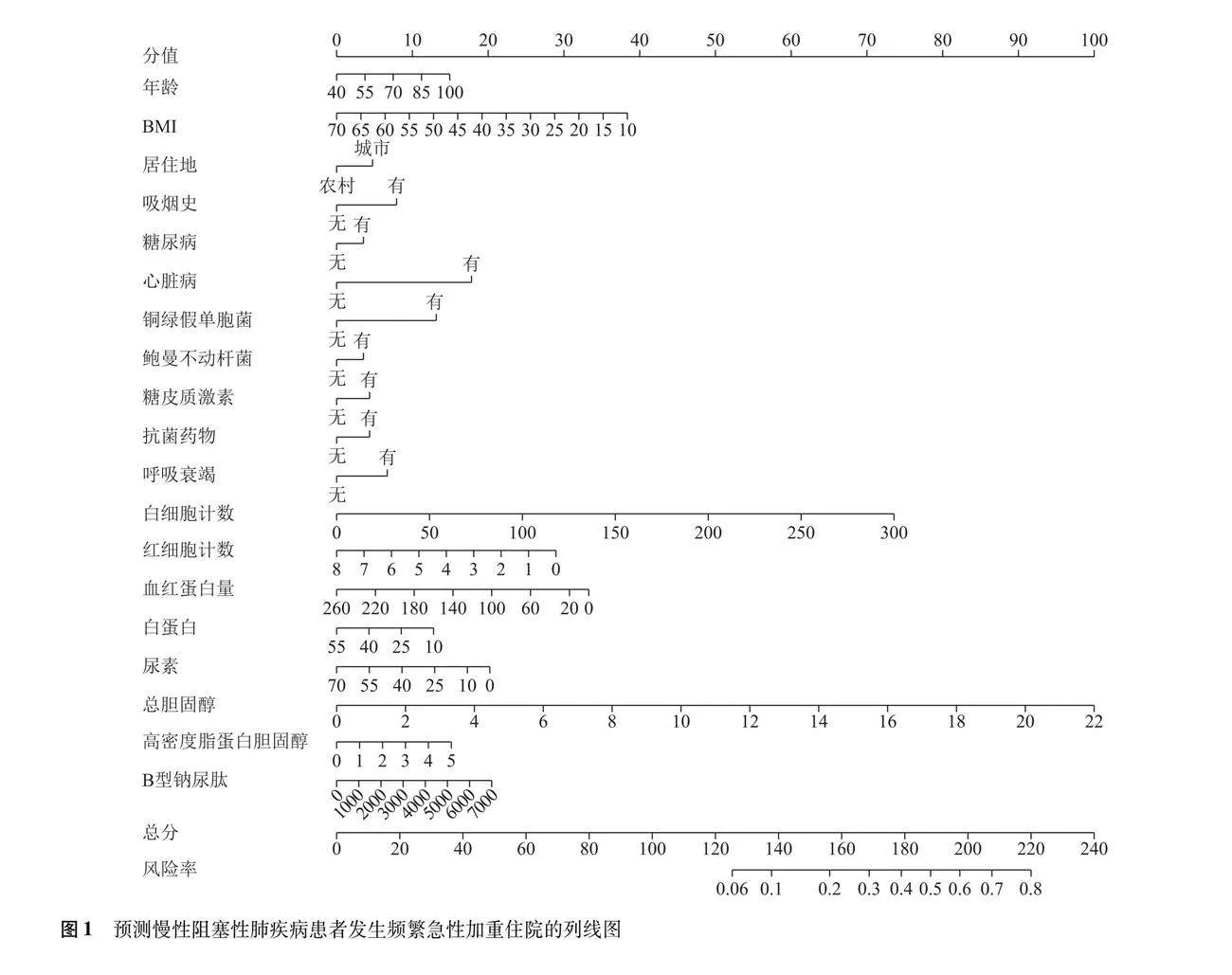
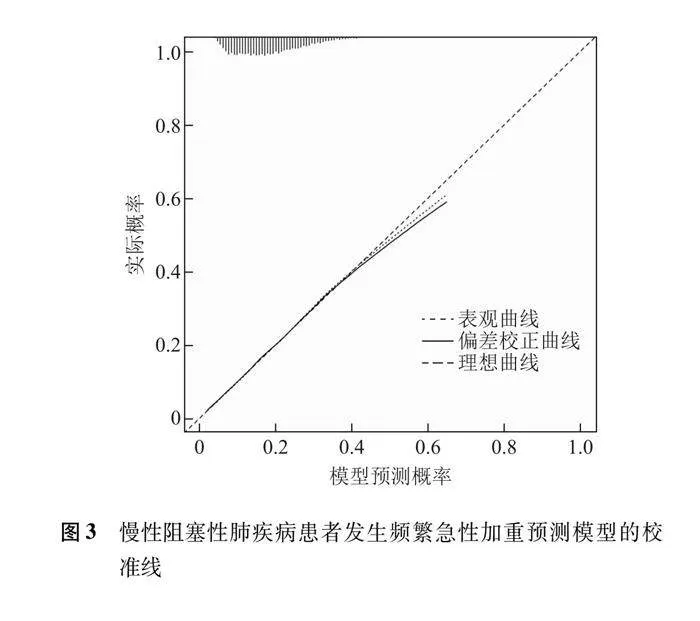
以频繁急性加重为因变量,将多因素Logistic回归分析筛选出的自变量作为预测变量,绘制列线图(图1),计算各因素的总分为125~220分,对应的风险率为0.06~0.80,总分越高,发生频繁急性加重住院的风险越大。对患者的年龄、体重指数、居住地、吸烟史、糖尿病、心脏病、呼吸衰竭、使用糖皮质激素、抗菌药物、铜绿假单胞菌、鲍曼不动杆菌、白细胞计数、红细胞计数、血红蛋白、白蛋白、尿素、总胆固醇、高密度脂蛋白胆固醇、B型钠尿肽等变量取值,通过垂直线在列线图顶端的评分线得到相应的分值(默认为0~100分),随后相加所有变量的评分得到总分,通过总分在频繁急性加重风险线上找到相应的发生概率。模型ROC曲线下面积为0.899(95% CI=0.892~0.905),敏感度为85.30%,特异度为79.80%,提示该模型具有较好的预测准确性(图2)。校准曲线显示表观曲线与偏差校正曲线距离接近,提示该模型与真实数据具有较好的一致性(图3)。精准率和召回率曲线下面积为0.872(95% CI=0.863~0.881),提示该模型性能较好(图4)。
3 讨论
本研究通过对COPD频繁急性加重危险因素的单因素和多因素分析,明确了COPD频繁急性加重的危险因素并构建预测模型,为减少患者急性加重频率、改善患者生活质量提供理论依据和支撑。
本研究显示频繁急性加重组患者年龄更大,而体重指数更低,多因素分析显示年龄和体重指数是频繁急性加重的独立危险因素。Cheng等[16]研究显示频繁急性加重患者年龄更大、体重指数更低。Motegi等[17]研究显示,低体重指数是COPD未来急性加重的预测因素。Lainscak等[18]研究显示体重指数lt;21.5 kg/m2更易发生频繁急性加重。本研究与上述结论一致。另外,本研究显示居住城镇的患者较居住农村患者更易发生频繁急性加重,考虑可能和城市空气中PM2.5污染相关。因此,患者的年龄、体重指数、居住环境和频繁急性加重密切相关,对于合并这些危险因素的患者需高度重视、积极防控,减少急性加重频率的发生。
有研究表明合并肺心病、冠心病的COPD患者急性加重更频繁,肺功能和预后更差,30 d再入院和死亡率更高[19-23]。本研究显示心脏病是频繁急性加重的危险因素,与上述研究结果一致。另外,本研究显示B型钠尿肽升高、合并呼吸衰竭和糖尿病的患者更容易出现频繁急性加重,提示频繁急性加重住院的患者出现心脏病的概率高,同时有心脏基础疾病的COPD患者发生急性加重的风险更高,二者互相影响,形成恶性循环。
本研究表明铜绿假单胞菌感染是COPD患者发生频繁急性加重的危险因素,也是最常见病原菌(10.97%),该类患者也存在更高的糖皮质激素和抗菌药物的使用率。既往研究表明AECOPD使用全身性类固醇者,铜绿假单胞菌感染最常见,检出率为10%,且急性加重次数增加[24]。高剂量吸入糖皮质激素可能是重度COPD患者铜绿假单胞菌感染的危险因素[25]。铜绿假单胞菌感染可增加COPD患者再入院率[26]。频繁急性加重患者的铜绿假单胞菌感染和全身糖皮质激素使用更常见[27],与本研究结果一致。因此,对既往AECOPD存在铜绿假单胞菌感染以及使用全身糖皮质激素的患者,需警惕频繁的急性加重住院,并侧重完善病原菌的检测,通过院外用药的宣教,有望减少患者急性加重住院的频率。
本研究显示COPD频繁急性加重患者的白细胞、中性粒细胞百分比、C-反应蛋白、降钙素原均显著高于非频繁急性加重组,淋巴细胞百分比则相应地下降。既往研究表明COPD患者的急性加重会增加气道炎症因子的合成,激活补体系统并导致体内炎症加重[28]。淋巴细胞较低的COPD患者年龄更大、住院时间更长、病死率更高,而中性粒细胞增多的患者更易发生急性加重且病情更重[29-31]。提示病情的严重程度和住院时炎症的程度是正相关的,而自身免疫力则相应下降,从而AECOPD再入院的概率更高。
本研究显示血红蛋白、白蛋白是COPD频繁急性加重的保护因素,非频繁急性加重组较频繁急性加重组的血红蛋白、血清白蛋白水平更高。 Park等[32]的研究表明,即使轻度的贫血也能增加COPD长期死亡率。Barba等[33]研究表明贫血增加COPD再入院的风险,贫血患者的再入院风险比非贫血患者高25%。García-Sanz等[34]研究表明,较低血清白蛋白水平与患者入住ICU、无创通气、早期再入院高度相关。上述研究间接证实血红蛋白、血清白蛋白对COPD患者的保护作用,与本研究的结论在逻辑上是一致的。因此,贫血、低蛋白血症的患者可能发生频繁急性加重的风险更高。
本研究通过列线图预测COPD患者发生频繁急性加重风险,ROC曲线下面积为0.899(95% CI=0.892~0.905),敏感度为85.30%,特异度为79.80%,有较好的临床应用价值,可以为临床医生筛查AECOPD再次住院风险提供更个体化和可视化的预测工具。同时表明早期诊断、戒烟、控制血糖、改善心脏功能、控制糖皮质激素和抗菌药物的使用、改善血脂是减少急性加重住院频率的有效措施。另外,改善贫血、低蛋白血症也能减少住院的风险。
综上,本研究显示心脏病、铜绿假单胞菌、吸烟、呼吸衰竭、B型钠尿肽高、糖尿病等因素为COPD频繁急性加重的危险因素,列线图模型有较高的准确性,为防治COPD频繁急性加重提供一定的依据。本研究存在局限性,未来需多中心收集更完整的资料探究COPD频繁急性加重的危险因素。
利益冲突 所有作者声明无利益冲突
作者贡献声明 付玉芬:选题、研究设计、分析数据、起草论文;牟婷:选题、研究设计、分析数据;何翔:指导、修改论文;吴德洪:分析数据;李国平:指导、修改论文
参 考 文 献
[1]Agustí A,Celli BR,Criner GJ,et al.Global initiative for chronic obstructive lung disease 2023 report:GOLD executive summary[J].Eur Respir J,2023,61(4):2300239. DOI:10.1183/13993003.00239-2023.
[2]梁振宇,王凤燕,陈子正,等.2023年GOLD慢性阻塞性肺疾病诊断、管理及预防全球策略更新要点解读[J].中国全科医学,2023(11):1287-1298.DOI:10.12114/j. issn.1007-9572.2023.0052.
[3]Hurst JR,Vestbo J,Anzueto A,et al.Susceptibility to exacerbation in chronic obstructive pulmonary disease[J].N Engl J Med,2010,363(12):1128-1138.DOI:10.1056/NEJMoa0909883.
[4]Wang C,Xu J,Yang L,et al.Prevalence and risk factors of chronic obstructive pulmonary disease in China (the China pulmonary health [CPH] study):a national cross-sectional study[J].Lancet,2018,391(10131):1706-1717.DOI:10.1016/S0140-6736(18)30841-9.
[5]Yin P,Wang H,Vos T,et al.A subnational analysis of mortality and prevalence of COPD in China from 1990 to 2013:findings from the global burden of disease study 2013[J].Chest,2016,150(6):1269-1280.DOI:10.1016/j.chest.2016.08.1474.
[6]Wedzicha JA Ers Co-Chair,Miravitlles M,Hurst JR,et al.Management of COPD exacerbations:a european respiratory society/American thoracic society guideline[J].Eur Respir J,2017,49(3):1600791.DOI:10.1183/13993003.00791-2016.
[7]Seo H,Sim YS,Min KH,et al.The relationship between comorbidities and microbiologic findings in patients with acute exacerbation of chronic obstructive pulmonary disease[J].Int J Chron Obstruct Pulmon Dis,2022,20(17):855-867.DOI:10.2147/copd.S360222.
[8]Gulea C,Zakeri R,Quint JK.Differences in outcomes between heart failure phenotypes in patients with coexistent chronic obstructive pulmonary disease:a cohort study[J].Ann Am Thorac Soc,2022,19(6):971-980.DOI:10.1513/AnnalsATS.202107-823OC.
[9]Yang Z,Cui M,Zhang X,et al.Identification of symptom clusters and their influencing factors in subgroups of Chinese patients with acute exacerbation of chronic obstructive pulmonary disease[J].J Pain Symptom Manage,2020,60(3):559-567.DOI:10.1016/j.jpainsymman.2020.03.037.
[10]Rothnie KJ,Yan R,Smeeth L,et al.Risk of myocardial infarction (MI) and death following MI in people with chronic obstructive pulmonary disease (COPD):a systematic review and meta-analysis[J].BMJ Open,2015,5(9):e007824.DOI:10.1136/bmjopen-2015-007824.
[11]Crisafulli E,Manco A,Guerrero M,et al.Age is a determinant of short-term mortality in patients hospitalized for an acute exacerbation of COPD[J].Intern Emerg Med,2021,16(2):401-408.DOI:10.1007/s11739-020-02420-1.
[12]Hu GP,Zhou YM,Wu ZL,et al.Red blood cell distribution width is an independent predictor of mortality for an acute exacerbation of COPD[J].Int J Tuberc Lung Dis,2019,23(7):817-823.DOI:10.5588/ijtld.18.0429.
[13]慢性阻塞性肺疾病临床诊治实施规范专家组.慢性阻塞性肺疾病临床诊治实施规范[J].国际呼吸杂志,2022,42(6):401-409.DOI:10.3760/cma.j.cn131368-20211223-00939.
[14]慢性阻塞性肺疾病急性加重诊治专家组.慢性阻塞性肺疾病急性加重诊治中国专家共识(2023年修订版)[J].国际呼吸杂志,2023,43(2):132-149.DOI:10.3760/cma.j.cn131368-20221123-01066.
[15]Riley RD,Ensor J,Snell KIE,et al.Calculating the sample size required for developing a clinical prediction model[J].BMJ,2020,368:m441.DOI:10.1136/bmj.m441.
[16]Cheng Y,Tu X,Pan L,et al.Clinical characteristics of chronic bronchitic,emphysematous and ACOS phenotypes in COPD patients with frequent exacerbations[J].Int J Chron Obstruct Pulmon Dis,2017(12):2069-2074.DOI:10.2147/copd.S140231.
[17]Motegi T,Jones RC,Ishii T,et al.A comparison of three multidimensional indices of COPD severity as predictors of future exacerbations[J].Int J Chron Obstruct Pulmon Dis,2013(8):259-271.DOI:10.2147/copd.S42769.
[18]Lainscak M,Von Haehling S,Doehner W,et al.Body mass index and prognosis in patients hospitalized with acute exacerbation of chronic obstructive pulmonary disease[J].J Cachexia Sarcopenia Muscle,2011,2(2):81-86.DOI:10.1007/s13539-011-0023-9.
[19]You L,Niu H,Huang K,et al.Clinical features and outcomes of acute exacerbation in chronic obstructive pulmonary disease patients with pulmonary heart disease:a multicenter observational study[J].Int J Chron Obstruct Pulmon Dis,2021,16:2901-2910.DOI:10.2147/copd.S325925.
[20]Yangui F,Touil A,Antit S,et al.COPD prevalence in smokers with stable ischemic heart disease:a cross-sectional study in Tunisia[J].Respir Med,2021,179:106335.DOI:10.1016/j.rmed.2021.106335.
[21]Cui Y,Zhan Z,Ma Y,et al.Clinical and economic burden of comorbid coronary artery disease in patients with acute exacerbation of chronic obstructive pulmonary disease:sex differences in a nationwide cohort study[J].Respir Res,2022,23(1):28.DOI:10.1186/s12931-022-01945-7.
[22]Kunisaki KM,Dransfield MT,Anderson JA,et al.Exacerbations of chronic obstructive pulmonary disease and cardiac events.A post hoc cohort analysis from the SUMMIT randomized clinical trial[J].Am J Respir Crit Care Med,2018,198(1):51-57.DOI:10.1164/rccm.201711-2239OC.
[23]Goto T,Shimada YJ,Faridi MK,et al.Incidence of acute cardiovascular event after acute exacerbation of COPD[J].J Gen Intern Med,2018,33(9):1461-1468.DOI:10.1007/s11606-018-4518-3.
[24]Sim YS,Lee JH,Lee EG,et al.COPD exacerbation-related pathogens and previous COPD treatment[J].J Clin Med,2022,12(1):111.DOI:10.3390/jcm12010111.
[25]Shafiek H,Verdú J,Iglesias A,et al.Inhaled corticosteroid dose is associated with Pseudomonas aeruginosa infection in severe COPD[J].BMJ Open Respir Res,2021,8(1):e001067.DOI:10.1136/bmjresp-2021-001067.
[26]Choi J,Oh JY,Lee YS,et al.Pseudomonas aeruginosa infection increases the readmission rate of COPD patients[J].Int J Chron Obstruct Pulmon Dis,2018,13:3077-3083.DOI:10.2147/copd.S173759.
[27]Kuwal A,Joshi V,Dutt N,et al.A prospective study of bacteriological etiology in hospitalized acute exacerbation of COPD patients:relationship with lung function and respiratory failure[J].Turk Thorac J,2018,19(1):19-27.DOI:10. 5152/TurkThoracJ.2017.17035.
[28]Holden V,Slack ID,Mccurdy MT,et al.Diagnosis and management of acute exacerbations of chronic obstructive pulmonary disease[J].Emerg Med Pract,2017,19(10):1-24.
[29]Hu Y,Long H,Cao Y,et al.Prognostic value of lymphocyte count for in-hospital mortality in patients with severe AECOPD[J].BMC Pulm Med,2022,22(1):376.DOI:10.1186/s12890-022-02137-1.
[30]Day K,Ostridge K,Conway J,et al.Interrelationships among small airways dysfunction,neutrophilic inflammation,and exacerbation frequency in COPD[J].Chest,2021,159(4):1391-1399.DOI:10.1016/j.chest.2020.11.018.
[31]龙波,李娜,蒋幼凡,等.基于外周血嗜酸粒细胞及中性粒细胞比较不同表型AECOPD临床特征及恶化风险[J].国际呼吸杂志,2023,43(2):187-194.DOI:10.3760/cma.j.cn131368-20221014-00901.
[32]Park SC,Kim YS,Kang YA,et al.Hemoglobin and mortality in patients with COPD:a nationwide population-based cohort study[J].Int J Chron Obstruct Pulmon Dis,2018,13:1599-1605.DOI:10.2147/copd.S159249.
[33]Barba R,De Casasola GG,Marco J,et al.Anemia in chronic obstructive pulmonary disease:a readmission prognosis factor[J].Curr Med Res Opin,2012,28(4):617-622.DOI:10.1185/03007995.2012.675318.
[34]García-Sanz MT,Cánive-Gómez JC,García-Couceiro N,et al.Factors associated with the incidence of serious adverse events in patients admitted with COPD acute exacerbation[J].Ir J Med Sci,2017,186(2):477-483.DOI:10.1007/s11845-016-1431-9.
(收稿日期:2023-12-18)
