补体受体免疫球蛋白超家族分子在调节肝脏免疫反应中的研究进展
2024-01-01杨树森李京涛闫曙光焦俊喆
摘要:库普弗细胞(KC)是肝脏免疫细胞的重要组成部分,其对于维持组织稳态和应对肝损伤的快速反应至关重要。补体受体免疫球蛋白超家族分子(CRIg)是KC膜上的一种受体蛋白,其既能以补体结合的方式捕获流经肝脏血液中的病原体,也可以通过调节肝脏内的免疫细胞介导肝脏免疫反应。近年来CRIg的研究进一步证实了其在调节肝脏免疫中的关键地位,本文综述了CRIg的主要作用方式以及其在调节肝脏免疫中的新进展。
关键词:补体受体免疫球蛋白超家族分子;库普弗细胞;肝脏免疫;病原体
中图分类号: R392.32" 文献标识码: A" 文章编号:1000-503X(2024)04-0603-07
DOI:10.3881/j.issn.1000-503X.15803
Research Progress in Complement Receptor of the Immunoglobulin Superfamily in Regulating Liver Immunity
YANG Shusen1,LI Jingtao2,YAN Shuguang1,JIAO Junzhe2
1Basic Medical College of Shaanxi University of Chinese Medicine,Xianyang,Shaanxi 712046,China
2Department of Hepatology,Affiliated Hospital of Shaanxi University of Chinese Medicine,Xianyang,Shaanxi 712000,China
Corresponding author:JIAO Junzhe Tel:18292921404,E-mail:516108526@qq.com
ABSTRACT:Kupffer cells (KC),an important subset of immune cells in the liver,are essential for maintaining tissue homeostasis and responding quickly to liver damage.The complement receptor of the immunoglobulin superfamily (CRIg) is a receptor protein on the KC membrane.CRIg can not only capture pathogens in the blood flowing through the liver by complement binding but also mediate immune responses by regulating immune cells in the liver.Recent studies have confirmed the role of CRIg in regulating liver immunity.This article reviews the main modes of action of CRIg and the research progress of CRIg in regulating liver immunity.
Key words:complement receptor of the immunoglobulin superfamily;Kupffer cells;liver immunity;pathogen
Acta Acad Med Sin,2024,46(4):603-609
肝脏是人体重要的免疫器官,其独特生理结构和供血方式决定了其在维持血液内稳态的关键作用。作为肝脏内常驻的巨噬细胞,库普弗细胞(Kupffer cells,KC)是调节肝脏免疫反应的关键[1]。KC广泛分布于肝血窦内,不仅可以吞噬从门静脉或动脉循环进入的病原体,还能够激活血液中的其他免疫细胞来清除病原体[2]。血液流动增加了捕获病原体的难度,而肝血窦内血液流速减慢则有助于补体协助KC在相对充足的时间内捕捉到病原体[3]。补体可以识别并结合病原体,但在血流剪切力存在条件下,绝大多数补体受体都无法完全结合补体病原体复合物,目前只有特异性表达于巨噬细胞表面的补体受体免疫球蛋白超家族分子(complement receptor of the immunoglobulin superfamily,CRIg)能够在血流剪切力存在条件下结合补体病原体复合物[4]。目前进一步的研究证实CRIg能够在介导调理KC吞噬病原体以及调节免疫细胞来清除病原体中发挥重要作用。本文总结了近年来关于CRIg在肝脏免疫调节中作用机制及新成果,以期为后续的研究提供理论依据。
1 肝脏特殊的免疫环境
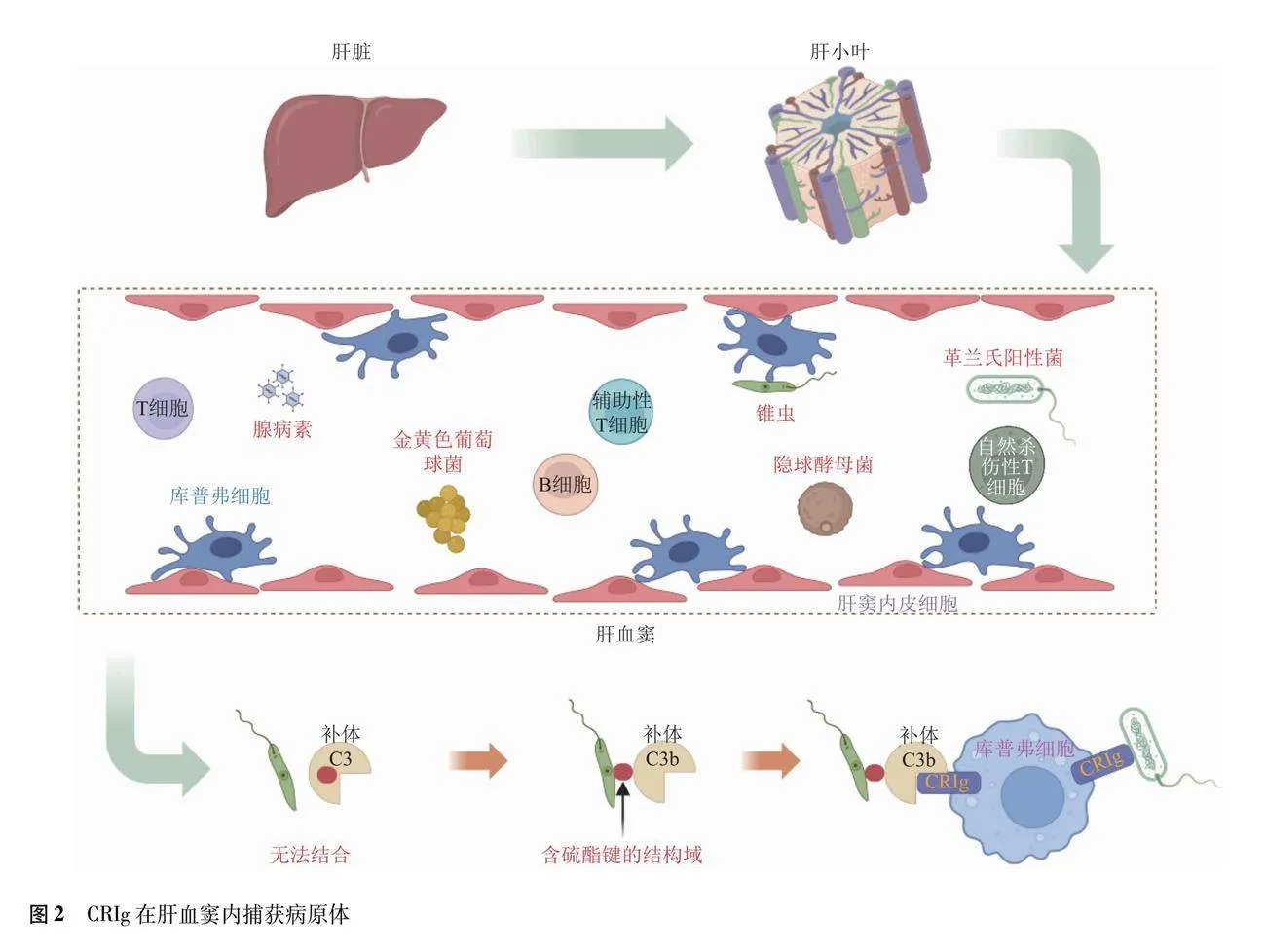
人体每分钟约有占总血液流量30%的血流通过肝脏,供应肝脏的血液主要来源于门静脉和肝动脉,其中有接近七成的血液来自门静脉[5]。肝脏是首个通过门静脉与来自小肠和大肠的静脉血连接的肠外器官,因此肝脏易受到从肠腔转移至门静脉的病原体产物影响[6]。只有少量病原体通过淋巴管流入肠系膜淋巴结,并启动适应性免疫反应,但大部分病原体会绕过脾和淋巴结的免疫检测,而随门静脉流向肝脏[7]。病原体随门静脉的血液进入肝血窦,可激活肝血窦内的KC、T细胞和自然杀伤性T细胞等多种免疫细胞来介导病原体的清除过程[8]。血液流动速度过快不利于免疫细胞结合病原体,但肝血窦的独特结构减缓了血液流动速度,延长了免疫细胞与病原体结合时间[9]。虽然血液流速减慢,捕获病原体仍具有挑战性,所以在流动血液中捕获病原体的免疫机制尤为重要。KC占体内组织中巨噬细胞总量的90%,作为肝内主要的免疫细胞,其对于捕获病原体和维持血液无菌尤为重要[10]。在活动区域上,KC主要附着在肝窦内皮细胞表面,独特的位置拉近KC与病原体的距离,这也为CRIg捕获病原体创造了良好的条件[11]。总的来说,肝脏的特殊免疫环境主要有以下2点:(1)肝脏是介导血管内免疫主要器官,监测并清除血液中的病原体是肝脏内免疫细胞重要任务;(2)肝脏内的KC是体内最大的常驻巨噬细胞群,这部分上决定了KC在肝脏免疫的中心地位,也是调节肝脏免疫的关键点。
2 CRIg概述
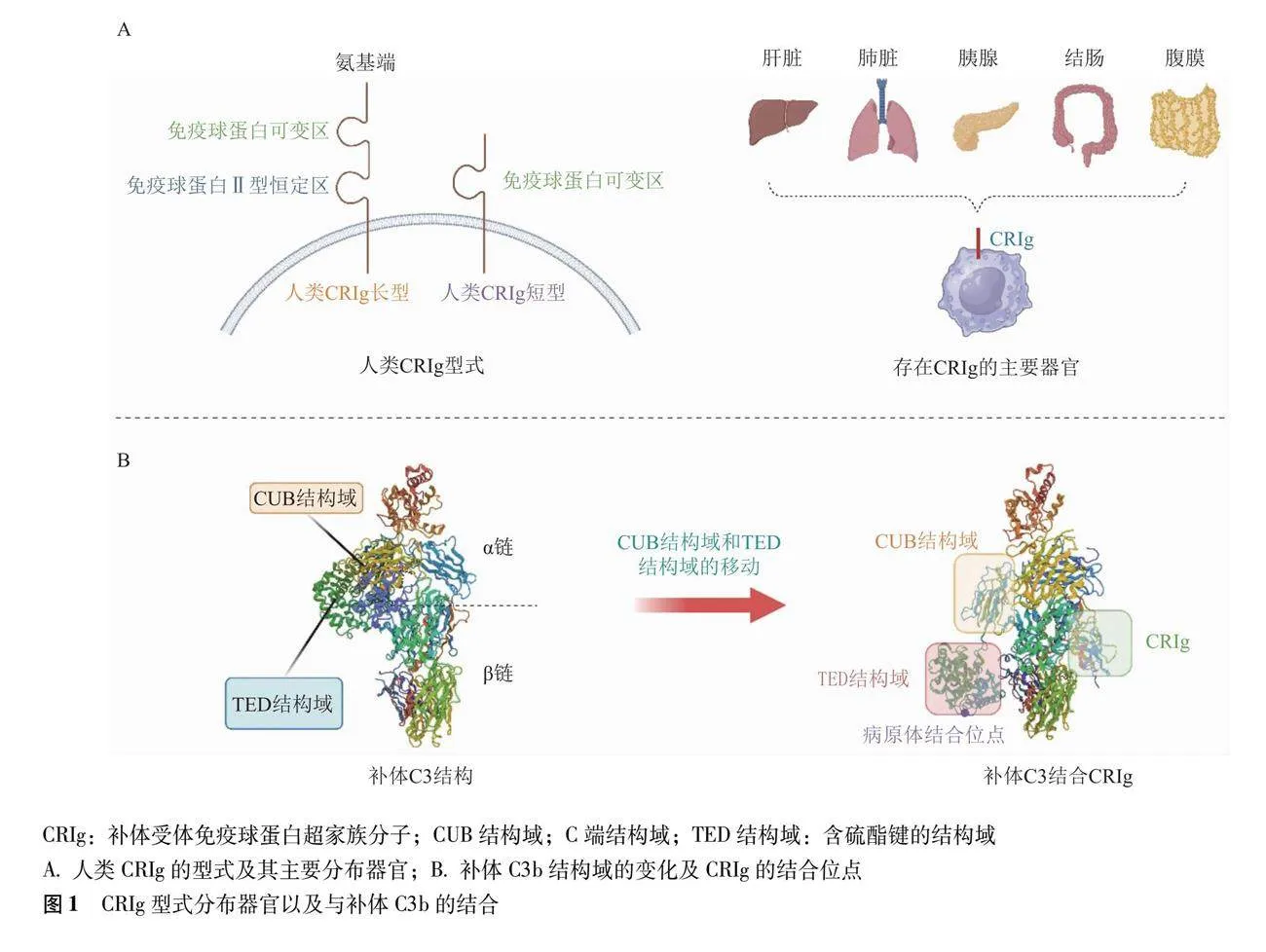
CRIg又被称为V-set免疫球蛋白域4,属于由多个1型跨膜蛋白组成V-set免疫球蛋白家族,该家族在调节细胞免疫中表现突出。CRIg是一种包含399个氨基酸的蛋白质,其基因覆盖18.3 kb,具有8个外显子,位于人类X染色体标记DXS1213和DXS1194之间的边缘区域[12]。在结构上,人类CRIg有两种类型:(1)长型CRIg由免疫球蛋白可变区和免疫球蛋白Ⅱ型恒定区结构域构成;(2)短型CRIg仅包含免疫球蛋白可变区结构域[13]。由于CRIg与B7家族蛋白结构相似,所以CRIg不仅具有B7家族抑制T细胞增殖和分化的能力,还包含补体受体对病原体的清除功能[14]。在分布上,CRIg主要在肝脏、腹膜、胰腺、结肠等器官组织内巨噬细胞的亚群上表达,其中KC是最大的亚群,所以肝脏是CRIg发挥免疫调节作用的主要场所[15](图1)。CRIg在静息的组织巨噬细胞上特异性表达,但在由脂多糖或巯基乙酸钠诱导的炎性巨噬细胞中则不表达。除了巨噬细胞,CRIg还存在于树突状细胞,其表达特点在一定程度上决定了其免疫特性[16]。作为先天免疫系统的重要组成部分,CRIg在维持免疫耐受、宿主防御和其他免疫调节中发挥了重要的作用。
3 CRIg的作用方式
CRIg主要通过与补体结合来参与肝脏免疫反应,补体系统包括血清蛋白和细胞表面受体,肝脏也是补体蛋白生产的主要场所。作为先天免疫系统的一部分,补体系统可以直接结合并杀死病原体,也可以使用已经存在的IgM抗体作为识别机制,并与适应性免疫相结合,在免疫反应初期促进B细胞介导的抗体反应,从而参与调节适应性免疫防御[17-18]。激活的补体C3被转化酶切割成补体C3a与补体C3b片段,补体C3b在接触病原体后,补体内的结构会发生持续改变(图1)。补体C3b中的含硫酯键的结构域移动暴露出补体C3b与病原体的共价结合的硫酯键位点,为补体结合病原体提供了空间[19-20]。CRIg结合位点和含硫酯键的结构域分别位于β链的两侧,易与共价附着在病原体上的补体C3b结合,且由于CRIg结合补体C3b不会引起显著构象变化,只有巨球蛋白样结构域6出现较小的环运动,所以CRIg并不会影响补体与病原体的结合位点[21]。此外,有研究表明补体允许血小板结合病原体,从而扩大补体病原体复合物的体积,该方式提高了CRIg对病原体的捕获效率[22]。除了通过补体结合方式,CRIg还能以直接结合的方式清除病原体。在介导的病原体捕获作用的同时,CRIg还可以通过调节巨噬细胞等免疫细胞来维持肝脏内免疫稳态。为了避免降解,CRIg可在与溶酶体融合之前,主动从吞噬体转移到再循环内体池中,再需要时又被募集回质膜,以确保能继续介导调理吞噬活动[23]。
4 CRIg在肝脏免疫反应中的作用
肝脏的特殊生理结构造就了肝脏内独特的免疫环境,作为KC捕获病原体的关键,CRIg是目前能与补体病原体复合物在血流剪切力存在条件下结合的主要补体受体,可以介导KC以及其他免疫细胞的活化,在肝脏免疫反应中发挥积极作用。
4.1 CRIg:病原体的最佳捕手
真菌扩散到血液中可导致侵袭性真菌感染,肝脏是真菌清除关键器官,有临床研究观察到肝硬化或终末期肝病患者更易发生新型梭菌的脑部感染,证实肝脏功能损伤增加侵袭性真菌感染的风险[24]。静脉注射新型隐球菌于CRIg基因敲除小鼠肝内,小鼠肝脏真菌负荷显著降低,而其他器官真菌负荷显著提高,说明CRIg基因敲除会降低KC的吞噬能力,并提高真菌逃逸机会,因此,CRIg清除功能丧失可能会增加其他器官罹患疾病的风险[25]。细菌也存在一定的免疫逃逸能力,金黄色葡萄球菌通过产生补体抑制物和细胞外纤维蛋白原结合蛋白来抑制补体C3b在细菌表面的沉积,这会阻滞补体结合CRIg,导致CRIg清除功能丧失。细菌脂磷壁酸是细菌生长和细胞分裂的关键分子,CRIg可以作为模式识别受体直接识别细菌脂磷壁酸,减少KC捕获革兰氏阳性菌所需的时间[26]。血源性寄生虫在血液中有复杂的生存机制,有研究表明抗体激活的补体是CRIg介导KC捕获循环寄生虫所必需的,但CRIg不能直接吞噬循环中非洲锥虫,这也说明直接结合方式的局限性[27]。CRIg在阻止病毒侵入机体中也发挥重要作用,有研究表明CRIg介导KC与腺病毒的补体C3b相结合,腺病毒被吞噬后,其衣壳释放膜裂解蛋白Ⅵ会诱导KC死亡,而阻断CRIg可以防止接种低剂量腺病毒后KC死亡,这些都证实CRIg是参与捕获腺病毒的重要蛋白[28]。总的来说,作为补体受体是CRIg介导病原体清除的主要方式,虽然直接结合可以更快地捕获病原体,但该途径有待进一步的研究证实(图2)。
4.2 CRIg:免疫细胞的“抑制剂”
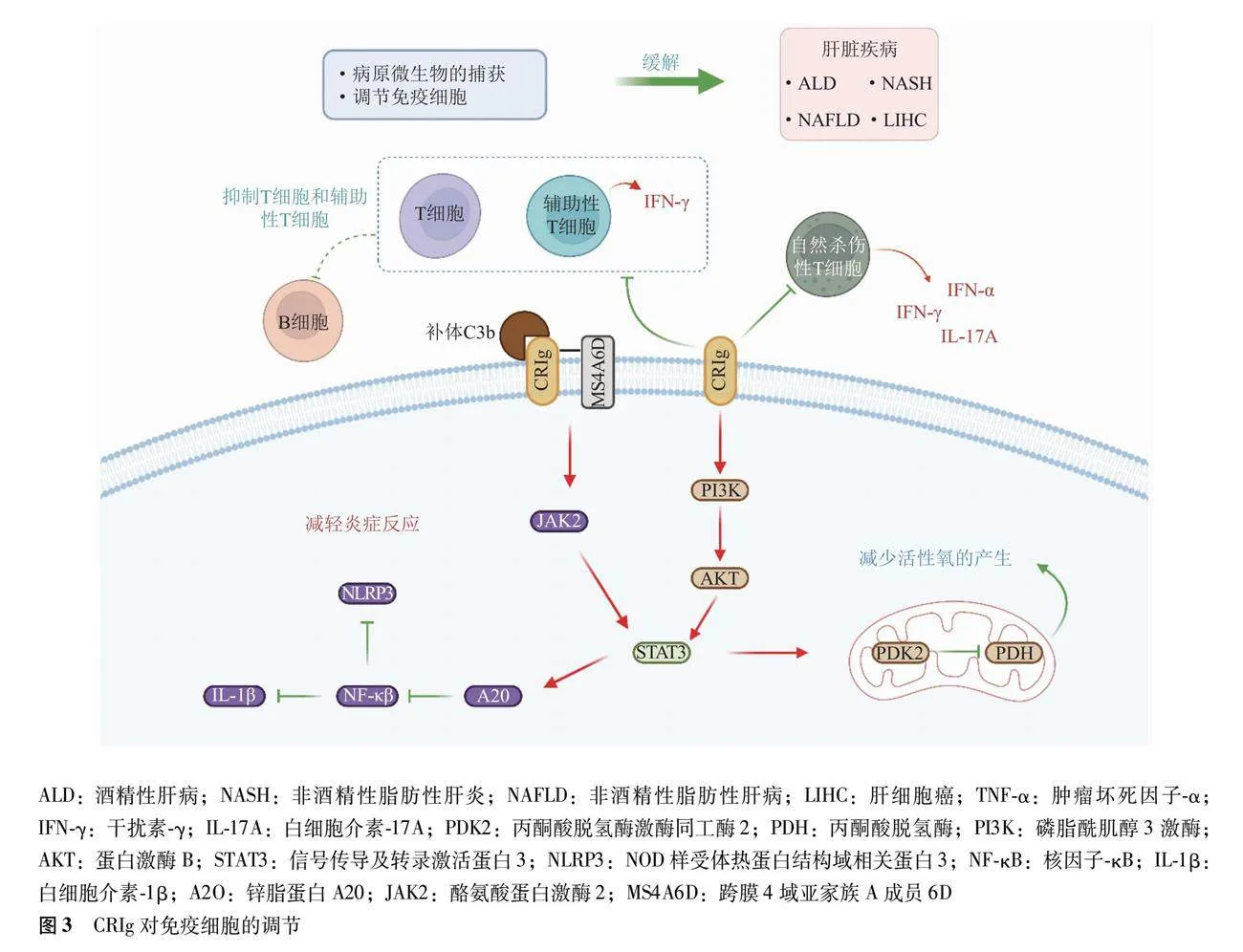
CRIg通过传递反馈信号激活磷酸肌醇3激酶-蛋白激酶B-信号转导及转录激活蛋白3信号轴,上调丙酮酸脱氢酶激酶2,并限制线粒体丙酮酸的代谢,继而抑制线粒体活性氧分泌和M1样基因表达,从而响应炎症刺激,并调节巨噬细胞活化[29]。CRIg也可以抑制巨噬细胞分泌促炎因子,诱导衔接蛋白MS4A6D形成表面抑制信号复合体,继而激活级联Janus激酶2-信号转导和转录激活因子3-A20信号通路来抑制核因子-κB,这减少了NOD样受体热蛋白结构域相关蛋白3和白细胞介素-1β的表达,抑制巨噬细胞活化来缓解其驱动的细胞内炎症[30]。除了调节巨噬细胞,CRIg还可以抑制小鼠和人类T细胞增殖。有研究观察到CRIg-Ig融合分子抑制了胞外信号调节激酶-促分裂原活化的蛋白激酶通路、蛋白激酶B-哺乳动物雷帕霉素靶蛋白等早期T细胞激活的关键通路并抑制了T细胞的激活,这表明CRIg可以通过结合T细胞上的未知膜受体并减弱早期T细胞受体激活信号来抑制T细胞的激活[31]。细胞死亡配体1也可有效抑制T细胞活化,体外实验表明CRIg抑制T细胞的增殖效用与细胞死亡配体1类似,体内实验表明CRIg-Ig融合分子能够抑制细胞毒性T淋巴细胞反应的诱导以及辅助性T细胞(T helper cell,Th)依赖性IgG反应的进程,Th细胞产生细胞因子不足,减少了B细胞的活化[32]。后续的研究也证明CRIg通过抑制辅助T细胞的活化、分化以及Th产生的同型转化诱导的细胞因子,阻断Th依赖性同种型转换,所以CRIg是T细胞以及Th细胞反应的有效负调节因子[33]。动物实验显示CRIg基因缺陷小鼠未能诱导肝脏T细胞和自然杀伤性T细胞对其同源抗原的耐受,由此可见,CRIg的抑制作用还表现在肝脏免疫耐受方面[34]。因此,CRIg可以通过调节T细胞、B细胞等多种免疫细胞来参与肝脏免疫反应,在作用方式上,CRIg主要以“抑制剂”的方式来干预免疫细胞的过度活化,这降低了肝脏内过度炎症反应以及自身免疫反应(图3)。
4.3 CRIg:改善肝脏疾病的潜在靶点
CRIg在改善肝脏疾病中发挥了重要作用,表达CRIg的KC数量减少会减弱致病菌的清除能力,而CRIg自身表达水平下降也会减弱其对免疫细胞的抑制作用。CRIg基因敲除进一步加重了溶细胞粪肠球菌促进乙醇诱导的小鼠肝损伤及炎症反应,而注射CRIg-Ig改善了小鼠的过度炎症反应以及肝脏损伤,这依赖于CRIg胞外结构域与病原体的结合作用,结合粪肠球菌的CRIg对Toll样受体2等促炎因子的病原体识别受体具有干扰作用,所以CRIg是阻断病原体诱导的肝损伤关键因子[35]。有报告表明在高脂饮食诱导的非酒精性脂肪性肝病中CRIg表达下调,免疫抑制能力减弱,诱导促炎的M1型巨噬细胞分化,继而激活核因子-κB信号通路来加剧炎症反应。同时,CRIg基因敲除还加速高脂饮食小鼠的胰岛素抵抗和脂质沉积等代谢功能异常;反之有实验证实在CRIg恢复正常表达后,炎症因子及代谢异常也恢复常态[36-37]。在非酒精性脂肪性肝炎中,单细胞RNA测序显示脂毒性环境显著减少了可表达CRIg的KC数量,在分布上,非酒精性脂肪性肝炎小鼠肝组织中表达CRIg的KC主要集中在中心静脉区,而肝组织中的CRIg明显减少,表达CRIg的KC数量与非酒精性脂肪性肝炎严重程度呈负相关[38]。由此可见,CRIg所介导的免疫抑制对于维持机体代谢稳态至关重要。在乙型肝炎病毒阳性相关的肝细胞癌中,CRIg在病理组织中的表达水平显著下调,其表达水平与肿瘤最大直径和血清甲胎蛋白水平呈负相关,该研究进一步佐证了CRIg与肝脏肿瘤疾病的联系性[39]。从最初的肝脏炎症与损伤到肝脏癌症,CRIg总体上处于被抑制的状态,这既加剧了肝脏内的过度炎症反应,也损害了肝脏内病原体的清除机制。因此,恢复CRIg的正常功能有望成为治疗多种类型肝病的潜在靶点。
5 问题和方向
CRIg主要以免疫抑制的方式干预免疫反应,这减轻了过度炎症反应,但对癌症等需要适度激活免疫细胞来阻断进程的疾病来说,CRIg的作用还存在争议。有研究表明CRIg可以协助肿瘤细胞的免疫逃逸,这与其在乙型肝炎病毒阳性相关肝细胞癌中的表现形成对比[40-41]。CRIg与T细胞、Th细胞等免疫细胞结合的膜受体尚未明确,未来的研究首先要明确CRIg在肝癌和其他癌症中的作用机制,验证发病机制的差异是否会影响CRIg在癌症中效用,探寻如何平衡其在癌症进程中可能存在的双面作用。未来要挖掘CRIg在已知免疫环境中发挥作用的明确机制,并探寻调节肝脏免疫反应的新通路,寻找免疫细胞与CRIg结合的关键受体,验证如何更好地发挥其对KC等免疫细胞的免疫抑制的作用。然后就是探索CRIg在结合方式上存在的多样性,例如CRIg是否作为模式识别受体直接结合革兰氏阴性菌或者其他病原体来参与病原体的清除。最后便是对激活CRIg的安全性进行验证,例如CRIg过度激活是否会在抑制适度炎症因子参与的组织修复再生等过程中发挥作用。
6 总结与展望
肝脏特殊的结构决定了肝脏免疫的特殊性,在捕获病原体方面,得益于补体受体的身份,CRIg可以及时捕获并吞噬流经肝血窦内的多种病原体,尽管不依赖于补体的直接捕获方式更为高效,但也存在一定局限性。在调节肝脏免疫细胞的方面,调控巨噬细胞活化是CRIg的主要作用方式,免疫抑制是CRIg的基本功能,所以CRIg也能抑制T细胞,B细胞等多种免疫细胞的过度活化,这对维持机体免疫稳态具有重要意义。通过对病原体的捕获与肝脏免疫细胞的调节,CRIg维持了肝脏免疫环境稳态,多种肝脏疾病模型中CRIg的低表达水平与敲除实验也验证了CRIg的关键作用。
CRIg自发现距今只有二十余年,目前其在调节肝脏免疫中作用机制尚未完全明确,但新型补体受体的身份使得CRIg成为免疫治疗的新靶点。当前多项针对CRIg的靶向药物正在开发,随着活体细胞显微成像等检测技术的进步以及后续研究的跟进,对CRIg的研究将有望从免疫调节方向为治疗肝脏疾病提供新的思路。
利益冲突 所有作者声明无利益冲突
作者贡献声明 杨树森:文献检索、论文的撰写、审阅和修订;闫曙光、李京涛:研究选题的提出,文献偏倚风险和适用性评估;焦俊喆:论文的修订和终审,并同意对研究工作诚信负责
参 考 文 献
[1]Dbernsmeier C,Van Der Merwe S,Périanin A.Innate immune cells in cirrhosis[J].J Hepatol,2020,73(1):186-201. DOI:10.1016/j.jhep.2020.03.027.
[2]Kulle A,Thanabalasuriar A,Cohen TS,et al.Resident macrophages of the lung and liver:the guardians of our tissues[J].Front Immunol,2022,13:1029085.DOI:10.3389/fimmu.2022.1029085.
[3]Krenkel O,Tacke F.Liver macrophages in tissue homeostasis and disease[J].Nat Rev Immunol,2017,17(5):306-321. DOI:10.1038/nri.2017.11.
[4]Kubes P,Jenne C.Immune responses in the liver[J].Annu Rev Immunol,2018,36(1):247-277.DOI:10.1146/annurev-immunol-051116-052415.
[5]Mikulak J,Bruni E,Oriolo F,et al.Hepatic natural killer cells:organ-specific sentinels of liver immune homeostasis and physiopathology[J].Front Immunol,2019,10:946.DOI:10.3389/fimmu.2019.00946.
[6]Seki E,Schnabl B.Role of innate immunity and the microbiota in liver fibrosis:crosstalk between the liver and gut:toll-like receptors,microbiota and liver fibrosis[J].J Physiol,2012,590(3):447-458.DOI:10.1113/jphysiol.2011.219691.
[7]Abst O,Hornef MW,Schaap FG,et al.Gut-liver axis:barriers and functional circuits[J].Nat Rev Gastroenterol Hepatol,2023,20(7):447-461.DOI:10.1038/s41575-023-00771-6.
[8]Yang X,Lu D,Zhuo J,et al.The gut-liver axis in immune remodeling:new insight into liver diseases[J].Int J Biol Sci,2020,16(13):2357-2366.DOI:10.7150/ijbs.46405.
[9]Tsoi KM,Macparland SA,Ma XZ,et al.Mechanism of hard-nanomaterial clearance by the liver[J].Nat Mater,2016,15(11):1212-1221.DOI:10.1038/nmat4718.
[10]Ju C,Tacke F.Hepatic macrophages in homeostasis and liver diseases:from pathogenesis to novel therapeutic strategies[J].Cell Mol Immunol,2016,13(3):316-327.DOI:10.1038/cmi.2015.104.
[11]Guilliams M,Scott c L.Liver macrophages in health and disease[J].Immunity,2022,55(9):1515-1529.DOI:10.1016/j.immuni.2022.08.002.
[12]Lee MY,Kim WJ,Kang YJ,et al.Z39Ig is expressed on macrophages and may mediate inflammatory reactions in arthritis and atherosclerosis[J].J Leukoc Biol,2006,80(4):922-928.DOI:10.1189/jlb.0306160.
[13]Helmy KY,Katschke KJ,Gorgani NN,et al.CRIg:a macrophage complement receptor required for phagocytosis of circulating pathogens[J].Cell,2006,124(5):915-927.DOI:10.1016/j.cell.2005.12.039.
[14]Li Y,Wang Q,Li J,et al.Therapeutic modulation of V Set and Ig domain-containing 4 (VSIG4) signaling in immune and inflammatory diseases[J].Cytotherapy,2023,25(6):561-572.DOI:10.1016/j.jcyt.2022.12.004.
[15]Zhao D,Yang F,Wang Y,et al.ALK1 signaling is required for the homeostasis of Kupffer cells and prevention of bacterial infection[J].J Clin Invest,2022,132(3):e150489.DOI:10.1172/JCI150489.
[16]Munawara U,Perveen K,Small AG,et al.Human dendritic cells express the complement receptor immunoglobulin which regulates T cell responses[J].Front Immunol,2019,10:2892.DOI:10.3389/fimmu.2019.02892.
[17]Garred P,Tenner AJ,Mollnes TE.Therapeutic targeting of the complement system:from rare diseases to pandemics[J].Pharmacol Rev,2021,73(2):792-827.DOI:10.1124/pharmrev.120.000072.
[18]Thorgersen EB,Barratt-due A,Haugaa H,et al.The role of complement in liver injury,regeneration,and transplantation[J].Hepatology,2019,70(2):725-736.DOI:10.1002/hep.30508.
[19]Geisbrecht BV,Lambris JD,Gros P.Complement component C3:a structural perspective and potential therapeutic implications[J].Semin Immunol,2022,59:101627.DOI:10.1016/j.smim.2022.101627.
[20]Alcorlo M,López-perrote A,Delgado S,et al.Structural insights on complement activation[J].FEBS J,2015,282(20):3883-3891.DOI:10.1111/febs.13399.
[21]Wiesmann C,Katschke KJ,Yin J,et al.Structure of C3b in complex with CRIg gives insights into regulate on of complement activation[J].Nature,2006,444(7116):217-220. DOI:10.1038/nature05263.
[22]Broadley SP,Plaumann A,Coletti R,et al.Dual-track clearance of circulating bacteria balances rapid restoration of blood sterility with induction of adaptive immunity[J].Cell Host Microbe,2016,20(1):36-48.DOI:10.1016/j.chom.2016.05.023.
[23]Van Lookeren Campagne M,Verschoor A.Pathogen clearance and immune adherence “revisited”:immuno-regulatory roles for CRIg[J].Semin Immunol,2018,37:4-11.DOI:10.1016/j.smim.2018.02.007.
[24]Singh N,Sifri CD,Silveira FP,et al.Cryptococcosis in patients with cirrhosis of the liver and posttransplant outcomes[J].Transplantation,2015,99(10):2132-2141.DOI:10.1097/TP.0000000000000690.
[25]Sun D,Sun P,Li H,et al.Fungal dissemination is limited by liver macrophage filtration of the blood[J].Nat Commun,2019,10(1):4566.DOI:10.1038/s41467-019-12381-5.
[26]Zeng Z,Surewaard BG,Wong CH,et al.CRIg functions as a macrophage pattern recognition receptor to directly bind and capture blood-borne gram-positive bacteria[J].Cell Host Microbe,2016,20(1):99-106.DOI:10.1016/j.chom.2016.06.002.
[27]Liu G,Fu Y,Yosri M,et al.CRIg plays an essential role in intravascular clearance of bloodborne parasites by interacting with complement[J].Proc Natl Acad Sci USA,2019,116(48):24214-24220.DOI:10.1073/pnas.1913443116.
[28]He JQ,Katschke KJ,Gribling P,et al.CRIg mediates early Kupffer cell responses to adenovirus[J].J Leukoc Biol,2013,93(2):301-306.DOI:10.1189/jlb.0612311.
[29]Li J,Diao B,Guo S,et al.VSIG4 inhibits proinflammatory macrophage activation by reprogramming mitochondrial pyruvate metabolism[J].Nat Commun,2017,8(1):1322.DOI:10.1038/s41467-017-01327-4.
[30]Huang X,Feng Z,Jiang Y,et al.VSIG4 mediates transcriptional inhibition of nlrp3 and il-1β in macrophages[J].Sci Adv,2019,5(1):eaau7426.DOI:10.1126/sciadv.aau7426.
[31]Yuan X,Yang BH,Dong Y,et al.CRIg,a tissue-resident macrophage specific immune checkpoint molecule,promotes immunological tolerance in NOD mice,via a dual role in effector and regulatory T cells[J].eLife,2017,6:e29540.DOI:10.7554/eLife.29540.
[32]Vogt L,Schmitz N,Kurrer MO,et al.VSIG4,a B7 family-related protein,is a negative regulator of T cell activation[J].J Clin Invest,2006,116(10):2817-2826.DOI:10.1172/JCI25673.
[33]Jung K,Seo SK,Choi I.Endogenous VSIG4 negatively regulates the helper T cell-mediated antibody response[J].Immunol Lett,2015,165(2):78-83.DOI:10.1016/j.imlet.2015.04.004.
[34]Jung K,Kang M,Park C,et al.Protective role of V-set and immunoglobulin domain-containing 4 expressed on kupffer cells during immune-mediated liver injury by inducing tolerance of liver T- and natural killer T-cells[J].Hepatology,2012,56(5):1838-1848.DOI:10.1002/hep.25906.
[35]Duan Y,Chu H,Brandl K,et al.CRIg on liver macrophages clears pathobionts and protects against alcoholic liver disease[J].Nat Commun,2021,12(1):7172.DOI:10.1038/s41467-021-27385-3.
[36]Li Y,Sun JP,Wang J,et al.Expression of Vsig4 attenuates macrophage-mediated hepatic inflammation and fibrosis in high fat diet (HFD)-induced mice[J].Biochem Biophys Res Commun,2019,516(3):858-865.DOI:10.1016/j. bbrc.2019.06.045.
[37]Luo Z,Ji Y,Zhang D,et al.Microbial DNA enrichment promotes liver steatosis and fibrosis in the course of non-alcoholic steatohepatitis[J].Acta Physiol (Oxf),2022,235(3):e13827. DOI:10.1111/apha.13827.
[38]Li HY,Fu SW,Wu JC,et al.Vsig4+ resident single-Kupffer cells improve hepatic inflammation and fibrosis in NASH[J].Inflamm Res,2023,72(4):669-682.DOI:10.1007/s00011-023-01696-1.
[39]Zhu S,Tan W,Li W,et al.Low expression of VSIG4 is associated with poor prognosis in hepatocellular carcinoma patients with hepatitis B infection[J].Cancer Manag Res,2018,10:3697-3705.DOI:10.2147/CMAR.S165822.
[40]Jung K,Jeon YK,Jeong DH,et al.VSIG4-expressing tumor-associated macrophages impair anti-tumor immunity[J].Biochem Biophys Res Commun,2022,628:18-24.DOI:10.1016/j.bbrc.2022.08.055.
[41]Small AG,Al-baghdadi M,Quach A,et al.Complement receptor immunoglobulin:a control point in infection and immunity,inflammation and cancer[J].Swiss Med Wkly,2016,146:w14301.DOI:10.4414/smw.2016.14301.
(收稿日期:2023-08-21)
