实体肿瘤免疫检查点抑制剂治疗的影像学评估研究进展
2024-01-01杨尚颖刘新宇薛华丹金征宇何泳蓝李源
摘要:近年来,免疫检查点抑制剂(ICI)在多种实体肿瘤治疗领域应用卓有成效,但其引发的特殊应答模式和免疫相关不良反应降低了疗效评价的准确性。影像学是评估肿瘤免疫治疗的重要手段,不仅可以利用形态学和功能成像评价疗效,又可结合人工智能技术提供独特预测价值。本文探讨了各种影像手段和人工智能技术在评估实体肿瘤ICI治疗领域的价值以及相关研究进展。
关键词:免疫治疗;免疫检查点抑制剂;影像学;人工智能
中图分类号: R730.51;R730.44" 文献标识码: A" 文章编号:1000-503X(2024)04-0610-09
DOI:10.3881/j.issn.1000-503X.15832
Advances in Imaging-Based Evaluation of Solid Tumors Treated With Immune Checkpoint Inhibitors
YANG Shangying1,LIU Xinyu1,XUE Huadan1,JIN Zhengyu1,HE Yonglan1,LI Yuan2
1Department of Radiology,2Department of Obstetrics and Gynecology,National Clinical Research Center for Obstetric amp; Gynecologic Diseases,PUMC Hospital,CAMS and PUMC,Beijing 100730,China
Corresponding authors:HE Yonglan Tel:010-69159610,E-mail:heyonglan@pumch.cn;
LI Yuan Tel:010-69156068,E-mail:liyuan10833@pumch.cn
ABSTRACT:Immune checkpoint inhibitors have shown remarkable benefits in the treatment of solid tumors,while the occurrence of atypical response patterns and immune-related adverse events during treatment challenges the accuracy of therapeutic evaluation.Medical imaging is crucial for the evaluation of immunotherapy.It enables the assessment of treatment efficacy via both morphological and functional ways and offers unique a predictive value when being combined with artificial intelligence.Here we review the recent research progress in imaging-based evaluation of solid tumors treated with immune checkpoint inhibitors.
Key words:immunotherapy;immune checkpoint inhibitor;imaging;artificial intelligence
Acta Acad Med Sin,2024,46(4):610-618
近年来,以细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated protein 4,CTLA-4)抑制剂、程序性死亡受体1(programmed cell death protein 1,PD-1)抑制剂、程序性死亡受体的配体1(programmed cell death ligand 1,PD-L1)抑制剂为代表的免疫检查点抑制剂(immune checkpoint inhibitor,ICI)在肿瘤免疫治疗领域取得巨大成就,开启了肿瘤治疗的新时代[1-3]。影像学作为一种非侵入性检查手段,被广泛用于免疫治疗患者的疗效评估,但由于在免疫治疗过程中患者会出现多种特殊应答模式和免疫相关不良反应(immune-related adverse event,irAE),影像医师想要准确评估仍颇具挑战[4-5]。本文从形态学、功能性成像和人工智能辅助技术三个方面综述各种影像手段和人工智能技术在评估实体肿瘤ICI治疗领域的价值以及相关研究进展。
1 ICI作用机制
免疫检查点通常指的是以CTLA-4、PD-1及PD-L1为代表的负性调控T细胞的蛋白[6]。位于T细胞表面的CTLA-4和白细胞分化抗原(cluster of differentiation,CD)28均可与作为配体的CD80/CD86结合,在T细胞识别抗原后,作为共刺激分子的CD28可与配体结合进一步活化T细胞,但CTLA-4则发挥相反作用,同理PD-L1与T细胞表面的PD-1相互作用也能下调T细胞活性,因此免疫检查点可作为肿瘤免疫逃逸的机制之一,ICI则可通过靶向抑制相应的免疫检查点提高免疫系统对肿瘤的杀伤作用[7-9]。
2 ICI治疗特殊应答模式
ICI突破了传统药物带来的生存获益,以既往接受过治疗的晚期非小细胞肺癌(non small cell lung cancer,NSCLC)为例,经纳武利尤单抗(ICI药物)治疗患者的5年生存率是多西他赛(传统药物)的5倍[10]。ICI治疗肿瘤有着明显优势,但其特殊应答模式却有两大缺点:(1)在已有证据表明假性进展患者是ICI获益人群的情况下,如果假性进展被误认为真性进展,那么会导致过早停药。(2)其他应答模式如超进展,该类患者一旦用药反而会加速病情恶化。从而增加了不必要的用药负担。以下将详细阐述各种特殊应答模式。
2.1 假性进展
有研究观察到少数接受ICI治疗的患者,其病灶在缩小或保持稳定之前可出现一过性的增大或新病灶,总体发生率约为6%[11-13]。活检提示假性进展是由免疫细胞浸润所致,而非肿瘤的真性进展,且假性进展患者预后优于发生真性进展患者[14]。早期准确识别假性进展有助于患者从ICI治疗中持续获益,但值得注意的是假性进展病灶缩小的时间不定,有的甚至大于6个月[15]。
2.2 超进展
超进展多指ICI首次治疗后肿瘤加速生长的一种现象,发生率为4%~29%[16]。超进展发生机制尚未明确,有研究发现鼠双微体基因2/鼠双微体基因4的扩增和表皮生长因子受体的突变可能与超进展的发生有关[17-18]。超进展患者病情通常易恶化,且预后较真性进展患者更差。
2.3 分离反应与持久应答
肿瘤具异质性,不同病灶对治疗的应答不同,分离反应指的是经ICI治疗后,部分病灶缩小的同时另一部分病灶增长,有研究报道分离反应发生率为3.3%,且这部分患者预后较真性进展好[19-20]。值得注意的是部分患者在治疗停止后仍可持久获益,称为持久应答,这对合理治疗时长的选择提出了挑战,但遗憾的是目前相关机制尚不清楚[4]。
3 免疫相关不良反应
ICI在上调免疫系统活性的同时可能引发一系列的不良反应,也即irAE。一般按严重程度将irAE分为5级,各级别irAE的发生率在54%~76%之间,irAE可发生于任何器官,其中位发生时间通常在治疗后的2~16周内,且最常累及胃肠道、内分泌腺、皮肤和肝脏[21-23]。多项研究指出irAE的发生可能与预后相关,以NSCLC为例,有研究者汇总了3项随机临床试验的数据,发现在接受阿替利珠单抗治疗的晚期NSCLC患者中,低级别irAE的发生与患者更长的总生存期(overall survival,OS)相关[24-25]。
4 基于形态学的影像学评估
4.1 实体瘤疗效评价标准
实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors version1.1,RECIST1.1)是目前临床试验中进行客观疗效评估的主要参考,其从病灶大小、数目等方面规定病灶测量的标准以评估肿瘤负荷,并将疗效划分为:完全缓解、部分缓解(partial response,PR)、疾病进展和疾病稳定[26]。完全缓解和PR时病灶都会缩小,代表治疗有效,可继续给药;病灶大小和数量基本不变视为疾病稳定,也可考虑继续给药;病灶增大或增多则视为疾病进展,需终止给药;传统上依赖于病灶大小变化的疗效评估方法能较为可靠地评估化疗药物的疗效,但当发生假性进展时,上述传统标准不再适用,因此需要新标准满足准确评估免疫治疗疗效的要求。
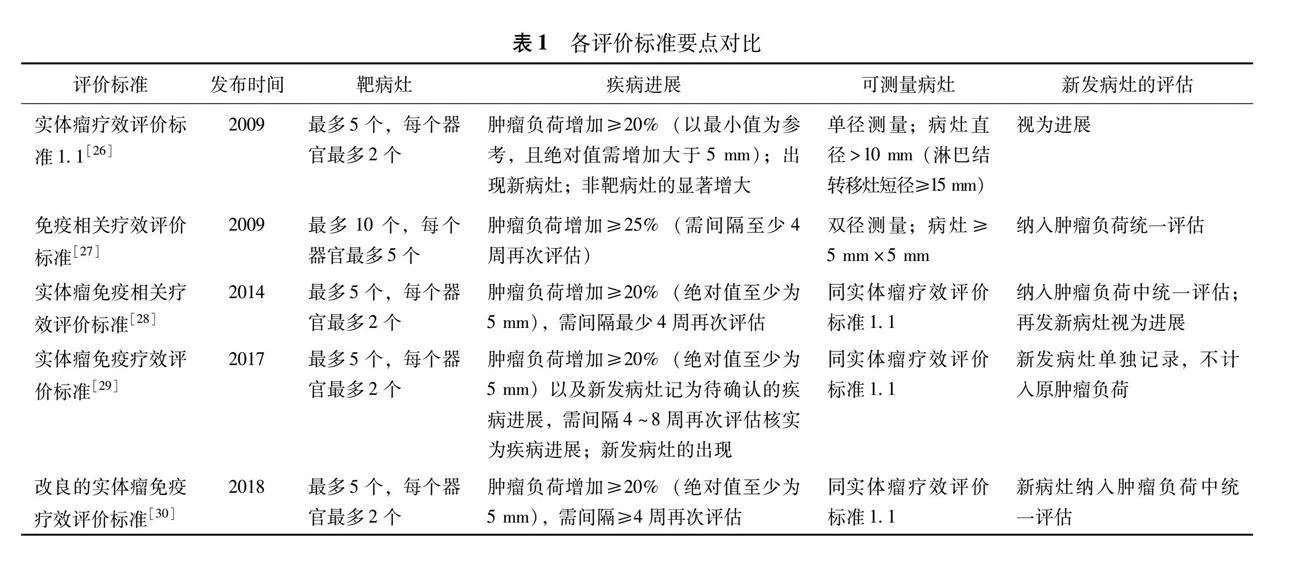
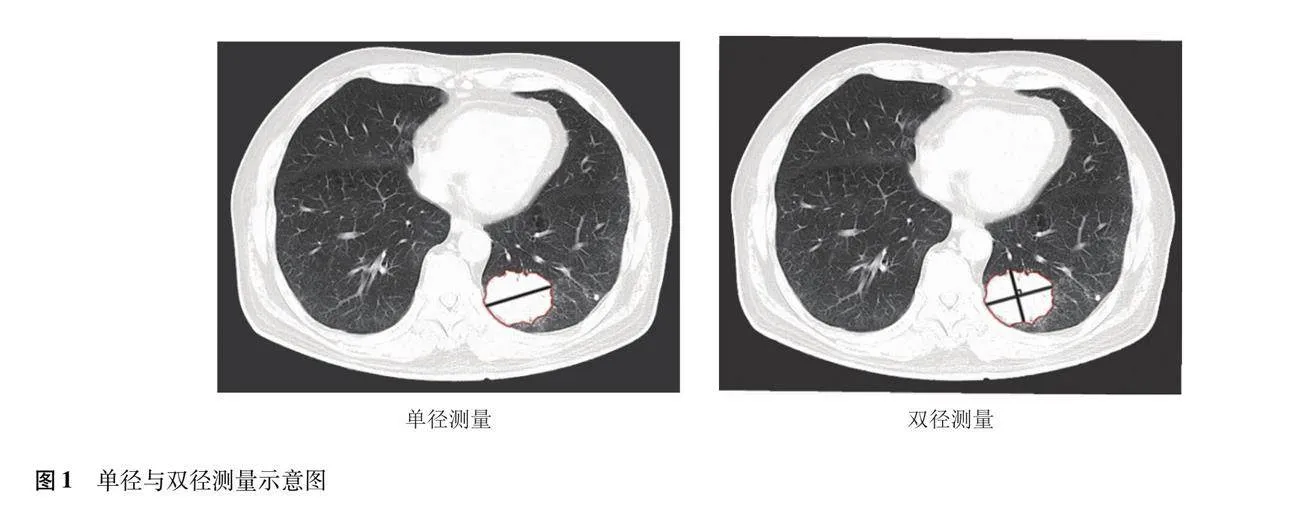
学者们基于相关临床试验数据,陆续提出免疫相关疗效评价标准(immune-related response criteria,irRC)、实体瘤免疫相关疗效评价标准、实体瘤免疫疗效评价标准(immune response evaluation criteria in solid tumors,iRECIST)和改良的实体瘤免疫疗效评价标准等标准(表1)[27-30]。2009年制定的irRC的重要特征在于对疾病进展的判断需通过间隔大于4周的连续影像学随访核实,且允许将一定的新发病灶纳入总肿瘤负荷的评估,这意味着不再将治疗后初次影像学评估的进展视作疾病进展而考虑终止治疗,而是允许后续再次评估,以确认真正的疾病进展后才可终止治疗[11]。有研究使用RECIST1.1和irRC分别评估了665例接受帕博利珠单抗治疗晚期黑色素瘤患者的疗效,发现RECIST1.1评估为进展、irRC评估为非进展的84例患者比二者均判断为进展的177例患者的OS更长,这表明RECIST1.1可能会低估部分患者的疗效[31]。irRC中病灶的测量参考先前的WHO实体肿瘤评估标准,以各靶病灶最大垂直径的乘积之和作为肿瘤负荷,从而区别于RECIST所采纳的单径测量法。单径测量法通过测量病灶的最大径和淋巴结的短径进行肿瘤负荷的评估,双径测量法误差较大,影响评估的一致性和准确性[11,32](图1)。实体瘤免疫相关疗效评价标准、iRECIST、改良的实体瘤免疫疗效评价标准等在遵循RECIST1.1的单径测量标准的基础上,也允许一定间隔的影像学随访,对初次影像学进展作进一步评估,更好地保证数据的一致性和准确性。值得注意的是上述标准各有不同,如iRECIST将新发病灶作为新的靶病灶单独评估,而不加入原肿瘤负荷进行评估,研究者应根据具体研究目的合理参考相关疗效评价标准。
各评价标准针对假性进展做出了适当改变,仍具有一定的局限性:(1)评价标准未纳入超进展等其他特殊应答模式进行评估[4](表1)。(2)有些病灶的延迟应答导致假性进展识别困难,个别患者基于实体瘤免疫相关疗效评价标准早期已被认定为进展,后期仍可发生应答[15]。(3)基于形态学的评估不够全面[33]。因此,尽管各评价标准为全面评估免疫治疗进行了积极探索,RECIST1.1仍作为现行临床试验中的主要框架(表1)。
4.2 超进展
超进展的评估至少需要2次治疗前和1次治疗后的影像学资料,不同文献对其定义有所不同。Champiat等[34]将超进展定义为符合RECIST1.1进展标准的同时,肿瘤生长速率大于治疗前两倍。Kato等[18]则把进展时间考虑在内,将超进展定义为满足以下条件:(1)发生影像学进展的时间小于两个月;(2)肿瘤生长速率超过治疗前两倍;(3)以irRC作为参考标准,肿瘤负荷在治疗后增加超过50%。
4.3 免疫相关不良反应
基于形态学的评估是目前影像学上irAE的主要评估方式,影像手段可检出约74%的不良反应,但因影像表现多样,且缺乏特异性,现有临床需求难以得到满足[35]。下面以免疫相关性肺炎为例描写如下:(1)最为常见的表现为隐源性机化性肺炎模式,出现沿支气管血管束和胸膜下分布的斑片实变影,并常伴磨玻璃影,部分还可出现反晕征;(2)少数病情严重患者可表现为急性间质性肺炎/急性呼吸窘迫综合征模式,出现双侧弥漫分布的磨玻璃影和实变影;(3)其他还可表现为非特异性间质性肺炎或过敏性肺炎模式。非特异性间质性肺炎模式常表现为双肺多发的磨玻璃影,伴不规则网格影及牵拉性支气管扩张,以双下肺受累为主,但一般不累及胸膜下区。小叶中心结节及马赛克样灌注则是过敏性肺炎模式的典型表现[36-37]。此外,部分irAE的影像学表现与疾病进展类似,如结节病样淋巴结增大及肉芽肿病,可出现双侧纵隔和肺门的肿大淋巴结,或同时累及肺实质,形成沿支气管血管束分布的结节影。因结节病样淋巴结增大及肉芽肿病的影像学表现与原发疾病进展引起的多发转移灶相似,鉴别诊断的难度明显增大[5]。
5 基于功能性成像的评价
5.1 基于18F-FDG正电子发射计算机断层显像/计算机体层显像的疗效评价
18F-FDG正电子发射型计算机断层显像/计算机体层显像(18F-FDG positron emission tomography/computed tomography,18F-FDG PET/CT)可评估肿瘤病灶代谢功能。与RECIST1.1类似,既往的欧洲癌症研究和治疗组织制定的标准以及实体瘤PET疗效评价标准无法精准评估免疫治疗疗效,故相继提出实体瘤免疫疗效PET评价标准、免疫治疗PET评价标准等标准[38-39]。基于PET/CT的标准将治疗疗效划分为:完全代谢缓解(complete metabolic response,CMR)、部分代谢缓解、代谢进展疾病、代谢稳定疾病。此外,类似iRECIST等标准,针对免疫治疗而更新的标准也强调影像学随访对评估假性进展的重要性。
借助获取的代谢信息,18F-FDG PET/CT在预测短期和远期疗效中具有一定应用价值。Wang等[40]前瞻性纳入了58例接受新辅助ICI联合化疗的可切除食管鳞癌患者,发现两个治疗周期后的各种代谢参数,如最大标准摄取值、平均标准摄取值、肿瘤代谢体积均可有效预测完全病理缓解,其受试者工作特征曲线下的面积(area under the curve,AUC)分别为0.848、0.853、0.856。Dimitriou等[41]对104例接受ICI治疗1年后仍未发生进展的转移性黑色素瘤患者进一步进行了为期5年的随访,在治疗后第1年分别以欧洲癌症研究和治疗组织制定的标准和RECIST1.1进行评估,比较了PET和CT对预测远期临床结局的差异,结果显示,于第1年被评估为CMR的78例患者预后良好,其5年无进展生存率和总生存率分别为90%、96%。此外,PR+CMR和PR+非CMR的两个亚组的5年无进展生存率存在明显差异(88% 比 59%)。这不仅意味着18F-FDG PET/CT能在早期阶段预测远期疗效的同时为临床医师缩短用药时长提供依据,同时也提示部分PR患者可能实际上并无可存活的残余肿瘤组织,18F-FDG PET/CT可有效识别此类患者并为准确的疗效评估提供帮助。
18F-FDG PET/CT在疗效评估方面的重要作用已逐步得到重视,但由于费用相对昂贵、特异性较差等原因,且PET免疫疗效评价标准及相关研究结果尚未在大型队列得到验证,故目前在临床实践中使用相对受限。
5.2 基于多参数磁共振成像的评估
多参数磁共振成像可通过多种序列从形态、微观结构、血供等多方面对肿瘤进行定性和定量评价。Lau等[42]前瞻性地对15例转移性黑色素瘤患者总计27个靶病灶进行纵向和横向的对比分析,在基线、治疗后第3周和第12周,借助T2加权成像、扩散峰度成像和动态对比增强磁共振成像分别从形态学、细胞密度和微观异质性、血管重塑变化3个方面以及从患者个体水平和病灶水平2个层次进行了对比分析:(1)发现治疗第3周时缓解患者和假性进展患者的中位平均水分子表观扩散系数分别比基线水平增高了8.9%、48.0%(P<0.05),提示了早期治疗过程中病灶细胞密度的降低,12周的治疗周期内并未观察到平均水分子表观扩散系数与肿瘤体积变化相关,说明早期病灶细胞密度的改变与体积变化无关。(2)在利用容积转移常数分析肿瘤血管通透性时,作者于治疗第12周发现,缓解病灶的平均容积转移常数相对于基线水平降低了66.19%(P<0.01),表明治疗后肿瘤血管通透性的降低。(3)反映肿瘤微观异质性的平均表观扩散峰度在预测病灶应答方面不具有统计学意义的变化。
6 基于人工智能辅助技术的评价
尽管临床上已开发多种生物标志物以筛选出可能的获益人群,ICI的治疗应答率仅为20%~40%[43]。影像组学可对影像图像进行高通量特征提取,将医学图像转换为高维、可挖掘和定量分析的信息,深度学习则能利用多层神经网络结构自动学习数据特征,二者在创新影像标志物开发中具有重要价值[44-45]。目前人工智能辅助技术在ICI治疗领域的相关研究多集中于黑色素瘤和NSCLC,展示了以下价值:(1)筛选ICI的受益人群;(2)预测治疗疗效;(3)识别假性进展;(4)识别irAE。
6.1 直接预测免疫应答和预后
Trebeschi等[46]对比分析203例NSCLC和黑色素瘤患者共计1055个原发灶和转移灶的增强CT图像,发现形态不规则、密度不均匀、边界紧凑的病灶更易对免疫治疗产生应答。使用封装式特征选择法以及随机森林分类器构建的模型能较好地预测NSCLC患者肺部病灶和淋巴结转移灶能否产生应答反应,测试集AUC分别为0.83、0.78。Mu等[47]分析146例NSCLC患者基线时18F-FDG PET/CT图像后也得出类似结论,该研究将无进展生存期大于6个月的患者视为持续临床获益者,发现2个纹理特征(PET_SRLGE,KLD_SZE)和1个形态特征(CHDensity)与持续临床获益有关,提示密度不均匀的病灶更易产生应答。然而近期的研究却得出相反结论,Ligero等[48]从85例不同类型实体肿瘤患者的基线CT图像提取影像组学特征构建预测模型,发现密度均匀的病灶更可能产生应答;而Dercle等[49]回顾性地纳入575例Ⅲ/Ⅳ期黑色素瘤患者,利用基线和治疗后3个月的CT图像提取影像特征构建预后预测模型,结果显示密度不均匀的病灶与患者预后较差相关。从另一角度出发,Khorrami等[50]额外纳入瘤周区域作为勾画靶区,根据两个中心139例晚期NSCLC患者ICI治疗前后瘤内和瘤周CT影像组学特征的变化得到的影像组学标志物,可有效区分应答者和非应答者(两个外部验证集AUC分别为0.85,0.81),进一步观察还发现瘤周Gabor滤波特征的变化与淋巴细胞的浸润有关(P<0.05),提示肿瘤周围区域潜在的预测价值。上述均为回顾性研究,且部分研究纳入的样本量较少,故病灶影像特征与免疫应答和预后的确切关系有待在将来更大规模的前瞻性研究中进一步验证。
6.2 关联生物标志物用于间接预测免疫应答和预后
目前,数种生物标志物可用于预测患者对免疫治疗的应答,包括PD-1/PD-L1、肿瘤突变负荷(tumor mutation burden,TMB)以及肿瘤浸润性淋巴细胞等,其检测主要依赖活检、免疫组化和/或测序技术,但局部取样较难反映肿瘤异质性和检测结果存在差异会造成预测免疫应答和预后不准[43]。人工智能辅助技术能通过建立影像数据与生物标志物的关系,达到间接预测免疫应答和预后的目的。
PD-1/PD-L1是目前最具代表性的生物标志物[51]。一般情况下,病灶PD-1/PD-L1表达水平越高意味着其产生应答的可能性越大。Jiang等[52]回顾性分析了399例NSCLC患者的PET/CT图像,发现12个从CT图像中选择的影像组学特征构建的PD-L1表达水平预测模型在不同的检测试剂(SP-142、28-8)和不同表达水平(>1%、>50%)中均取得良好效能,预测模型对SP-142表达水平>1%、>50%的AUC分别为0.97、0.80;对28-8表达水平>1%、>50%的AUC分别为0.86、0.91。但该研究未纳入患者生存数据,无法验证该模型对预后的预测效果。Tian等[53]利用深度学习的方法,基于939例NSCLC患者的CT图像构建了预测PD-L1表达水平的影像标志物,结果显示该标志物能有效预测PD-L1>50%的患者(测试集AUC=0.76),该研究还进一步分析了其与患者预后的关系,然而,在将另外94例接受免疫治疗的患者根据影像标志物表达水平分为两组后,却发现影像标志物低表达水平的患者具有更长的中位无进展生存期(363 d比183 d,P=0.010),这样的结果可能是纳入样本量不足和随访时间有限,且无法获取中位OS而造成的。
TMB是肿瘤组织基因组区域每兆碱基对体细胞非同义突变的数目[54]。较高的 TMB意味着能产生更多的新抗原,而易于被免疫系统识别[55-56]。He等[57]通过深度学习方法将327例晚期NSCLC患者的CT图像纳入研究,以10个突变/每兆碱基对作为高TMB阈值,最终构建的TMB标志物具良好的预测效能(测试集AUC=0.81)。同时,外部独立验证集中123例接受ICI治疗的患者可被上述TMB标志物划分为高、低风险两组,两组患者生存期的差异具有统计学意义(阈值=0.61,P=0.030),进一步验证了该标志物的预测价值。
瘤内淋巴细胞平均密度,特别是T淋巴细胞的丰度,与免疫应答相关[58]。Sun等[59]创新性地以RNA测序数据中CD8基因的表达水平评估病灶中浸润性CD8细胞丰度,从135例接受抗PD-1/PD-L1单药治疗的晚期实体肿瘤患者治疗前的增强CT图像中提取了5个影像组学特征,并进一步联合其他相关变量构建了浸润性CD8细胞丰度的预测模型。模型性能在癌症基因组图谱相关数据集(AUC=0.67)和免疫表型数据集(AUC=0.76)中均得到验证。研究还同时评估了该模型对治疗应答和预后的预测性能,结果显示,高分组患者中位OS明显高于低分组(24.3个月比11.5个月,P=0.0081)。
6.3 识别假性进展
早期准确鉴别假性进展和真性进展,既可使假性进展者从ICI治疗中持续获益,又可避免真性进展者接受不必要的治疗,进而避免irAE的发生。Basler等[60]利用多个时间节点的18F-FDG PET/CT图像,分析了112例转移性黑色素瘤患者的645个转移灶,结果发现分形维度的增加和粗糙度的减少,也即纹理特征从均匀到不均匀的变化可提示真性进展的发生,这种基于CT图像粗糙度特征变化值构建的逻辑回归模型能较好地识别假性进展(AUC=0.78,敏感性0.89,特异性0.53)。
6.4 识别irAE
影像组学在早期识别和鉴别irAE的发生具有一定的应用价值,Mu等[61]利用146例NSCLC患者的18F-FDG PET/CT图像提取相应影像组学特征,并联合两个临床特征构建模型,发现其能有效预测高级别irAE(≥3级)的发生,测试集和前瞻性验证集的AUC分别为0.92、0.88。Tohidinezhad等[62]则纳入经ICI治疗后出现肺炎的72例Ⅳ期NSCLC患者进行研究,发现基于CT图像的影像组学模型可有效鉴别免疫相关肺炎和其他类型肺炎(AUC=0.83)。
6.5 局限性
影像学技术和人工智能技术高速发展一定会带来精准医学应用的快速发展,但目前这些技术仍有其局限性:(1)图像采集参数、靶区勾画以及特征提取软件的不同造成的差异直接导致了特征提取结果的可重复性差[63-64]。(2)以采取多层神经网络作为算法的深度学习为例,研究结果缺乏可靠解释。(3)相关研究多为回顾性的单中心研究。因此,在免疫治疗领域,上述影像组学和人工智能技术距离真正的临床应用仍有一定距离。近年来,影像标志物标准化倡议已被提出旨在构建标准化的特征提取方案以应对特征重复性差的难题[65]。与此同时,随着多中心合作模式的兴起、联邦学习等新技术的不断发展,上述问题将得到进一步解决。
7 总结与展望
影像学是评估ICI治疗疗效不可或缺的手段,其既可捕捉病灶在治疗过程中的宏观和微观变化,又能与人工智能技术相结合获取肉眼无法辨认的信息并加以利用,从而为临床制订个体化策略提供帮助。然而,免疫应答特殊模式和irAE的存在,以及人工智能模型泛化能力不足、可解释性差等问题阻碍着个体化精准评估的实现。相信随着研究的不断深入,未来可将影像学技术与人工智能相结合开发出ICI治疗评估中的个体化精准评估解决方案。
利益冲突 所有作者声明无利益冲突
作者贡献声明 何泳蓝、李源:选题提出和设计;杨尚颖:研究设计、文献检索和文章撰写;刘新宇、薛华丹、金征宇、何泳蓝、李源:论文修订、质量控制和审查;所有作者均同意对研究工作诚信负责
参 考 文 献
[1]Hodi FS,O’Day SJ,McDermott DF,et al.Improved survival with ipilimumab in patients with metastatic melanoma[J].N Engl J Med,2010,363(8):711-723.DOI:10.1056/NEJMoa1003466.
[2]Borghaei H,Paz-Ares L,Horn L,et al.Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer[J].N Engl J Med,2015,373(17):1627-1639.DOI:10.1056/NEJMoa1507643.
[3]Hellmann MD,Ciuleanu TE,Pluzanski A,et al.Nivolumab plus ipilimumab in lung cancer with a high tumor mutational burden[J].N Engl J Med,2018,378(22):2093-2104. DOI:10.1056/NEJMoa1801946.
[4]Borcoman E,Kanjanapan Y,Champiat S,et al.Novel patterns of response under immunotherapy[J].Ann Oncol,2019,30(3):385-396.DOI:10.1093/annonc/mdz003
[5]Nishino M,Hatabu H,Hodi FS.Imaging of cancer immunotherapy:current approaches and future directions[J].Radiology,2019,290(1):9-22.DOI:10.1148/radiol.2018181349.
[6]Bagchi S,Yuan R,Engleman EG.Immune checkpoint inhibitors for the treatment of cancer:clinical impact and mechanisms of response and resistance[J].Annu Rev Pathol,2021,16(1):223-249.DOI:10.1146/annurev-pathol-042020-042741.
[7]Pardoll DM.The blockade of immune checkpoints in cancer immunotherapy[J].Nat Rev Cancer,2012,12(4):252-264. DOI:10.1038/nrc3239.
[8]Keir ME,Butte MJ,Freeman GJ,et al.PD-1 and its ligands in tolerance and immunity[J].Annu Rev Immunol,2008,26(1):677-704.DOI:10.1146/annurev.immunol.26.021607.090331.
[9]Vinay DS,Ryan EP,Pawelec G,et al.Immune evasion in cancer:mechanistic basis and therapeutic strategies[J].Semin Cancer Biol,2015,35 Suppl:S185-S198.DOI:10.1016/j.semcancer.2015.03.004.
[10]Borghaei H,Gettinger S,Vokes EE,et al.Five-year outcomes from the randomized,phase III trials CheckMate 017 and 057:nivolumab versus docetaxel in previously treated non-small-cell lung cancer[J].J Clin Oncol,2021,39(7):723-733.DOI:10.1200/JCO.20.01605.
[11]Nishino M.Immune-related response evaluations during immune-checkpoint inhibitor therapy:establishing a “common language” for the new arena of cancer treatment[J].J Immunother Cancer,2016,4:30.DOI:10.1186/s40425-016-0134-0.
[12]Chiou VL,Burotto M.Pseudoprogression and immune-related response in solid tumors[J].J Clin Oncol,2015,33(31):3541-3543.DOI:10.1200/JCO.2015.61.6870.
[13]Park HJ,Kim KW,Pyo J,et al.Incidence of pseudoprogression during immune checkpoint inhibitor therapy for solid tumors:a systematic review and meta-analysis[J].Radiology,2020,297(1):87-96.DOI:10.1148/radiol.2020200443.
[14]Di Giacomo AM,Danielli R,Guidoboni M,et al.Therapeutic efficacy of ipilimumab,an anti-CTLA-4 monoclonal antibody,in patients with metastatic melanoma unresponsive to prior systemic treatments:clinical and immunological evidence from three patient cases[J].Cancer Immunol Immunother,2009,58(8):1297-1306.DOI:10.1007/s00262008-0642-y.
[15]Nishino M,Giobbie-Hurder A,Manos MP,et al.Immune-related tumor response dynamics in melanoma patients treated with pembrolizumab:identifying markers for clinical outcome and treatment decisions[J].Clin Cancer Res,2017,23(16):4671-4679.DOI:10.1158/1078-0432.CCR-17-0114.
[16]Frelaut M,du Rusquec P,de Moura A,et al.Pseudoprogression and hyperprogression as new forms of response to immunotherapy[J].Bio Drugs,2020,34(4):463-476.DOI:10.1007/s40259-020-00425-y.
[17]Lo Russo G,Moro M,Sommariva M,et al.Antibody-Fc/FcR interaction on macrophages as a mechanism for hyperprogressive disease in non-small cell lung cancer subsequent to PD-1/PD-L1 blockade[J].Clin Cancer Res,2019,25(3):989-999.DOI:10.1158/1078-0432.CCR-18-1390.
[18]Kato S,Goodman A,Walavalkar V,et al.Hyperprogressors after immunotherapy:analysis of genomic alterations associated with accelerated growth rate[J].Clin Cancer Res,2017,23(15):4242-4250.DOI:10.1158/1078-0432.CCR-16-3133.
[19]Tazdait M,Mezquita L,Lahmar J,et al.Patterns of responses in metastatic NSCLC during PD-1 or PDL-1 inhibitor therapy:comparison of RECIST 1.1,irRECIST and iRECIST criteria[J].Eur J Cancer,2018,88:38-47.DOI:10.1016/j.ejca.2017.10.017.
[20]Bernard-Tessier A,Baldini C,Castanon E,et al.Patterns of progression in patients treated for immuno-oncology antibodies combination[J].Cancer Immunol Immunother,2021,70(1):221-232.DOI:10.1007/s00262-020-02647-z.
[21]Xu C,Chen YP,Du XJ,et al.Comparative safety of immune checkpoint inhibitors in cancer:systematic review and network meta-analysis[J].BMJ,2018,363:k4226.DOI:10.1136/bmj.k4226.
[22]Ramos-Casals M,Brahmer JR,Callahan MK,et al.Immune-related adverse events of checkpoint inhibitors[J].Nat Rev Dis Primer,2020,6(1):1-21.DOI:10.1038/s41572-020-0160-6.
[23]Postow MA,Sidlow R,Hellmann MD.Immune-related adverse events associated with immune checkpoint blockade[J].N Engl J Med,2018,378(2):158-168.DOI:10.1056/NEJMra1703481.
[24]Socinski MA,Jotte RM,Cappuzzo F,et al.Association of immune-related adverse events with efficacy of atezolizumab in patients with non-small cell lung cancer:pooled analyses of the phase 3 IMpower130,IMpower132,and IMpower150 randomized clinical trials[J].JAMA Oncol,2023,9(4):527-535.DOI:10.1001/jamaoncol.2022.7711.
[25]Matsuoka H,Hayashi T,Takigami K,et al.Correlation between immune-related adverse events and prognosis in patients with various cancers treated with anti PD-1 antibody[J].BMC Cancer,2020,20(1):656.DOI:10.1186/s12885-020-07142-3.
[26]Eisenhauer EA,Therasse P,Bogaerts J,et al.New response evaluation criteria in solid tumours:revised RECIST guideline (version 1.1)[J].Eur J Cancer,2009,45(2):228-247.DOI:10.1016/j.ejca.2008.10.026.
[27]Wolchok JD,Hoos A,O’Day S,et al.Guidelines for the evaluation of immune therapy activity in solid tumors:immune-related response criteria[J].Clin Cancer Res,2009,15(23):7412-7420.DOI:10.1158/1078-0432.CCR-09-1624.
[28]Bohnsack O,Hoos A,Ludajic K.Adaptation of the immune related response criteria:irrecist[J].Ann Oncol,2014,25(Suppl 4):iv369.DOI:10.1093/annonc/mdu342.23.
[29]Seymour L,Bogaerts J,Perrone A,et al.iRECIST:guidelines for response criteria for use in trials testing immunotherapeutics[J].Lancet Oncol,2017,18(3):e143-e152.DOI:10.1016/S1470-2045(17)30074-8.
[30]Hodi FS,Ballinger M,Lyons B,et al.Immune-modified response evaluation criteria in solid tumors(imRECIST):refining guidelines to assess the clinical benefit of cancer immunotherapy[J].J Clin Oncol,2018,36(9):850-858.DOI:10.1200/JCO.2017.75.1644.
[31]Hodi FS,Hwu WJ,Kefford R,et al.Evaluation of immune-related response criteria and RECIST v1.1 in patients with advanced melanoma treated with pembrolizumab[J].J Clin Oncol,2016,34(13):1510-1517.DOI:10.1200/JCO.2015.64.0391.
[32]Nishino M.Pseudoprogression and measurement variability[J].J Clin Oncol,2016,34(28):3480-3481.DOI:10.1200/JCO.2016.67.6759.
[33]Costa LB,Queiroz MA,Barbosa FG,et al.Reassessing patterns of response to immunotherapy with PET:from morphology to metabolism[J].Radiographics,2021,41(1):120-143. DOI:10.1148/rg.2021200093.
[34]Champiat S,Dercle L,Ammari S,et al.Hyperprogressive disease is a new pattern of progression in cancer patients treated by anti-PD-1/PD-L1[J].Clin Cancer Res,2017,23(8):1920-1928.DOI:10.1158/1078-0432.CCR-16-1741.
[35]Mekki A,Dercle L,Lichtenstein P,et al.Detection of immune-related adverse events by medical imaging in patients treated with anti-programmed cell death 1[J].Eur J Cancer,2018,96:91-104.DOI:10.1016/j.ejca.2018.03.006.
[36]Nishino M,Ramaiya NH,Awad MM,et al.PD-1 inhibitor-related pneumonitis in advanced cancer patients:radiographic patterns and clinical course[J].Clin Cancer Res,2016,22(24):6051-6060.DOI:10.1158/1078-0432.CCR-16-1320.
[37]Pozzessere C,Lazor R,Jumeau R,et al.Imaging features of pulmonary immune-related adverse events[J].J Thorac Oncol,2021,16(9):1449-1460.DOI:10.1016/j.jtho.2021.05.017.
[38]Goldfarb L,Duchemann B,Chouahnia K,et al.Monitoring anti-PD-1-based immunotherapy in non-small cell lung cancer with FDG PET:introduction of iPERCIST[J].EJNMMI Res,2019,9(1):8.DOI:10.1186/s13550-019-0473-1.
[39]Anwar H,Sachpekidis C,Winkler J,et al.Absolute number of new lesions on 18F-FDG PET/CT is more predictive of clinical response than SUV changes in metastatic melanoma patients receiving ipilimumab[J].Eur J Nucl Med Mol Imaging,2018,45(3):376-383.DOI:10.1007/s00259-017-3870-6.
[40]Wang X,Yang W,Zhou Q,et al.The role of 18F-FDG PET/CT in predicting the pathological response to neoadjuvant PD-1 blockade in combination with chemotherapy for resectable esophageal squamous cell carcinoma[J].Eur J Nucl Med Mol Imaging,2022,49(12):4241-4251.DOI:10.1007/s00259-022-05872-z.
[41]Dimitriou F,Lo SN,Tan AC,et al.FDG-PET to predict long-term outcome from anti-PD-1 therapy in metastatic melanoma[J].Ann Oncol,2022,33(1):99-106.DOI:10.1016/j.annonc.2021.10.003.
[42]Lau D,McLean MA,Priest AN,et al.Multiparametric MRI of early tumor response to immune checkpoint blockade in metastatic melanoma[J].J Immunother Cancer,2021,9(9):e003125.DOI:10.1136/jitc-2021-003125.
[43]Doroshow DB,Bhalla S,Beasley MB,et al.PD-L1 as a biomarker of response to immune-checkpoint inhibitors[J].Nat Rev Clin Oncol,2021,18(6):345-362.DOI:10.1038/s41571-021-00473-5.
[44]Lambin P,Leijenaar RTH,Deist TM,et al.Radiomics:the bridge between medical imaging and personalized medicine[J].Nat Rev Clin Oncol,2017,14(12):749-762.DOI:10.1038/nrclinonc.2017.141.
[45]Chen X,Wang X,Zhang K,et al.Recent advances and clinical applications of deep learning in medical image analysis[J].Med Image Anal,2022,79:102444.DOI:10.1016/j.media.2022.102444.
[46]Trebeschi S,Drago SG,Birkbak NJ,et al.Predicting response to cancer immunotherapy using noninvasive radiomic biomarkers[J].Ann Oncol,2019,30(6):998-1004.DOI:10.1093/annonc/mdz108.
[47]Mu W,Tunali I,Gray JE,et al.Radiomics of 18F-FDG PET/CT images predicts clinical benefit of advanced NSCLC patients to checkpoint blockade immunotherapy[J].Eur J Nucl Med Mol Imaging,2020,47(5):1168-1182.DOI:10.1007/s00259-019-04625-9.
[48]Ligero M,Garcia-Ruiz A,Viaplana C,et al.A CT-based radiomics signature is associated with response to immune checkpoint inhibitors in advanced solid tumors[J].Radiology,2021,299(1):109-119.DOI:10.1148/radiol.2021200928.
[49]Dercle L,Zhao B,Gnen M,et al.Early Readout on overall survival of patients with melanoma treated with immunotherapy using a novel imaging analysis[J].JAMA Oncol,2022,8(3):385-392.DOI:10.1001/jamaoncol.2021.6818.
[50]Khorrami M,Prasanna P,Gupta A,et al.Changes in CT radiomic features associated with lymphocyte distribution predict overall survival and response to immunotherapy in non-small cell lung cancer[J].Cancer Immunol Res,2020,8(1):108-119.DOI:10.1158/2326-6066.CIR-19-0476.
[51]Davis AA,Patel VG.The role of PD-L1 expression as a predictive biomarker:an analysis of all US Food and Drug Administration (FDA) approvals of immune checkpoint inhibitors[J].J Immunother Cancer,2019,7(1):278.DOI:10. 1186/s40425-019-0768-9.
[52]Jiang M,Sun D,Guo Y,et al.Assessing PD-L1 expression level by radiomic features from PET/CT in nonsmall cell lung cancer patients:an initial result[J].Acad Radiol,2020,27(2):171-179.DOI:10.1016/j.acra.2019.04.016.
[53]Tian P,He B,Mu W,et al.Assessing PD-L1 expression in non-small cell lung cancer and predicting responses to immune checkpoint inhibitors using deep learning on computed tomography images[J].Theranostics,2021,11(5):2098-2107.DOI:10.7150/thno.48027.
[54]辇伟奇,聂勇战,应建明,等.肿瘤突变负荷检测及临床应用中国专家共识(2020年版)[J].中国癌症防治杂志,2020,12(5):485-494.DOI:10.3969/j.issn.1674-5671.2020.05.01.
[55]Ricciuti B,Wang X,Alessi JV,et al.Association of high tumor mutation burden in non-small cell lung cancers with increased immune infiltration and improved clinical outcomes of PD-L1 blockade across PD-L1 expression levels[J].JAMA Oncol,2022,8(8):1160.DOI:10.1001/jamaoncol.2022.1981.
[56]Samstein RM,Lee CH,Shoushtari AN,et al.Tumor mutational load predicts survival after immunotherapy across multiple cancer types[J].Nat Genet,2019,51(2):202-206. DOI:10.1038/s41588-018-0312-8.
[57]He B,Dong D,She Y,et al.Predicting response to immunotherapy in advanced non-small-cell lung cancer using tumor mutational burden radiomic biomarker[J].J Immunother Cancer,2020,8(2):e000550.DOI:10.1136/jitc-2020-000550.
[58]Balatoni T,Mohos A,Papp E,et al.Tumor-infiltrating immune cells as potential biomarkers predicting response to treatment and survival in patients with metastatic melanoma receiving ipilimumab therapy[J].Cancer Immunol Immunother CII,2018,67(1):141-151.DOI:10.1007/s00262-017-2072-1.
[59]Sun R,Limkin EJ,Vakalopoulou M,et al.A radiomics approach to assess tumour-infiltrating CD8 cells and response to anti-PD-1 or anti-PD-L1 immunotherapy:an imaging biomarker,retrospective multicohort study[J].Lancet Oncol,2018,19(9):1180-1191.DOI:10.1016/S1470-2045(18)30413-3.
[60]Basler L,Gabrys' HS,Hogan SA,et al.Radiomics,tumor volume,and blood biomarkers for early prediction of pseudoprogression in patients with metastatic melanoma treated with immune checkpoint inhibition[J].Clin Cancer Res,2020,26(16):4414-4425.DOI:10.1158/1078-0432.CCR-20-0020.
[61]Mu W,Tunali I,Qi J,et al.Radiomics of 18F fluorodeoxyglucose PET/CT images predicts severe immune-related adverse events in patients with NSCLC[J].Radiol Artif Intell,2020,2(1):e190063.DOI:10.1148/ryai.2019190063.
[62]Tohidinezhad F,Bontempi D,Zhang Z,et al.Computed tomography-based radiomics for the differential diagnosis of pneumonitis in stage IV non-small cell lung cancer patients treated with immune checkpoint inhibitors[J].Eur J Cancer,2023,183:142-151.DOI:10.1016/j.ejca.2023.01.027.
[63]Bettinelli A,Marturano F,Avanzo M,et al.A novel benchmarking approach to assess the agreement among radiomic tools[J].Radiology,2022,303(3):533-541.DOI:10.1148/radiol.211604.
[64]Gillies RJ,Kinahan PE,Hricak H.Radiomics:images are more than pictures,they are data[J].Radiology,2016,278(2):563-577.DOI:10.1148/radiol.2015151169.
[65]Zwanenburg A,Vallières M,Abdalah MA,et al.The image biomarker standardization initiative:standardized quantitative radiomics for high-throughput image-based phenotyping[J].Radiology,2020,295(2):328-338.DOI:10.1148/radiol.2020191145.
(收稿日期:2023-09-07)
