五味子木脂素对跑步机睡眠剥夺大鼠警觉性的影响
2024-01-01武亚楠马青王艳艳黄莉莉




摘要:目的 探讨五味子木脂素对跑步机睡眠剥夺大鼠警觉性水平的影响及其可能的神经生物学机制。方法 SD雄性大鼠,随机数字表法分为空白组,睡眠剥夺组,五味子木脂素低、中、高剂量组,盐酸托莫西汀组,每组8只。除空白组外,其他各组大鼠均进行跑步机睡眠剥夺,连续3 d。剥夺期间,各个给药组分别灌胃给予相应药物,采用5~9孔测试仪测试各组大鼠的警觉性表现;另取SD雄性大鼠,睡眠剥夺方法造模和给药方法同上,随机数字表法分为空白组、睡眠剥夺组、五味子木脂素组(67.2 mg/kg)和盐酸托莫西汀组,每组10只,采用ELISA技术测定各组大鼠血清中食欲素A的含量;采用免疫荧光、Western blot法观察各组大鼠前额叶皮层(PFC)c-Fos蛋白表达和食欲素受体 1、2水平的变化。结果 与空白组相比,睡眠剥夺组大鼠警觉性表现的选择准确性显著降低(Plt;0.001),遗漏反应、遗漏率和平均反应潜伏期均显著升高(P=0.002,P=0.003,P=0.020);与睡眠剥夺组相比,五味子木脂素中、高剂量组和盐酸托莫西汀组均可改善跑步机睡眠剥夺大鼠的警觉性指标,表现为选择准确性提高(P=0.001,P=0.006,Plt;0.001),遗漏反应(P=0.001,P=0.001,Plt;0.001)、遗漏率(P=0.001,P=0.002,Plt;0.001)和平均反应潜伏期(P=0.018,P=0.003,P=0.014)减少。与空白组相比,睡眠剥夺组大鼠血清中的食欲素 A含量、PFC脑区c-Fos均显著增加(P均lt;0.001),食欲素受体1蛋白表达水平显著减少(P=0.037);与睡眠剥夺组相比,五味子木脂素组(67.2 mg/kg)和盐酸托莫西汀组大鼠血清中的食欲素 A水平(P=0.005,P=0.029)、PFC脑区c-Fos(P=0.028,P=0.036)均显著降低,食欲素受体1蛋白表达水平显著升高(P=0.043,P=0.013)。结论 五味子木脂素可能通过调节食欲素分泌和PFC的食欲素受体1表达发挥拮抗睡眠剥夺所致警觉性水平下降的作用。
关键词:五味子木脂素;睡眠剥夺;警觉性;食欲素
中图分类号: R285.5" 文献标识码: A" 文章编号:1000-503X(2024)04-0471-11
DOI:10.3881/j.issn.1000-503X.15910
Effects of Schisandrae Chinensis Fructus Lignans on Alertness of Rats With Sleep Deprived by Treadmill Exercise
WU Yanan,MA Qing,WANG Yanyan,HUANG Lili
College of Pharmacy,Heilongjiang University of Chinese Medicine,Harbin 150040,China
Corresponding author:HUANG Lili Tel:0451-82114410,E-mail:908668195@qq.com
ABSTRACT:Objective To investigate the effects of Schisandrae Chinensis Fructus lignans on the alertness of the rats with sleep deprived by treadmill exercise and the underlying neurobiological mechanism.Methods According to the random number table method,SD male rats were assigned into control,sleep deprivation,low-,medium-,and high-dose Schisandrae Chinensis Fructus lignans,and atomoxetine hydrochloride groups,with 8 rats in each group.The rats in other groups except the control group were subjected to sleep deprivation by treadmill exercise for 3 d.During the deprivation period,each administration group was administrated with the corresponding drug by gavage,and a 5-9 hole tester was used to test the alertness performance of rats in each group. Furthermore,other SD male rats were selected and randomized into control,sleep deprivation,Schisandrae Chinensis Fructus lignans (67.2 mg/kg) and atomoxetine hydrochloride groups,with 10 rats in each group.The rats were modeled with the sleep deprivation method the same as that above and administrated with corresponding agents.ELISA was employed to measure the serum level of orexin A in each group of rats.The protein levels of c-Fos,orexin receptor 1,and orexin receptor 2 in the prefrontal cortex of rats in each group were observed by immunofluorescence and Western blotting.Results Compared with the control group,sleep deprivation reduced the choice accuracy (Plt;0.001) and increased the omission responses,omission percent,and mean correct response latency (P=0.002,P=0.003,P=0.020).Compared with the sleep deprivation group,medium- and high-dose Schisandrae Chinensis Fructus lignans and atomoxetine hydrochloride improved the alertness of rats,as demonstrated by the increased choice accuracy (P=0.001,P=0.006,Plt;0.001) and reduced omission responses (P=0.001,P=0.001,Plt;0.001),omission percent (P=0.001,P=0.002,Plt;0.001),and mean correct response latency (P=0.018,P=0.003,P=0.014).Compared with the control group,the sleep deprivation group showed elevated level of orexin A in the serum (Plt;0.001),up-regulated expression of c-Fos (Plt;0.001),and down-regulated expression of orexin receptor 1 (P=0.037) in the prefrontal cortex.Compared with the sleep deprivation group,Schisandrae Chinensis Fructus lignans (67.2 mg/kg) and atomoxetine hydrochloride lowered the orexin A level in the serum (P=0.005,P=0.029),down-regulated the expression of c-Fos (P=0.028,P=0.036),and up-regulated the expression of orexin receptor 1 (P=0.043,P=0.013) in the prefrontal cortex.Conclusion Schisandrae Chinensis Fructus lignans may antagonize the alertness decrease caused by sleep deprivation by regulating the secretion of orexin and the expression of orexin receptor 1 in the prefrontal cortex.
Key words:Schisandrae Chinensis Fructus lignans;sleep deprivation;alertness;orexin
Acta Acad Med Sin,2024,46(4):471-481
警觉性作为认知的一个最基本维度,是完成其他高级认知过程的必要条件,影响警觉性的因素有多种:光照、声音、温度、年龄和性别等[1-4]。警觉性作为广泛认知任务的主要组成部分,在日常的工作学习和生活中都不可或缺。相关失眠流行病学的研究中,失眠是中青年人群普遍存在的问题[5],睡眠障碍会损害警觉性和神经认知能力,并增加开车时睡着的风险,从而导致交通事故的发生[6];在进行军事演练、应急处置等高强度的训练中,军人常处于睡眠剥夺状态下,需要服用兴奋剂保持较高的警觉性以维持军人的战斗状态[7]。5~9孔测试仪和啮齿动物精神运动警觉性任务是用于研究啮齿类动物的测试装置,现已成为评估啮齿类动物警觉性及持续性注意力的有效工具[8-9]。因此,研究开发拮抗睡眠不足引起的警觉性下降的药物,对于维持国家和社会安全具有重要的意义。
食欲素是处于下丘脑外侧区的食欲素神经元合成分泌的兴奋性神经多肽类物质,食欲素包括食欲素 A、 B两种类型的神经肽[10]。有研究显示食欲素可以通过兴奋皮层下促觉醒核团,在启动和维持觉醒中发挥关键作用。前额叶皮层(prefrontal cortex,PFC)是与意识、注意力、抉择等认知功能高度相关的脑区,研究表明食欲素能神经元可直接投射到PFC,从而激发PFC对机体注意力的调控[11-12]。临床上常用的治疗警觉性下降的药物为中枢神经兴奋剂(咖啡因、右旋苯丙胺、莫达非尼、安非他明等)[13-14]和非中枢神经兴奋剂(盐酸托莫西汀),但可能会出现腹痛、恶心、呕吐、嗜睡和食欲减退等不良反应,且长期疗效也存在一定的争议[15]。五味子最早记载于《神农本草经》,具有收敛固涩、益气生津、补肾宁心之功效,中医临床常用其治疗久嗽虚喘、津伤口渴、心悸失眠等症状[16]。现代药理学表明,五味子中的主要药效物质基础——五味子木脂素对中枢神经系统具有广泛的药理作用[17]。本课题组前期研究表明,五味子木脂素具有改善睡眠剥夺大鼠的睡眠,以及拮抗睡眠剥夺大鼠的日间功能下降,表现为抗疲劳、抗焦虑样和抑郁样作用[18]。但有关睡眠剥夺大鼠警觉性的影响的报道较少。本研究旨在通过5~9孔测试仪评价五味子木脂素对跑步机睡眠剥夺大鼠警觉性水平的影响及其可能的神经生物学机制。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
雄性SD大鼠88只,体重90~110 g,SPF级,由黑龙江中医药大学实验动物中心提供[动物许可证号:SCXK(黑)2020-004]。本研究通过黑龙江中医药大学实验动物管理及福利伦理委员会审批(伦理审查编号:2023113011)。
1.1.2 实验药物及试剂
五味子木脂素冻干粉(总木脂素含量不小于56%)由黑龙江中医药大学药学院中药药理教研室制备;盐酸托莫西汀(D407991)购自美国礼来公司;大鼠食欲素 A酶联免疫吸附测定试剂盒(JL47983)购自江莱生物科技有限公司;一抗c-Fos Rabbit pAb(A16641)、二抗FITC Goat Anti-Rabbit IgG(H+L)(AS011)和β-actin Rabbit mAb(AC026)均购自武汉爱博泰克公司;吐温20(批号:T6220)购自北京博奥拓达科技有限公司;一抗HCRTR1 Ab-DF5218(52g4607)、HCRTR2 Ab-DF7162(1414369)均购自美国艾菲公司;二抗IRDye 800CW Goat Anti-Rabbit(bs-40295G-IRDye8)购自北京博奥森生物技术有限公司。
1.1.3 实验仪器
5~9孔测试仪(LE509MO)购自美国哈佛生物公司;跑步机睡眠剥夺仪(BW-NSD404)购自上海软隆科技发展有限公司;酶标仪(Synergy MX)购自美国BIOTEK 公司;高速低温冷冻离心机(3-18R3006004)购自美国TOMOS 有限公司;电泳仪(JY-300E)和垂直电泳槽(JY-SCZ2+)购自北京君意东方电泳设备有限公司;正置显微镜(DM4000B)购自德国徕卡公司;LED数显圆周摇床(SLK-O3000-S)购自美国赛洛捷克公司;磁力搅拌器(MS-PB)购自武汉塞维尔生物科技有限公司;双色荧光成像系统(Odyssey CLx System)购自美国LI-COR公司。
1.2 实验方法
1.2.1 实验前准备
每笼饲养4只大鼠,实验室适应1周,自由饮食饮水。在首次进行9孔选择任务训练前,大鼠禁食24 h。实验期间,每只大鼠每天于训练后限制给予饲料10 g,自由获取水。
1.2.2 实验前测试训练
实验前测试训练主要选择5~9孔测试仪中的9孔选择任务(图1)。参照文献[8]中的学习训练步骤,9孔选择任务包括3个阶段:适应训练、强化训练和正式训练。
1.2.3 适应训练
每只大鼠每天训练18 min。在前8 min训练中,将大鼠放入5~9孔测试仪的实验箱中,实验箱内箱顶照明灯熄灭,让大鼠熟悉箱内的环境,并通过在食槽放置15粒奖励饲料颗粒使其了解食槽位置。后10 min训练中,设置投放装置每隔30 s自动投放奖励饲料1粒。在训练期间,当大鼠将全部奖励饲料食尽,此阶段训练结束。此阶段训练的目的是让大鼠熟悉饲料盒的位置及通过投放装置供给饲料颗粒的方法。适应训练持续时间设定为2 d。
1.2.4 强化训练
每只大鼠每天训练30 min。在前15 min训练中,将大鼠放入实验箱中,9个信号灯全亮,若大鼠移至该信号灯前,鼻触发红外感应,则饲料投放装置自动投放饲料1粒。在后15 min训练中,9个信号灯全亮,大鼠需要在信号灯前鼻触发红外感应,饲料投放装置自动投放饲料1粒,这时大鼠需返回食槽并获取奖励。如大鼠未能返回食槽触发食槽红外感应,再次鼻触信号灯的红外感应,饲料投放装置也不会投放饲料。强化训练期间,若大鼠连续2 d在后15 min训练程序中获得超过20粒的奖励饲料,则强化训练结束后进入正式训练阶段。此阶段训练的目的是让大鼠在光源信号与奖励饲料投放之间建立稳定的条件反射。完成此项训练平均约5 d。
1.2.5 正式训练
每只大鼠每天训练15 min,将大鼠放入实验箱中,经过3~7 s的间隔期(interatrial interval,ITI),即大鼠完成1轮训练后与下1轮训练周期启动之间的时间间隔,此时某一信号灯亮,当大鼠在信号期(9孔信号灯随机1孔中信号灯亮起的持续时间)和后续期(信号灯刚熄灭的3 s内)至该信号灯前触发红外感应,饲料投放装置自动投放奖励饲料1粒。当完成1轮训练后,即获得奖励饲料1粒,记为正确反应1次。经ITI后,启动下1轮训练。当大鼠在信号期和后续期触发未亮信号灯的红外感应、在ITI期间鼻触9孔中的任意一孔,则奖励饲料不能自动投放,同时箱顶照明灯亮起并持续2 s进行惩罚,惩罚结束后箱顶照明灯灭,经ITI后,进行下1轮训练。最初,训练程序包括3~7 s的ITI后,信号灯亮起持续10 s,后续期3 s,允许实验动物有强化反应的充分时间。当大鼠在15 min的训练中,完成超过20轮训练,并且持续2 d选择准确性超过50%,遗漏率小于20%,进行进阶程序的训练,即信号期由10 s逐步递减至1 s(依次为10、5、3、1 s)。在信号期为1 s,后续期为3 s的训练中,大鼠连续3 d的选择准确性超过50%,遗漏率小于20%,且3 d的选择准确性和遗漏率差异无统计学意义,可认为大鼠达到正式训练完成标准。完成此项训练平均约30 d,该程序旨在慢慢地将每只大鼠的表现推向9孔选择任务程序的最终表现(图2)。
1.2.6 9孔选择任务表现的指标
大鼠达到正式训练完成标准后,按照正式训练程序测定9孔选择任务的表现,具体指标为:正确反应(大鼠在信号期及后续期成功获得奖励饲料的次数)、不正
确反应(大鼠在信号期及后续期用鼻触发未亮信号灯的红外感应次数)、遗漏反应(大鼠在信号期及后续期未用鼻触发信号灯红外感应的次数)、提前反应(大鼠在ITI用鼻触发信号灯红外感应的次数,反映较高的冲动性水平)、实验次数(正确反应、不正确反应、遗漏反应、提前反应的总和,反映大鼠的主动探索能力)、选择准确性[正确次数/(正确反应+不正确反应)×100%,反映大鼠的注意力高低,同时也是作为能否进入下一阶段的标准之一]、遗漏率[遗漏反应/(正确反应+不正确反应+遗漏反应)×100%,也是作为能否进入下一阶段的标准之一]、平均反应潜伏期(大鼠在信号灯亮开始,至用鼻触发亮起的信号灯红外感应的平均反应时间,是检测警觉性水平的最敏感指标)。
1.3 跑步机睡眠剥夺复制大鼠睡眠障碍模型
在大鼠正式进行睡眠剥夺前,需先进行2 d的跑步机适应训练。在第1、2天均于每天8:00点进行1 h的跑步机适应,设定1 h的适应程序(5 min运转,5 min停止,速度为3 m/min)。在第3天,进行连续3 d的跑步机睡眠剥夺(4 s运转,12 s停止,速度为3 m/min)。
1.4 跑步机睡眠剥夺9孔选择任务表现的指标测定
达到训练完成标准的大鼠随机选取8只进行跑步机睡眠剥夺。大鼠分别于剥夺前24 h,剥夺2、26、50、74 h,恢复1、2、3、4 d,进行9孔选择任务正式训练程序,并测定9孔选择任务表现的指标。
1.5 大鼠造模及给药
达到训练完成标准的大鼠48只,随机数字表法分为空白组,睡眠剥夺组,五味子木脂素低、中、高剂量组,盐酸托莫西汀组,每组8只。除空白组外,各组大鼠均置于跑步机进行连续3 d的跑步机睡眠剥夺。剥夺期间,睡眠剥夺组和空白组大鼠于每日早8∶00点、晚20∶00点分别灌胃给予1%羧甲基纤维素钠溶液(0.005 mL/ g),连续3 d,五味子木脂素低、中、高剂量组大鼠于每日早8∶00点、晚20∶00点分别灌胃给予不同剂量的五味子木脂素混悬液(33.6、67.2、134.4 mg/kg),连续3 d。盐酸托莫西汀组大鼠于每日早8∶00点灌胃给予盐酸托莫西汀溶液(5.36 mg/kg),晚20∶00点灌胃给予相同体积的1%羧甲基纤维素钠溶液(0.005 mL/ g),连续3 d。
1.6 五叶子木脂素对睡眠剥夺大鼠9孔选择任务表现的指标测定
各组大鼠分别于剥夺前,剥夺1、2、3 d,进行9孔选择任务正式训练程序,测定各组大鼠剥夺前和剥夺3 d的9孔选择任务表现的指标。
1.7 取材
另取实验大鼠,睡眠剥夺方法造模和给药方法同前。由图3中的9孔选择任务结果可知,五味子木脂素给药剂量为67.2 mg/kg时,具有拮抗跑步机睡眠剥夺所致大鼠警觉性下降的作用,对睡眠剥夺大鼠9孔选择任务表现的各项指标,均具有明显的改善作用。故将实验大鼠按照随机数字表法分为空白组、睡眠剥夺组、五味子木脂素组(67.2 mg/kg)和盐酸托莫西汀组(5.36 mg/kg),每组10只。跑步机剥夺结束后,每组随机数字表法取6只大鼠,并将大鼠放入含有乙醚棉球的钟罩中,待大鼠麻醉后,进行眼内眦取血。取血后,各组大鼠进行4%多聚甲醛心脏灌注,取全脑,固定液(0.1 mol/L磷酸缓冲液,4%多聚甲醛)浸泡后置于4 ℃冰箱中备用。剩余大鼠同法麻醉,断头处死,取PFC。血清及PFC置于-80 ℃冰箱中备用。
1.8 ELISA法检测血清中食欲素A含量
采用ELISA检测血清中食欲素 A水平,具体操作按试剂盒说明书进行。
1.9 免疫荧光染色检测PFC脑区c-Fos蛋白表达
取大鼠脑组织冰冻切片依次放入0.1 mol/L PBST 6孔板中,将脑片置于0.1 mol/L PBST中漂洗10 min,重复3次;以0.2%的Triton X-100溶液于室温孵育15 min;PBST冲洗10 min,重复3次;10%的山羊血清封闭处理1 h;1∶100稀释c-Fos一抗孵育过夜(4 ℃冰箱);隔日取出复温1 h后PBST冲洗10 min,重复3次;将脑片避光放入1∶100稀释的荧光二抗溶液,在37 ℃水浴孵育90 min;PBST冲洗10 min,重复3次;DAPI处理10 min;PBST冲洗10 min,重复3次;封片后使用荧光显微镜采集图片,lmage J软件对免疫阳性细胞数进行定量分析。
1.10 Western blot 检测大鼠PFC脑区食欲素-R1和食欲素-R2表达
取大脑的PFC经磷酸盐缓冲液洗涤后,采用RIPA裂解液裂解,BCA法检测蛋白浓度,根据目的蛋白的相对分子质量,配制 8%分离胶,5%浓缩胶。待检测蛋白样品上样量20 μg/孔进行电泳分离,湿转法转膜。含5% 脱脂牛奶的 PBST 封闭液中摇床封闭1 h,PBST 洗膜后,分别加入已稀释好的CLOCK一抗(1∶1000)、BMAL1 一抗(1∶1000)、PER1一抗(1∶500)、PER2一抗(1∶1000)及 β-actin一抗(1∶50 000)、食欲素-R1一抗(1∶1000)、食欲素-R2一抗(1∶1000)、内参β-actin(1∶10 000)中,置于4 ℃下孵育过夜。PBST漂洗后,加入荧光二抗(1∶10 000)封膜,室温避光孵育1 h,PBST洗膜,利用荧光成像系统进行显影成像,采用Image J图像分析系统进行分析。
1.11 统计学处理
采用SPSS 26.0软件进行统计分析。所有指标采用Shapiro Wilk检验进行正态性检验,均符合正态分布,定量资料以均数±标准差表示,多组间比较采用单因素方差分析,进一步两组间比较采用Tukey检验,双侧Plt;0.05为差异有统计学意义。
2 结果
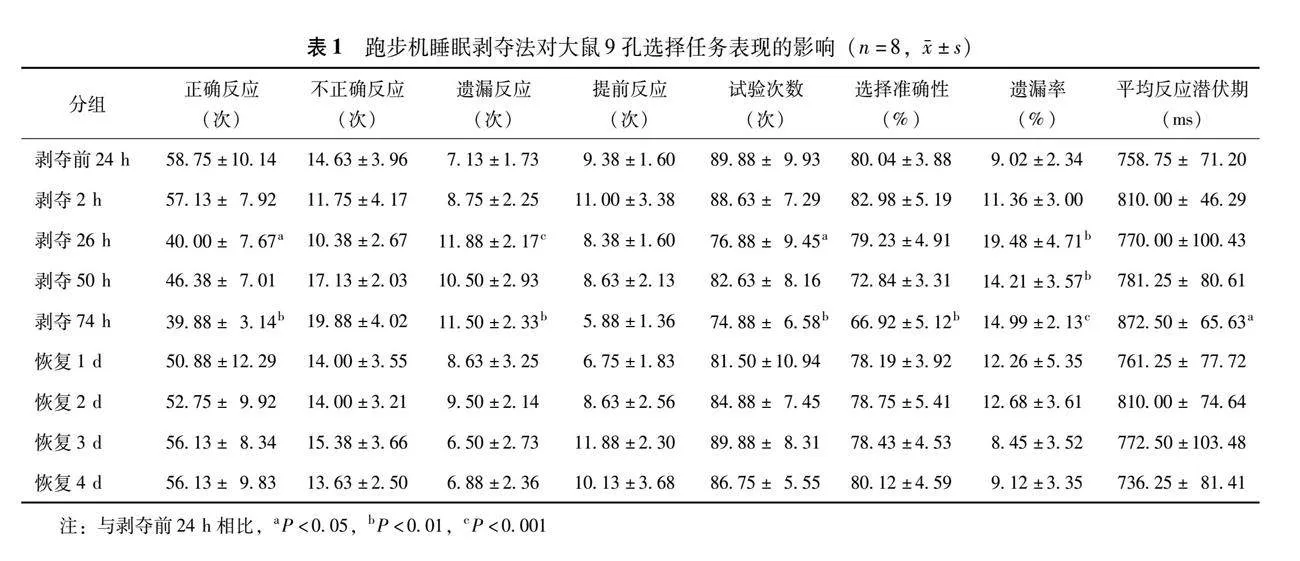
2.1 跑步机睡眠剥夺对大鼠9孔选择任务表现的影响
与剥夺前24 h相比,跑步机连续睡眠剥夺2 h后,大鼠9孔选择任务表现的各项指标无变化(P均gt;0.05);跑步机连续睡眠剥夺26 h后,大鼠的正确反应(P=0.018)和实验次数(P=0.034)均显著降低,遗漏反应(Plt;0.001)和遗漏率(P=0.002)均显著增高;跑步机连续睡眠剥夺50 h后,仅见大鼠遗漏率显著升高(P=0.004);跑步机连续睡眠剥夺74 h后,大鼠正确反应(P=0.003)、试验次数(P=0.001)和选择准确性(P=0.001)均显著降低,遗漏反应(P=0.005)、遗漏率(Plt;0.001)和平均反应潜伏期(P=0.014)均显著升高。跑步机连续睡眠剥夺结束后,恢复1~4 d,大鼠的9孔选择任务表现的各项指标与剥夺前24 h比较差异均无统计学意义(P均gt;0.05)(表 1)。
2.2 五味子木脂素对跑步机睡眠剥夺前后大鼠9孔选择任务表现的影响
剥夺前9孔选择任务表现的指标各组之间差异均无统计学意义(P均gt;0.05),数据具有可比性。与空白组相比,跑步机剥夺3 d后睡眠剥夺组大鼠的正确反应(P=0.004)、不正确反应(P=0.041)、遗漏反应(P=0.002)、提前反应(P=0.014)、试验次数(P=0.040)、选择准确性(Plt;0.001)、遗漏率(P=0.003)、平均反应潜伏期(P=0.022)差异均有统计学意义。与睡眠剥夺组相比,五味子木脂素低、中、高剂量组和盐酸托莫西汀组大鼠的遗漏反应(Plt;0.001,P=0.001,P=0.001,Plt;0.001)和遗漏率(P=0.003,P=0.001,P=0.002,Plt;0.001)均显著降低,此外,五味子木脂素中、高剂量组的选择准确性(P=0.001,P=0.006)均显著升高,平均反应潜伏期(P=0.018,P=0.003)均显著降低;盐酸托莫西汀组大鼠的正确反应和选择准确性(P均lt;0.001)均显著升高,平均反应潜伏期(P=0.014)显著降低;与五味子木脂素低剂量组相比,盐酸托莫西汀组大鼠的选择准确性(P=0.022)显著升高(图3)。
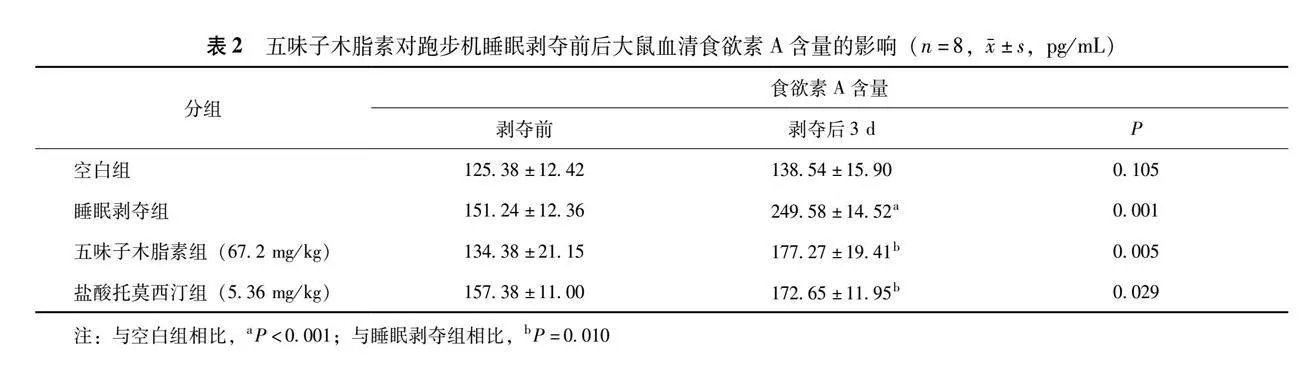
2.3 五味子木脂素对跑步机睡眠剥夺大鼠血清中食欲素A含量的影响
与剥夺前相比,剥夺后睡眠剥夺组(P=0.001)、五味子木脂素组(67.2 mg/kg)(P=0.005)和盐酸托莫西汀组(5.36 mg/kg)(P=0.029)大鼠的血清食欲素A水平均显著增加,增加的幅度依次为65%、32%和10%。剥夺前各组大鼠血清食欲素A水平差异无统计学意义(P均gt;0.05),各组数据具有可比性。与剥夺后空白组相比,剥夺后睡眠剥夺组大鼠血清中食欲素A水平显著升高(Plt;0.001);与剥夺后睡眠剥夺组相比,剥夺后五味子木脂素组(67.2 mg/kg)(P=0.010)和盐酸托莫西汀组(5.36 mg/kg)(P=0.010)大鼠血清食欲素A水平均显著降低(表2)。
2.4 五味子木脂素对跑步机睡眠剥夺大鼠PFC脑区c-Fos蛋白表达的影响
与空白组相比,睡眠剥夺组大鼠PFC脑区神经元c-Fos蛋白表达显著升高(Plt;0.001)。与睡眠剥夺组相比,五味子木脂素组(67.2 mg/kg)和盐酸托莫西汀组(5.36 mg/kg)大鼠PFC脑区神经元c-Fos蛋白表达均显著降低(P=0.028,P=0.036)(图4)。
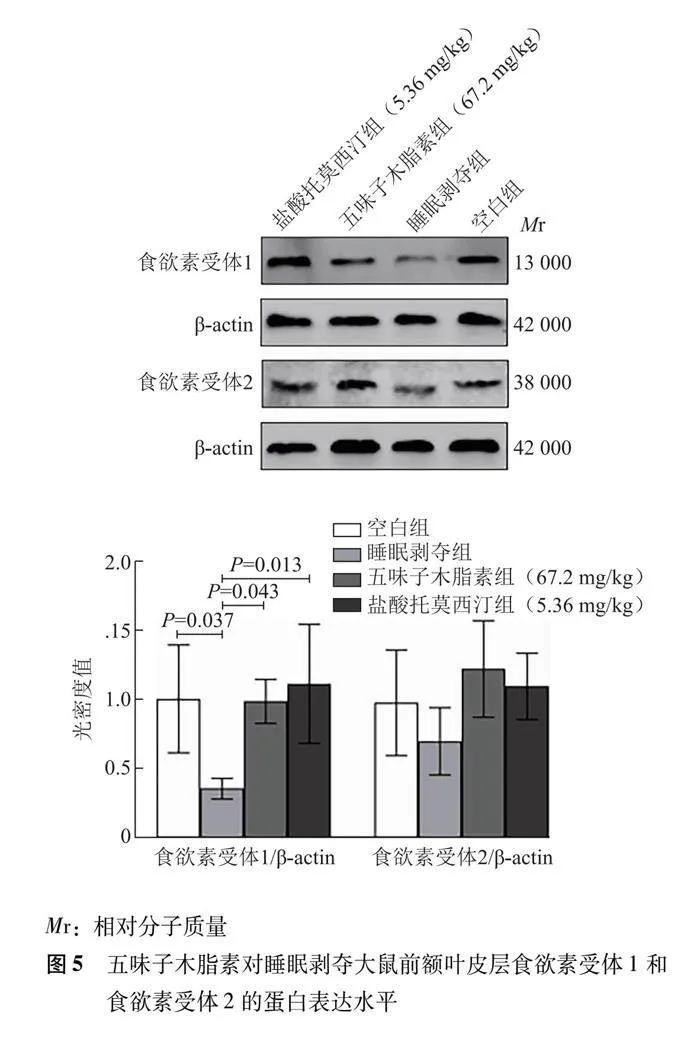
2.5 五味子木脂素对跑步机睡眠剥夺大鼠PFC脑区食欲素受体1和食欲素受体2表达的影响
与空白组相比,睡眠剥夺组大鼠PFC脑区中食欲素受体1蛋白表达水平显著减少(P=0.037),食欲素受体2蛋白表达水平有减少趋势,但差异无统计学意义(P=0.462)。与睡眠剥夺组相比,五味子木脂素组(67.2 mg/kg)(P=0.043)和盐酸托莫西汀组(5.36 mg/kg)(P=0.013)大鼠PFC脑区中食欲素受体1蛋白表达水平均显著增加,食欲素受体2蛋白表达水平有增加的趋势,但差异无统计学意义(P=0.051,P=0.180)(图5)。
3 讨论
本研究结果表明,跑步机持续睡眠剥夺可使大鼠的警觉水平下降,这种警觉水平的下降可随着睡眠的恢复而提高。五味子木脂素(67.2 mg/kg,每天2次)可拮抗跑步机睡眠剥夺所致的大鼠警觉性下降,其作用机制可能与其调节食欲素分泌和PFC的食欲素受体1表达有关。
睡眠剥夺24 h后,跑步机睡眠剥夺方法对警觉性表现中的各项指标影响不同。Christie 等[19]通过活动轮旋转的方式对大鼠进行24 h睡眠剥夺,仅观察到大鼠警觉性表现的反应延迟、失误反应显著增加。Oonk
等[20]通过轻柔处理的方式对大鼠进行24 h完全睡眠剥夺,与剥夺前相比,睡眠剥夺大鼠表现出更多的错误反应和过早反应。由此可见,大鼠警觉性表现中各项指标的变化与睡眠剥夺方法相关,且睡眠剥夺时间24 h对警觉性水平的主要指标——平均反应潜伏期无影响。本研究显示跑步机持续睡眠剥夺74 h时,大鼠警觉性表现中的平均反应潜伏期明显升高,警觉水平下降,且在恢复的第1天,警觉性水平得以恢复。尽管与本研究使用的睡眠剥夺方法不同,Deurveilher等[21]研究显示,大鼠通过旋转笼进行为期2 d慢性睡眠限制,其警觉性表现中延长的平均反应潜伏期于睡眠限制后的第1或2天均恢复至剥夺前水平。以上结果表明,睡眠恢复可以使受损的警觉水平得以恢复。
本研究显示五味子木脂素可拮抗跑步机睡眠剥夺所致的大鼠血清中食欲素 A含量的增加。在清醒和睡眠的调节中,食欲素系统被认为是机体的觉醒启动开关,用于维持觉醒的状态和睡眠稳定[22],参与注意力、警觉、学习记忆等多种神经活动的相关调节[11,23]。食欲素能系统可通过增加皮质乙酰胆碱的释放和皮质神经元活动促进注意力处理,在相同的精神运动性警觉任务表现下,食欲素 A分泌水平越高,相应神经元的持续觉醒调节能力越强,警觉性表现越稳定[24]。睡眠剥夺会导致大鼠食欲素神经元活性增强,血清中的食欲素 A水平增加[25]。与本研究结果一致,王忠等[25]研究显示24 h的睡眠剥夺会导致受试对象血清中食欲素 A含量上升,其含量变化与精神运动性警觉任务中的中位反应时间变化呈负相关。倪丽艳等[12]研究显示睡眠剥夺会导致大鼠下丘脑食欲素 A的过度表达,损害其空间学习记忆能力。然而,多数研究支持警觉性水平与觉醒水平呈正相关[26-27]。推测食欲素 A对机体警觉性具有双向调控作用,当机体食欲素 A含量过高时,导致机体处于过度觉醒状态,从而造成9孔选择任务表现受损,警觉性水平降低。
c-Fos蛋白是神经元受到刺激后被激活的一种标志物,可作为神经元激活的标志,与注意力等认知功能有关[28]。研究显示大鼠鼻内食欲素 A给药可上调介导重要认知功能脑区的c-Fos蛋白的表达,增加前额叶皮层的乙酰胆碱外排,改善注意相关认知功能[29]。动物清醒程度与c-Fos蛋白表达水平呈正相关[30]。本研究显示睡眠剥夺会增加PFC的c-Fos蛋白表达,五味子木脂素给药后可激活PFC来逆转这种变化。崔建梅等[31]研究显示睡眠剥夺后前额叶脑区c-Fos的表达增多。相反,Basheer 等[32]研究显示大脑皮层c-Fos表达水平在强制觉醒的6或12 h内保持高水平,但随着剥夺时间的增加而迅速下降。由此可见,睡眠剥夺导致c-Fos表达变化与剥夺时长及外界多种因素有关,在短时间的睡眠剥夺中,大鼠受应激刺激占比较大,随剥夺时间延长,其逐渐适应刺激,导致其表达下降。
食欲素能神经元分泌的食欲素A和食欲素B是促进觉醒的重要中枢兴奋性递质。PFC是与注意力、警觉性和认知功能相关的重要脑区,存在食欲素受体1和食欲素受体2两种受体[33],可接受食欲素神经纤维的投射。本研究显示睡眠剥夺后食欲素受体1表达减少,在给予五味子木脂素后上调。然而,么嵌巍等[34]研究显示小平台水环境睡眠剥夺后,脑组织中食欲素受体1、食欲素受体2表达均上调。造成这种差异性的原因,可能与测定的脑区和睡眠剥夺方法的不同有关。
安非他明、哌甲酯和咖啡因等中枢兴奋药在人类注意力和冲动行为等认知领域被广泛研究,但在提高注意力方面的报道存在诸多矛盾。有研究表明,安非他明可降低平均反应潜伏期,并显著增加提前反应,但对正确反应没有影响[35]。然而,Grottick等[36]研究显示,安非他明可提高正确反应,但对平均反应潜伏期无影响。Bizarro等[37]研究表明,不同剂量的咖啡因对注意力影响不同,小剂量咖啡因可增加正确反应和提前反应,减少平均反应潜伏期和遗漏反应,而大剂量咖啡因反而增加遗漏反应。本研究结果表明,五味子木脂素(67.2 mg/kg)与盐酸托莫西汀作用相似,可减少睡眠剥夺大鼠的遗漏反应和平均反应潜伏期,增加正确反应。盐酸托莫西汀是一种非中枢兴奋药,可用于治疗儿童及青少年的注意缺陷。有研究显示,儿童患者口服盐酸托莫西汀治疗时,可产生体重下降,并伴有腹痛、嗜睡和呕吐等不良反应;成年人常见的不良反应是恶心、失眠、尿潴留和疲劳[38]。
综上,与盐酸托莫西汀相比,五味子木脂素安全性较高,且表现出改善睡眠、抗疲劳等药理作用,五味子木脂素具有开发成为拮抗睡眠剥夺所致的警觉性水平下降药物的潜力。
利益冲突 所有作者声明无利益冲突
作者贡献声明 武亚楠:参与本研究的选题、设计,对数据搜集、分析、解释工作,按编辑部的修改意见进行核修,对拟发表的文稿做最后的审阅和定稿;马青:对数据搜集、分析,对学术问题进行解答;王艳艳:对重要学术性内容做出关键性修订;黄莉莉:参与研究的选题、设计,对学术问题进行解答,同意对研究工作各方面的诚信问题负责
参 考 文 献
[1]熊晓,朱莹莹,陈庆伟,等.室内照度和时间对警觉性和视空绩效的影响[J].心理科学,2018,41(6):1325-1332.DOI:10.16719/j.cnki.1671-6981.20180606.
[2]Helton WS,Matthews G,Warm JS.Stress state mediation between environmental variables and performance:the case of noise and vigilance[J].Acta Psychol (Amst),2009,130(3):204-213.DOI:10.1016/j.actpsy.2008.12.006.
[3]Te Lindert BHW,Van Someren EJW.Skin temperature,sleep,and vigilance[J].Handb Clin Neurol,2018,156:353-365. DOI:10.1016/B978-0-444-63912-7.00021-7.
[4]Beijamini F,Silva AG,Peixoto CA,et al.Influence of gender on psychomotor vigilance task performance by adolescents[J]. Braz J Med Biol Res,2008,41(8):734-738.DOI:10.1590/s0100-879x2008000800016.
[5]赵运浩,罗娴.失眠的流行病学及发病机制研究进展[J].中国临床医生杂志,2023,51(12):1397-1401.DOI:10. 3969/j.issn.2095-8552.2023.12.004.
[6]Karimi M,Eder DN,Eskandari D,et al.Impaired vigilance and increased accident rate in public transport operators is associated with sleep disorders[J].Accid Anal Prev,2013,51(5):208-214.DOI:10.1016/j.aap.2012.11.014.
[7]石彤,傅振寰,王汝州,等.军人疲劳、情绪状态对睡眠质量的影响及睡眠质量与警觉性相关性分析[J].军事医学,2023,47(4):259-263,267.DOI:10.7644/j.issn. 1674-9960.2023.04.004.
[8]Bruinsma B,Terra H,de Kloet SF,et al.An automated home-cage-based 5-choice serial reaction time task for rapid assessment of attention and impulsivity in rats[J].Psychopharmacology (Berl),2019,236(7):2015-2026.DOI:10.1007/s00213-019-05189-0.
[9]Davis CM,Roma PG,Hienz RD,et al.The rodent psychomotor vigilance test (rPVT):a method for assessing neurobehavioral performance in rats and mice[J].J Vis Exp,2016,118(12):54629.DOI:10.3791/54629.
[10]Inutsuka A,Yamanaka A.The physiological role of orexin/hypocretin neurons in the regulation of sleep/wakefulness and neuroendocrine functions[J].Front Endocrinol (Lausanne),2013(4):18.DOI:10.3389/fendo.2013.00018.
[11]Sargin D.The role of the orexin system in stress response[J].Neuropharmacology,2019,154:68-78.DOI:10.1016/j. neuropharm.2018.09.034.
[12]倪丽艳,唐吉友.睡眠剥夺后大鼠下丘脑Orexin-A神经元的表达及其对学习记忆的影响[J].山东第一医科大学(山东省医学科学院)学报,2021,42(5):380-384.DOI:10.3969/j.issn.2097-0005.2021.05.010.
[13]Wesensten NJ.Effects of modafinil on cognitive performance and alertness during sleep deprivation[J].Curr Pharm Des,2006,12(20):2457-2471.DOI:10.2174/138161206777698819.
[14]Urry E,Landolt HP.Adenosine,caffeine,and performance:from cognitive neuroscience of sleep to sleep pharmacogenetics[J].Curr Top Behav Neurosci,2015,25:331-366.DOI:10.1007/7854_2014_274.
[15]Chang Z,Lichtenstein P,Halldner L,et al.Stimulant ADHD medication and risk for substance abuse[J].J Child Psychol Psychiatry,2014,55(8):878-885.DOI:10.1111/jcpp.12164.
[16]国家药典委员会.中国人民共和国药典(一部)[M].北京:中国医药科技出版社,2020.
[17]刘媛媛,黄仕其,李玉泽,等.五味子属植物木脂素类化学成分及其药理作用研究进展[J].中草药,2022,53(6):1903-1918.DOI:10.7501/j.issn.0253-2670.2022.06.034.
[18]李玟玟,王琪,耿一玄,等.五味子木脂素对PCPA睡眠剥夺大鼠睡眠-觉醒及日间功能的影响研究[J].军事医学,2021,45(12):919-923.DOI:10.7644/j.issn.1674-9960.2021.12.008.
[19]Christie MA,McKenna JT,Connolly NP,et al.24 hours of sleep deprivation in the rat increases sleepiness and decreases vigilance:introduction of the rat-psychomotor vigilance task[J]. J Sleep Res,2008,17(4):376-384.DOI:10.1111/j.1365-2869.2008.00698.x.
[20]Oonk M,Davis CJ,Krueger JM,et al.Sleep deprivation and time-on-task performance decrement in the rat psychomotor vigilance task[J].Sleep,2015,38(3):445-451.DOI:10. 5665/sleep.4506.
[21]Deurveilher S,Bush JE,Rusak B,et al.Psychomotor vigilance task performance during and following chronic sleep restriction in rats[J].Sleep,2015,38(4):515-528.DOI:10.5665/sleep.4562.
[22]Sutcliffe JG,de Lecea L.The hypocretins:setting the arousal threshold[J].Nat Rev Neurosci,2002,3(5):339-349.DOI:10.1038/nrn808.
[23]Zamarian L,Hgl B,Delazer M,et al.Authors response to “Deficits of attention and cognition in narcoleptic patients-is it hypocretin dependent?”[J].Sleep Med,2015,16(8):1025.DOI:10.1016/j.sleep.2015.04.005.
[24]苗雯蓉,厚玉姣,石晓静,等.睡眠剥夺对机体认知功能的影响及其简要机制[J].世界睡眠医学杂志,2020,7(5):927-930.DOI:10.3969/j.issn.2095-7130.2020.05.074.
[25]王忠,朱囡囡,陈文浩,等.睡眠剥夺所致的警觉性受损及其可能机制[J].实用医学杂志,2018,34(13):2177-2180,2184.DOI:10.3969/j.issn.1006-5725.2018.13.020.
[26]Mehta R,Khanday MA,Mallick BN.REM sleep loss associated changes in orexin-A levels in discrete brain areas in rats[J].Neurosci Lett,2015,590:62-67.DOI:10.1016/j.neulet.2015.01.067.
[27]Ikeda H,Kubo T,Kuriyama K,et al.Self-awakening improves alertness in the morning and during the day after partial sleep deprivation[J].Sleep Res,2014,23(6):673-680.DOI:10. 1111/jsr.12176.
[28]Léger L,Goutagny R,Sapin E,et al.Noradrenergic neurons expressing Fos during waking and paradoxical sleep deprivation in the rat[J].Chem Neuroana,2009,37(3):149-157.DOI:10.1016/j.jchemneu.2008.12.008.
[29]Calva CB,Fayyaz H,Fadel JR.Effects of intranasal orexin-A (hypocretin-1) administration on neuronal activation,neurochemistry,and attention in aged rats[J].Front Aging Neurosci,2020(11):362.DOI:10.3389/fnagi.2019.00362.
[30]宋国萍,皇甫恩,苗丹民,等.睡眠剥夺及恢复睡眠1小时后大鼠脑干中c-Fos蛋白的表达[J].中国行为医学科学,2002,11(6):15-17.DOI:10.3760/cma.j.issn.1674-6554.2002.06.005.
[31]崔建梅,郭旭玥,药宏慧,等.跑台运动预干预对睡眠剥夺大鼠行为学改变、前额叶皮质氧化应激及c-fos表达的影响[J].西安体育学院学报,2016,33(5):590-599. DOI:10.16063/j.cnki.issn1001-747x.2016.05.016.
[32]Basheer R,Sherin JE,Saper CB,et al.Effects of sleep on wake-induced c-fos expression[J].J Neurosci,1997,17(24):9746-9750.DOI:10.1523/JNEUROSCI.17-24-09746.1997.
[33]闫洁.Orexins对小鼠内侧前额叶皮层神经元的兴奋作用[D].重庆:第三军医大学,2008.DOI:10.7666/d.y1401963.
[34]么嵌巍,张星平,闫德祺,等.肺不藏魄型失眠大鼠相关脏器中食欲素受体表达差异[J].上海中医药杂志,2022,56(1):75-80.DOI:10.16305/j.1007-1334.2022.2108104.
[35]Higgins GA,Grzelak ME,Pond AJ,er al.The effect of caffeine to increase reaction time in the rat during a test of attention is mediated through antagonism of adenosine A2A receptors[J].Behav Brain Res,2007,185(1):32-42.DOI:10. 1016/j.bbr.2007.07.013.
[36]Grottick AJ,Higgins GA.Assessing a vigilance decrement in aged rats:effects of pre-feeding,task manipulation,and psychostimulants[J].Psychopharmacology (Berl),2002,164(1):33-41.DOI:10.1007/s00213-002-1174-3.
[37]Bizarro L,Patel S,Murtagh C,et al.Differential effects of psychomotor stimulants on attentional performance in rats:nicotine,amphetamine,caffeine and methylphenidate[J].Behav Pharmacol,2004,15(3):195-206.DOI:10.1097/01.fbp.0000131574.61491.50.
[38]Wietecha LA,Ruff DD,Allen AJ,et al.Atomoxetine tolerability in pediatric and adult patients receiving different dosing strategies[J].J Clin Psychiatry,2013,74(12):1217-1223. DOI:10.4088/JCP.12m07991.
(收稿日期:2023-11-01)
