四烯类抗真菌抗生素效价测定方法的改进
2024-01-01王立新马步芳张培培姚尚辰宁保明常艳
王立新 马步芳 张培培 姚尚辰 宁保明 常艳
摘要:目的 对四烯类抗真菌抗生素的效价含量测定方法进行改进,提高方法的可靠性与可操作性。方法 管碟法。改进培养基pH 6.0~6.2;pH 6.0磷酸盐缓冲液;检定菌为啤酒酵母菌(ATCC9763);培养温度为30℃±2℃;培养时间为(20±2) h;抗生素浓度范围为10~50 U/mL;可信限率(FL%)为不得大于5%。结果 抑菌圈大小符合规定,边缘清晰可以使用仪器进行测量;制霉菌素、制霉素分别在9.45~56.34 U/mL和8.43~50.23 U/mL浓度范围内线性良好,回归方程分别为y=0.08854x+1.31343(R2= 0.99978)和y=0.10454x+1.28875(R2=0.99843);重现性与重复性好[日内精密度分别为1.95%(n=6)和1.95%(n=6),日间精密度分别为1.83%(n=12)和1.84%(n=12)]。结论 改进方法可以作为四烯类抗真菌抗生素及其制剂的常规质量控制方法。
关键词:四烯类抗真菌抗生素;抗生素微生物检定法;效价测定;制霉菌素;制霉素;不确定度
中图分类号:R917 文献标志码:A
Improvement of microbiological potency measurement of tetraenes
antifungal antibiotics
Wang Lixin, Ma Bufang, Zhang Peipei, Yao Shangchen, Ning Baoming and Chang Yan
(National Institutes for Food and Drug Control, Beijing 102629)
Abstract Objective A potency determination method for tetraene antifungal antibiotics was established to improve the reliability and operability of existing methods. Methods The cylinder plate method with medium (pH 6.0~6.2) and pH 6.0 phosphate buffer was used. The test organism was Saccharomyces cerevisiae (ATCC 9763). Incubation lasted 18~22 hours at the temperature 30℃ ±2℃. The range of test dilution concentration was 10 to 50 U/mL. The fiducial limit (FL%) was not more than 5%. Results The size of circular area (zone) of growth inhibition around the cylinder was moderate and the brim of ones was clear, which can be determined by the measuring instrument. The linearity was achieved over the range of 9.45~56.34 U/mL (y=0.08854x+1.31343, R2=0.99978) and 8.43~50.23 U/mL (y=0.10454x+1.28875, R2=0.99843) for nystatin and nysfungin, respectively. The reproducibility and recovery were acceptable. For nystatin and nysfungin, the relative standard deviation (RSD) of intra-day repeatability was 1.95% (n=6) and 1.95% (n=6) and the RSD of inter-day repeatability was 1.83% (n=12) and 1.84% (n=12), respectively. Conclusion The method has the potential to become the routine quality control method for tetraenes antifungal antibiotics.
Key words Tetraenes antifungal antibiotics; Microbiological assay of antibiotics; Potency determination; Nystatin; Nysfungin; Uncertainty
多烯類抗生素由于结构中含有一系列共轭双键使其具有抗真菌活性,按其中共轭双键可以分为四烯、五烯、六烯和七烯类化合物,临床常用药物包括,四烯类:制霉菌素、制霉素;七烯类两性霉素B等[1]。
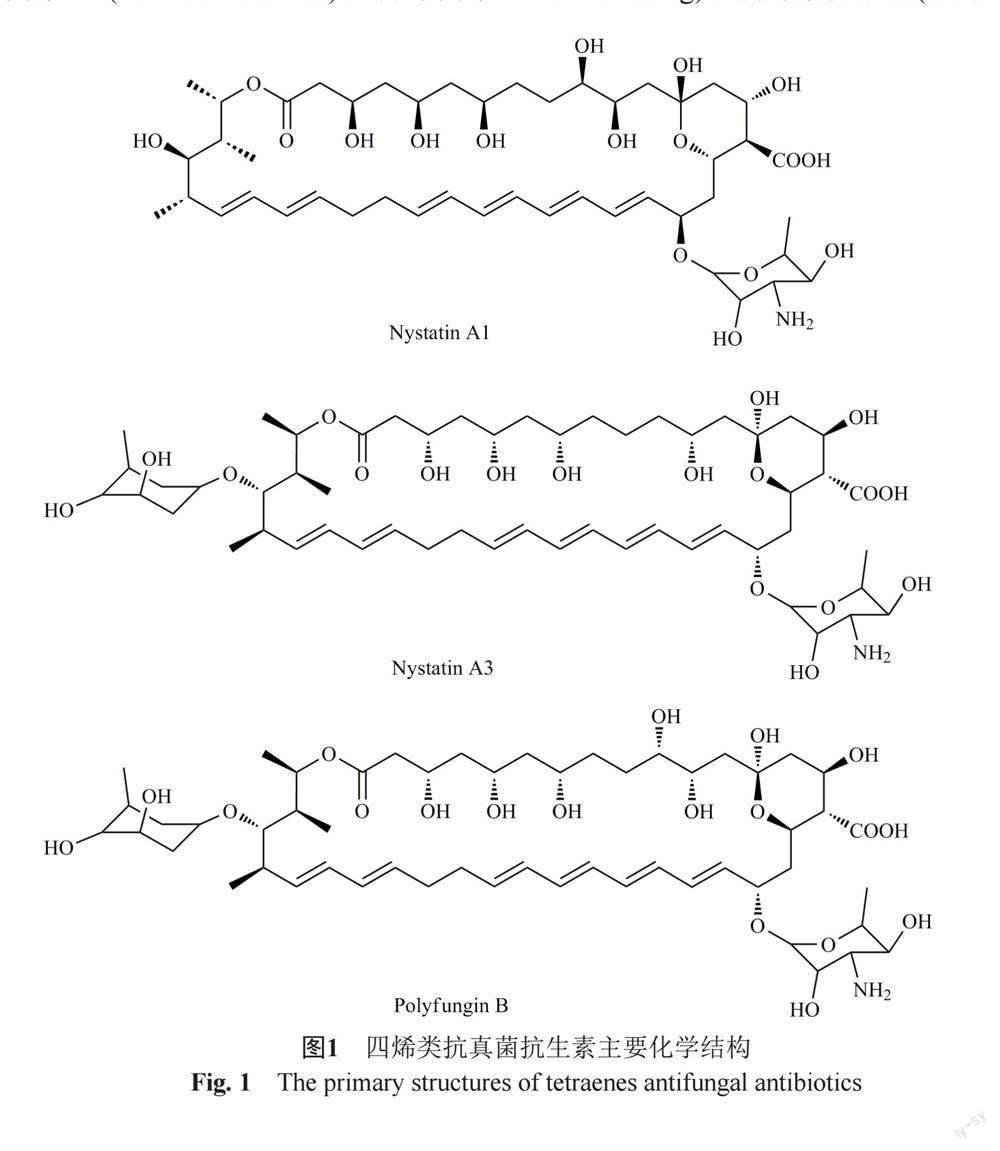
制霉菌素(nystatin)在1950年被Hazen和Brown从土壤微生物Streptomyces noursei的培养物中分离获得[2],该品种被国际药典(IntP)、欧洲药典(EP)、英国药典(BP)、美国药典(USP)和日本药典(JP)所收载,在各国药典中定义该品种为多组分抗生素[3-7],其主要组分为制霉菌素A1(图1)[3-6],组分限度规定:制霉菌素A1不得低于85.0%,其他任一组分不得大于4.0%[4-6]。
制霉素(nysfungin)是从广东土壤中分离的链霉菌Norse actinomycetes的培养物中分离获得[8-9],该品种为中国特有品种,执行部颁标准(WS1-C2-0025-89)。制霉素为多组分抗生素,但其在组分构成上与制霉菌素存在明显差异,其主要组分为制霉菌素A1(2.12%~15.56%)、制霉菌素 A3(27.22%~53.52%)、多真菌素B(19.13%~39.83%)[10](图1)和其他成分[11],目前标准中尚未对各组分的含量限度进行规定。
目前,各国药典[3-7]和部颁标准中均采用抗生素微生物检定法(管碟法)测定四烯类抗真菌抗生素的效价含量。但在实际检验过程中发现,现有各标准中规定的实验条件均存在相同的问题:抑菌圈边缘模糊不清,无法使用抑菌圈测量仪进行测量,严重影响检验结果的准确性。为了改善现有标准中遇到的主要问题,本研究在现有试验条件基础上,对试验菌选择、菌悬液制备、培养基配方、双碟制备方式、菌碟的培养温度和時间等进行优化,建立了针对四烯类抗真菌抗生素效价含量测定的改进方法。
1 仪器与试药
1.1 材料与试剂
制霉菌素标准品(批号130375-201802,效价含量5900 U/mg)、制霉素标准品(批号130344-201703,效价含量5581 U/mg)由中国食品药品检定研究院提供;制霉菌素原料(批号4011010)由罗马尼亚Antibiotice S.A公司提供;制霉素原料(批号01-060-151128)由浙江震元制药有限公司提供。
色谱纯乙腈购自美国Fisher公司;分析纯N,N-二甲基甲酰胺、磷酸二氢钾、磷酸氢二钾、氢氧化钠和醋酸铵购自北京化学试剂公司;现有方法所用培养基按EP中F号培养基配方自制(pH 6.0~6.2)、改进培养基、灭菌缓冲液(pH 6.0)均由中国食品药品检定研究院提供;自制培养基中各配方购自三药技术开发公司;啤酒酵母菌(Saccharomyces cerevisiae)ATCC 9763和ATCC2601购自中国医学细菌保藏中心。
1.2 仪器
Waters e2695液相色谱仪、Waters 2998 Photodiode Array Detector、Empower工作站(美国waters公司);CHB-1抗生素效价测量仪(北京超声技术发展公司);GRP-9270型隔水式恒温培养箱(上海森信实验仪器有限公司)。
2 实验方法
2.1 效价测定方法
照抗生素微生物检定法(中国药典2020年版四部通则1201)测定[12]。现有方法中高、低剂量分别为28和14 U/mL,培养温度为30℃±2℃,培养时间为(20±2) h;改进方法中高、低剂量分别为50和25 U/mL,培养温度为30℃±2℃,培养时间为(20±2) h。培养基、灭菌缓冲液、试验菌均见“仪器与试药”。
2.2 HPLC分析方法[4-6]
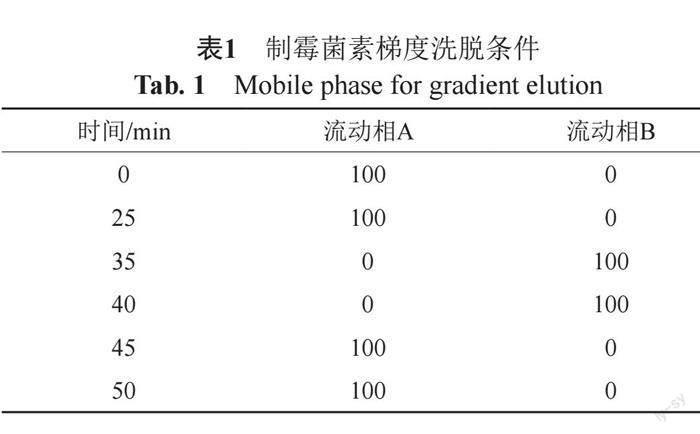
色谱柱:CAPCELL PAK C18(4.6 mm×150 mm, 5 μm);梯度洗脱(表1);流动相A:乙腈:0.05 mol/L(3.85 g/L)醋酸铵(29:71, V/V),流动相B:乙腈:0.05 mol/L(3.85 g/L)醋酸铵(60:40, V/V);流速:1 mL/min;柱温:30℃;检测波长:305 nm; 进样量:20 μL。
3 结果与讨论
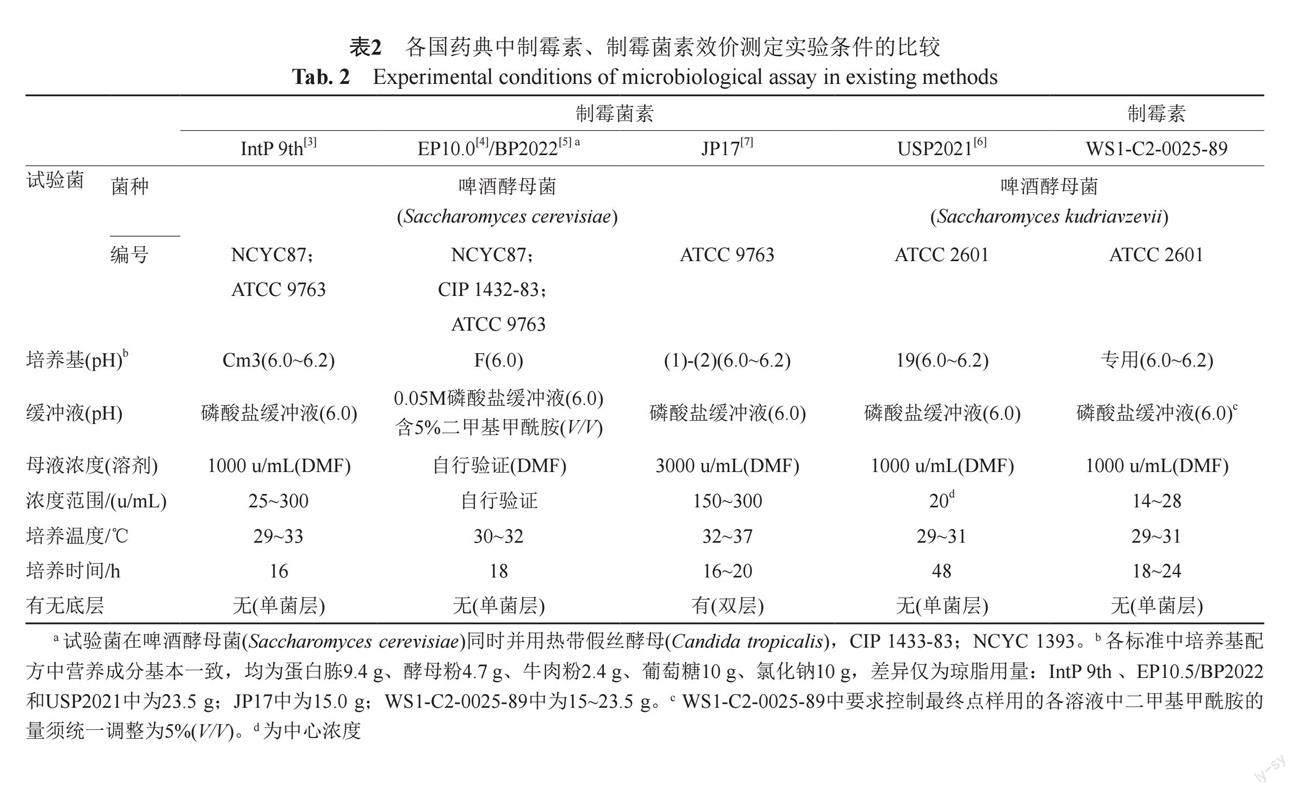
3.1 现有效价测定方法实验条件的比较(表2)
制霉素在研发之初曾一度被认为是“国产制霉菌素”,因此,部颁标准(WS1-C2-0025-89)中的质控项目和实验条件等与当时的USP基本保持一致。故将制霉菌素和制霉素现有质量标准中收载的效价测定实验条件一并比较(表2)。各标准中,相同点:起始母液浓度和溶剂、培养基配方、缓冲液基本一致;不同点:在试验菌、是否为单菌层、培养温度和时间、最终点样溶液的浓度范围上存在较大差异。
由于四烯类(制霉菌素和制霉素)和七烯类(两性霉素B)同属多烯类抗真菌抗生素,基于本实验室早期对两性霉素B的研究基础[13],结合现有试验中遇到的抑菌圈边缘模糊的主要问题,本研究选择试验菌、菌悬液制备、培养基配方、双碟中是否增加底层、菌碟的培养温度和时间等作为优化对象,对改进方法中的实验条件进行逐一确定。
3.2 试验菌的选择
目前各标准中规定的四烯类抗真菌抗生素(制霉菌素和制霉素)效价测定用试验菌分为两个不同的种属,分别为假丝酵母属热带假丝酵母种[4-5]和酵母属酿酒酵母种[3-7],其中酿酒酵母种为各标准中的通用菌,但在具体应用上存在差异,其中:IntP 9th[3]、EP10.0[4]、BP2022[5]和JP17[7]采用Saccharomyces cerevisiae菌种,具体标准菌株(NCYC 87、CIP 1432-83、ATCC9763)分别向英国NCYC(National Collection of Yeast Cultures, AFRC Food Research Institute, Colney Lane, Norwich NR4 7UA, England)、法国CIP(Collection of the Institute Pasteur, Rue du Dr. Roux, Paris 15, France)和美国ATCC(American Type Culture Collection, 10801 University Boulevard, Manassas, Virginia 20110-2209, USA)菌种保藏机构进行溯源;USP2021[6]和部颁(WS1-C2-0025-89)采用Saccharomyces kudriavzevii菌种,具体标准菌株(ATCC2601)向美国ATCC进行溯源。从标准菌株溯源角度,国内ATCC标准菌株最为易得。根据ATCC官方网站提供的资料显示:ATCC9763的染色体组型为多倍体,且较ATCC2601的使用范围广,ATCC2601仅用于制霉菌素和两性霉素B的效价测定,而ATCC 9763除用于制霉菌素和两性霉素B的含量测定外,还用于茴香霉素(anisomycin)、杀假丝菌素(candicidin)、纳他霉素(natamycin)等品种的含量测定。通过试验,在现有条件下ATCC2601和ATCC9763形成的抑菌圈情况并无明显差异,边缘均模糊不清无法使用抑菌圈测量仪进行测量。根据菌株易得性和本实验室前期研究基础,最终选择ATCC9763开展后续研究。
3.3 培养基的选择
培养基为检定菌提供生长所需的营养,因此在抗生素微生物检定法中选用的培养基的成分应包含检定菌生长必需的营养物质[14]。啤酒酵母菌(Saccharomyces cerevisiae)在生长过程中需要充足的碳源及氮源,而最佳碳源和氮源分别是葡萄糖和蛋白胨[15]。基于本实验室早期对两性霉素B的研究基础[13],选择培养基配方:蛋白胨10 g、葡萄糖40 g、氯化钠10 g、琼脂约13 g,加水至1000 mL,调灭菌后pH值为6.0~6.2。采用2种不同培养模式:20 mL底层加5 mL菌层和无底层仅15 mL单菌层,在相同温度和时间下对ATCC 9763进行培养,比较菌株在不同培养模式下的生长状态,ATCC9763在双层条件下的生长状态明显优于单菌层,故选择20 mL底层加5 mL菌层的方式制备双碟开展后续研究。在应用该改进培养基时需注意,因该配方中葡萄糖含量较高,如配制后反复加热融化或多次高压灭菌,培养基的颜色会随加热或高压次数的增加而明显变深,从浅土黄色变至深褐色,可能是其中糖在高温条件下转化为醛所致,而ATCC 9763在颜色变深的培养基中,即便在20 mL底层加5 mL菌层的培养模式下,生长速度和状态都会明显受到抑制。因此,在使用该改进培养基时需临用现制。
3.4 菌悬液的制备
在管碟法中需要使用一定浓度的菌悬液来制备菌层,菌悬液的质量与抑菌圈的边缘清晰度直接相关[14]。各国药典中均对啤酒酵母菌(Saccharomyces cerevisiae)菌悬液的制备作出规定[3-5,7,12],但在具体要求间存在较大差异(表3),主要差异点:培养温度、时间,制备菌悬液的溶剂以及菌悬液是否可以储存使用。为了改善现有抑菌圈边缘模糊的现象,对上述因素进行逐一考察。根据ATCC官网信息,ATCC 9763在30 ℃条件下进行培养。故本研究中选择不同温度(27℃±2℃、30℃±2℃、35℃±2℃)和时间[(24±2) h、(48±2) h、(72±2) h]条件下对ATCC9763在斜面培养物上的生长状态进行观察,并采用不同溶剂(灭菌水和生理鹽水)制备菌悬液,分别在菌悬液制备后的第0、1、3、7、14天按“3.3”中确定的改进培养基制备双碟观察抑菌圈边缘的清晰情况。通过试验观察,在30℃±2℃培养(48±2) h的斜面培养物ATCC9763的菌落形态最为理想,呈现奶油色、光滑扁平并散发出浓郁的啤酒香气;不同溶剂制备的菌悬液所形成的抑菌圈形态并无明显差别;但随菌悬液放置时间的延长抑菌圈边缘明显出现模糊的现象,其中由新制菌悬液(放置0 d)获得的抑菌圈边缘最为清晰,可以满足仪器测量需求。最终确定:将ATCC9763接种于沙氏或YPD斜面上,在30℃±2℃培养(48±2) h,用灭菌水或生理盐水将菌苔洗下置含有灭菌玻璃珠的试管中,振摇均匀(应避免剧烈震荡),该菌悬液需临用现制,当天使用。此外,虽然均使用临用现制的菌悬液,但制霉素形成的抑菌圈边缘仍较制霉菌素形成的抑菌圈边缘模糊,有时甚至出现“双圈”现象,这正是由于制霉素和制霉菌素在组分构成上存在差异所致(图2)。当待测抗生素由多个组分构成时,不同组分可能具有不同的MIC值,各组分形成的抑菌圈直径可能存在差异,各组分共同作用时可能形成多个抑菌圈叠加的现象,致使该多组分抗生素所形成的抑菌圈边缘模糊呈现“双圈”现象,此时更应严格控制试验菌传代和菌悬液的制备操作[14]。
3.5 培养温度和培养时间的选择
按前述“3.2”至“3.4”确定的改进试验条件制备双碟,选择不同温度(30℃±2℃、35℃±2℃)和时间[(17±2) h、(20±2) h、(46±2) h]条件下培养,对菌层生长、抑菌圈形成过程和钢管内剩余抗生素溶液的量进行观察。通过试验观察,在30℃±2℃培养(20±2) h的菌层生长和抑菌圈形成情况最为理想,可以直接使用抑菌圈测量仪进行测定,且在培养终点时各钢管内均有剩余抗生素溶液。35℃±2℃温度条件下菌层的生长较30℃±2℃受到抑制,这与啤酒酵母菌(saccharomyces cerevisiae)自身的生长特性相关。双碟培养(17±2) h时菌层中试验菌呈现的整体状态略薄、颜色较培养(20±2) h明显偏浅,由于ATCC 9763呈现奶油色,菌层颜色偏浅时和培养基的颜色较为接近,不利于仪器测量时对抑菌圈边缘的判断;双碟培养(46±2) h时菌层状态最优,但菌圈边缘较培养(20±2) h明显出现模糊的现象,这可能由于各钢管中的抗生素溶液在培养24 h后逐渐耗尽所致。根据抑菌圈形成的原理:培养基中的试验菌开始生长与钢管中的抗生素溶液向培养基内呈球面状扩散同时发生,当培养到某一时间段,培养基中的两种互动作用达到动态平衡,培养基中形成透明的抑菌圈,在抑菌圈边缘处抗生素的浓度恰好等于此抗生素对于该试验菌的最低抑菌浓度[14]。如果当钢管中的抗生素溶液耗尽后继续培养,随着时间的不断延长,已形成的抑菌圈边缘处的动态平衡将被打破,边缘外的菌将逐渐向圈内生长或抑菌圈内原本受到抑制的试验菌随抗生素浓度的不断下降将逐渐恢复生长,最终呈现出边缘模糊的现象。故最终确定培养温度和时间分别为30℃±2℃和(20±2) h。
3.6 对改进方法的验证
按中国药典2020年版四部通则指导9101分析方法验证指导原则对改进方法进行方法学验证[12]。
3.6.1 线性与范围
取制霉菌素和制霉素标准品(130375-201802批和130344-201703批,效价含量5900 U/mg和5581 U/mg),分别精密称定19.1和18.0 mg,各置于100 mL容量瓶中,加入N,N-二甲基甲酰胺(DMF)溶解并稀释制成约1000 U/mL的母液,再分别精密量取制霉菌素和制霉素母液适量,以pH6.0磷酸盐缓冲液为稀释剂,采用0.8作为剂间比进行9点等比稀释,并确保各溶液中DMF的含量均为5%(V/V),即:制霉菌素各溶液浓度分别为56.34、45.08、36.06、28.85、23.08、18.46、14.77、11.82和9.45 U/mL;制霉素各溶液浓度分别为50.23、40.18、32.15、25.72、20.57、16.46、13.17、10.53和8.43 U/mL。采用改进培养基,按抗生素微生物检定法测定标准曲线,得制霉菌素和制霉素回归方程分别为y=0.08854x+1.31343(R2=0.99978)和y=0.10454x+1.28875(R2=0.99843),即在9.45~56.34 U/mL、8.43~50.23 U/mL的浓度范围内,制霉菌素、制霉素各自浓度的对数剂量和抑菌圈半径的平方值呈直线关系。综上,确定四烯类抗真菌抗生素效价测定的浓度范围为10~50 U/mL。
3.6.2 精密度
对同一批样品的效价含量进行测定,制霉菌素和制霉素日内的相对标准偏差(RSD)为1.95%(n=6)和1.95%(n=6),制霉菌素和制霉素日间的RSD为1.83%(n=12)和1.84%(n=12)。
3.6.3 准确度
对现有方法与改进方法的测定结果进行比较。采用所间协作方式分别对同一批制霉菌素和制霉素样品进行效价测定,采用测量结果的不确定度(即测量的分散性)作为准确度的评价指标,即在两种方法测定结果间无显著性差异时,测量结果的不确定度越小则结果的准确度越高,其中:制霉菌素以JP17中二剂量作为现有方法,由3个协作单位采用现有方法测得34组结果;另外4个协作单位采用改进方法测得51组结果;制霉素以部颁标准(WS1-C2-0025-89)中二剂量作为现有方法,由5个协作单位采用现有方法测得60组结果;另外5个协作单位采用改进方法测得60组结果。测定结果及其不确定度详见表4~5。利用两样本独立t检验对由现有方法和改进方法获得的测定结果间的差异性进行统计分析,制霉菌素和制霉素的统计结果分别为P=0.608>0.05和P=0.097>0.05,即2种方法获得的制霉菌素和制霉素测量结果间均无显著性差异。但现有方法结果的不确定度约是改进方法的3~4倍。根据不确定度评定中的1/3原则,即某一分量的不确定度数值小于最大分量不确定度数值的1/3时,该分量对总不确定度的贡献可以忽略不计的原则[16],由此可以认为改进方法测定结果的分散程度小于现有方法测定结果的分散程度,即改进方法可以明显提高测定结果的准确度。
3.6.4 可信限率(FL%)
分别计算出采用现有方法与改进方法测定结果FL%的平均值(表6),可见改进方法的可信限率更低。因此,将改进方法中的可信限率要求由现有方法中的7%下调为“不得大于5%”。
4 结论
本研究以现有试验中遇到的抑菌圈边缘模糊的主要问题为出发点,从试验菌选择、菌悬液制备、培养基配方、双碟制备方式、各关键环节的培养条件等几个方面入手对现有测定方法进行了改进。改进方法中形成的抑菌圈边缘清晰可以使用抑菌圈测量仪进行测量,可以大大提高测定结果的准确性。通过系统的方法学验证,证明了改进方法的可靠性,该方法可以作为四烯类抗真菌抗生素(制霉菌素和制霉素)原料及其制剂的常规质量控制方法。目前,该方法已作为常规标定方法在制霉素国家标准品的换批标定工作中使用。
参 考 文 献
Gallis H A, Drew R H, Pickard W W. Amphotericin B: 30 year of clinical experience[J]. Rer Infect Dis, 1990, 12(2): 308-329.
Hazen E L, Brown R. Two antifungal agents produced by a soil actinomycete[J]. Science, 1950, 112(2911): 423.
World Health Organization. The International Pharmacopoeia[S/OL]. (9th Ed). Geneva, WHO Press, 2019. http://www.internetpip.com.
The European Pharmacopoeia Commission. The European Pharmacopoeia[S]. (10.0th Ed). Strasbourg: Council of Europe, 2020: 3401-3402.
The British Pharmacopoeia Commission. The British Pharmacopoeia[S/OL]. (2022). London, The Stationary Office, 2022. http://www.internetpip.com.
The United States Pharmacopoeia Commission Inc. The United States Pharmacopeia[S]. (2021). Rockville, Md: the United States Pharmacopeia Convention, Inc, 2021. http://www.internetpip.com.
The Ministry of Health, Labour and Welfare. The Japanese pharmacopoeia[S]. (17th Ed). Tokyo: Society of Japanese Pharmacopoeia, 2011: 1328.
蔡润生, 吴淑云, 沈丽君, 等. 制霉菌素A-94的研究[J]. 科学通报, 1959, (23): 795-796.
蔡润生, 包琴珠, 吴淑云, 等. 从中国南方土壤分离的3种放线菌产生的多烯类抗菌素[J]. 药学学报, 1960, 8(1): 47.
汪素岩, 王健, 孟铮. 制霉素中制霉素A1、A3和多真菌素B含量比例的研究[J]. 中国药事, 1996, 10(1): 41.
孙胜男, 冷霄云, 李怡然, 等. 制霉素中未知成分的结构鉴定及UHPLC法含量测定[J]. 药物分析杂志, 2021, 41(8): 1375-1380.
国家药典委员会. 中华人民共和国药典[S]. (2020年版四部). 北京: 化学工业出版社, 2020: 480-483.
常艳, 胡昌勤. 两性霉素B效价测定方法的改进[J]. 中国抗生素杂志, 2013, 38(6): 434-438.
张治锬.《抗生素药品检验》[M]. 北京: 人民卫生出版社, 1987: 12-18.
周羽中, 张四槐, 谭周进, 等. 酿酒酵母菌培養条件的研究[J]. 现代生物医学进展, 2011, 11(23): 4465-4467.
中国实验室国家认可委员会, 化学分析中不确定度的评价指南[S]. 北京: 中国计量出版社, 2006: 149.
