参附汤提取物经miRNA-1 调控HSP70 表达对心力衰竭模型大鼠线粒体功能的影响
2023-12-29柴树人贾旭锦
柴树人 杨 征 贾旭锦
心力衰竭以心肌收缩力降低、心排出量不足为主要病理改变,是多种心脏疾病的终末阶段,我国成人心力衰竭的发生率大约为0.9%,且随着我国老龄化的加剧发病率逐年升高[1]。线粒体能量代谢障碍、钙稳态失衡、氧化应激损伤等均可导致心力衰竭进展,热休克蛋白70(Heat shock protein 70,HSP70)具有保护心肌细胞线粒体功能[2-3]。微小RNA-1(MicroRNA-1,miRNA-1)具有促进心肌细胞凋亡的作用,而HSP70 属于miRNA-1 的靶基因,在抑制miRNA-1 表达后HSP70 升高,可逆转心肌损伤,减少心肌细胞凋亡[4]。参附汤是治疗心力衰竭的经典方,参附汤提取物人参皂苷Rg1 与去甲乌药碱(HG)均具有明确的强心、抗细胞凋亡作用[5-6]。本研究探讨参附汤提取物HG 联合人参皂苷Rg1 通过miRNA-1调控HSP70 表达对心肌损伤细胞线粒体功能的保护机制。现报道如下。
1 材料与方法
1.1 实验动物 依据n=[(Zα/2+Zβ)*σ/δ]2实验动物样本量计算公式计算本研究所需样本量[7],共分5 组,每组20 只,选取无特定病原体(specific pathogen free,SPF)级SD 大鼠100 只,8~10 周龄,体质量200~240 g,雌雄各半,购自斯贝福(北京)生物技术有限公司[动物许可证号:SCXK(京)2019-0010],均在明暗周期12 h、22~28℃、45%~50%相对湿度环境下,自由饮食,预饲养1 周。所有动物实验均获得天津中医药大学动物伦理委员会的批准(批准号:20220208)。
1.2 主要试剂及仪器 主要试剂:阿霉素(山西普德药业有限公司,批号20220501),HG(去甲乌药碱盐酸盐)(纯度98%,20 mg/瓶,上海远慕生物科技有限公司,批号20220612),人参皂苷Rg1(纯度>98%,20 mg/支,成都曼斯特生物科技有限公司,批号20220521),脑钠肽(Brain natriuretic peptide,BNP)试剂盒(上海酶研生物科技有限公司,批号20220614),HSP70 试剂盒(上海梵态生物科技有限公司,批号20220724)。主要仪器:小动物超声仪(X5彩色多普勒超声成像仪,上海玉研科学仪器有限公司),显微镜(LEXT OLS5100 型,奥林巴斯(中国)有限公司);酶标仪(LD-96A 型,山东莱恩德智能科技有限公司);透射电镜(LVEM 5 型,Quantum Design公司);实时荧光定量聚合酶链式反应(Polymerase chain reaction,PCR)仪(Applied Biosystems 型,赛默飞世尔科技公司)。
1.3 方 法
1.3.1 分组及建模 随机数字表法选取100 只中20只作为正常组,剩余80 只大鼠建立阿霉素诱导的心力衰竭模型大鼠,将阿霉素(4 mg/kg)注射入大鼠腹腔注射,1 次/周,连续6 周[8]。第7、8 周观察大鼠一般情况,在第8 周末使用超声心动图检验建模是否成功,若大鼠心功能指标均较正常组有明显改变则说明心力衰竭模型建立成功。建模成功后分为模型组、HG 组、Rg1 组、HG/Rg1 组,每组各20 只。
1.3.2 给 药
1.3.2.1 HG 制备 20 mg HG 药品中加入200 μL二甲基亚砜,振荡均匀,4 ℃冰箱保存。使用时,15 mL EP 管中加入200 μL HG 溶液,0.9%生理盐水定容至4 mL,即为5 mg/mL 的溶剂。
1.3.2.2 人参皂苷Rg1 制备 20 mg 人参皂苷Rg1药品中加入200 μL 二甲基亚砜,振荡均匀,4 ℃冰箱保存。使用时,15 mL EP 管中加入200 μL 人参皂苷Rg1 溶液,0.9%生理盐水定容至4 mL,即为5 mg/mL的溶剂。
1.3.2.3 给药方法 HG 组、Rg1 组分别于左侧大腿股骨沟处注射5 mg/kg HG、人参皂苷Rg1,HG/Rg1组左侧大腿股骨沟联合注射HG、人参皂苷Rg1,正常组、模型组注射等剂量的生理盐水。每天1 次,连续4 周。
1.4 观察指标
1.4.1 心功能测定 使用小动物超声仪测定大鼠心功能,包括左心室收缩末期内径(left ventricular end-systolic diameter,LVESD)、左心室舒张末期内径(left ventricular end-diastolic diameter,LVEDD)、左室射血分数(left ventricular ejection fraction,EF)、左心室短轴缩短率(left ventricular short-axis shortening rate,FS)。
1.4.2 BNP 测定 采集大鼠腹主动脉血,分离血清后使用BNP 检测试剂盒测定BNP 水平。
1.4.3 心肌组织采集 给药结束后次日,使用40 mg/kg 的戊巴比妥钠麻醉后脱颈处死大鼠,迅速取心肌组织,冷冻保存后备用。
1.4.4 心肌病理组织学观察 取心肌组织,在甲醛中固定后脱水、透明、包埋、切5 μm 的薄片后行苏木素-伊红(HE)染色,使用显微镜观察心肌组织病理改变情况。
1.4.5 心肌组织HSP70 测定 取心肌组织,制备为组织匀浆后,使用HSP70 检测试剂盒测定心肌组织中HSP70 表达水平。
1.4.6 线粒体功能指标测定 取心肌组织,裂解获得心肌细胞后使用酶标仪测定线粒体功能指标三磷酸腺苷(adenosine triphosphate,ATP)、活性氧(reactive oxygen species,ROS)、线粒体膜电位(mitochondrial membrane potential,MMP)。
1.4.7 线粒体超微结构观察 取心肌组织,固定24 h后脱水、包埋、超薄切片,采用饱和醋酸铀和枸橼酸铅分步染色,各5~10 min,将制作好的超薄切片放在透射电镜下进行观察。
1.4.8 心肌组织miRNA-1 测定 使用实时荧光定量PCR 法测定心肌组织miRNA-1 表达量,提取并测定组织总RNA,反转录,以反转录产物为反应模板,做PCR 扩增,扩增体系:0.4 μL miRNA-1 上游引物、0.4 μL miRNA-1 下游引物、1 μL cDNA 模板、10 μL SYB Green,加蒸馏水至20 μL。扩增条件:94 ℃预变性1 min、55 ℃1 min、72 ℃1 min,72 ℃延申5 min,40 个循环,采用2-△△Ct方法计算miRNA-1表达量。miRNA-1 上游引物序列:5'-CTGTGGAATGTAAAGAAGTATGTAT-3',下游引物序列:5'-CGAGGAAGAAGACGGAAGAAT-3';内参GAPDH 上游引物序列:5'-AATGCATCCTGCCACCAACTGC-3',下游引物序列:5'-CCAGGCCATGTAGTAGGCCATGAGGTC-3',引物序列合成由上海生工生物工程技术服务有限公司完成。
1.5 统计学方法 应用SPSS 24.0 软件处理。符合正态分布的计量资料以均数±标准差(±s)表示,多组间比较单因素方差分析(ANOVA),两两对比采用LSD-t 检验;不符合正态分布的计量资料以中位数、四分位间距[M(Q1,Q3)]表示,组间采用Wilcoxon 比较。P<0.05 为差异具有统计学意义。
2 结 果
2.1 心力衰竭模型验证 心力衰竭模型大鼠心功能参数较正常组明显改变(P<0.05),说明心力衰竭模型建立成功。见表1。
表1 正常组、心力衰竭组大鼠心功能参数比较(±s)

表1 正常组、心力衰竭组大鼠心功能参数比较(±s)
注:LVESD 为左心室收缩末期内径;LVEDD 为左心室舒张末期内径;EF 为左室射血分数;FS 为左心室短轴缩短率;与正常组比较,aP<0.05
组别正常组心力衰竭组鼠数20 80 LVESD(mm)3.12±0.78 7.86±0.12a LVEDD(mm)6.10±1.12 11.80±0.31a EF(%)87.68±7.98 56.89±3.42a FS(%)50.98±4.53 25.64±2.12a
2.2 各组大鼠给药后心功能参数比较 与正常组比较,模型组LVESD、LVEDD 升高,EF、FS 降低(P<0.05);与模型组比较,HG 组、Rg1 组、HG/Rg1 组LVESD、LVEDD 降低,EF、FS 升高(P<0.05);与HG组、Rg1 组比较,HG/Rg1 组LVESD、LVEDD 降低,EF、FS 升高(P<0.05)。HG 组、Rg1 组心功能参数比较,差异无统计学意义(P>0.05)。见表2。
表2 各组大鼠给药后心功能参数比较(±s)
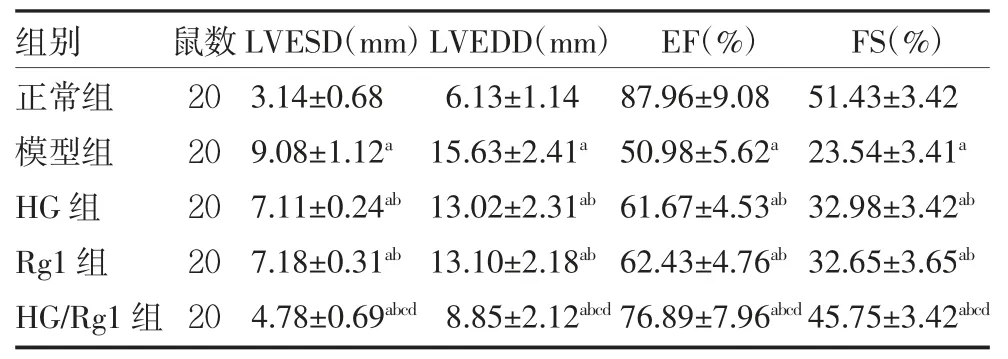
表2 各组大鼠给药后心功能参数比较(±s)
注:HG 组、Rg1 组分别于左侧大腿股骨沟处注射5 mg/kg 去甲乌药碱、5 mg/kg 人参皂苷Rg1;HG/Rg1 组左侧大腿股骨沟联合注射去甲乌药碱、人参皂苷Rg1;正常组、模型组注射等剂量的生理盐水;LVESD 为左心室收缩末期内径;LVEDD 为左心室舒张末期内径;EF 为左室射血分数;FS 为左心室短轴缩短率;与正常组比较,aP<0.05;与模型组比较,bP<0.05;与HG 组比较,cP<0.05;与Rg1 组比较,dP<0.05
组别正常组模型组HG 组Rg1 组HG/Rg1 组鼠数20 20 20 20 20 LVESD(mm)3.14±0.68 9.08±1.12a 7.11±0.24ab 7.18±0.31ab 4.78±0.69abcd LVEDD(mm)6.13±1.14 15.63±2.41a 13.02±2.31ab 13.10±2.18ab 8.85±2.12abcd EF(%)87.96±9.08 50.98±5.62a 61.67±4.53ab 62.43±4.76ab 76.89±7.96abcd FS(%)51.43±3.42 23.54±3.41a 32.98±3.42ab 32.65±3.65ab 45.75±3.42abcd
2.3 各组大鼠给药后BNP 比较 与正常组比较,模型组BNP 升高(P<0.05);与模型组比较,HG 组、Rg1组、HG/Rg1 组BNP 降低(P<0.05);与HG 组、Rg1 组比较,HG/Rg1 组BNP 降低(P<0.05)。HG 组、Rg1 组BNP 比较,差异无统计学意义(P>0.05)。见表3。
表3 各组大鼠给药后BNP 比较(ng/mL,±s)

表3 各组大鼠给药后BNP 比较(ng/mL,±s)
注:HG 组、Rg1 组分别于左侧大腿股骨沟处注射5 mg/kg 去甲乌药碱、5 mg/kg 人参皂苷Rg1;HG/Rg1 组左侧大腿股骨沟联合注射去甲乌药碱、人参皂苷Rg1;正常组、模型组注射等剂量的生理盐水;BNP为脑钠肽;与正常组比较,aP<0.05;与模型组比较,bP<0.05;与HG 组比较,cP<0.05;与Rg1 组比较,dP<0.05
组别正常组模型组HG 组Rg1 组HG/Rg1 组鼠数20 20 20 20 20 BNP 33.12±3.21 77.89±4.52a 70.42±4.52ab 70.83±6.12ab 43.32±4.86abcd
2.4 各组大鼠给药后心肌病理组织学观察 正常组心肌形态正常,无病理改变,心肌纤维排列有序。模型组心肌纤维断裂、疏松,甚至消失,心肌细胞变性、肿大,部分心肌纤维消失。HG 组、Rg1 组、HG/Rg1 组心肌细胞改变较模型组明显被修复,心肌纤维有少量断裂,以HG/Rg1 组修复更显著。见图1。

图1 心肌病理组织学HE 观察图(200×)
2.5 各组大鼠给药后线粒体功能指标比较 与正常组比较,模型组ATP、MMP 降低,ROS 升高(P<0.05);与模型组比较,HG 组、Rg1 组、HG/Rg1 组ATP、MMP升高,ROS 降低(P<0.05);与HG 组、Rg1 组比较,HG/Rg1 组ATP、MMP 升高,ROS 降低(P<0.05)。HG 组、Rg1 组线粒体功能指标比较,差异无统计学意义(P>0.05)。见表4。
表4 各组大鼠给药后线粒体功能指标比较(±s)
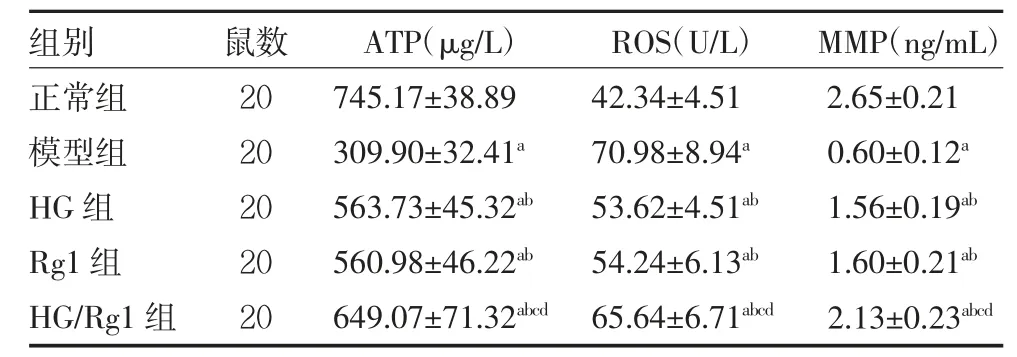
表4 各组大鼠给药后线粒体功能指标比较(±s)
注:HG 组、Rg1 组分别于左侧大腿股骨沟处注射5 mg/kg 去甲乌药碱、人参皂苷Rg1;HG/Rg1 组左侧大腿股骨沟联合注射去甲乌药碱、人参皂苷Rg1;正常组、模型组注射等剂量的生理盐水;ATP 为三磷酸腺苷;ROS 为活性氧;MMP 为线粒体膜电位;与正常组比较,aP<0.05;与模型组比较,bP<0.05;与HG 组比较,cP<0.05;与Rg1 组比较,dP<0.05
组别正常组模型组HG 组Rg1 组HG/Rg1 组鼠数20 20 20 20 20 ATP(μg/L)745.17±38.89 309.90±32.41a 563.73±45.32ab 560.98±46.22ab 649.07±71.32abcd ROS(U/L)42.34±4.51 70.98±8.94a 53.62±4.51ab 54.24±6.13ab 65.64±6.71abcd MMP(ng/mL)2.65±0.21 0.60±0.12a 1.56±0.19ab 1.60±0.21ab 2.13±0.23abcd
2.6 各组大鼠给药后线粒体超微结构观察 正常组大鼠心肌线粒体体积匀称,大小均衡,排列较规则,有完整的线粒体嵴、线粒体膜,明暗带清晰可见。模型组大鼠心肌线粒体体积、大小不一,线粒体肿胀肥大,线粒体嵴断裂溶解,线粒体膜缺失,肌纤维排列紊乱甚至缺失。HG 组、Rg1 组、HG/Rg1 组线粒体结构较模型组明显被修复,线粒体体积增大,以HG/Rg1 组修复更显著。见图2。

图2 大鼠线粒体超微结构电镜观察图(15000×)
2.7 各组大鼠给药后HSP70、miRNA-1 表达比较与正常组比较,模型组HSP70 降低,miRNA-1 升高(P<0.05);与模型组比较,HG 组、Rg1 组、HG/Rg1 组HSP70 升高,miRNA-1 降低(P<0.05);与HG 组、Rg1组比较,HG/Rg1 组HSP70 升高,miRNA-1 降低(P<0.05)。HG 组、Rg1 组HSP70、miRNA-1 表达水平比较,差异无统计学意义(P>0.05)。见表5。
表5 各组大鼠给药后HSP70、miRNA-1 表达比较(±s)
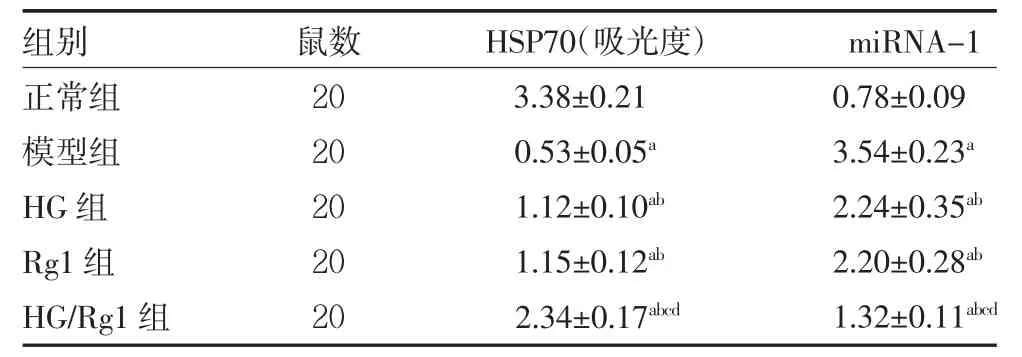
表5 各组大鼠给药后HSP70、miRNA-1 表达比较(±s)
注:HG 组、Rg1 组分别于左侧大腿股骨沟处注射5 mg/kg 去甲乌药碱、人参皂苷Rg1;HG/Rg1 组左侧大腿股骨沟联合注射去甲乌药碱、人参皂苷Rg1;正常组、模型组注射等剂量的生理盐水;HSP70 为热休克蛋白70;miRNA-1 为微小RNA-1;与正常组比较,aP<0.05;与模型组比较,bP<0.05;与HG 组比较,cP<0.05;与Rg1 组比较,dP<0.05
组别正常组模型组HG 组Rg1 组HG/Rg1 组鼠数20 20 20 20 20 HSP70(吸光度)3.38±0.21 0.53±0.05a 1.12±0.10ab 1.15±0.12ab 2.34±0.17abcd miRNA-1 0.78±0.09 3.54±0.23a 2.24±0.35ab 2.20±0.28ab 1.32±0.11abcd
3 讨 论
心肌线粒体是为心脏提供ATP 的细胞器,在心力衰竭中心肌细胞凋亡、心肌氧化应激等病理改变均与线粒体功能有关[9]。目前虽然多种药物已经用于心力衰竭的治疗,但由于药物自身毒性、心力衰竭病因的多样性,临床应用具有一定局限。
中医认为心力衰竭本虚标实、虚实夹杂,治疗应以益气温阳为主,参附汤作为益气温阳的常用方剂,具有改善心室重构、促进心功能恢复的作用[10]。现代药理研究表明,人参皂苷类具有强心、提高射血分数、改善心室重构、改变血流动力学的作用,主要通过调控磷脂酰肌醇3-激酶/蛋白激酶B/内皮一氧化氮合酶信号转导通路,抑制心肌细胞凋亡,影响肌质网、线粒体等的钙交流,介导心肌细胞内线粒体膜电位,从而达到改善心力衰竭的目的[11-13]。HG 是从附子中分离出的有效强心成分,目前研究已经发现,其在心血管方面具有多重作用,如抑制心肌细胞凋亡、增强心力衰竭细胞活性、舒张血管、减轻心肌缺血再灌注损伤等,主要经磷脂酰肌醇3-激酶/蛋白激酶B 信号通路,作用于线粒体依赖性细胞凋亡相关细胞色素C 释放和Bax 活性而发挥抗心肌细胞凋亡,从而改善心力衰竭[14-15]。在本研究中,将参附汤提取物HG、人参皂苷Rg1 用于心力衰竭大鼠模型中,结果显示,在给药后心力衰竭大鼠心功能均得到明显改善,心肌损伤明显被修复,且与HG、人参皂苷Rg1 单独给药相比,两者联合作用更强,此结果说明,HG、人参皂苷Rg1 配伍更能充分发挥强心作用。
心肌能量代谢异常可诱发心力衰竭,ATP 属于心肌细胞线粒体的主要能量物质来源,而ROS 作用与ATP 相反,ROS 增加可导致心肌氧化损伤、心肌细胞凋亡[16-17]。心力衰竭发生后,大量的脂肪酸堆积至心肌细胞中,线粒体内膜解偶联蛋白生成增加,导致线粒体通透性转孔持续开放,ROS 快速分泌,ROS经破坏DNA 抑制ATP 生成,此时表现为ROS 含量增加,ATP、MMP 降低[18]。进一步分析HG、人参皂苷Rg1 对心力衰竭大鼠线粒体功能的影响,结果显示,使用HG、人参皂苷Rg1 联合干预的大鼠心肌线粒体结构改变明显被修复,且ATP、MMP 增加,ROS 降低,提示HG、人参皂苷Rg1 可能经改善线粒体功能障碍发挥抗心力衰竭的作用。
报道发现,在心力衰竭线粒体功能障碍发生过程中涉及多个分子机制,HSP70 作为热休克蛋白,在心力衰竭中属于一种保护性反应机制,可维持钙离子动态平衡,保护心肌细胞,减少钙离子减少介导的心肌多位点损伤,同时经修复细胞质、核糖体、DNA、RNA 合成损伤,恢复Na-K-ATP 酶活性[19-21]。而HSP70在心力衰竭中的保护作用受短链非编码RNA 家族的影响,miRNA-1 在转录后经调节钙离子通道、心脏电活动相关蛋白质诱导心肌细胞凋亡,而作为HSP70 的下游靶基因,miRNA-1 表达升高抑制HSP70 诱导心肌线粒体自噬,加重心肌损伤[22-23]。在本研究中,进一步分析HG、人参皂苷Rg1 改变心力衰竭大鼠线粒体障碍的途径,结果发现,HSP70 在使用HG、人参皂苷Rg1 干预的心力衰竭大鼠中表达升高,而miRNA-1 表达降低,此结果提示着参附汤提取物HG 联合人参皂苷Rg1 可能经抑制miRNA-1上调HSP70 而维护线粒体结构和功能不受破坏,从而保护心肌细胞。
综上所述,参附汤提取物HG 联合人参皂苷Rg1具有调节阿霉素致大鼠心力衰竭心肌细胞线粒体功能的作用,其可能经抑制miRNA-1 上调HSP70 而维护线粒体结构和功能不受破坏,从而保护心肌细胞。
