阿魏酸钠阻断NF-κB 降低NALP3 诱导的矽肺成纤维细胞增殖
2023-12-29韩静茵王淑娟贾仰民干晓瑜
韩静茵 王淑娟 贾仰民 干晓瑜
矽肺是尘肺病中危害最为严重的一种类型,由于长期吸入游离的二氧化硅(SiO2)粉尘引起的肺组织弥漫性间质纤维化,导致肺功能严重受损和呼吸困难的肺部疾病[1]。矽肺的重要病理学改变是肺成纤维细胞大量增殖,且成纤维细胞中基质金属蛋白酶2(MMP2)和基质金属蛋白酶9(MMP9)表达量相比正常成纤维细胞增多,说明SiO2促进了肺成纤维细胞的增殖。动物实验证明,阿魏酸钠(SF)可作用于核苷酸结合寡聚化结构域样受体3(NALP3)/转化生长因子β1(TGF-β1)/平滑肌肌动蛋白α(α-SMA)通路,抑制矽肺模型小鼠成纤维细胞增殖,从而缓解矽肺病肺损伤和纤维化[2],而核因子κB(NF-κB)激活能够诱导NALP3 表达,可见全身抑制NF-κB 的活化能够降低SiO2诱导的肺损伤[3-4]。有研究证明,NALP3炎症小体是通过NF-κB 途径合成胶原蛋白所必需的[5]。本研究旨在探讨SF 对成纤维细胞的作用机制及为矽肺防治提供分子学依据。
1 实验材料
1.1 实验动物 SPF 级雄性C57BL/6 小鼠(4~5 周龄)3 只,饲养在温度22 ℃、湿度55%、12 h 明暗交替的房间中。所有小鼠可以自由饮水和取食。小鼠统一购买自杭州医学院[生产许可证编号:SCXK(浙)2019-0002]。本研究得到浙江百越生物科技有限公司实验动物福利伦理委员会的批准(审查编号:ZJBYLA-IACUC-20211125)。
1.2 实验材料 小鼠饲料(批号2017041021,北京科澳协力饲料有限公司,中国);MTT 细胞活力检测试 剂 盒(V13154,Thermo Fisher Scientific,USA);Cell-Light EdU Apollo488 体外试剂盒(C10310-3,广州锐博生物有限公司,中国);白介素1β(IL-1β)酶联免疫吸附试验(ELISA)检测试剂盒(PI301,碧云天生物有限公司,中国);半胱氨酸天冬氨酸特异性蛋 白 酶-1 (Caspase -1)ELISA 检 测 试 剂 盒(MBS282353,艾美捷科技有限公司,中国);TRIzol 试剂(12183555,Thermo Fisher Scientific,USA);RIPA蛋白裂解液(R0278,Sigma-Aldrich,USA);BCA 试剂盒(55R-1544,Fitzgerald,USA);Lipofectamine3000 转染试剂(L3000001,Thermo Fisher Scientific,USA);聚偏氟乙烯(PVDF)膜(24937,Sigma-Aldrich,中国);实验所用抗体均由Abcam 公司(USA)提供:核转录因子p65(p65)(ab32536,65kDa)、抑制因子κB(IkB)(ab32518,35kDa)、NALP3(ab263899,118kDa)、胶原蛋白-1(collagen-1)(ab260043,139kDa)、α-SMA(ab5694,42kDa)、GAPDH(ab8245,36kDa)、山羊抗兔二抗(ab6721)、兔抗鼠二抗(ab6728)。
1.3 实验仪器 电子称(BSA124S,赛多利斯科学仪器北京有限公司,中国);高速智能梯度PCR 仪(Sure-Cycler 8800,Agilent Technologies,USA);荧光显微镜(PA53 FS6,Motic China Group co.,ltd,中国)。
2 实验方法
2.1 矽肺模型的建立和成纤维细胞处理 3 只小鼠一次性灌注50 g/L 生理盐水稀释的SiO2混悬液以建立矽肺小鼠模型。所有小鼠饲养4 周后采用1%戊巴比妥钠腹腔麻醉,颈椎脱位处死小鼠。收集肺纤维组织并提取肺纤维细胞进行原代培养。肺组织块经胰蛋白酶消化,在此过程中随时吸取少量消化液,在显微镜下观察是否有分散的细胞团或单个细胞,若有则终止消化,并将消化的细胞离心后弃上清液,加入含有10%血清的培养基中培养,经过反复吹打摇匀后制成细胞悬液。在无菌条件下将长满整个培养瓶的细胞反复清洗,再加入0.3%胰蛋白酶消化。显微镜观察细胞形态由回缩变为圆形后,传代培养至3代的细胞用于后续实验。
2.2 细胞分组 (1)将成纤维细胞分为Control 组、0.1 mg/mL 组和0.28 mg/mL 组(细胞分别经0、0.1 和0.28 mg/mL SF 处理48 h)。(2)将成纤维细胞分为Control 组(细胞正常培养),SF 组(细胞经过0.28 mg/mL SF 处理48 h),NF-κB 激活剂(Prostratin)组(细胞经过100 nmol 的Prostratin 处理48 h),SF+Prostratin 组(细胞经0.28 mg/mL SF 和100 nmol Prostatin 联合处理48 h)。(3)将成纤维细胞分成Normal 组(成纤维细胞正常培养),shNALP3 组(细胞转染NALP3 敲减质粒),shNC 组(细胞转染NALP3 的阴性对照),Prostratin 组(细胞经过100 nmol Prostratin 处理48 h),Prostratin+shNALP3 组(细胞转染NALP3 敲减质粒并经100 nmol 的Prostratin 处理48 h),Prostratin+shNC 组(细胞转染NALP3 阴性对照并经100 nmol Prostratin 处理48 h)。
2.3 细胞转染 NALP3 敲减质粒(shNALP3)及阴性对照(shNC)由生工生物工程(上海)有限公司合成。复苏后常规培养的细胞按照3×105/孔的数量接种于6 孔板,置于37 ℃二氧化碳培养箱中过夜。将无血清培养基稀释后的质粒与Lipofectamine3000 转染试剂混合,随后加入无血清培养的细胞中进行转染。
2.4 细胞活力和增殖检测 根据MTT 试剂盒说明,细胞在96 孔板中培养48h 后,将20μL 浓度为2mg/mL的MTT 试剂加入平板孔中。37 ℃孵育2 h 后,完全抽吸含MTT 试剂的培养基并烘干孔。每孔加入100 μL DMSO 溶解形成的甲醛晶体,在酶标仪570 nm 处记录吸光度。计算细胞存活率,数值以百分比表示。
根据Cell-Light EdU Apollo488 体外试剂盒说明,细胞接种于96 孔板,每孔5×103个细胞。将EdU溶液稀释到细胞培养基中,稀释比例为1∶1000,取稀释后的EdU(浓度:50 μmol/L)注入平板,每孔100 μL。孵育2 h,固定后,用染色反应液和Hoechst 33342 溶液处理细胞。使用荧光显微镜检测结果。
2.5 ELISA 首先按照说明书配制溶液,然后将标准品和样品稀释,并设置标准品孔和待测样品孔,分别加入标准品和待测样本。板覆盖膜,在37 ℃培养90 min。洗涤后,加入相应抗体与生物素化的孵化工作液在37 ℃下孵育60 min。将酶标抗体工作液加入培养板后置于37 ℃孵育30 min。酶标板洗涤4 次后,每个反应孔添加100 μL 彩色显影剂,在37 ℃避光的孵化器中孵育20 min。最后,每孔添加100 μL 终止液,混合后用酶标仪在波长450 nm 处测量吸光度。
2.6 实时荧光定量聚合酶链反应实验(QRT-PCR)使用TRIzol 试剂从细胞中提取总RNA。利用纳米滴分光光度计检测总RNA 的浓度和纯度。当A260/A280 比值在1.8~2.0 之间时,用反转录试剂盒将RNA 反转录为cDNA,并在-20 ℃保存备用。以cDNA为模板进行PCR 扩增。NALP3 的上游引物序列为5'-GCAAGTCAGACTGGAACTACTGA-3',下游引物序列为5'-GTACAGGCAGTAGAACAGTTCCA-3'。内参使用甘油醛-3-磷酸脱氢酶(GAPDH),采用2-ΔΔCT方法计算NALP3 的相对表达量。
2.7 蛋白质印迹实验(Western blot) 将处理过的细胞加入RIPA 蛋白裂解液,置于冰上充分裂解。12000 r/min,4 ℃离心10 min,收集上清。采用BCA法测定蛋白含量。蛋白质经10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,电移至PVDF膜,并用5%脱脂牛奶在室温下密封。用三羟甲基氨基甲烷缓冲液(TBST)冲洗膜后,一抗4 ℃孵育12 h。再次使用TBST 洗净膜后,加入辣根过氧化物酶(HRP)标记的二抗,室温孵育。冲洗膜后,加入ECL发光液进行显影,凝胶成像系统拍照,用ImageJ 软件分析蛋白条带的灰度值。
2.8 统计学方法 应用SPSS 21.0 软件进行统计学分析,符合正态分布的计量资料以均数±标准差(±s)表示,各组数据的差异比较采用单因素方差分析和邦弗朗尼(Bonferroni)事后检验法分析;计数资料均以百分数(%)的形式表示,组间比较采用χ2检验。以P<0.05 为差异具有统计学意义。
3 结 果
3.1 NF-κB 通路参与SF 调控的矽肺小鼠成纤维细胞增殖 采用Western blot 检测经SF 处理的矽肺小鼠纤维细胞中p65、IkB、NALP3、collagen-1 和α-SMA 蛋白表达量。如图1 和表1 所示,0.28 mg/mL 的SF 抑制p65、IkB、NALP3、collagen-1 和α-SMA 蛋白的表达(P<0.05)。后续采用Prostratin 处理矽肺小鼠成纤维细胞。MTT、EdU 和ELISA 检测结果显示,与Control 组比较,SF 组细胞的活力和增殖被抑制,Caspase-1 和IL-1β 活性降低,Prostratin 组结果相反;和SF 组比较,SF+Prostratin 组的细胞活力、增殖、Caspase-1 和IL-1β 活性显著升高(P<0.05),见表2。Western blot 实验结果显示,和Control 组比较,SF 组细胞中p65、IkB、NALP3、collagen-1 和α-SMA 蛋白的表达被抑制,Prostratin 组的上述蛋白表达水平上调;进一步和SF 组比较,SF+Prostratin 组细胞中p65、IkB、NALP3、collagen-1 和α-SMA 蛋白水平显著上调(P<0.05),见图2、表3。
表1 各组细胞的相对蛋白表达量(±s)

表1 各组细胞的相对蛋白表达量(±s)
注:Control 组、0.1 mg/mL 组和0.28 mg/mL 组细胞分别经过浓度为0、0.1 和0.28 mg/mL 的阿魏酸钠处理48 h;p65 为核转录因子p65;IkB 为抑制因子κB;NALP3 为核苷酸结合寡聚化结构域样受体3;collagen-1 为胶原蛋白-1;α-SMA 为平滑肌肌动蛋白α;与Control 组比较,aP<0.05
组别Control 组0.1 mg/mL 组0.28 mg/mL 组实验次数333 p65 1.00±0.08 0.80±0.06a 0.51±0.04a IkB 1.00±0.09 0.81±0.06a 0.46±0.04a NALP3 1.00±0.08 0.86±0.06 0.54±0.05a collagen-1 1.00±0.09 0.77±0.06a 0.49±0.04a α-SMA 1.00±0.08 0.92±0.08 0.62±0.05a
表2 各组细胞的活力、增殖和细胞因子含量(±s)
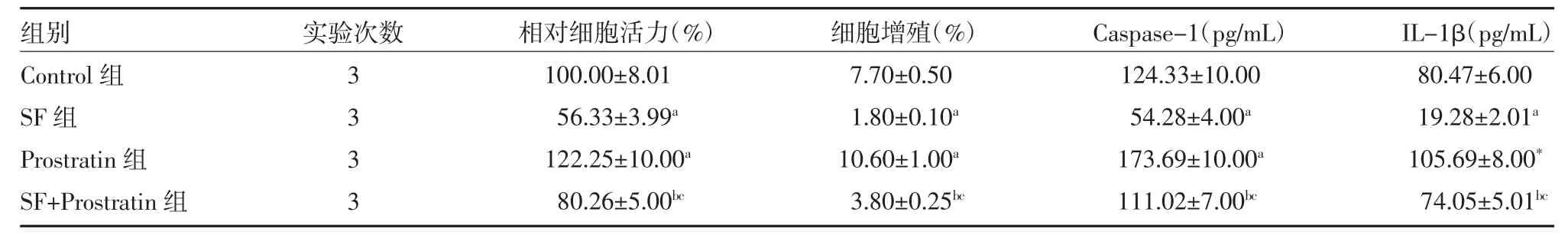
表2 各组细胞的活力、增殖和细胞因子含量(±s)
注:Control 组细胞正常培养;SF 组细胞给予0.28 mg/mL 阿魏酸钠处理48 h;Prostratin 组细胞给予100 nmol Prostratin 处理48 h;SF+Prostratin组细胞给予0.28 mg/mL 阿魏酸钠和100 nmoL Prostatin 联合处理48 h;Caspase-1 为半胱氨酸天冬氨酸特异性蛋白酶-1;IL-1β 为白介素1β;与Control 组比较,aP<0.05;与Prostratin 组比较,bP<0.05;与SF 组比较,cP<0.05
组别Control 组SF 组Prostratin 组SF+Prostratin 组实验次数3333相对细胞活力(%)100.00±8.01 56.33±3.99a 122.25±10.00a 80.26±5.00bc细胞增殖(%)7.70±0.50 1.80±0.10a 10.60±1.00a 3.80±0.25bc Caspase-1(pg/mL)124.33±10.00 54.28±4.00a 173.69±10.00a 111.02±7.00bc IL-1β(pg/mL)80.47±6.00 19.28±2.01a 105.69±8.00*74.05±5.01bc
表3 各组的相对蛋白表达量(±s)
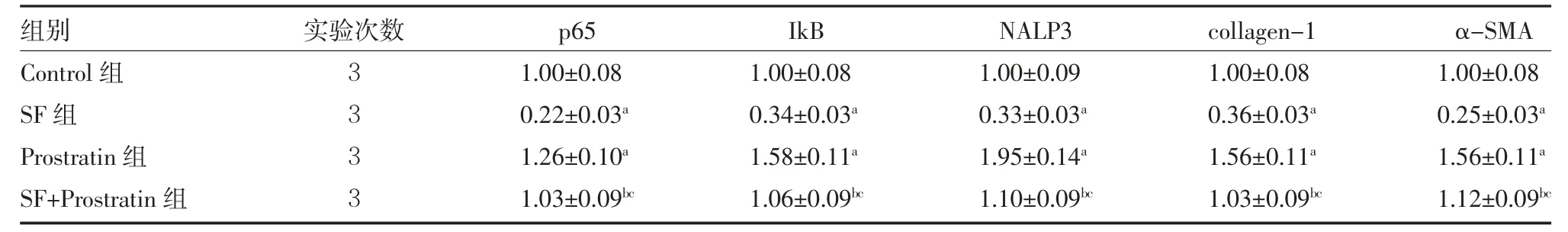
表3 各组的相对蛋白表达量(±s)
注:Control 组细胞正常培养;SF 组细胞给予0.28 mg/mL 阿魏酸钠处理48 h;Prostratin 组细胞给予100 nmol Prostratin 处理48 h;SF+Prostratin组细胞给予0.28 mg/mL 阿魏酸钠和100 nmol Prostatin 联合处理48 h;p65 为核转录因子p65;IkB 为抑制因子κB;NALP3 为核苷酸结合寡聚化结构域样受体3;collagen-1 为胶原蛋白-1;α-SMA 为平滑肌肌动蛋白α;与Control 组比较,aP<0.05;与Prostratin 组比较,bP<0.05;与SF 组比较,cP<0.05
组别Control 组SF 组Prostratin 组SF+Prostratin 组实验次数3333 p65 1.00±0.08 0.22±0.03a 1.26±0.10a 1.03±0.09bc IkB 1.00±0.08 0.34±0.03a 1.58±0.11a 1.06±0.09bc NALP3 1.00±0.09 0.33±0.03a 1.95±0.14a 1.10±0.09bc collagen-1 1.00±0.08 0.36±0.03a 1.56±0.11a 1.03±0.09bc α-SMA 1.00±0.08 0.25±0.03a 1.56±0.11a 1.12±0.09bc

图1 Western blot 检测经阿魏酸钠处理的矽肺小鼠纤维细胞中p65、IkB、NALP3、collagen-1 和α-SMA 蛋白表达量

图2 Western blot 检测经prostratin 和阿魏酸钠处理的矽肺小鼠纤维细胞中p65、IkB、NALP3、collagen-1 和α-SMA 蛋白表达量
3.2 NALP3 参与NF-κB 通路介导的矽肺小鼠成纤维细胞增殖 继续构建shNALP3 质粒并转染于模型成纤维细胞,通过qRT-PCR 检测shNALP3 质粒的转染效率,结果显示转染shNALP3 的细胞中NALP3 含量明显低于shNC(P<0.05),见表4。MTT、EdU 和ELISA检测结果发现,和Prostratin+shNC 组比较,Prostratin+shNALP3 组的细胞活力、增殖、Caspase-1 和IL-1β 的活性水平均降低(P<0.05),见表5。Western blot 检测collagen-1 和α-SMA 蛋白水平显示,和Prostratin+shNC 组比较,Prostratin+shNALP3 组细胞中collagen-1和α-SMA 蛋白表达被抑制(P<0.05),见图3、表6。
表4 shNALP3 的转染效率检测(±s)

表4 shNALP3 的转染效率检测(±s)
注:Normal 组细胞正常培养;shNALP3 组细胞转染NALP3 敲减质粒;shNC 组细胞转染NALP3 的阴性对照;NALP3 为核苷酸结合寡聚化结构域样受体3;与shNC 组比较,aP<0.05
组别Normal 组shNC 组shNALP3 组实验次数333 NALP3 1.00±0.06 0.95±0.09 0.34±0.03a
表5 各组细胞的活力、增殖和细胞因子含量(±s)

表5 各组细胞的活力、增殖和细胞因子含量(±s)
注:Prostratin 组细胞给予100 nmol Prostratin 处理;Prostratin+shNALP3 组细胞转染NALP3 敲减质粒并给予100 nmol Prostratin 处理;Prostratin+shNC 组细胞转染NALP3 阴性对照并给予100 nmol Prostratin 处理;Caspase-1 为半胱氨酸天冬氨酸特异性蛋白酶-1;IL-1β 为白介素1β;与Prostrain+shNC 组比较,aP<0.05
组别Prostrain 组Prostrain+shNC 组Prostrain+shNALP3 组实验次数333相对细胞活力(%)100.00±7.01 98.58±6.99 53.33±4.99a细胞增殖(%)12.12±1.03 11.35±1.11 4.30±0.58a Caspase-1(pg/mL)172.36±10.01 174.87±9.99 120.25±7.89a IL-1β(pg/mL)104.33±6.99 105.25±6.47 74.05±5.01a
表6 各组的相对细胞蛋白表达量(±s)
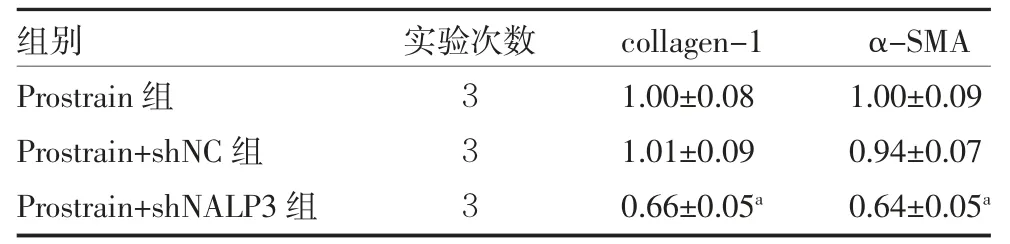
表6 各组的相对细胞蛋白表达量(±s)
注:Prostratin 组 细 胞 给 予100 nmol Prostratin 处 理;Prostratin+shNALP3 组细胞转染NALP3 敲减质粒并给予100 nmol Prostratin 处理;Prostratin+shNC 组细胞转染NALP3 阴性对照并给予100 nmol Prostratin 处理;collagen-1 为胶原蛋白-1;α-SMA 为平滑肌肌动蛋白α;与Prostrain+shNC 组比较,aP<0.05
组别Prostrain 组Prostrain+shNC 组Prostrain+shNALP3 组实验次数333 collagen-1 1.00±0.08 1.01±0.09 0.66±0.05a α-SMA 1.00±0.09 0.94±0.07 0.64±0.05a

图3 Western blot 检测成纤维细胞相关蛋白collagen-1 和α-SMA 的表达
4 讨 论
本研究在前期研究基础上,进一步探究SF 在治疗矽肺过程中可能涉及的内在分子机制[2]。本研究结果证实,SF 治疗矽肺的过程中可能阻断NF-κB 通路,并且证实该通路参与治疗过程并影响矽肺模型成纤维细胞的增殖。此外,通过探究NF-κB 通路作用矽肺模型小鼠成纤维细胞的分子机制证实NALP3是一个关键调控基因。
目前已有研究报道NF-κB 与矽肺进展相关,全身抑制的NF-κB 活化能够降低SiO2诱导的肺损伤[6-8]。在化合物治疗矽肺的研究中,有研究报道,槲皮素通过抑制NF-κB 通路减少大鼠炎症细胞、炎症介质肿瘤坏死因子α(TNF-α)等释放,减轻炎症反应,缓解肺纤维化[9]。通过对模型细胞内相关蛋白的检测发现SF 能够抑制p65、IkB、NALP3、collagen-1 和α-SMA蛋白的表达,说明在SF 治疗矽肺的过程中可能阻断NF-κB 通路,并且该通路参与治疗过程。王焱等[10]研究显示,NF-κB 可与其他因子共同参与大鼠矽肺纤维化的形成,并且干预NF-κB 形成可以改变大鼠矽肺纤维化程度。在本研究中我们选择能够激活NFκB 的试剂Prostratin 处理经SF 处理的成纤维细胞,结果发现,Prostratin 逆转SF 抑制的细胞活力和细胞增殖,这说明NF-κB 通路可参与SF 的治疗过程。
往往一条信号通路发挥作用机制的过程涉及其他基因的调控。研究显示,肿瘤坏死因子2 型受体(TNFR2)可激活NF-κB 信号通路调控机制,进而影响心力衰竭进程[11]。在大鼠痛风性关节炎的研究中NF-κB 激活能够诱导NALP3 表达[4]。NALP3 是研究最多、特征最明确的炎症小体[12],其在矽肺的发生发展中起到重要作用[2]。为了进一步探究NF-κB 通路作用矽肺模型小鼠成纤维细胞的分子机制,我们基于以往的研究,构建NALP3 敲减质粒并转染于模型成纤维细胞。结果发现,Prostratin 促进的细胞活力受到shNALP3 的逆转,这说明NF-κB 通路通过NALP3 参与矽肺小鼠成纤维细胞的增殖。
综上所述,SF 通过阻断NF-κB 途径降低NALP3 诱导的矽肺成纤维细胞增殖,可为矽肺纤维化的治疗提供新途径。
