基于血液学参数的急性高原反应潜在预测指标的筛查分析*
2023-12-26刘鑫源罗勇军
叶 梓,刘鑫源,陈 郁,罗勇军△
(1.陆军军医大学陆军卫勤训练基地军事医学地理学教研室,重庆 400038;2.陆军军医大学基础医学院学员四大队,重庆 400038)
当人体快速暴露于高原环境(海拔超过2 500 m)时,如果低氧压力超出了自身习服水平,则可能发生急性高原病,其中急性高原反应(acute mountain sickness,AMS)最为常见,表现为头痛、头晕、乏力、呕吐等[1]。AMS通常在到达目的地域4~12 h后发生,可持续到第5天,这对有紧急任务的人员开展工作影响严重,且AMS进一步恶化可发展为高原脑水肿(high-altitude cerebral edema,HACE),死亡风险增加[2]。
然而,尽管AMS被研究了上百年,但其确切病因和发病机制仍不完全清楚,以低氧为核心的各类生理参数变化都被认为是AMS的潜在易感因素,包括肺通气、血氧饱和度(blood oxygen saturation,SpO2)、心血管功能、血液学和代谢参数,其中SpO2被认为是最有前途的预测变量,已被许多研究证实与AMS发病风险呈明显负相关[3],然而也有研究表明两者并无相关性[4]。此外,参与氧气运输的血液学指标,包括红细胞数(red blood cell count,RBC)、血红蛋白(hemoglobin,Hb)水平、红细胞比容(hematocrit,HCT)也被证实与AMS发生明显相关[5],然而暴露时间和参数值范围的不同,其相关性也存在很大差异。因此,本研究希望建立一个从平原到高原,并连续暴露于低氧环境的队列,根据到达高原时是否出现AMS,连续观测AMS和非AMS 2组人员在高原习服不同阶段的生理代谢参数差异,从而筛查出可能对AMS的发生、发展有稳定预测价值的参数,并为进一步了解高原习服过程、探索AMS的潜在发生机制提供参考。
1 资料与方法
1.1 一般资料
46例健康平原汉族人于2019年7月在重庆(海拔500 m)招募。纳入标准为20~30岁于重庆生活4年以上的健康男性,排除有严重呼吸系统疾病、心血管系统疾病、消化系统疾病患者,以及既往到达拉萨(海拔3 650 m)出现急慢性高原病史者。所有受试者通过低压氧舱完成低氧预适应训练(模拟海拔3 000 m,8 h/d,共2 d),并于在重庆出发前(CQ)采集基本生理和血液学参数。随后32例乘坐火车(用时52 h),14例乘坐飞机(用时2 h)于同一天到达拉萨,于到达第2天(LS1)、第23天(LS2)、第44天(LS3)、第65天(LS4)采集相同生理和血液学参数,并根据LS1时填写的2018版路易斯湖急性高山病评分系统(The 2018 Lake Louise Acute Mountain Sickness Score,LLS)量表评分将受试者分为AMS组与非AMS组。本研究获本校医学伦理委员会审查批准(2020第001-02号)。
1.2 方法
1.2.1基本生理参数采集
所有研究对象均签署知情同意书,经专业人员调查其年龄、性别、民族、既往病史和急慢性高原病史等基本情况,并做体格检查,记录 BMI、血压(blood pressure,BP)、心率(heart rate,HR)、SpO2等。BP、HR均为清晨空腹舒适状态下静坐至少15 min后进行测量,SpO2为静坐后待数值稳定时的取值。随后受试者由专业医护人员统一采集5 mL静脉血于高原特殊真空抗凝采血管中,采集完毕后立即送往西藏阜康医院健康体检中心进行血常规、血生化指标检测。
采用欧姆龙U30电子血压计(欧姆龙大连有限公司)测量受试者BP、HR;采用鱼跃YX102指夹式SpO2检测仪(江苏鱼跃医疗设备股份有限公司)测量SpO2;采用乙二胺四乙酸二钾(EDTA-K2)抗凝真空管(江苏康捷医疗器械有限公司)采集静脉血;采用汉方HF-3800全自动血细胞分析仪(济南汉方医疗器械有限公司)检测血常规指标;采用迈瑞BS-800全自动生化仪(深圳迈瑞生物医疗电子股份有限公司)检测血生化指标。仪器使用按标准化操作流程进行,血常规、血生化指标分析前采用对应配套质控物进行质控,保证数据的准确性和稳定性。
1.2.2AMS的诊断
所有受试者于LS1清晨在专业人员指导下填写LLS量表[6],主观症状包括头痛、头昏/头晕、疲劳/虚弱、恶心/呕吐4类,每一类症状根据无、轻度、中度、重度分别评为0、1、2、3分,AMS诊断标准:强制要求头痛评分至少1分并具有其他3种症状中的至少一种,最终所有症状总分>3分。
1.3 统计学处理
2 结 果
2.1 研究对象基线特征情况
根据LS1时是否发生AMS将研究对象分为AMS组20例和非AMS组26例,比较2组研究对象的一般情况。2组人员基线水平,包括BMI、收缩压(systolic blood pressure,SBP)和舒张压(diastolic blood pressure,DBP)、HR、SpO2、RBC、Hb、HCT、总蛋白(total protein,TP)、清蛋白(albumin,ALB)、球蛋白(globulin,GLB)、丙氨酸氨基转移酶(alanine transaminase,ALT)、天门冬氨酸氨基转移酶(glutamic-oxalacetic transaminase,AST)、总胆红素(total bilirubin,TBIL)、肌酐(creatinine,CREA)、尿素氮(blood urea nitrogen,BUN)、甘油三酯(triacylglycerol,TRIG)等基本生理、血液学参数及交通方式比较,差异均无统计学意义(P>0.05),2组间年龄比较差异有统计学意义,提示年龄增长可能是AMS发生的风险因素。此外,通过低氧预适应训练,2组Hb中位数均超过160 g/L,见表1。
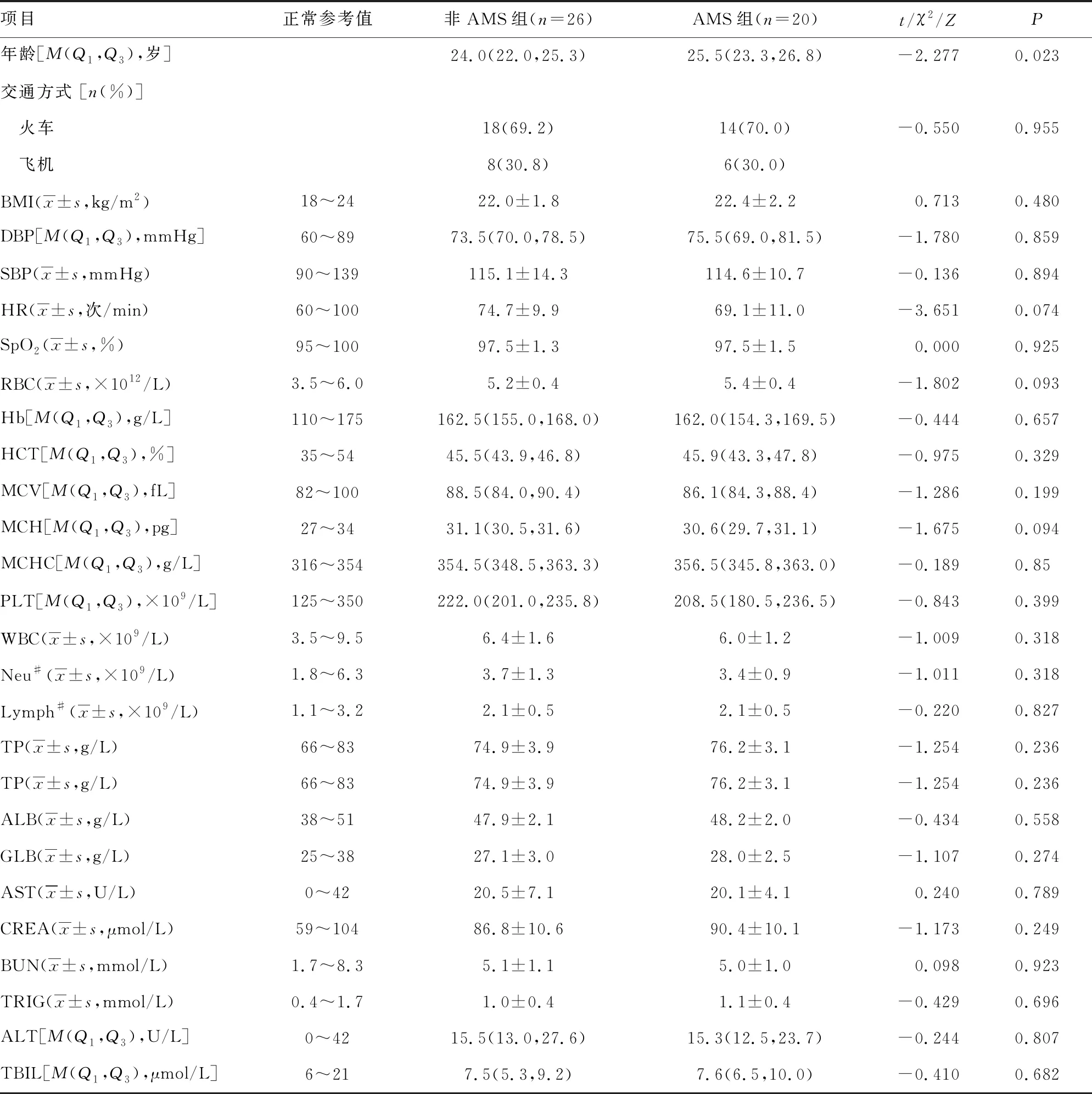
表1 2组间基线(CQ)时特征比较
2.2 低氧暴露后2组间生理参数与血细胞参数比较
AMS LS1时,2组间SpO2、SBP、DBP、HR等基本生理参数和RBC、Hb、HCT等血细胞参数比较,差异无统计学意义(P>0.05),而在AMS症状消失后的高原习服过程中(LS2~LS4),上述参数2组间差异也无统计学意义(P>0.05),即从急性低氧暴露到2个多月的高原习服过程中,包括SpO2、RBC、Hb、HCT等以往被证实具有AMS预测价值的参数在2组间的变化是稳定一致的,见图1。
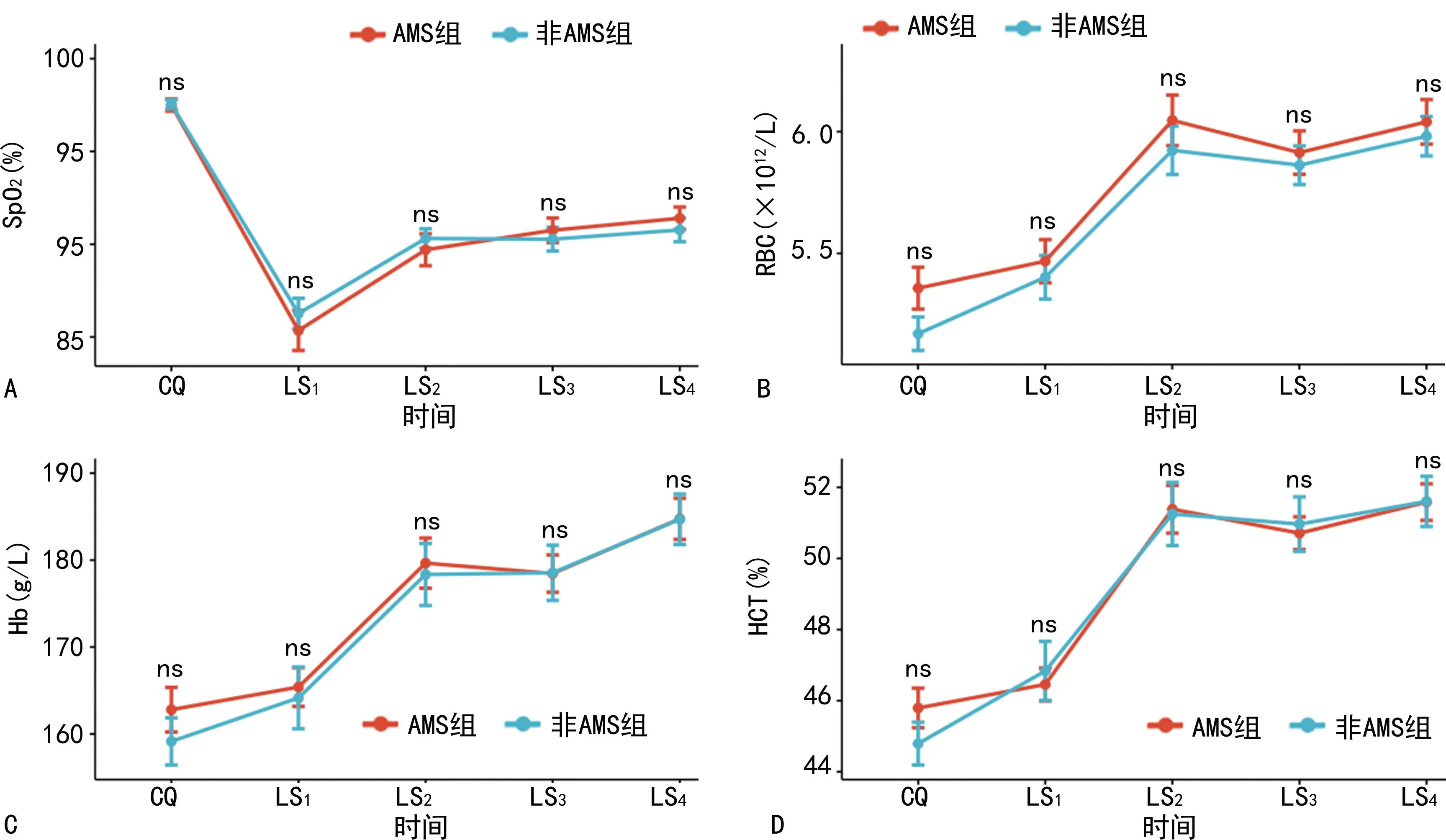
A:SpO2;B:RBC;C:Hb;D:HCT;ns:P>0.05,组间同时间点比较。
2.3 低氧暴露后组间血生化参数比较
CQ、LS1~LS4各时间点,除ALB以外,其余血生化参数组间差异均无统计学意义(P>0.05),在LS1和LS3(AMS症状消失)时,非AMS组ALB水平明显高于AMS组,组间差异有统计学意义(P<0.05)。另外,与CQ基线水平比较,无论是AMS组还是非AMS组,ALB在整个高原习服过程中的变化趋势都经历了一个先明显升高(LS2)又明显下降(LS3)至基线水平的过程,差异仅在于非AMS组在LS1时就已经明显升高,而AMS组直到LS2时才明显升高并与健康习服者保持一致,这完全不同于血细胞参数在低氧暴露后的变化趋势,见图2。
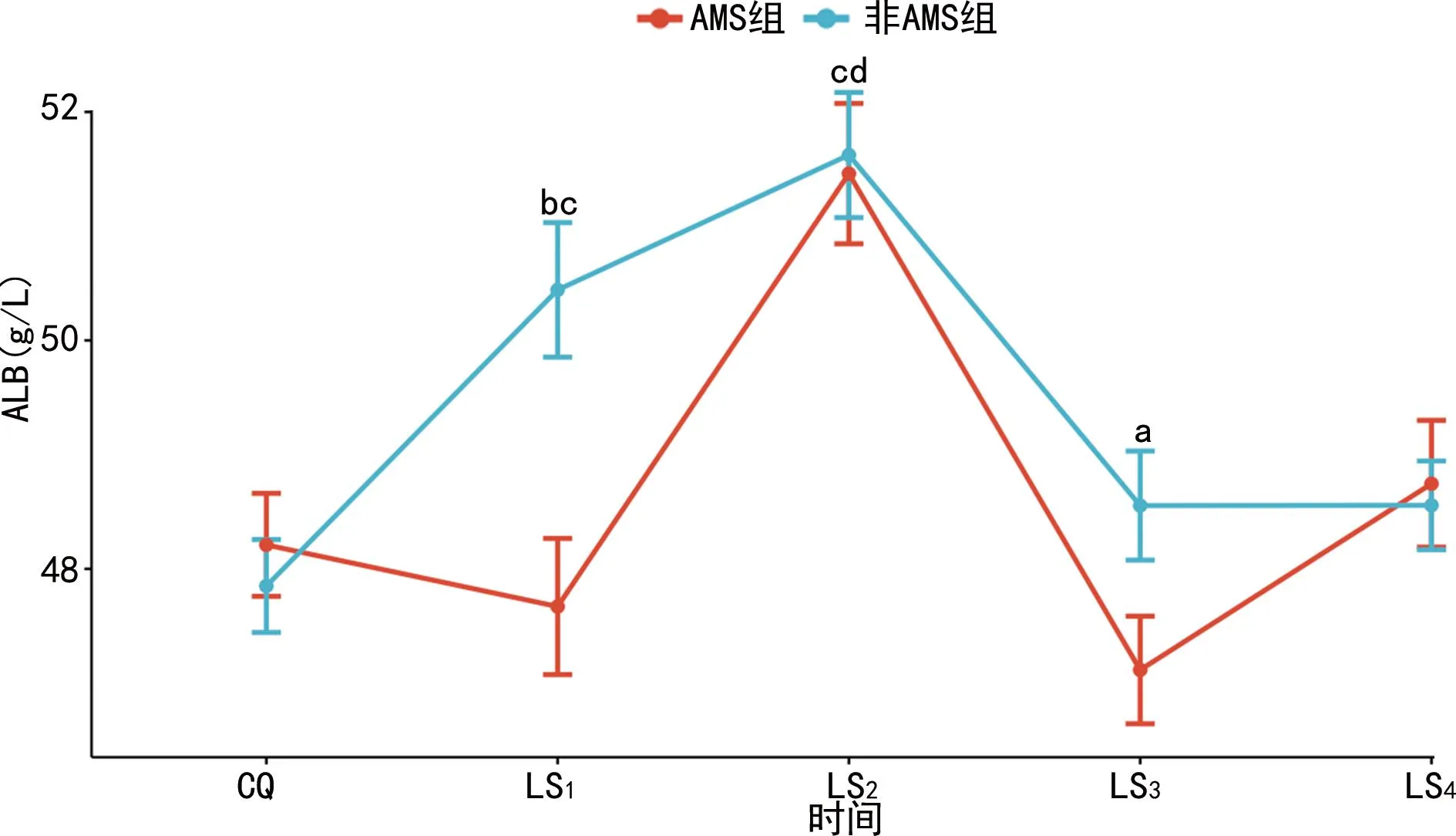
a:P<0.05,b:P<0.01,同一时间点组间比较;c:P<0.01,非AMS组LS1、LS2时与CQ时比较;d:P<0.01,AMS组LS2时与CQ时比较。
2.4 AMS发生、发展的潜在预测因素筛查
为发现AMS的潜在预测因素,对CQ和LS1时的所有基本生理、血细胞和血生化参数进行单因素logistic回归分析。在CQ时,单因素logistic回归显示,只有年龄(OR=1.508,95%CI:1.043~2.179,P=0.029)与AMS明显相关;在LS1时,仅ALB(OR=0.706,95%CI:0.549~0.906,P=0.006)与AMS明显相关性,见表2。接着,将单因素logistic回归中与AMS明显相关的年龄、ALB及以往被证实有预测价值的SpO2、RBC、Hb、HCT全部纳入多因素logistic回归中进行分析。结果显示在CQ时,仅年龄(OR=1.508,95%CI:1.043~2.179,P=0.029)是AMS的独立危险因素;在LS1时,年龄(OR=1.611,95%CI:1.059~2.451,P=0.026)是AMS的独立危险因素,而ALB(OR=0.676,95%CI:0.511~0.894,P=0.006)是AMS的独立保护因素,见表3。
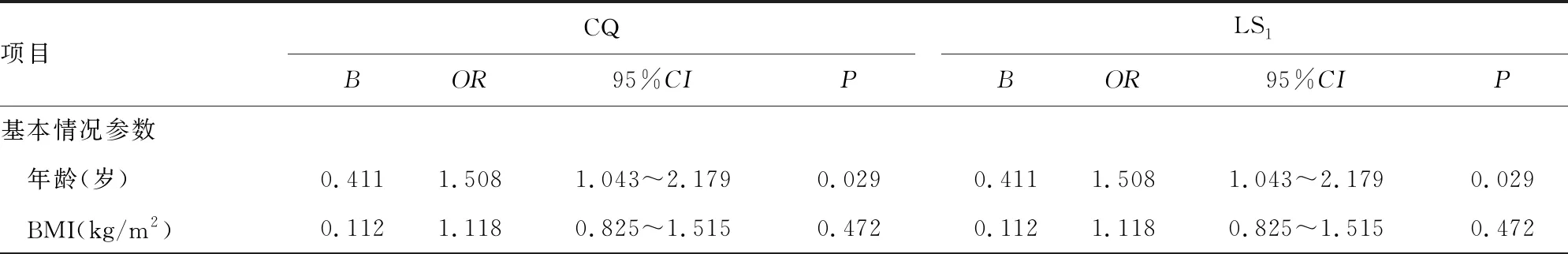
表2 在CQ和LS1时AMS的单因素logistic回归分析
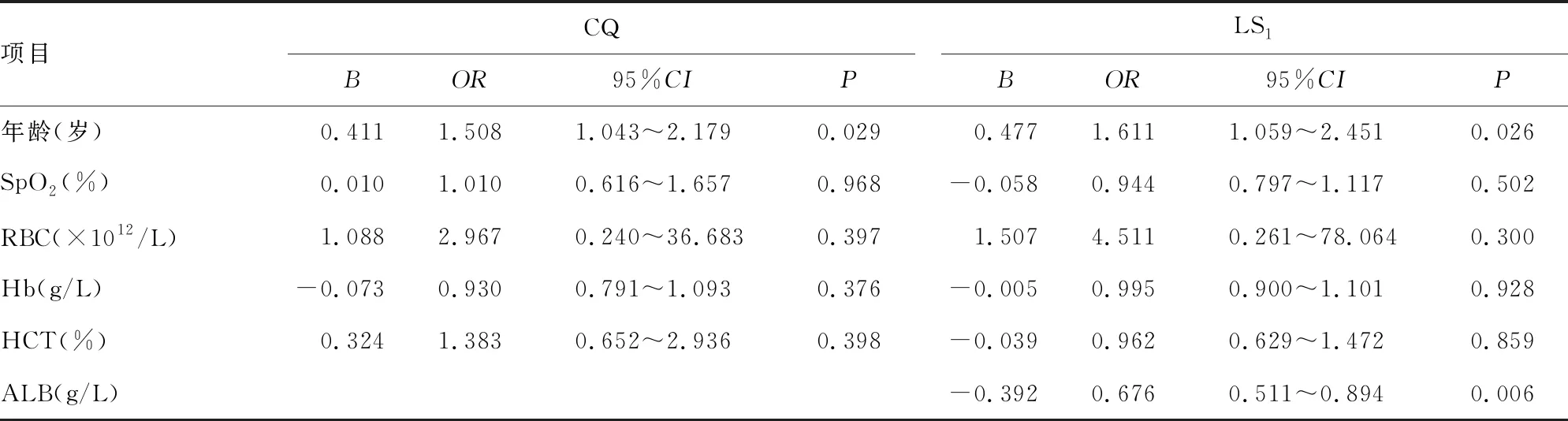
表3 在CQ和LS1时AMS的多因素logistic回归分析
3 讨 论
本研究确定了从海拔500 m到3 650 m人员基本生理和血液学参数持续75 d(共5个时间点)的变化过程,并比较了AMS患者与健康习服人员在此期间所有参数的差异变化,结果发现SpO2、RBC、Hb、HCT等基本生理和绝大部分血液学参数及交通方式差异均无统计学意义(P>0.05),因此这些参数可能对AMS并无预测价值。值得注意的是,本研究发现在LS1时年龄增长可能是发生AMS的风险因素。同时,在急性低氧暴露时健康习服人员血浆ALB明显高于AMS患者,而在AMS症状消失后的高原习服过程中,2组人员ALB均出现了先升高后降低的一致变化过程,提示ALB可能对AMS有一定预测价值。并且通过logistic回归分析再次验证上述发现。
尽管直到现在对AMS的发病机制仍缺乏统一的解释,但是绝大部分研究表明更明显的低氧血症是发生AMS的首要因素[7],这可能是由于AMS患者受到低氧暴露后的影响在症状和病理生理变化出现前数小时就已经开始了,包括氧化应激、较低的通气量、间质性肺水肿造成的气体交换障碍及液体潴留[8]。因此,SpO2作为反映氧气输送和血氧含量的直接参数,被某些研究认为是AMS最有价值的预测指标[9]。然而本研究发现,低氧暴露后2组人员SpO2的变化趋势是一致的,在各个时间点差异也均无统计学意义(P>0.05),因此提示AMS的易感性似乎不是低氧血症直接导致。这可能是由于在本研究中低氧环境触发的可能发生AMS的危险因素并不能得到有效控制,包括个体的健康、生理和遗传及在高海拔地区进行了特定行为和活动,从而造成个体对同水平低氧血症存在不同的生理反应[10]。故单纯测量SpO2的数值可能对AMS并无预测价值,还要考虑到其他因素的影响。同时,本研究中轻度AMS患者其SpO2与健康习服者无明显差异,这也从另一个角度说明单纯测量SpO2的预测价值可能受到其他因素的影响。
由于RBC是全身氧气运输的关键参与者,因此,它们在适应缺氧方面发挥着明确的作用[11-12]。低氧暴露后一定程度上的红细胞系增生被认为是减轻低氧血症的有力补偿,然而其过度增生甚至病理状态(HAPC)将使血液黏度增加、血流速度和心输出量减慢,从而导致向组织输送的氧气反而减少[13-14],可能会诱发AMS[15]。有研究显示Hb在超过160 g/L的范围后,其过度增生与AMS发生明显相关,AMS组Hb明显高于非AMS组[16]。然而本研究中,无论是AMS组还是非AMS组,经低氧预适应训练后平均Hb在基线水平(CQ)就已经超过160 g/L,且在低氧暴露后Hb不断上升至180~190 g/L的整个过程中,组间Hb、BRC、HCT差异均无统计学意义(P>0.05),这提示健康习服人员和AMS患者红细胞系增生的变化趋势是一致的。虽然缺氧诱导的红细胞代偿性增生及Hb的升高有助于提高红细胞的携氧能力,但这二者导致高黏滞血症和血流速度降低,可能会增加血栓形成的临床风险[11]。那么上述参数若是达到上限后可能无法显示明显的差异或是低氧刺激可能对2组人员的红细胞系参数影响是同等的,但也可能受到其他不同因素的影响。因此,红细胞系参数过度增生对是否罹患AMS的预测价值还不能确定。
ALB是人体血液中含量最丰富的蛋白,约占血浆总蛋白的60%,它的主要作用是调节血浆胶体渗透压(colloid osmotic pressure,COP),占COP的75%~80%,从而维持血管内外平衡,保证正常血容量,故临床上常用于对症治疗低血容量、出血、休克、烧伤、急性肝功能衰竭、慢性肝病等[17]。此外,ALB还通过其抗氧化、抗炎和抗细胞凋亡的作用维持血管内皮细胞稳定,减轻血管通透性的增加[18]。既往研究显示血浆ALB与AMS间缺乏明显相关性[19],但本研究发现健康习服人员在急性低氧暴露时(LS1)血浆ALB明显升高,而AMS患者并未发生明显变化,血浆ALB升高是AMS的独立保护因素,提示血浆ALB可能在预防AMS中发挥积极作用,然而其变化的具体机制目前并不清楚,可能是ALB降解减少或合成增加,也可能是血液浓缩间接引起。对于健康习服人员ALB直接降解减少或合成增加导致:有研究显示高原低氧环境可能对ALB的合成有一定的刺激作用,尽管低氧已被证明抑制动物的肝脏蛋白合成,但低氧引起的呼吸性碱中毒可刺激肝脏蛋白合成,从而弥补低氧引起的直接效应。ALB合成增加在理论上确实可以通过增加COP,维持血管内皮细胞稳定和血管通透性等作用以减少血液往组织间隙渗漏,从而避免脑肿胀或脑白质细胞内水肿,这是AMS发生的潜在机制[7]。然而通常来说,血浆ALB增加应该会导致血浆容量的增加,可能反而还引起颅内压升高,而且这似乎也与高原暴露后血浆容量下降相矛盾[20-21]。对于健康习服人员血液浓缩间接导致:大量研究表明由于高原湿度降低、肺通气增加及呼吸性碱中毒促进肾脏利钠和利尿的作用[22],抵达高海拔地区后血浆容量可持续减少以提高血液的携氧能力,这种变化甚至持续至3周后,与观察到的LS1(非AMS组出现),LS2(2组均出现)时ALB明显升高相一致。这也可以用血液被稀释来解释,也与之前报道的长时间高海拔逗留后血浆容量将部分或全部恢复相吻合[20]。但是血浆容量变化与AMS发生是否相关仍存在很大争议[19],仍有部分研究显示AMS患者表现出更高的液体滞留量,更大的血浆渗透压下降和更大的血浆容量增加[23],这与本研究的假设相吻合。
值得注意的是,如果ALB升高是由于血液浓缩间接导致,那为何在LS1时血液浓缩的非AMS组和血液未浓缩的AMS组其红细胞系参数表现出无差异的一致性,这是否提示健康习服者与AMS患者在急性高原暴露时其习服模式是不同的,而在短暂逗留后(LS2及以后)其习服模式又恢复一致?这还需要继续深入研究。
综上所述,本研究证实SpO2、RBC、Hb、HCT等生理和血液学参数可能对AMS并无预测价值,而急性低氧暴露时血浆ALB的变化可能对AMS有一定预测价值,尽管并不清楚这种变化是由于其合成增加、降解减少还是血液浓缩引起的。此外,低氧暴露后期血浆ALB在健康习服人群和AMS患者症状消失后的一致变化过程反映了其在高原习服中可能扮演重要角色,这还需要深入研究其在低氧暴露条件下的生理效应,为今后通过应用ALB及其相关制品来预防AMS带来可能。
