胃癌组织中circMAPK14的表达及意义研究
2023-12-26唐洁,宋丹
唐 洁,宋 丹
(重庆市大渡口区人民医院急诊科,重庆 400084)
胃癌是常见的消化系统恶性肿瘤之一,在全球的发病率和致死率均较高。尽管医学的进步促进了胃癌的诊断和治疗,但大多数晚期胃癌患者的5年总生存率仍不到30%[1]。目前,临床上胃癌的治疗方式主要为外科手术(早期或中期)和化、放疗(晚期)。早期手术效果较好,生存率可超过90%,而晚期常常面临患者对放化疗不敏感或者耐受性较差的问题,且患者容易复发,因此迫切需要寻找新的治疗方式[2]。环状RNAs(circular RNAs,circRNAs)是一类以共价键形成闭合环状结构的长链非编码RNA,没有5′帽子结构和3′ poly A尾巴,具有稳定性、丰富性和保守性等特点[3-4]。研究表明,circRNA在消化系统恶性肿瘤的发生和发展中发挥重要作用[5-7]。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路是众多经典信号转导通路之一,通过蛋白激酶、转录因子等信号将细胞外信号转运至细胞内,最终导致细胞增殖、分化、凋亡、转移等[8]。MAPK14是MAPK家族的关键成员,在信号级联中发挥核心功能[9]。然而,源自MAPK14的circRNA(circMAPK14)在胃癌中是否具有功能,目前缺乏相关报道。本研究分析胃癌患者癌灶组织及癌旁组织中circMAPK14(hsa_circ_24603)的表达情况,研究其功能和相关机制,现报道如下。
1 材料与方法
1.1 材料
1.1.1临床组织标本
收集2021年2月至2022年8月本院收治的29例胃癌患者癌灶组织和癌旁组织(距离肿瘤组织边缘2 cm)作为研究对象。患者和家属均签署了知情同意书。
1.1.2细胞株及试剂
正常永生化胃上皮细胞株GES-1和人胃癌细胞系SGC7901购于美国典型培养物保藏中心(ATCC)细胞库;DMEM高糖培养基、RPMIl640培养基、Opti-MEM培养基、胎牛血清、胰酶购于美国HyClone公司;细胞计数试剂盒(CCK-8)购于日本Dojindo Laboraories公司;LipofectamineTM2000转染试剂购于美国Invitrogen公司;逆转录试剂盒、TRIzol试剂购于TaKaRa宝生物工程(大连)有限公司;SYBR Green/ROX Master Mix试剂盒购于加拿大Fermentas公司;膜联蛋白-Ⅴ(Annexin-Ⅴ)-异硫氰酸荧光素(fluorescein isothiocyanate isomer,FITC)/碘化丙啶(propidium iodide,PI)凋亡检测试剂盒、叔丁基过氧化氢(tert-butyl hydroperoxide,TBH)购于德国Sigma公司;抗体p-MAPK14、β-actin、辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗购于美国Cell Signaling Technology公司。
1.2 方法
1.2.1临床组织标本处理
将收集的组织标本在液氮中速冻,用研钵研磨后加入TRIzol试剂提取RNA,再逆转录为cDNA。
1.2.2细胞培养
SGC7901用RPMIl-1640培养基、GES-1用DMEM高糖培养基培养,胎牛血清浓度为10%。培养箱设定参数为37 ℃、5% CO2、饱和湿度。
1.2.3小干扰RNA(small interfering RNA,siRNA)干扰与TBH处理
circMAPK14 siRNA干扰序列由广州锐博生物技术有限公司设计合成,分装、储存方法按照说明书进行。将对数生长期的SGC7901细胞用胰蛋白酶消化计数后接种于6孔板(每孔约5×105个细胞),待细胞密度约为60%时,更换成无血清培养基。24 h后进行转染,实验组加入终浓度50 nmol/L的circMAPK14 siRNA,对照组加入同剂量的阴性对照(scramble siRNA),转染48 h。
1.2.4流式细胞分析
实验组与对照组均加入TBH(分别纳入实验+TBH组,对照+TBH组),浓度为50 μmol/L。24 h后收集细胞及上清液,用预冷磷酸盐缓冲液(PBS)洗2次,室温1 000 r/min离心5 min,按照Annexin Ⅴ-FITC/PI凋亡检测试剂盒说明书进行处理,流式细胞仪检测细胞的凋亡情况。
1.2.5逆转录实时荧光定量PCR(RT-qPCR)检测
根据不同标本的cDNA,检测circMAPK14、MAPK14、Noxa、Bax、Puma的表达水平。以GAPDH基因为内参基因,采用SYBR Green/ROX Master Mix试剂盒通过荧光定量PCR仪(美国BioRad公司)进行操作,引物序列见表1。提取SGC7901、GES-1细胞RNA,逆转录后定量检测circMAPK14的表达情况。

表1 PCR引物序列
1.2.6CCK-8法检测细胞增殖
将SGC7901细胞接种于96孔板中,每孔1×103个细胞,12 h后更换成无血清培养基进行siRNA干扰。转染24、48 h后每孔加入10 μL CCK-8试剂,在细胞培养箱中孵育1 h后用酶标仪检测450 nm处吸光度[A(450)]值。每组实验重复3次,取平均值并绘制生长曲线图。
1.2.7划痕试验
将SGC7901细胞接种于6孔板中(1×106/孔),转染24 h后用无菌200 μL移液器枪头沿孔的中间刮擦细胞板,显微镜拍照。随后更换成无血清培养基,孵育48 h后再用显微镜拍照。
1.2.8Western blot检测MAPK14磷酸化水平
干扰circMAPK14 48 h后,弃掉细胞上清液,预冷的PBS洗涤2次,加入蛋白裂解液冰上裂解30 min,刮下细胞后置于1.5 mL EP管中,12 000 r/min、4 ℃离心15 min。转移裂解上清液并检测蛋白水平。在裂解液中加入5×上样缓冲液,煮沸5 min。采用聚丙烯酰胺凝胶电泳(12%)后将分离的蛋白条带转移到硝酸纤维膜上,丽春红染色、漂洗后用5%的脱脂牛奶室温封闭2 h,加入一抗孵育,4 ℃过夜。吸掉一抗后加入TBST洗膜3次,再用二抗室温孵育2 h,吸弃二抗洗膜后进行化学发光反应,使用ImageJ进行灰度值分析。
1.3 统计学处理
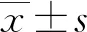
2 结 果
2.1 circMAPK14在癌灶组织和胃癌细胞中的表达
纳入研究的29例胃癌患者癌灶组织中circMAPK14的mRNA表达水平低于癌旁组织(P<0.01);SGC7901细胞中circMAPK14的mRNA表达水平低于GES-1细胞(P<0.01),见图1。
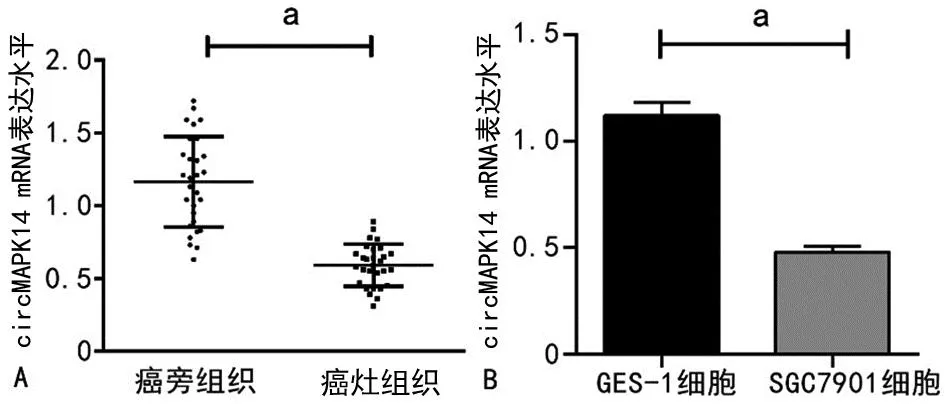
A:circMAPK14在癌灶组织中和癌旁组织中的表达水平;B:circMAPK14在SGC7901和GES-1细胞中的表达水平;a:P<0.01。
2.2 对照组与实验组胃癌细胞circMAPK14 mRNA表达水平比较
实验组circMAPK14的mRNA表达水平低于对照组(P<0.01),见图2。
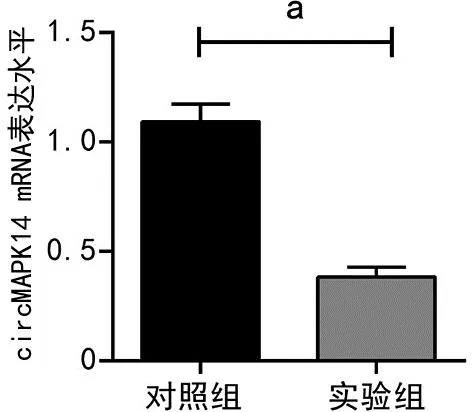
a:P<0.01。
2.3 circMAPK14对细胞增殖的影响
CCK-8结果显示,实验组吸光度明显高于对照组(P<0.01),细胞增殖明显增强,见图3。
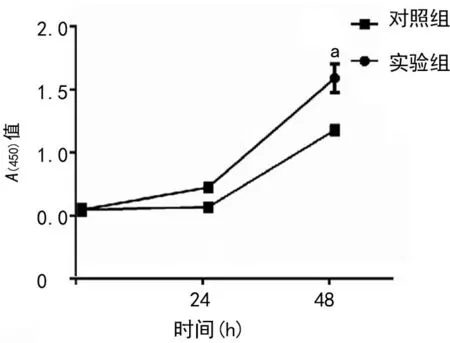
a:P<0.01,与对照组比较。
2.4 circMAPK14对胃癌细胞凋亡的影响
流式细胞术结果显示,实验+TBH组细胞凋亡率低于对照+TBH组(P<0.01),下调SGC7901细胞circMAPK14表达会降低由TBH诱导的SGC7901细胞凋亡,见图4。
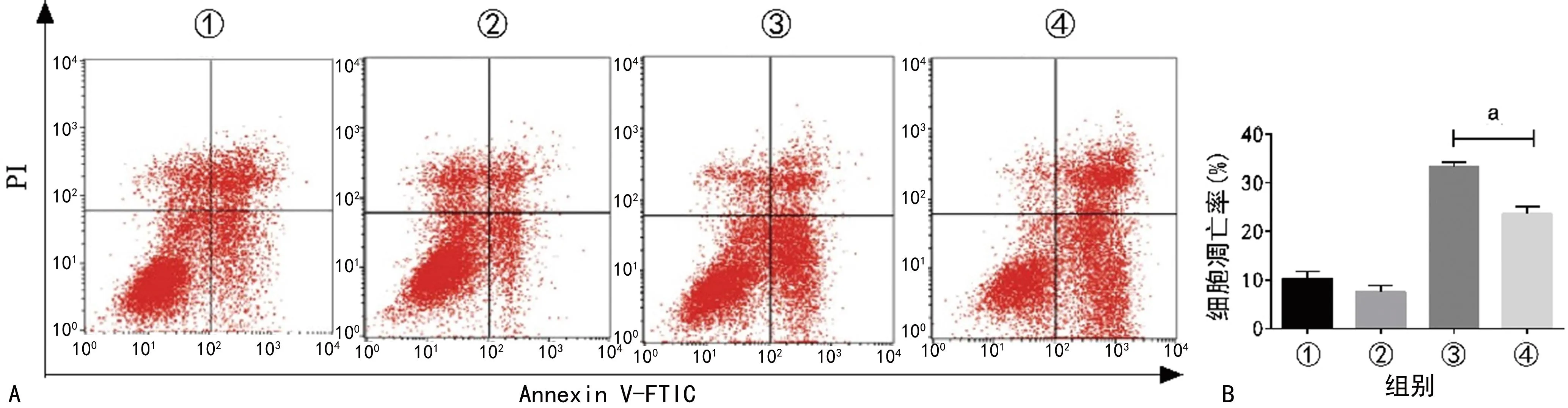
A:流式细胞图;B:统计分析图;①:对照组;②:实验组;③:对照+TBH组;④:实验+TBH组;a:P<0.01。
2.5 circMAPK14对胃癌细胞的迁移影响
划痕实验结果表明,实验组细胞迁徙能力明显上升,见图5。

图5 划痕实验检测circMAPK14对SGC7901细胞迁移的影响(200×)
2.6 circMAPK14对MAPK14和凋亡相关基因的影响
实验组MAPK14磷酸化水平增强,Bax、Puma、Noxa的mRNA表达水平降低,差异有统计学意义(P<0.01),见图6。
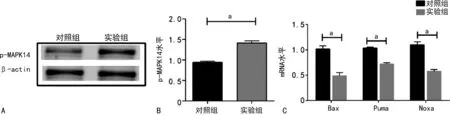
A、B:p-MAPK14的Western blot实验结果;C:凋亡相关基因mRNA表达水平比较;a:P<0.01。
3 讨 论
胃癌是常见的恶性肿瘤之一,靶向治疗方法正越来越受到重视。最初,研究人员认为circRNA是机体错误拼接的产物,不具有任何生物学作用,但随着人们对基因研究的深入,发现circRNA具有强大的功能,与细胞分化、细胞存活、细胞增殖息息相关,在胃癌的治疗方面发挥重要作用。例如circRNA GAP1能竞争结合miR-877-3p的靶位点,抑制其表达,从而促进胃癌细胞的侵袭、迁移和生长[10]。核受体相互作用蛋白1环状RNA(circNRIP1)充当miR-149-5p的海绵,活化下游的AKT1/哺乳动物雷帕霉素靶蛋白(mTOR)通路,促进胃癌细胞进展和上皮-间充质转化[11]。YANG等[12]的体内体外实验均证明人抗原R环状RNA(circHuR)能抑制胃癌细胞的生长。线粒体核糖体蛋白S35环状RNA(circMRPS35)可作为分子支架,将组蛋白乙酰转移酶KAT7募集到叉头转录因子O亚型1(FOXO1)和叉头转录因子O亚型3a(FOXO3a)基因的启动子上,从而诱导H4K5的乙酰化,触发FOXO信号通路,抑制胃癌细胞的侵袭和增殖[13]。氧固醇结合蛋白样10抗体环状RNA(circOSBPL10)可作为胃癌患者总生存期和无病生存期的一个预后指标[14]。此外,还有研究指出,circRNA参与了胃癌化疗耐药的调控[15-16]。因此,circRNA具有潜在治疗靶点、生物学标志物等优势。
MAPK信号通路参与调控了细胞增殖、迁移、分化和凋亡等一系列生理活动[8,17]。MAPK共有4个亚族:细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)1/2、ERK5、p38、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)[17]。p38的活化不仅能促进肿瘤细胞的增殖、转移和侵袭,还能通过调控血管的形成来促进肿瘤细胞在人体的发展[18-20]。此外,某些药物也能通过抑制p38通路来发挥效果,例如异丙酚通过抑制表皮生长因子受体和p38的表达来抑制细胞增殖与侵袭,二氢杨梅素通过抑制ERK和p38的表达而具有明显抑制胃癌细胞增殖的效能[21-22]。MAPK14即p38α,属于p38成员之一,可通过激活多种转录因子产生级联反应,发挥其生物学效应[9]。自发现MAPK14以来,临床试验阐明了其在肿瘤发生、转移、侵袭和化疗反应中的作用[23-24]。因此,在胃癌中寻找与MAPK14紧密相关的circRNA至关重要。
本研究中的circRNA来源于MAPK14,是在胃癌组织中发现的差异表达明显的基因,提示此circRNA可能与胃癌的发生、发展有关。进一步研究发现,circMAPK14能抑制胃癌细胞增殖、迁移,促进细胞凋亡,这为胃癌的研究提供了新思路和可能的治疗靶点。机制研究方面,本研究结果提示circMAPK14可作为MAPK信号通路的调控因子,调控MAPK14磷酸化水平,并产生级联效应,影响Bax、Noxa、Puma等抑癌基因的表达,从而抑制胃癌细胞的增殖、凋亡等进程。
然而,circRNA对MAPK的调控方式多种多样,部分通过充当miRNAs的分子海绵,进而调控MAPK和PI3K/AKT-mTOR信号通路[25];部分circRNA能编码蛋白,影响MAPK磷酸化进而影响癌症的进程[26];部分扮演支架角色影响相关基因的降解,从而调控MAPK信号通路[27]。本研究已明确circMAPK14能影响MAPK14的磷酸化,但如何调控还需更深入的实验研究。
