蚕豆荚甾醇的提取及其动力学研究和热力学分析
2023-12-25杨旭诸爱士廖瑜晨
杨旭 诸爱士 廖瑜晨


摘要:為了提高副产物老蚕豆荚的利用率,以乙醇水溶液为提取剂,研究了蚕豆荚甾醇的提取工艺,并对其提取过程进行动力学研究和热力学分析。通过单因素试验考察确定较优的液料比、乙醇体积分数及搅拌速度;于不同提取温度下测得溶液中的甾醇浓度与提取时间的关系,选用一级动力学平板模型,对所得动力学试验数据进行拟合;计算蚕豆荚甾醇提取过程的活化能、内扩散系数、吉布斯自由能、焓和熵。结果表明,从蚕豆荚中成功提取了甾醇,甾醇收率可达6.2 mg/g;液料比、乙醇体积分数、搅拌速度、提取温度、提取时间等对甾醇收率均有影响;适宜的提取工艺为液料比20∶1、乙醇体积分数80%、搅拌速度200 r/min、提取时间1.0 h;一级动力学平板模型适用于描述甾醇提取过程;在考察温度范围内,提取过程的活化能为22.50 kJ/mol;内扩散系数值随着提取温度的升高从2.08×10-10 m2/min增大到4.95×10-10 m2/min;各提取温度下提取过程的吉布斯自由能都小于0,显示从老蚕豆荚中提取甾醇的过程是一个自发过程;蚕豆荚甾醇提取过程的焓为28.26 kJ/mol以及熵为102.26 J/(mol·K),表明蚕豆荚甾醇提取过程是一个吸热、熵增的过程。研究所得结果可为蚕豆荚甾醇提取的规模化应用提供参考。
关键词:蚕豆荚;甾醇;提取;模型;动力学;热力学
中图分类号:TQ645.98 文献标识码:A
文章编号:0439-8114(2023)11-0131-06
DOI:10.14088/j.cnki.issn0439-8114.2023.11.023 开放科学(资源服务)标识码(OSID):
The extraction process of the sterols from faba pods and its kinetic investigation and thermodynamic analysis
YANG Xu1, ZHU Ai-shi2, LIAO Yu-chen2
(1.Zhejiang Wason Cold Chain Technology Co., Ltd., Hangzhou 311121, China; 2.School of Biological and Chemical Engineering, Zhejiang University of Science and Technology, Hangzhou 310023, China)
Abstract: In order to improve the utilization rate of the byproduct old faba pods, the extraction technology of the sterols from faba pods was studied with ethanol aqueous solution as the extraction agent, and the kinetic investigation and thermodynamic analysis of the extraction process were carried out. The optimal liquid-solid ratio, ethanol volume fraction and stirring rate were determined by single factor test investigation; the relationship between sterols concentration and extraction time was measured at different extraction temperatures, the first-order kinetic plate model was used to fit the experimental data; the activation energy, internal diffusion coefficient, Gibbs free energy, enthalpy and entropy of the extraction process of sterols from faba pods were calculated. The results showed that the sterols were successfully extracted from faba pods, and the yield of sterols was 6.2 mg/g. The liquid-solid ratio, ethanol volume fraction, stirring rate, extraction temperature and extraction time had effects on sterols yield. The suitable extraction process was the liquid-solid ratio of 20∶1, ethanol volume fraction of 80%, stirring rate of 200 r/min, and extraction time of 1.0 h. The first-order kinetic plate model was suitable for describing the extraction process of sterols. The activation energy of extraction was 22.50 kJ/mol in the range of temperatures examined. The internal diffusion coefficient increased from 2.08×10-10 m2/min to 4.95×10-10 m2/min with increasing extraction temperature. The Gibbs free energy of the extraction process was less than zero at all extraction temperatures, indicating that the extraction of sterol from old faba pods was a spontaneous process. The enthalpy and entropy of the extraction process of sterols from faba pods were 28.26 kJ/mol and 102.26 J/(mol·K), which indicated that the extraction process of sterols from faba pods was endothermic and increased entropy. The results could provide reference for large-scale application of the extraction of faba pods sterols.
Key words: faba pod; sterols; exctraction; model; kinetics; thermodynamics
据统计,2019年亞洲蚕豆(Vicia faba L.)产量占全球的88.5%,中国蚕豆种植面积占世界的36.68%,产量达1.11×104 kg/hm2,两者均位列世界第一[1]。然而除去可食部分,剩余的青蚕豆荚一般用于加工饲料、堆肥或丢弃,老蚕豆荚用作燃料或就地焚烧,不仅用途单一、附加值低,造成资源的浪费[2],而且焚烧产生的烟尘、CO2也会对环境造成污染。据报道,蚕豆荚多糖含量高、木质素含量低(分别为48.8%~56.5%和13.1%~14.4%),可用作替代资源开发利用[3];Petersson等[4]研究了蚕豆荚中的生物质在生物燃料-生物乙醇和沼气生产中的潜力;Minajeva等[5]对蚕豆废弃物用于球团生产和能源转化进行研究,结果表明其可以被用作生物燃料;也有报道从蚕豆荚中提取了原花青素[6];还有报道用蚕豆荚通过化学活化使其碳化合成硫磺和氮双掺杂多孔碳材料,用作储能装置的电极材料[7]。这些研究均涉及农业废弃物的资源化利用,对环境的保护与改善亦具有积极作用。
植物甾醇是一种具有高生物活性的物质,具有抗氧化、免疫调节、降胆固醇、促生长等生理活性功能,被誉为“生命钥匙”,已经被广泛应用于食品、饲料、化妆品、医药等行业[8-10]。然而还鲜见文献报道从蚕豆荚中提取甾醇,如果能将农业废弃物老蚕豆荚作为原料,从中提取较高含量的甾醇,就可以实现农业废弃物资源的循环利用,带来经济效益的同时也能减少燃烧蚕豆荚时造成的环境污染,减少温室气体排放。已有文献报道了从大豆荚中提取甾醇[11],受其启发,本研究用乙醇水溶液作为提取剂,探索从废弃的老蚕豆荚中提取甾醇,先对提取工艺进行单因素考察,然后在较优的提取条件下进行动力学试验,于不同提取温度下测定溶液中甾醇的质量浓度随提取时间变化的规律,进一步选用相关模型对试验数据进行关联,求解提取过程的动力学参数,进行提取过程的热力学分析,以期为规模化应用提供参考。
1 材料与方法
1.1 材料与仪器
材料:老蚕豆荚,采集于江西新余农家。
试剂:豆甾醇标准品,广州亮化化工有限公司;硫酸、无水乙醇,上海凌峰化学试剂有限公司;磷酸,浙江新安化工集团股份有限公司;氯化高铁,国药集团化学试剂有限公司;以上均为分析纯。
仪器:DK-S24型电热恒温水浴锅,上海精宏实验设备有限公司;T500Y型电子天平,常熟双杰测试仪器厂;722E型可见分光光度计,上海光谱仪器有限公司;800B型离心机,上海安亭科学仪器厂。
1.2 方法
1.2.1 样品处理将老蚕豆荚去杂后在50 ℃烘箱中恒温加热烘干,直到质量不再变化,进行分装,保存在干燥、鼠害不侵处。
1.2.2 甾醇质量浓度的测定
1)绘制甾醇标准曲线:精密称取豆甾醇标准样品5.000 mg,溶于无水乙醇,定容至10 mL,豆甾醇质量浓度至0.500 mg/mL,贮于棕色瓶中,低温保存备用。吸取2.5 mL储备液,用无水乙醇定容至25 mL,得到质量浓度为50 μg/mL豆甾醇标准溶液[12,13]。
取6支20 mL具塞试管,分别编号,均添加4 mL磷硫铁显色剂,分别加入0、3、4、5、6、7 mL的50 μg/mL豆甾醇标准溶液,并分别加入8、5、4、3、2、1 mL的无水乙醇,摇匀,显色15 min,然后用分光光度计在520 nm波长处测定吸光度。以甾醇质量浓度(X)为横坐标,以吸光度(A)为纵坐标,绘制标准曲线。得到回归方程:
A=0.001 7X-0.008 5 (1)
式中,X为甾醇质量浓度(以豆甾醇计,μg/mL);A为520 nm处的吸光度;相关系数R2=0.998 9,说明该方法线性良好。
2)蚕豆荚甾醇提取液质量浓度测定:用移液管精确吸取离心后得到的蚕豆荚甾醇提取清液2.00 mL于10 mL具塞试管内,加提取溶剂2.00 mL,再加磷硫铁试剂2.00 mL,另取一支空管加入4.00 mL乙醇和2.00 mL磷硫铁作对照。混匀,静置5 min,显色10 min,冷水浴冷却10 min,用分光光度计在520 nm波长处测定吸光度。
依照上述方法测定蚕豆荚甾醇的质量浓度后,即可得到蚕豆荚甾醇的收率(单位质量原料所提取得到的甾醇质量)。蚕豆荚甾醇的收率计算公式如下:
[Y=XVB1 000M] (2)
式中,Y为蚕豆荚甾醇的收率(mg/g);X为样品的甾醇质量浓度(μg/mL);V为提取液定容体积(mL);B为稀释倍数;M为原料豆荚用量(g)。
1.2.3 甾醇提取 流程:设置恒温水浴待其恒温,称原料样投入三口烧瓶,加入乙醇水溶液,将烧瓶固定在恒温水浴中,搅拌进行提取,达到提取时间时取样,离心,取上清液,测定浓度。
为确定各因素合适的条件,先进行提取条件的单因素试验,原料采用蚕豆荚小片(2~3 mm),固定提取时间1.0 h、提取温度70 ℃,分别研究液料比(提取溶剂体积与蚕豆荚质量比,15∶1、20∶1、25∶1、 30∶1、35∶1)、乙醇体积分数(60%、70%、80%、90%、100%)、搅拌速度(50、100、150、200、250 r/min)对蚕豆荚甾醇提取效果的影响;然后在此基础上进行动力学提取试验,于不同提取温度下测得提取溶液中甾醇的质量浓度随提取时间变化的试验数据(可以观察提取温度和提取时间对收率的影响)。
1.2.4 动力学模型与参数 乙醇以较低的速度渗入蚕豆荚,甾醇溶解进溶剂后以低速传递至固液界面,该过程对甾醇提取影响较大,是整个过程的限速控制步骤。蚕豆荚碎片基本是片状,因此豆荚中甾醇成分的提取过程可以尝试用一级动力学平板模型来描述。
对于片状壳类物质,可视为一维平板,扩散在平板中心面的两侧对称,分布在两侧的浓度任意时刻也必然对称,所以物料内部的有效浓度是均匀的。
一级动力学平板模型表示如下[14,15]:
[lnC∞C∞-C=kt+lnπC∞4C∞-C0] (3)
[k=π2Ds4L2] (4)
式中,t为提取时间(min);k为提取速率常数(1/min);Ds为内扩散系数(m2/min);L为距平板中心的距离(m);C∞为提取平衡时溶液中甾醇的浓度(mg/mL);C0为溶液中甾醇的初始浓度(mg/mL); C为t时刻溶液中的甾醇浓度(mg/mL)。
绘制[lnC∞C∞-C]与t的关系图,如果成线性,则说明一级动力学平板模型可以用来描述从老蚕豆荚中提取甾醇的过程,传质速率常数k可由直线斜率计算得到,C0、C∞可由直线截距计算,即可得到各提取温度下的动力学方程。式(3)即可作为蚕豆荚甾醇提取的动力学模型,该模型可直观反映出蚕豆荚的厚度、提取时间与蚕豆荚甾醇质量浓度之间的函数关系。
由动力学基本知识可知,对低浓度下的扩散过程,可用Arrhenius式将提取速率常数与提取温度进行关联[16-18]:
lnk=lnA-Ea/RT (5)
式中,k为提取速度常数(1/min),由动力学模型拟合而得;A为指前因子(1/min);R是气体常数,为8.314 J/(mol·K);T为提取温度(K);Ea为提取过程的表观活化能(J/mol)。
利用所得试验数据作lnk~1/T线性关系图,就可由直线斜率和截距分别计算出活化能Ea和指前因子A。
根据式(4),提取速率常数k是内扩散系数Ds、物料传质距离L(物料平板厚度的50%)的函数,根据各温度下的速率常数k和已知的物料厚度,即可计算得各温度下的内扩散系数Ds。
1.2.5 热力学分析 李亚峰等[16]对红松松针甾醇提取过程进行了热力学分析,其中热力学参数按照范德霍夫方程进行估算:
[lnK=-ΔGRT=-ΔHRT+ΔSR] (6)
[K=YcYn≈C∞CT-C∞] (7)
式中,K是平衡常数,无量纲;T是温度(K);R是气体摩尔常数,为8.314 J/(mol·K);ΔG为提取甾醇的自由能(kJ/mol);ΔH为提取甾醇的焓(kJ/mol);ΔS为提取甾醇的熵(J/(mol·K))。Yn是给定时间时原料中剩余的甾醇含量(mg/g);Yc是给定时间时提取液中甾醇含量(mg/g);CT为在考察的提取温度范围溶液中能达到的最高甾醇浓度(mg/mL);C∞为各自温度下提取平衡时溶液中甾醇浓度(mg/mL)。
根据式(6),以[lnC∞CT-C∞]对1/T作图,由斜率可计算得ΔH,由截距计算得ΔS,再由ΔG=ΔH-TΔS可计算得ΔG[19, 20]。
2 结果与分析
2.1 提取试验
2.1.1 单因素试验
1)液料比对甾醇收率的影响。在搅拌速度200 r/min、乙醇体积分数80%的条件下,考察蚕豆荚甾醇收率与液料比的关系,结果见图1。由图1可知,液料比的改变对甾醇收率有明显的影响,当液料比从15∶1 增加至20∶1时,对应的甾醇收率发生了很大的提升,出現6.2 mg/g的最高值。这是因为液料比的增加会使得溶液浓度被稀释,传质时的传质推动力增大,所以加快了传递速率。当液料比大于20∶1时,甾醇收率却开始不断降低。造成此现象的原因可能是溶剂的增多使得试验过程中有更多的其他成分溶解萃出,从而影响目标物的提取,并且这也导致后续的取样、计量等操作时间的延长,增加了甾醇的降解与损失[11]。因此,选择20∶1作为后续提取试验的适宜液料比。
2)乙醇体积分数对甾醇收率的影响。在液料比20∶1、搅拌速度200 r/min的条件下考察蚕豆荚甾醇收率与乙醇体积分数的关系,结果见图2。由图2可知,乙醇体积分数对甾醇收率的影响也很明显。在试验范围内,甾醇收率先随着乙醇体积分数的增加而增加,并且于乙醇体积分数为80%时出现6.2 mg/g的最高值,随后乙醇体积分数的增大对于收率的提高就造成了负面影响。出现此现象的原因可能是甾醇是羟基类化合物,羟基具有活性并且能够与乙醇和水形成氢键,所以甾醇在水中的溶解度和在有机溶剂中的溶解度有一定差异,而80%的乙醇溶液为最佳乙醇与水的配比,使得甾醇在此溶剂中溶解度最大。乙醇占比过高反而会影响其结合,且乙醇挥发性增大[11]。因此,选择80%作为后续提取试验的适宜乙醇体积分数。
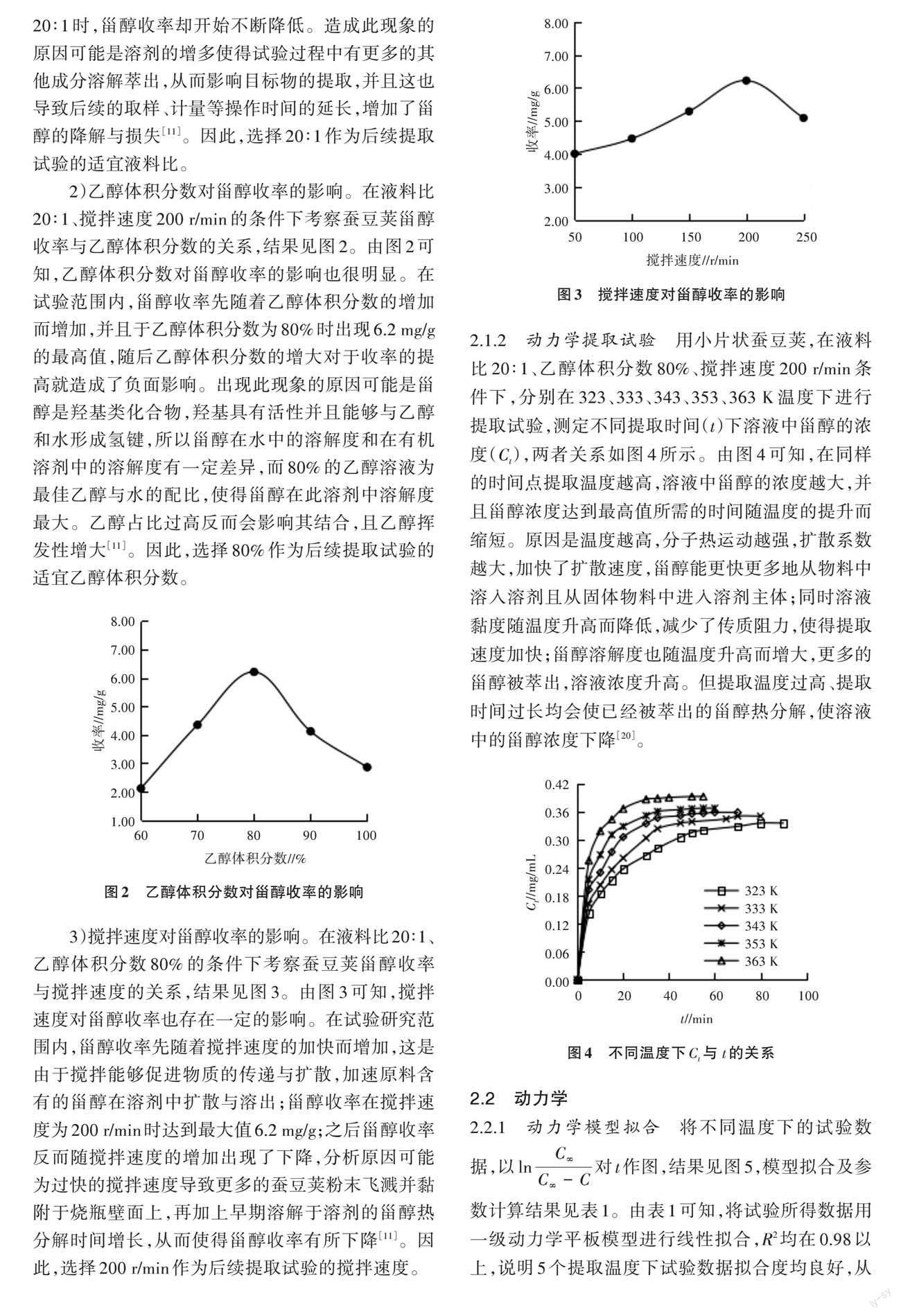
3)搅拌速度对甾醇收率的影响。在液料比20∶1、乙醇体积分数80%的条件下考察蚕豆荚甾醇收率与搅拌速度的关系,结果见图3。由图3可知,搅拌速度对甾醇收率也存在一定的影响。在试验研究范围内,甾醇收率先随着搅拌速度的加快而增加,这是由于搅拌能够促进物质的传递与扩散,加速原料含有的甾醇在溶剂中扩散与溶出;甾醇收率在搅拌速度为200 r/min时达到最大值6.2 mg/g;之后甾醇收率反而随搅拌速度的增加出现了下降,分析原因可能为过快的搅拌速度导致更多的蚕豆荚粉末飞溅并黏附于烧瓶壁面上,再加上早期溶解于溶剂的甾醇热分解时间增长,从而使得甾醇收率有所下降[11]。因此,选择200 r/min作为后续提取试验的搅拌速度。
2.1.2 動力学提取试验 用小片状蚕豆荚,在液料比20∶1、乙醇体积分数80%、搅拌速度200 r/min条件下,分别在323、333、343、353、363 K温度下进行提取试验,测定不同提取时间(t)下溶液中甾醇的浓度(Ct),两者关系如图4所示。由图4可知,在同样的时间点提取温度越高,溶液中甾醇的浓度越大,并且甾醇浓度达到最高值所需的时间随温度的提升而缩短。原因是温度越高,分子热运动越强,扩散系数越大,加快了扩散速度,甾醇能更快更多地从物料中溶入溶剂且从固体物料中进入溶剂主体;同时溶液黏度随温度升高而降低,减少了传质阻力,使得提取速度加快;甾醇溶解度也随温度升高而增大,更多的甾醇被萃出,溶液浓度升高。但提取温度过高、提取时间过长均会使已经被萃出的甾醇热分解,使溶液中的甾醇浓度下降[20]。
2.2 动力学
2.2.1 动力学模型拟合 将不同温度下的试验数据,以[lnC∞C∞-C]对t作图,结果见图5,模型拟合及参数计算结果见表1。由表1可知,将试验所得数据用一级动力学平板模型进行线性拟合,R2均在0.98以上,说明5个提取温度下试验数据拟合度均良好,从老蚕豆荚中提取甾醇的过程可以用此模型加以描述。同时,表1显示提取温度越高则提取速率常数k越大,这表明提取温度越高,提取速率越大,其原因在于温度升高,分子间的空隙增大、液体的黏度下降,致使分子的扩散阻力减小、扩散能力增大[20]。
2.2.2 表观活化能 根据试验数据和求得表1中的k值,作lnk~1/T图,结果如图6所示。由图6可知,两者可拟合成线性关系,回归系数R2>0.95,线性较好,说明试验数据较好地符合Arrhenius方程,由此可以得出提取蚕豆荚甾醇过程在液料比20∶1、乙醇体积分数80%、搅拌速度200 r/min等试验条件下的活化能Ea=2 706.4×8.314=22.50 kJ/mol,指前因子A=221.40 1/min。Ea>0,表明蚕豆荚甾醇的提取过程为吸热过程,因此提高提取温度有利于蚕豆荚甾醇的提取。两者的关联式为k=221.40e-2 706.4 1/T。
2.2.3 内扩散系数 经测量,老蚕豆荚的厚度约为0.000 2 m,则传质距离L=0.000 1 m,根据k=π2Ds/4L2,代入各温度下的提取速率常数k,可计算得各温度下的内扩散系数Ds,然后作Ds~T关系图,结果如图7所示。由图7可知,两者可拟合成指数函数,关系是Ds=3×10-20T7.886 3;回归系数R2>0.95。随着温度的上升,内扩散系数逐渐从2.08×10-10 m2/min增大到4.95×10-10 m2/min。这是因为温度越高,分子热运动加强,溶液黏度下降,有利于溶质的迁移,扩散越快。
2.3 热力学分析
在乙醇水溶液为溶剂的提取条件下,根据图4可以看出,在提取温度90 ℃下提取50 min时,提取达到平衡时所显示的溶液体系中的甾醇浓度为最大,假设此时溶液中的甾醇浓度为老蚕豆荚中甾醇固有的质量浓度CT。作[lnC∞CT-C∞]~1/T图,结果如图8所示。得到两者间的线性方程关系式:[lnC∞CT-C∞=-3 399.5T+12.3],依据该方程的斜率和截距计算得到焓ΔH、熵ΔS和吉布斯自由能ΔG的值,结果如表2所示。
由表2可知,在不同提取温度下,ΔH为28.26 kJ/mol,ΔS为102.26 J/(mol·K),两者数值都大于0,表明从老蚕豆荚中提取甾醇发生了吸热、熵增,说明升高提取温度有利于甾醇提取;由ΔG小于0可以判定甾醇提取能自发进行,且可由ΔG值随提取温度升高而逐渐减小的现象推定提取温度的升高会使得提取过程更容易进行[20]。
3 小结
本试验用乙醇水溶液作溶剂,成功地从老蚕豆荚中提取了甾醇。碎片状蚕豆荚在液料比20:1、乙醇体积分数80%、搅拌速度200 r/min条件下提取甾醇能获得较高的收率。在考察温度范围内,溶液中的甾醇浓度随提取温度升高而增大,达到平衡所需时间随提取温度升高而缩短;但温度不宜过高,时间不宜过长,否则提取的甾醇会热降解;从老蚕豆荚中提取甾醇的过程可用一级动力学平板模型来描述;提取过程的表观活化能为22.50 kJ/mol;内扩散系数与提取温度两者关系为Ds=3×10-20T7.886 3;过程的焓为28.26 kJ/mol、熵为102.26 J/(mol·K),吉布斯自由能均小于0,说明乙醇水溶液提取蚕豆荚甾醇过程为自发、吸热、熵增的过程;增加提取温度,有利于实现从蚕豆荚中提取甾醇。
参考文献:
[1] 喻敏博, 张 贵, 侯 璐, 等. 青海省34份蚕豆资源抗赤斑病性评价分析[J]. 分子植物育种, 2021, 19(13): 4504-4516.
[2] 阎 娥, 刘颖坤, 刘建利, 等. 响应曲面法优化蚕豆壳中原花青素的微波提取工艺[J]. 食品科技, 2009, 34(11): 163-167.
[3] ALKHTIB A S, WAMATU J A, WEGI T, et al. Variation in the straw traits of morphological fractions of faba bean (Viciafaba L.) and implications for selecting for food-feed varieties[J]. Animal feed science and technology, 2016, 222: 122-131.
[4] PETERSSON A, THOMSEN M H, HAUGGAARD-NIELSEN H, et al. Potential bioethanol and biogas production using lignocellulosic biomass from winter rye, oilseed rape and faba bean[J]. Biomass and bioenergy, 2007, 31(11-12): 812-819.
[5] MINAJEVA A,JASINSKAS A,DOMEIKA R,et al. The study of the faba bean waste and potato peels recycling for pellet production and usage for energy conversion[J]. Energies,2021,14(10): e2954.
[6] 阎 娥, 刘建利, 原江锋, 等. 蚕豆壳中原花青素的提取及抗氧化性研究[J]. 食品工业科技, 2009, 30(2): 65-67.
[7] XU G Y, HAN J P, DING B, et al. Biomass-derived porous carbon materials with sulfur and nitrogen dual-doping for energy storage[J]. Green chemistry, 2015, 17(3): 1668-1674.
[8] PLAT J, BAUMGARTNER S, VANMIERLO T, et al. Plant-based sterols and stanols in health & disease: “Consequences of human development in a plant-based environment?”[J]. Progress in lipid research, 2019, 74: 87-102.
[9] RAS R T, KOPPENOL W P, GARCZAREK U, et al. Increases in plasma plant sterols stabilize within four weeks of plant sterol intake and are independent of cholesterol metabolism[J]. Nutrition, metabolism and cardiovascular diseases, 2016, 26(4): 302-309.
[10] 张泽生,于衛涛. 超声波法提取米糠中植物甾醇的工艺研究[J]. 食品研究与开发, 2007, 28(1): 43-46.
[11] 诸爱士, 金志强, 潘明纬, 等. 响应面法优化大豆豆荚甾醇提取工艺的研究[J]. 中国粮油学报, 2020, 35(4): 127-133.
[12] 汤锦程, 钟 鑫, 吴雪辉, 等. 超声波强化油茶籽油油脚中甾醇的提取研究[J]. 中国油脂, 2011, 36(10): 70-73.
[13] 张 寒, 李锋丽, 马亚荣, 等. 正交设计优化青荚叶中植物甾醇的提取工艺[J]. 应用化工, 2014, 43(2): 212-214.
[14] 李 冬, 李稳宏, 廉媛媛, 等. 化香树果序总黄酮提取动力学研究[J]. 天然产物研究与开发, 2011, 23(4): 689-692, 708.
[15] 吴 洁, 诸爱士, 金志强, 等. 大豆荚甾醇提取动力学与热力学的研究[J]. 中国粮油学报, 2020, 35(12): 87-93.
[16] 李亚峰, 修 毅, 杨元直, 等. 超临界CO2萃取红松松针甾醇的动力学和热力学[J]. 林业科学, 2018, 54(4): 128-133.
[17] 李兰兰, 张 宇, 赵统超, 等. 超声波辅助提取白鲜皮多糖的动力学模型研究[J]. 辽宁中医杂志, 2018, 45(6): 1247-1250.
[18] 郭宏垚, 李 冬, 雷 雄, 等. 花椒多酚提取工艺响应面优化及动力学分析[J]. 食品科学, 2018, 39(2): 247-253.
[19] 刘继超, 刘晓风, KIATOUKOSIN L, 等. 地木耳粗多糖超声波辅助提取工艺优化及其动力学和热力学分析[J]. 天然产物研究与开发, 2018, 30(2): 316-324.
[20] LIAO Y C, FAN F Y, ZHU A S, et al. Kinetics characteristics and thermodynamics analysis of soybean pods sterols extraction process[J]. Environmental challenages, 2021, 5: e100357.
