基于指纹图谱结合化学模式识别对接骨草的质量评价
2023-12-25海来约布蔡晓霞地久此呷兰建龙曲别军长李文兵
文 阳,海来约布,蔡晓霞,地久此呷,兰建龙,曲别军长,马 权,刘 圆,3,4,李文兵,3,4*
1. 西南民族大学,四川 成都 610041
2. 四川中医药高等专科学校,四川 绵阳 621000
3. 四川省羌彝药用资源保护与利用技术工程实验室,四川 成都 610225
4. 青藏高原民族药用资源保护与利用国家民委重点实验室,四川 成都 610225
5. 新疆医科大学药学院,新疆 乌鲁木齐 830054
接骨草又名陆英,为忍冬科接骨木属植物接骨草SambucusjavanicaBlume.的干燥全草,具有疏肝健脾、活血化瘀、利尿消肿的功效,用于急性病毒性肝炎,肾炎水肿,跌扑损伤,骨折[1]。接骨草最早以陆英之名在《神农本草经》中记载:“主骨问诸痹,四肢拘挛疼酸,膝寒痛”[2]。说明其最早用于治疗骨科疾病,与现代羌医临床用于治疗骨伤骨病一致。其资源非常丰富,广泛分布于我国各地山坡、林下、沟边和草丛中[3]。
近年来,国内外学者对接骨草开展了较为广泛的研究,但多集中在化学成分和药理活性,对于其质量评价研究较少。现代研究表明,接骨草化学成分主要有黄酮类、苯丙素类、甾体类、酚酸类及挥发油类成分[4-8]。《卫生部药品标准中药材第一册》(1992 年版)收载接骨草标准(陆英),但仅有简单的性状描述,缺乏含量测定项,难以全面控制和评价药材的质量。本研究以不同产地17 批接骨草为研究对象,通过HPLC 指纹图谱对接骨草主要化学成分进行宏观整体表征,并结合化学模式识别谱对指纹图谱中提取共有峰的面积进行分析,从而得到影响不同产地质量的特征化学成分并进行含量测定,拟为接骨草质量控制提供科学依据。
1 仪器与试药
1.1 仪器
Agilent 1260 型高效液相色谱仪(美国安捷伦科技公司),ME-104/02 型万分之一电子天平(梅特勒-托利多仪器有限公司),ME-55/02 型十万分之一电子天平(梅特勒-托利多仪器有限公司),XP26 型百万分之一电子天平(Mettler Toledo 公司),KQ300DB 型超声波清洗器(昆山市超声仪器有限公司),HWS-26 型电热恒温水浴锅(上海一恒科学仪器有限公司),1810D 型摩尔超纯水器(重庆摩尔水处理设备有限公司)。
1.2 试剂
绿原酸(批号MUST-21070910,质量分数≥99.60%)、新绿原酸(批号MUST-21030108,质量分数≥99.67%)、隐绿原酸(批号MUST-21082610,质量分数≥99.88%),均购于成都曼思特生物科技有限公司;乙腈为色谱纯,水为超纯水,其余试剂均为分析纯。
1.3 药材
17 批接骨草药材分别采自于四川省成都市、阿坝州和西藏自治区林芝市,经西南民族大学青藏高原研究院刘圆教授鉴定为忍冬科接骨木属植物接骨草S.javanicaBlume.的干燥全草,信息见表1。

表1 接骨草样品来源信息Table 1 Sample information of S. javanica
2 方法与结果
2.1 色谱条件
Agilent C18(150 mm×4.6 mm,4 μm)色谱柱,流动相为乙腈(A)-0.2%磷酸溶液(B),梯度洗脱,0~11 min,90%~82% B;11~30 min,82%~80%B;30~35 min,80%~90% B;检测波长为327 nm,体积流量为1.0 mL/min,柱温为30 ℃;进样体积为10 μm。
2.2 供试品溶液的制备
取接骨草粉末(过三号筛)0.5 g,精密称定,置具塞锥形瓶中,精密加入50%甲醇20 mL,密塞,称定质量,回流提取30 min,放冷,再称定质量,用50%甲醇补足减失的质量,摇匀,滤过。取续滤液,即得。
2.3 对照品溶液的制备
分别取新绿原酸5.09 mg、绿原酸5.04 mg、隐绿原酸5.30 mg 对照品,精密称定,置于5 mL 量瓶,用50%甲醇稀释至刻度,得混合对照品母液,质量浓度分别为1.018、1.008、1.060 mg/mL;再精密量取母液1 mL,置于5 mL 量瓶,用50%甲醇稀释至刻度,制得含新绿原酸0.203 6 mg/mL、绿原酸0.201 6 mg/mL、隐绿原酸0.212 0 mg/mL 的混合对照品。
2.4 方法学考察
2.4.1 精密度考察 取同一接骨草供试品(S1),按“2.2”项下方法制备供试品溶液一份,按“2.1”项下色谱条件连续进样6 次,以绿原酸(3 号峰)为参照峰(S),计算各特征峰的相对保留时间与相对峰面积。各特征峰的相对保留时间RSD 值分别为0.06%、0.05%、0.08%、0.10%、0.07%、0.09%、0.12%、0.07%,各特征峰的相对保留峰面积分别为0.25%、0.96%、0.32%,1.43%、1.23%、0.79%、1.86%、0.88%均小于2%,表明仪器精密度良好。
2.4.2 重复性考察 取同一接骨草供试品(S1),按“2.2”项下方法制备6 份供试品溶液,按“2.1”项下色谱条件进样,以绿原酸(3 号峰)为参照峰(S),计算各特征峰的相对保留时间与相对峰面积。各特征峰的相对保留时间RSD 值分别为0.09%、0.07%、0.03%、0.06%、0.08%、0.08%、0.09%、0.10%,各特征峰的相对峰面积RSD 值分别为0.35%、0.89%、0.11%、0.81%、1.01%、1.89%、1.42%、1.43%均小于2%,表明重复性良好。
2.4.3 稳定性试验 取同一接骨草供试品(S1),按“2.2”项下方法制备供试品一份,按“2.1”项下色谱条件分别于配制后0、4、10、14、24 h 进样,以绿原酸(3 号峰)为参照峰(S),计算各特征峰的相对保留时间与相对峰面积。各特征峰的相对保留时间RSD 值分别为0.06%、0.06%、0.03%、0.03%、0.03%、0.04%、0.04%、0.04%,各特征峰相对峰面积RSD 值分别为0.88%、1.14%、1.19%、0.69%、1.11%、1.26%、1.36%、1.85%,均小于2%,表明稳定性良好。
2.5 指纹图谱的建立及相似度评价
取17 批不同产地接骨草药材按“2.2”项下方法制备供试品溶液,按“2.1”项色谱条件进样并记录色谱数据,将所得的17 批接骨草色谱图以AIA格式导入“中药色谱指纹图谱相似度评价系统(2012.1 版本)”,设S6 为参照峰多点校正得到接骨草样品的指纹图谱(图1),并进行相似度评价。17批接骨草指纹图谱的共有峰有9 个,通过对照品图谱对比,指认其中3 个色谱峰,见图2,即1 号峰为新绿原酸、2 号峰为绿原酸及3 号峰为隐绿原酸。2 号峰峰面积较大,峰形与分离度较好,故选择2 号峰(绿原酸)为参照峰(S),计算共有峰相对保留时间RSD%均小于0.5%,但共有峰相对峰面积为44.68%~136.11%,差异较大,表明17 批接骨草药材中9 个化合物之间含量差异较大,相对峰面积结果见表2。以接骨草药材指纹图谱为对照,17 批接骨草药材的相似度为0.926~0.998,相似度均大于0.9,说明不同接骨草药材批次整体相似度较高,相似度评价见表3。

图1 17 批接骨草药材的HPLC 指纹图谱Fig. 1 UPLC fingerprints of 17 batches of S. javanica
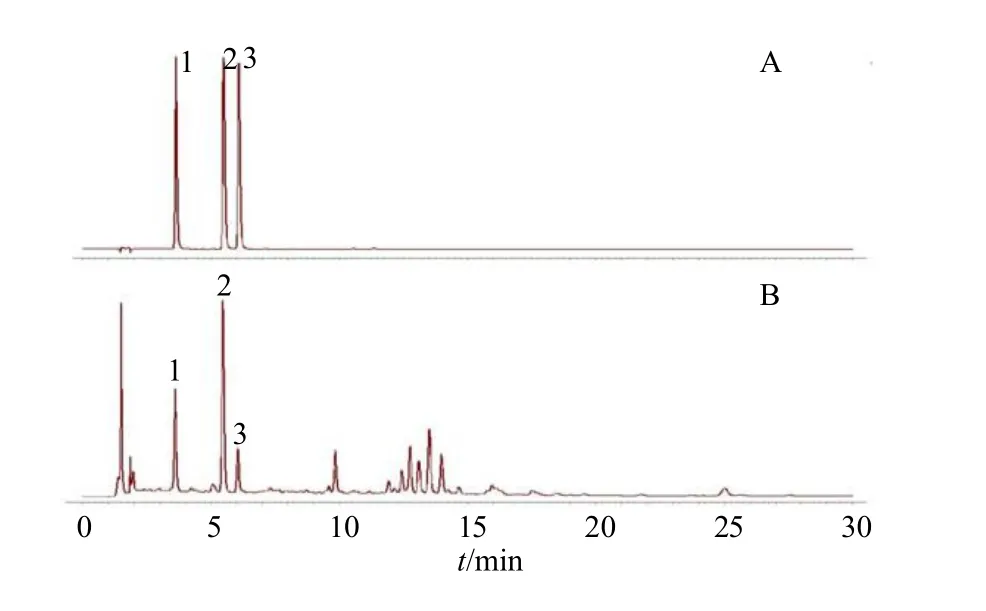
图2 混合对照品 (A) 和样品 (B) HPLC 色谱图Fig. 2 HPLC of reference substance (A) and samples (B)

表3 17 批接骨草药材相似度评价结果Table 3 Results of similarity evaluation of 17 batches of S.javanica fingerprints
2.6 基于化学模式识别对接骨草药材的分析
2.6.1 聚类分析(cluster analysis,CA) 利用SPSS.26.0 软件以接骨草指纹图谱标定的9 个共有峰的峰面积为变量,对17 批接骨草药材数据进行聚类分析,采用最远邻元素的聚类方法,以平方欧式距离为样品间距离进行聚类分析,结果见图3。当分类距离15 时,显示17 批样品共聚为3 类,其中来自成都市双流区黄甲镇产地的S10 单独聚为一类为,S6(汶川县卧龙镇三圣沟)、S9(汶川县卧龙镇三家寨)、S13(黑水县达古冰川)聚为一类,其余成都产地、汶川产地、黑水产地、全部茂县产地和西藏产地聚为一类。
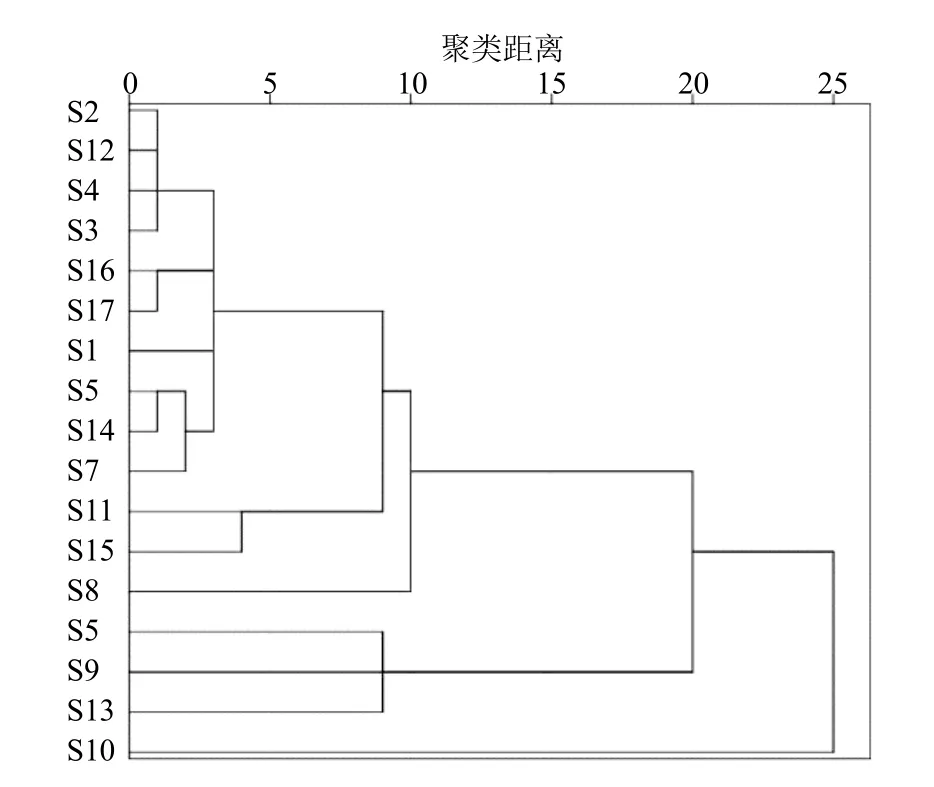
图3 17 批接骨草药材聚类分析树状图Fig. 3 Dendrogram of cluster analysis of 17 batches of S.javanica
2.6.2 主成分分析(principal component analysis,PCA) 采用SPSS.26.0 软件对17 批接骨草的9 个共有峰峰面积进行降维标准化处理,计算相关系数载荷矩阵、特征值和累积方差贡献率,结果显示KMO 值为0.533>0.5,代表各变量相关性较好,以主成分特征值>1 为提取标准,提取得到3 个主成分(L1、L2 和L3),主成分累积方差贡献率为77.643%,结果见表4,能基本反映样品共有峰的信息,以主成分因子变量绘制公因子碎石图,结果显示特征值较高的3 个主成分因子的斜率更大,说明所提取的3 个主成分可以最大程度地代表接骨草药材的整体质量特征。因此可将这3 个主成分作为接骨草药材的评价指标。初始因子载荷矩阵,见表5,将其进行正交旋转,旋转后得到的9 个共有峰成分在3 个主成分中的旋转矩阵,反映了各变量对主成分的贡献大小,其绝对值越大对该成分在决定样品区分中的作用越大。载荷矩阵结果表明主成分1 信息主要来自3 号峰(绿原酸)、5 号峰、9 号峰,主成分2 信息主要来自1 号峰(新绿原酸)、4 号峰(隐绿原酸),主成分3 信息主要来自7 号峰。并根据主成分载荷矩阵,计算3 个主成分得分,3 个主成分得分表达式:L1=−0.079X1+0.023X2+0.546X3+0.157X4+0.518X5+0.197X6+0.119X7-0.075X8+0.315X9;L2=0.716X1+0.454X2+0.190X3+0.371X4+0.242X5+0.006X6+0.187X7+0.447X8-0.004X9。L3=0.033X1-0.014X2-0.014X3+0.119X4-0.014X5+0.042X6+1.396X7+0.689X8+0.350X9。将17 批样品各特征向量标准化,代入主成分得分表达式中计算主成分得分,再以每个主成分所对应的贡献率占所提取主成分总的贡献率之和的比例作为权重计算主成分综合模型[9]:L综=0.220X1+0.098X2+0.325X3+0.226X4+0.330X5+0.103X6+0.362X7+0.240X8+0.209X9,3 个主成分得分及综合得分情况见表6,其中S10 综合得分为2.866 远高于其他批次,可单独聚为一类;S6、S9 和S13 综合得分均大于1 而小于2,将该3 批聚为一类;S2~S5、S7~S9、S11~S12、S14~S17 综合得分均为小于1,因此将该13 批样品聚为一类,这与聚类分析结果一致。根据综合得分可知,其值越大表明峰面积相对越大,说明药材含量相对含量越高[10],可知S10 批次含量最高,S6、S9 和S13 批次次之,然后为S1、S8、S11 批次,S2~S5、S7、S9、S12、S14~S17 样品批次排最后。
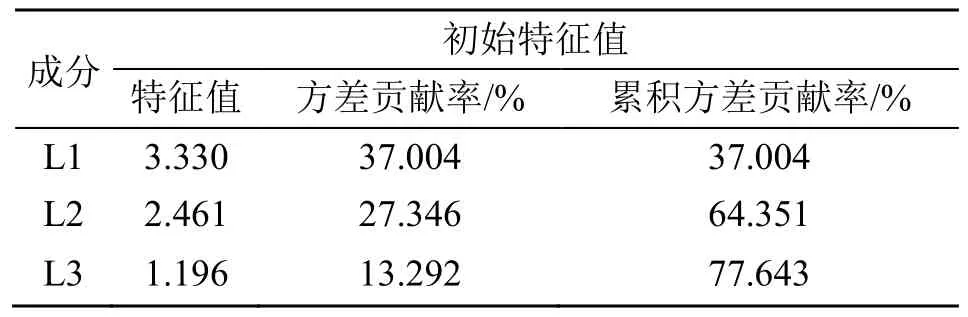
表4 特征值及累积方差贡献率Table 4 Eigenvalue and cumulative variance contribution rate

表5 初始因子载荷矩阵Table 5 Initial factor load matrix

表6 主成分得分和综合得分Table 6 Principal component score and comprehensive score table
用SIMAC14.1 软件对17 批接骨草药材样品进行主成分分析,以指纹图谱中的9 个共有峰峰面积为变量,以此构建17×9 的原始数据矩阵,绘制17 批不同产地接骨草样品的PCA 得分图,见图4,结果显示3 个主成分能反映不同产地接骨草的主要特征,说明不同产地接骨草在化学成分含量上存在一定差异。

图4 接骨草PCA 得分散点图Fig. 4 PCA scores of S. javanica
2.6.3 正交偏最小二乘-判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA) 为了进一步区分不同产地的接骨草组内质量差异,将17 批样品9 个共有峰峰面积导入SIMAC14.1 软件进行OPLS-DA 方法分析,建立OPLS-DA 模型,见图5,结果显示17 批接骨草样品被分为3 类,与聚类分析和主成分分析结果一致,结合OPLS-DA 模型中变量重要性投影值(variable importance in the projection,VIP)(图6)进行分析,以VIP>1 为条件筛选出差异标志物,筛选出4 个差异标志物,对接骨草样品的影响程度依次为3 号峰(绿原酸)>4 号峰(隐绿原酸)>5 号峰(未知)>1 号峰(新绿原酸),其对应的VIP 值依次为1.155、1.152、1.093、1.086,见表7,说明绿原酸(3 号峰)、隐绿原酸(4 号峰)、5 号峰及新绿原酸(1 号峰)是不同产地的接骨草有的差异标志物。

图5 接骨草样品OPLS-DA 得分图Fig. 5 OPLS-DA scores of S. javanica

图6 17 批接骨草样品的OPLS-DA 的VIP 图Fig. 6 VIP value from OPLS-DA load diagram of 17 batches of S. javanica

表7 接骨草各成分VIP 值Table 7 VIP values of each component of S. javanica
2.7 接骨草差异特征成分的含量测定
采用指纹图谱结合CA、PCA 及PLS-DA 对不同批次的接骨草样品进行研究分析,通过PCA 可知3 号峰(绿原酸)、5 号峰、9 号峰,1 号峰(新绿原酸)、4 号峰(隐绿原酸)以及7 号峰是影响不同批次接骨草样品质量的特征化学成分。由PLS-DA 结果可知VIP>1 的有3 号峰(绿原酸)、4 号峰(隐绿原酸)、5 号峰及1 号峰(新绿原酸),表明不同批次间的含量差异较大,是接骨草的差异性特征成分,基于刘昌孝院士[11-13]提出的于质量标志物(quality marker,Q-Marker)的五大原则既有效性、特有性、传递性与溯源性、可测性,推测5 号峰不适合作为接骨草质量标准控制的特征指标。综上,本实验以绿原酸、隐绿原酸、新绿原酸作为接骨草差异特征成分进行含量测定。
2.7.1 线性关系考察 取新绿原酸、绿原酸和隐绿原酸混合对照品5 mL,用50%甲醇逐级稀释2 倍成6 个对照品溶液,按“2.1”项下色谱条件测定新绿原酸、绿原酸和隐绿原酸的峰面积,绘制标准曲线,计算线性回归方程及相关系数(r),结果见表8。

表8 对照品的线性方程、相关系数和线性范围Table 8 Linear equation, correlation coefficient and linear range of reference substance
2.7.2 精密度试验 取混合对照品一份,按“2.1”项下色谱条件连续进样6 次,测得新绿原酸、绿原酸、隐绿原酸峰面积的RSD值分别为1.07%、0.26%、0.27%,结果显示仪器精密度良好。
2.7.3 重复性试验 取接骨草(S1)样品按“2.2”项下方法制备6 份供试品溶液,按“2.1”项下色谱条件进样,测得新绿原酸、绿原酸、隐绿原酸质量分数的RSD 值分别为0.54%、0.43%、0.44%,结果表明该方法的重复性良好。
2.7.4 稳定性试验 按“2.2”项下方法制备供试品一份,按“2.1”项下色谱条件分别在0、4、10、14、24 h 进样,测得新绿原酸、绿原酸、隐绿原酸峰面积的RSD 值分别为0.73%、2.23%、1.01%,表明供试品24 h 内稳定。
2.7.5 加样回收率试验 精密称S1 样品0.25 g,共6 份,分别加入一定量的新绿原酸、绿原酸、隐绿原酸对照品溶液,按“2.2”项下方法制备供试品,按“2.1”项下色谱条件进样,新绿原酸、绿原酸、隐绿原酸的加样回收率分别为95.26%、96.68%、98.07%,RSD 分别为1.52%、1.31%、0.99%。
2.7.6 样品含量测定 取17 批接骨草样品,按“2.2”项下方法制备供试品,按“2.1”项下色谱条件,进样分析,测定17 批样品新绿原酸、绿原酸、隐绿原酸含量,结果见表9,接骨草药材中新绿原酸、绿原酸、隐绿原酸平均质量分数分别为0.034%、0.190%、0.036%。

表9 17 批接骨草样品中差异特征成分的含量Table 9 Contents of Q-Markers in S. javanica
3 讨论
本实验考察了不同提取溶剂(水、乙醇、甲醇、70%甲醇、50%甲醇和30%甲醇)、不同提取时间(15、30、45、60 min)、不同提取方法(超声、回流)、不同料液比(1∶20、1∶40、1∶60)对接骨草药材指纹图谱色谱图及含量测定的影响,结果发现:提取时间、提取方法及料液比对接骨草指纹图谱色谱图及含量测定无明显改变,而50%甲醇提取的色谱峰较多新绿原酸、绿原酸及隐绿原酸含量较高。故选择料液比为1∶20,50%甲醇超声提取30 min 为最佳提取方法。同时在《中国药典》2020 年版和文献的洗脱方法基础上进行优化,考察了甲醇-纯水、乙腈-0.2%磷酸水梯度洗脱2 种流动相体系,结果发现以乙腈-0.2%磷酸水为流动相时,样品的分离度最佳,故选择乙腈-0.2%磷酸水作为流动相;通过全波长扫描,比较不同波长色谱图,发现在327 nm 处色谱峰目标成分分离度最佳,故选择327 nm 作为接骨草药材指纹图谱的检测波长。
综上,本实验采用指纹图谱结合相似度评价、CA、PCA、PLS-DA 分析对不同产地接骨草药材进行质量评价研究,筛选出特征性指标成分并进行定量分析。利用HPLC 建立了17 批接骨草药材指纹图谱有9 个共有峰,指认了其中3 个特征峰,分别为新绿原酸、绿原酸和隐绿原酸。相似度表明 17 批接骨草药材的相似度均大于0.9,说明不同接骨草药材批次整体相似度较高。在聚类分析中,将17 批样品聚成3 类,既S10为单独一类,S6、S9、S13 聚为一类,其余13 批次聚为一类。PCA 和OPLS-DA 与CA 结果一致,表明17 批接骨草样品化学成分既有相似性又有差异性,采用OPLS-DA 模型VIP 值筛选出绿原酸、隐绿原酸、新绿原酸是接骨草的差异性特征成分。研究表明绿原酸具有调控成骨细胞增殖和分化的能力,也可促进成骨细胞的增殖,抑制成骨细胞碱性磷酸酶活性,从而具有一定的成骨活性,是接骨草的成骨活性成分之一[14],新绿原酸、绿原酸、隐绿原酸具有治疗免疫性关节炎的作用[15],与接骨草的接骨功效有一定关联性。结合化学模式识别对指纹图谱中提取共有峰的面积进行分析,并基于中药Q-Marker 的“五大原则”,推测绿原酸、隐绿原酸、新绿原酸为接骨草药材的 QMarkers,为接骨草药材质量评价及临床应用提供参考。
利益冲突所有作者均声明不存在利益冲突
