血见愁中1 个新的倍半萜类化合物
2023-12-25王建斌付宏征
王建斌,高 纯,陈 昊,付宏征
1. 扬州大学医学院(转化医学院),江苏 扬州 225009
2. 江苏省中西医结合老年病防治重点实验室,江苏 扬州 225009
3. 北京大学医学部 天然药物及仿生药物国家重点实验室,北京 100191
唇形科(Labiatae)香科科属TeucriumL.植物在全球约有300 余种,遍布世界各地,尤其是在地中海地区。我国有18 种、10 变种,全国各地均有分布,多数种主要集中在西南地区[1-3]。香科科属植物作为药用植物已有2000 多年的历史,具有清热解毒、发表散寒、健脾利湿等功效,民间主要用以治疗风寒感冒、消化不良、痢疾、无名肿痛、跌打损伤等症[4],化学成分及现代药理研究表明香科科属植物的主要化学成分为单萜、倍半萜、二萜、甾醇、皂苷、环烯醚萜、黄酮、多酚、生物碱及挥发油,主要药理活性有抗炎、抗氧化、抗肿瘤、抗菌及降血糖的作用[5-15]。
血见愁TeucriumviscidumBl.,又名山藿香、肺形草、布地锦等,产于江苏南部、浙江、福建、台湾、江西、湖南、广东、广西、云南、四川西南部及西藏东南部。全草入药,各地广泛用于风湿性关节炎、跌打损伤、肺脓疡、急性胃肠炎、消化不良、冻疮肿痛、翠丸陉肿、吐血、衄血、外伤出血、毒蛇咬伤、疗疮疖肿等症[1]。据《岭南采药录》载:“凉血解毒,去瘀生新,理跌打,敷疮毒,治蛇伤,消肠风下血”。但是关于其化学成分及药理作用的研究等方面报道较少[6,11-15]。为了进一步丰富血见愁的化学成分库,本研究对其全草乙醇提取物进行系统的化学成分研究,得到1 个倍半萜类化合物和6 个苯丙素类化合物(图1),分别鉴定为9-羟基-6,7-去环氧-茎点霉甜菜烯酮(9-hydroxy-6,7-deepoxyphomenone,1)、迷迭香酸(rosmarinic acid,2)、迷迭香酸甲酯(methyl rosmarinate,3)、迷迭香酸乙酯(ethyl rosmarinate,4)、反式咖啡酸(trans-caffeic acid,5 )、反式咖啡酸乙酯(trans-caffeic acid ethyl ester,6)、反式咖啡酸乙烯酯(trans-caffeic acid,7)。其中,化合物1 为新化合物,命名为血见愁酮A,化合物2~4 为血见愁植物中首次分离得到。同时对所得化合物进行了超氧阴离子清除活性筛选,以期发现具有抗氧化活性的化合物,为血见愁的后续开发研究提供基础。
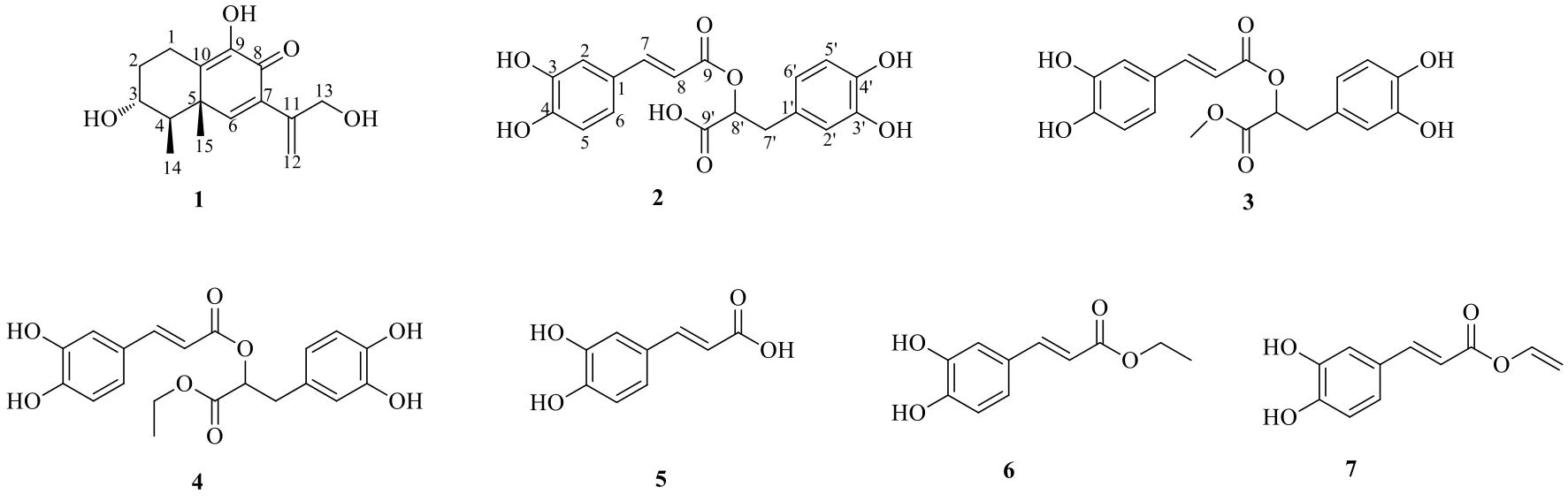
图1 化合物1~7 的结构Fig. 1 Structures of compounds 1−7
1 仪器与材料
Bruker-400/Avance DRX-400 核磁共振光谱仪(德国Bruker 公司),Nicolet Nexus 470 红外光谱仪(美国Thermo 公司),XEVO-G2QTOF# YCA166 质谱仪(美国Waters 公司),PL341/343 型旋光仪(美国Perkin-Elmer 公司),BP1224S 万分之一电子秤(北京赛多利斯天平有限公司),LabAlliance 分析型高效液相(天津兰博实验仪器设备有限公司),Waters 2487 型半制备型高效液相(美国Waters 公司),Rotavapor R-210 旋转蒸发仪(瑞士Buchi 公司)。
分析纯甲醇、乙腈、醋酸乙酯、氯仿、石油醚、丙酮、正丁醇(分析纯,北京化工厂),柱色谱用硅胶(200~300、60~80 目,安徽良臣硅源材料有限公司),Sephadex LH-20 葡聚糖凝胶(台州市路桥四甲生化塑料厂),薄层色谱硅胶H(青岛海洋化工厂),YMC*GEL ODS-A 反相硅胶(日本YMC 公司)YMC-pack C18column 半制备型色谱柱(日本YMC 公司)。
血见愁于2012 年3 月采购自广东清远药材市场,由广东中医药大学关世侠教授鉴定为T.viscidumBl.。植物样品(201210XJC)保存在北京大学天然药物及仿生药物国家重点实验室。
2 提取与分离
10 kg 干燥血见愁全草用10 倍量95%乙醇提取3 次,每次4 h。得到浸膏3.1 kg。将其溶解于热水中,醋酸乙酯萃取3 次,得到醋酸乙酯层181.4 g。将其溶解于甲醇溶液中,用石油醚萃取,共得到石油醚层25.4 g(暂存),余下甲醇部分156.0 g。
将甲醇部分经硅胶柱分离,氯仿-甲醇系统(100∶0→0∶1)梯度洗脱,得到10 个组分(Fr. 1~10),组分Fr. 3(7.3 g)经硅胶柱色谱分离,石油醚-醋酸乙酯系统(5∶1→1∶2)梯度洗脱,得到9个组分Fr. 3.1~3.9,Fr. 3.5(236.5 mg)经Sephadex LH-20 分离(甲醇洗脱),制备液相色谱纯化(48%甲醇-水洗脱,体积流量1.5 mL/min),得到化合物1(8.9 mg,tR=58.5 min)。组分Fr. 3.3(1.25 g)Sephadex LH-20 分离(甲醇系统洗脱),制备液相纯化(45%甲醇-水洗脱,体积流量1.5 mL/min),得到化合物6(13.1 mg,tR=59.2 min)和7(8.3 mg,tR=63.5 min)。组分Fr. 7(33.6 g)经硅胶柱分离,石油醚-醋酸乙酯(3∶1→1∶3)梯度洗脱,重结晶得到化合物5(25.5 mg)。组分Fr. 8(16.1 g)经硅胶柱分离,石油醚-醋酸乙酯(3∶1→1∶3)梯度洗脱,得到8 个组分Fr. 8.1~8.8,Fr. 8.8(133.4 mg)经Sephadex LH-20 分离(甲醇洗脱),制备液相色谱纯化(42%甲醇-水洗脱,体积流量1.5 mL/min),得到化合物2(20.1 mg,tR=22.6 min)、3(32.3 mg,tR=39.7 min)和4(3.8 mg,tR=42.2 min)。
3 结构鉴定
13C-NMR 谱结合DEPT 谱共给出1 个共轭酮羰基 (δC180.7)、6 个烯碳 (δC155.3, 135.1, 143.8,138.1, 148.4, 114.1)、1 个sp3杂化的季碳 (δC43.4)、2 个sp3杂化的次甲基碳 (δC70.6, 44.9)、3 个sp3杂化的亚甲基碳 (δC64.6, 36.0, 19.1) 和2 个甲基碳(δC20.9, 13.9)。1H-NMR 给出3 个次甲基氢δH7.36(s, H-6), 3.97 (d,J= 2.4 Hz, H-3), 1.44 (td,J= 7.1,2.4 Hz, H-4);1 对末端烯氢δH5.81 (d,J= 1.5 Hz,H-12α), 5.63 (s, H-12β);3 对亚甲基氢δH4.89 (s, 2H,H-13), 3.40 (brd,J= 2.8 Hz, H-1α), 2.77 (td,J= 13.4,4.2 Hz, H-1β) 和δH2.22 (brd,J= 13.4 Hz, H-2α),1.64 (tt,J= 13.4, 2.8 Hz, H-2β);2 个甲基信号δH1.35(d,J= 7.1 Hz, CH3-14), 1.56 (s, CH3-15)。二维核磁信号的详细解析(图2)表明该化合物与已知化合物(+)-6-dehydropetasol[16]非常相似,不同之处在于低场区比其少了1 个9 位烯氢,且9 位烯碳的化学位移符合连氧烯碳的特征,表明化合物1 中9 位上的烯氢被羟基取代;另外高场区少了1 个13 位甲基信号,而在化学位移64.6 处多了1 对连氧次甲基信号δH4.89 (2H, s, H-13) 表明化合物1 的13 位由甲基变成羟甲基。在HMBC 谱中(图2),H-13 (δH4.89)与C-11 (δC148.4)、C-7 (δC135.1)、C-12 (δC114.1) 有相关,H-1 (δH2.77) 与C-9 (δC143.8) 有相关,证明了以上结论。
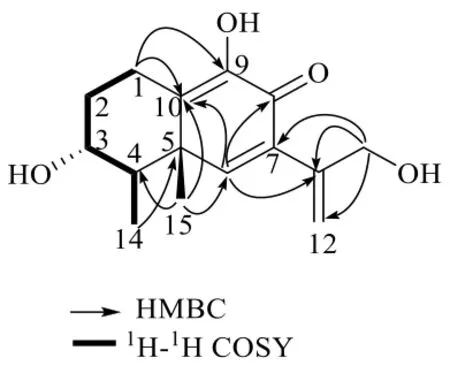
图2 化合物1 的主要HMB 和COSY 相关Fig. 2 Key HMBC and COSY correlations of compound1
NOESY 谱中(图3),H-3 (δH3.97) 与H-1α(δH2.77) 及H3-15 (δH1.35) 有相关,H-1β (δH2.77)与H3-15 (δH1.59) 有相关,提示他们位于分子同侧;H-2α (δH2.22) 与H-4 (δH1.44) 的相关峰提示其空间位置接近。提示1 的相对构型如图所示。综上确定化合物1的结构为9-羟基-6,7-去环氧-茎点霉甜菜烯酮,为1 个新化合物,命名为血见愁酮A。

图3 化合物的主要NOESY 相关Fig. 3 Key NOESY correlations of compound 1
化合物2:淡黄色油状物,1%茴香醛-硫酸显紫红色,ESI-MSm/z359.08 [M-H]−,分子式C18H16O8,1H-NMR (400 MHz, DMSO-d6)δ: 7.45(1H, d,J= 15.8 Hz, H-7),7.05 (1H, s, H-2), 7.00 (1H,d,J= 7.9 Hz, H-5), 6.77 (1H, d,J= 7.9 Hz, H-6), 6.67(1H, s, H-2′), 6.63 (1H, d,J= 7.8 Hz, H-5′), 6.52 (1H,d,J= 7.8 Hz, H-6′), 6.23 (1H, d,J= 15.8 Hz, H-8),5.02 (1H, brs, H-8′), 3.00~2.86 (2H, m, H-7′);13CNMR (100 MHz, DMSO-d6)δ: 170.9 (C-9′), 165.9(C-9), 148.6 (C-4), 145.8 (C-7), 145.5 (C-3), 144.9(C-3′), 144.0 (C-4′), 127.5 (C-1′), 125.3 (C-1), 121.5(C-6), 120.0 (C-6′), 116.7 (C-2′), 115.8 (C-5), 115.4(C-5'), 114.9 (C-2), 113.4 (C-8), 73.0 (C-8′), 36.2 (C-7′)。物理性质及波谱数据与文献对照基本一致[17-18],故鉴定该化合物为迷迭香酸。
化合物3:淡黄色油状物,1%茴香醛-硫酸显紫红色,ESI-MSm/z: 373.09 [M-H]−,分子式C19H18O8,1H-NMR (400 MHz, Pyridine-d5)δ: 7.99(1H, d,J= 15.8 Hz, H-7),7.52 (1H, s, H-2), 7.35 (1H,s, H-2′), 7.21 (1H, overlapped, H-5′), 7.18 (1H,overlapped, H-5), 7.08 (1H, d,J= 8.0 Hz, H-6), 6.91(1H, d,J= 8.0 Hz, H-6′), 6.60 (1H, d,J= 15.8 Hz,H-8), 5.70 (1H, t,J= 6.4 Hz, H-8′), 3.63 (1H, s, H-10′), 3.32 (2H, m, H-7′);13C-NMR (100 MHz,Pyridine-d5)δ: 170.8 (C-9′), 166.9 (C-9), 150.6 (C-4),147.2 (C-7), 147.1 (C-3), 147.5 (C-3′), 146.2 (C-4′),127.9 (C-1′), 126.5 (C-1), 122.2 (C-6), 120.9 (C-6′),117.8 (C-2′), 116.6 (C-5), 116.4 (C-5′), 115.8 (C-2),113.9 (C-8), 73.8 (C-8′), 51.9 (C-10′), 37.3 (C-7′)。物理性质及波谱数据与文献对照基本一致[17-18],故鉴定该化合物为迷迭香酸甲酯。
化合物4:淡黄色油状物,1%茴香醛-硫酸显紫红色,ESI-MSm/z387.12 [M-H]−,分子式C20H20O8,1H-NMR (400 MHz, DMSO-d6)δ: 7.49(1H, d,J= 16.0 Hz, H-7), 7.07 (1H, s, H-2), 7.03 (1H,d,J= 7.6 Hz, H-5), 6.78 (1H, d,J= 8.0 Hz, H-5'),6.66 (1H, s, H-2'), 6.65 (1H, d,J= 8.0 Hz, H-6'), 6.51(1H, d,J= 7.6 Hz, H-6), 6.23 (1H, d,J= 16.0 Hz,H-8), 5.09 (1H, t,J= 6.2 Hz, H-8'), 4.09 (2H, q,J=7.0 Hz, H-10'), 2.96 (2H, d,J= 6.2 Hz, H-7'), 1.15(3H, t,J= 7.0 Hz, C-11');13C-NMR (100 MHz,DMSO-d6)δ: 169.9 (C-9'), 166.3 (C-9), 149.2 (C-4),146.7 (C-7), 146.1 (C-3), 145.4 (C-3'), 144.6 (C-4'),127.1 (C-1'), 125.6 (C-1), 122.1 (C-6), 120.6 (C-6'),117.2 (C-2'), 116.2 (C-5), 115.9 (C-5'), 115.5 (C-2),113.4 (C-8), 73.3 (C-8'), 61.2 (C-10'), 36.8 (C-7'),14.4 (C-11')。物理性质及波谱数据与文献对照基本一致[17],故鉴定该化合物为迷迭香酸乙酯。
化合物5:黄色无定形粉末,1%茴香醛-硫酸显黄色,ESI-MSm/z179.04 [M-H]−,分子式C9H8O4,1H-NMR (400 MHz, DMSO-d6)δ: 12.12 (1H, s, H-9),9.53 (1H, s, H-3), 9.14 (1H, s, H-4), 7.42 (1H, d,J=15.8 Hz, H-7), 7.03 (1H, brs, H-2), 6.96 (1H, brd,J=8.1 Hz, H-6), 6.76 (1H, d,J= 8.1 Hz, H-5), 6.18 (1H,d,J= 15.8 Hz, H-8);13C-NMR (100 MHz, DMSO-d6)δ: 168.4 (C-9), 148.6 (C-3), 146.0 (C-4), 145.1 (C-7),126.2 (C-1), 121.6 (C-6), 116.2 (C-5), 115.6 (C-2),115.1 (C-8)。物理性质及波谱数据与文献对照基本一致[19],故鉴定该化合物为反式咖啡酸。
化合物6:黄色固体,1%茴香醛-硫酸显黄色,ESI-MSm/z: 207.07 [M-H]−,分子式C11H12O4,1H-NMR (400 MHz, Pyridine-d5)δ: 7.97 (1H, d,J=15.9 Hz, H-7), 7.62 (1H, s, H-2), 7.21 (2H,overlapped, H-5, 6), 6.60 (1H, d,J= 15.9 Hz, H-8),4.24 (2H, q,J= 7.1 Hz, H-10), 1.19 (1H, t,J= 7.1 Hz,H-11);13C-NMR (100 MHz, Pyridine-d5)δ: 167.3(C-9), 150.4 (C-4), 147.7 (C-3), 145.7 (C-7), 126.9(C-1), 122.0 (C-6), 116.7 (C-5), 115.7 (C-2), 115.1(C-8), 60.1 (C-10), 14.4 (C-11)。物理性质及波谱数据与文献对照基本一致[17],故鉴定该化合物为反式咖啡酸乙酯。
化合物7:黄色固体,1%茴香醛-硫酸显黄色,ESI-MSm/z: 205.04 [M-H]−,分子式C11H10O4,1HNMR (400 MHz, Acetone-d6)δ: 7.67 (1H, dd,J=15.8, 3.3 Hz, H-7), 7.39 (1H, m, H-10), 7.23 (1H, brs,H-2), 7.07 (1H, brs, H-5), 6.91 (1H, m, H-6), 6.32(1H, dd,J= 15.8, 3.3 Hz, H-8), 4.92 (1H, m, H-11a),4.61 (1H, m, H-11b);13C-NMR (100 MHz, Acetone-d6)δ: 163.8 (C-9), 148.7 (C-4), 147.2 (C-3), 145.7 (C-7),141.4 (C-10), 126.3 (C-1), 122.1 (C-6),115.6 (C-5),114.6 (C-2), 112.7 (C-8), 96.5 (C-11)。物理性质及波谱数据与文献对照基本一致[20],故鉴定该化合物为反式咖啡酸乙烯酯。
4 活性测定
香科科属植物提取物具有明确的抗氧化活性[21-22]。采用酶标法测定化合物1~7 的抗氧化活性(超氧阴离子清除率),化合物2、3、5~7 均表现出了一定的抗氧化活性,半数效应浓度(median effect concentration, EC50)结果见表2。

表2 化合物2、3、5~7 体外超氧阴离子清除活性结果Table 2 Superoxide anion scavenging activities of compounds 2, 3, 5-7
5 讨论
香科科属植物种类丰富,分布广泛,药理作用多样,具有一定的开发价值。目前,对该属植物的化学成分、药理作用及作用机制的研究相对较少,药用价值开发不够充分,尤其是药用植物血见愁。本研究从血见愁中分离得到7 个化合物,化合物1为1 个新的倍半萜类化合物。药理活性筛选发现,化合物2、3、5~7 表现出了一定的体外抗氧化活性,为血见愁开发和利用提供了化学成分以及药理活性方面的依据。基于当前的文献报道,该属植物萜类成分丰富,可能是发挥作用的物质基础,同时也具有发现结构新颖的化学成分的潜力,因此,从血见愁中发现更多的萜类成分并根据血见愁的传统功效,开展药理活性研究,阐明其物质基础,是其药用价值开发的前提,也是后续需要关注的问题。
利益冲突所有作者均声明不存在利益冲突
