新型全蝎寡肽在体外抗苯并芘毒性的功能及其机制的评价
2023-12-24郑曼袁燕张风雷马凯李叶婷顾磊刘杰王殿云
郑曼,袁燕,张风雷,马凯,李叶婷,顾磊,刘杰,王殿云
(1.东营市人民医院,山东 东营 257091;2.深圳大学过敏反应与免疫学研究所,广东 深圳 518060)
动脉粥样硬化(atherosclerosis,AS)是一种慢性血管炎症性疾病,其特点是动脉内膜受损和炎性细胞浸润,参与其中的细胞和分子众多[1-2]。每年全球有近2 000 万人死于心血管疾病(cardiovascular disease,简称CVD)。作为心肌梗死等多种CVD 的病理基础,AS 对人类健康构成了重大的公共卫生问题[3]。目前,AS 的预防和治疗主要是通过控制心血管危险因素并结合患者的临床症状给予抗血小板药物、抗缺血药物治疗等[4]。然而,长期大量服药可能产生耐药及药物相关不良反应,给患者带来巨大经济负担及心理负担[5]。多环芳烃(polycyclic aromatic hydrocarbons,简称PAHs)是一类广泛存在于环境中的污染物,可通过吸入、饮食和皮肤接触等途径摄入。研究表明,PAHs 的暴露会增加AS 形成和CVD 发病的风险[6-7]。而苯并芘(Benzopyrene,BaP)则为PAHs中含量最多且毒性最强的化合物之一,早在2010年已被列为I类致癌物[8]。
全蝎是指东亚钳蝎(Buths martensii)的干燥体,被广泛应用于民间与临床治疗风湿痹症、痉挛抽搐、恶疮肿毒等疾病[9]。现代药理研究证实,全蝎具有抗肿瘤[10]、抗癫痫[11]、抗惊厥、抗凝、抗菌[12]等多种药理作用,并且还有镇痛抗炎和提高免疫力等活性[13]。蝎毒、甾体衍生物和生物碱等小分子成分是全蝎药理活性的重要基础[14]。作为传统药食同源类中药,我国全蝎资源十分丰富,但现有研究主要集中在蝎毒等生物活性成分的鉴定和临床应用上,如芪蝎活血通络汤(主要成分为全蝎)对于脑血栓的形成,具有显著的抑制效果[15];同样以全蝎为主要成分的复方芎蝎胶囊,在临床上可有效改善颈动脉粥样硬化患者的脑供血不足的症状[16];然而对于全蝎中具有抗AS 活性的肽类单体化合物的研究却并没有见到相关报道。本研究旨在通过构建苯并芘(BaP)诱导的人脐静脉血管内皮细胞(HUVEC)细胞氧化和炎症损伤模型,追踪分离全蝎中具有活性的肽,并研究其抗炎和抗氧化活性以及潜在的分子机制,以期为发现全蝎中潜在缓解和治疗AS相关活性物质,为功能性食品或药物的研发提供实验基础。
1 材料与方法
1.1 材料与试剂
人脐静脉血管内皮细胞(中国科学院上海细胞生物研究所);DMEM 基础培养基、胎牛血清-FBS和青霉素-链霉素混合液(美国Gbico);BCA 蛋白质浓度测定试剂盒(碧云天生物技术研究所);Cell counting KIT-8(CCK-8)(日本同仁);ELISA 试剂盒(ROS、IL-1β、IL-6、IL-8、TNF-α、PGE2、ICAM-1 及VCAM-1)(北京四正柏生物科技有限公司);COX-2、ASC、Caspase-1、NLRP3、p62、LC3-Ⅱ、Pink1、Parkin和β-actin 的一抗抗体(美国CST);山羊抗兔二抗和山羊抗鼠二抗(美国CST);苯并芘(美国MCE)。
1.2 主要仪器
SW-CJ-IC 型超净工作台(苏州净化);INCO 2108 型CO2培养(Memmert,德国);2K15 型低温高速离心机(Sigma 公司,美国);IKA-Labortechnik 涡旋振荡器(Staufen,德国);3-30K 高速台式冷冻离心机(Sigma 公司,美国);Multiskan ™FC 酶标仪(Thermo Fisher,美国)。
1.3 方法
1.3.1 全蝎活性肽分离、氨基酸序列鉴定 首先制备全蝎的总蛋白,后超滤分离全蝎总蛋白,利用疏水色谱法、阴离子交换色谱法、
反相高效液相色谱(RP-HPLC)分离等,最终分离纯化得SOP-1(301.5 mg)、SOP-2(432.8 mg)、SOP-3(227.2 mg)、SOP-4(355.6 mg)。通过质谱仪进行ESI-MS 分析。使用Edman 降解法进一步验证SOP-1~4的氨基酸序列[17]。
1.3.2 细胞活力检测 将HUVEC 细胞按5 000 cells/well的密度接种于96 孔板中,并按以下方法处理细胞:①空白(Control)组不做任何处理,第2~6组,用10 μmol/L 的BaP 处理12 h,第3~6 组分别用20 μmol/mL 的SOP-1~4 孵育24 h,20 μmol/mL 的谷胱甘肽(glutathione,GSH)作为对照组;②不同剂量的SOP-1(0、10、50、250、500及1 000 μmol/L)孵育24 h;③空白组不做任何处理,第2~5 组,用10 μmol/L 的BaP处理12 h,随后在第3~5组用20 μmol/L的SOP-1分别孵育24、48、72 h;④空白组不做任何处理,用10 μmol/L的BaP处理12 h,随后第3~5组分别用10、50、250、1 000 μmol/L的SOP-1孵育24 h。分别检测其细胞活力[18-19]。
1.3.3 ELISA 法检测细胞炎性因子及ICAM-1、VCAM-1 含量 将HUVEC 细胞按1×106cells/well的密度接种于6 孔板中,Control 组不做任何处理,BaP组、10 μmol/L组和50 μmol/L组首先用10 μmol/L 的BaP 处理12 h;随后10 μmol/L 组和50 μmol/L组再分别用10 μmol/L 和50 μmol/L 的SOP-1 处理24 h;收集细胞培养上清,按照ELISA试剂盒的操作说明检测ROS、TNF-α、IL-1β、IL-6、IL-8、PGE2、ICAM-1及VCAM-1含量。
1.3.4 Western blot检测相关蛋白的表达 按照方法“1.3.3”处理细胞,胰蛋白酶消化并收集细胞,提取细胞总蛋白;在SDS-PAGE凝胶上分离蛋白;随后将分离的蛋白转移到硝酸纤维素膜上;将一抗(COX-2、ASC、Caspase-1、NLRP3、p62、LC3-Ⅱ、Pink1、Parkin 和β-actin)用一抗稀释液按1∶1000 稀释,在4 ℃条件下孵育过夜;将二抗同样按照按1∶1 000稀释,用相应的二抗室温孵育1 h;加入显色液后在WB显影仪中显影。
1.3.5 数据处理 采用SPSS 18 软件统计,实验结果均以表示,n=3。采用独立样本t检验,对SOP-1 处理效应进行回归分析。P<0.05 为差异有统计学意义。
2 结果与分析
2.1 GSPs鉴定
基于MS/MS 数据解析及结合Edman 降解法验证,共分离并鉴定出4 种活性肽,见图1。SOP-1 为氨基酸序列为Pro-Met-Tyr-His-Glu-Pro 的寡肽,SOP-2 为氨基酸序列为Phe-Thr-Glu-Gly-Pro 的寡肽,SOP-3为氨基酸序列为Phe-Arg-His-Ala-Leu-Ser的寡肽,SOP-4 为氨基酸序列为Trp-Glu-His-Lys-His-Ala的寡肽。

图1 SOP-1~4 MS图谱及结构Figure 1 SOP-1~4 MS and structure
2.2 SOPs抗BaP损伤的活性评价
实验结果如图2A 所示,BaP 暴露损伤HUVEC细胞,使细胞活力显著降低;与Control 组相比,BaP暴露HUVEC 细胞12 h 后,细胞活力降低21.6%(P<0.01)。而SOPs及GSH 能够缓解BaP暴露导致的HUVEC 细胞损伤,提高细胞活力;相比于BaP 处理组,SOP-1、SOP-2、SOP-3 及SOP-4 组细胞活力分别提高19.3%(P<0.01)、13.4%(P<0.05)、13.7%(P<0.05)及15.2%(P<0.05);其中,SOP-1 保护活性最佳,且SOP-1 减轻BaP 暴露导致HUVEC 细胞损伤具有时间和剂量依赖性(图2C、2D),因此后续以SOP-1为代表化合物对全蝎寡肽发挥保护活性的潜在分子机制进行研究;同时,结果显示,浓度不高于1 000 μmol/L 时,SOP-1 对HUVEC 细胞无显著细胞毒性(图2B)。
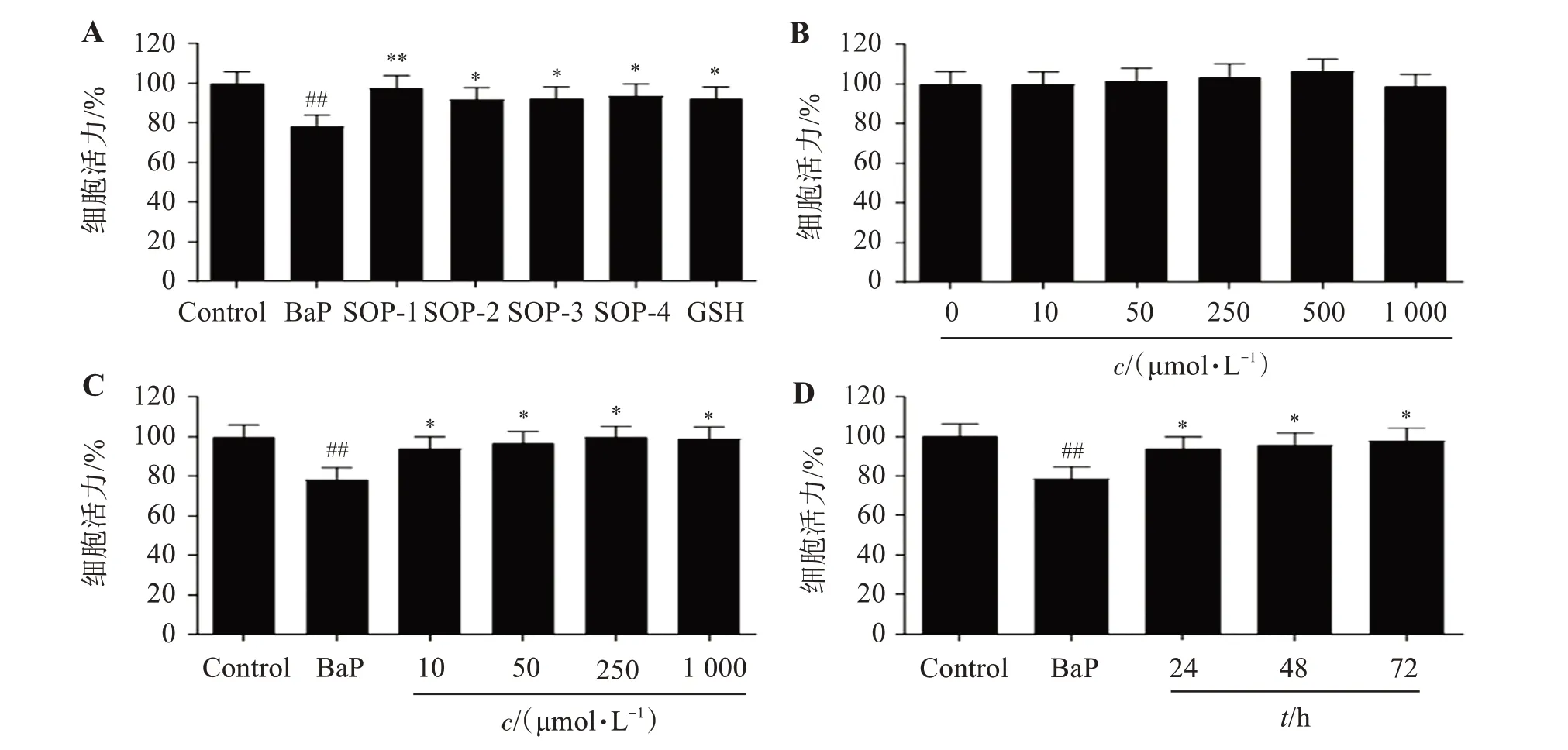
图2 SOP-1抑制BaP的细胞毒性Figure 2 Inhibition of SOP-1 on the cytotoxicity induced by BaP(n=3)
2.3 SOP-1对BaP诱导的HUVEC细胞ROS及炎性因子过量分泌的影响
研究结果显示,与Control组相比,BaP处理组的细胞ROS水平显著增加了451.3%(P<0.01);而相比于BaP组,不同浓度的SOP-1治疗后,ROS含量分别减少33.6%(10 μmol/L,P<0.01)、63.5%(50 μmol/L,P<0.01)。表明SOP-1 可能具有抗氧化活性,能够通过抑制BaP暴露诱导的HUVEC 细胞ROS过量产生,抑制细胞的氧化损伤(图3A)。
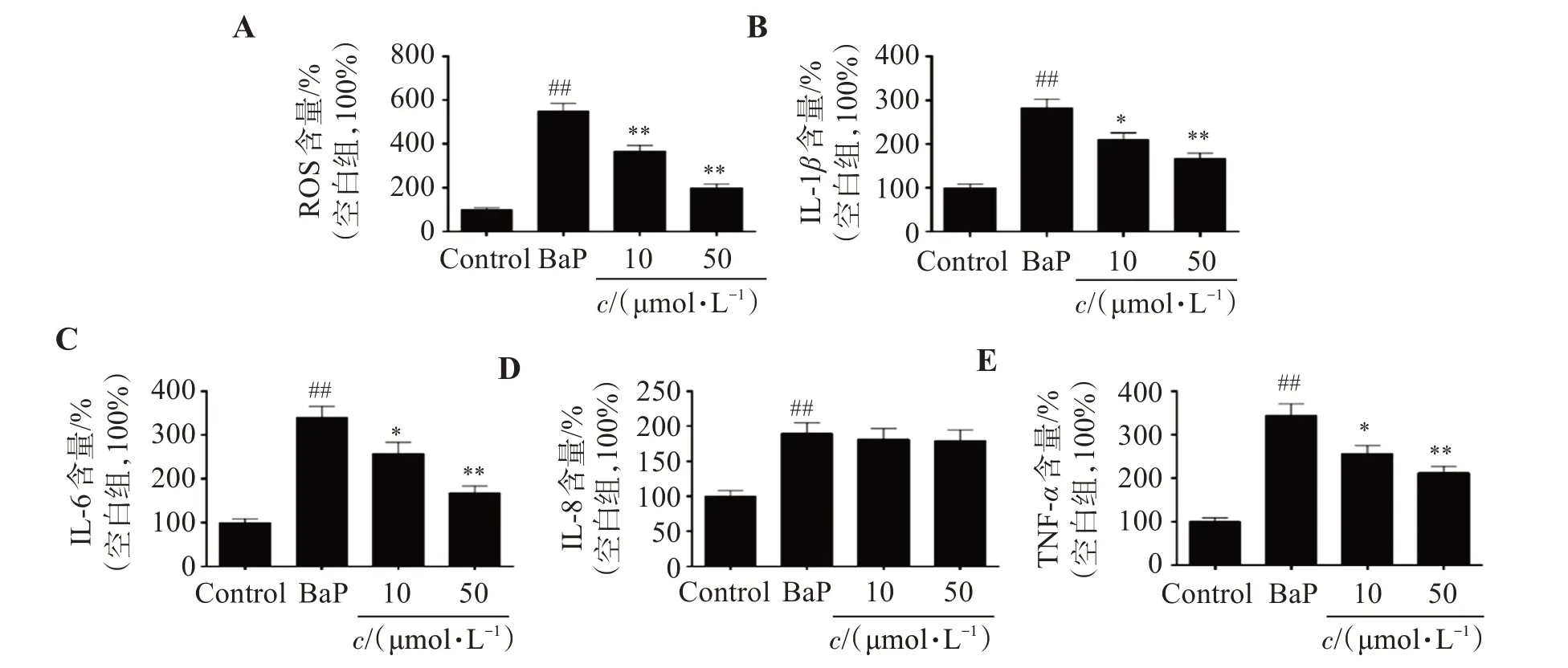
图3 SOP-1抑制BaP诱导的HUVEC细胞ROS及炎性因子过量分泌Figure 3 Inhibition of SOP-1 on the excessive expression of ROS and inflammatory factors in HUVEC cells induced by BaP
ELISA 的结果显示,与Control 组相比,BaP 组的IL-1β、IL-6、IL-8 及TNF-α含量分别增加183.4%(P<0.01)、239.7%(P<0.01)、89.7%(P<0.01)和222.2%(P<0.01);而50 μmol/L SOP-1 可显著抑制BaP 导致的炎性损伤,IL-1β、IL-6、IL-8 及TNF-α的含量分别减少了41.3%(P<0.01)、50.7%(P<0.01)、5.29%及38.4%(P<0.01)。结果表明,SOP-1能够通过抑制BaP 暴露诱导的HUVEC 细胞炎性因子过量表达、分泌发挥抗炎活性。
2.4 SOP-1对BaP诱导的HUVEC细胞PGE2、COX-2、ICAM-1和VCAM-1蛋白高表达的影响
与Control 组相比,BaP 组PGE2含量增加188.6%(P<0.01);而与BaP组相比,50 μmol/L SOP-1 组PGE2含量减少42.1%(P<0.01,图4A);说明SOP-1 能够有效抑制BaP 暴露诱导的PGE2过量分泌。COX-2 是PGE2的合成酶,为了探讨SOP-1 对PGE2上游通路的影响,本研究还检测了COX-2蛋白表达量的变化,结果显示,BaP 暴露显著诱导HUVEC 细胞COX-2 蛋白高表达,而SOP-1 则有效抑制BaP暴露诱导的HUVEC 细胞COX-2蛋白表达增加(图4B)。
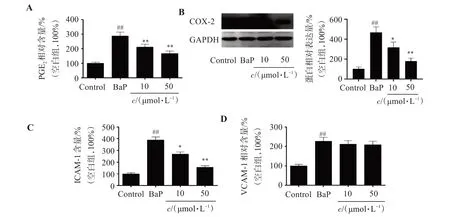
图4 SOP-1对BaP诱导的HUVEC细胞PGE2、COX-2、ICAM-1和VCAM-1蛋白高表达的影响Figure 4 Effect of SOP-1 on the overexpression of PGE2,COX-2,ICAM-1 and VCAM-1 in HUVEC cells induced by BaP (n=3)
同样的,对于VCAM-1 和ICAM-1,BaP 暴露会导致其显著升高,与Control组相比,BaP组ICAM-1、VCAM-1 含量分别增加289.5%(P<0.01)、126.7%(P<0.01);而经过50 μmol/L 的SOP-1 治疗后,ICAM-1、VCAM-1 含量分别减少了59.8%(P<0.01)、5.87%(图4C、D)。
2.5 SOP-1 对BaP 诱导的HUVEC 细胞NLRP3 炎症小体激活的影响
为了进一步探讨SOP-1 抗BaP 诱导的HUVEC细胞炎症的机制,本研究对NLRP3 炎症小体相关蛋白的表达进行了检测。结果显示,BaP 处理后,NLRP3、ASC 和Caspase-1 的蛋白表达量显著升高,NLRP3 炎症小体被激活;而SOP-1 能够有效抑制BaP 暴露诱导的HUVEC 细胞NLRP3、ASC和Caspase-1 蛋白表达增加,抑制NLRP3 炎性小体激活,SOP-1 的浓度越高,抑制效果越强(如图5)。说明SOP-1 发挥抗炎活性与抑制BaP 诱导的HUVEC 细胞NLRP3 炎症小体激活密切相关。

图5 SOP-1抑制BaP诱导的HUVEC细胞NLRP3炎症小体相关蛋白表达Figure 5 Inhibition of SOP-1 on the expression of NLRP3 inflammasome associated proteins in HUVEC cells induced by BaP(n=3)
2.6 SOP-1 对BaP 诱导的HUVEC 细胞Pink1/Parkin信号通路激活的影响
为了研究SOP-1 抗BaP 诱导的HUVEC 细胞氧化损伤的机制,对Pink1/Parkin 信号相关蛋白表达进行检测。如图6 所示,BaP 暴露导致Pink 1、LC 3-Ⅱ及Parkin 蛋白的表达显著增加,同时p62 的表达量显著降低;表明BaP 暴露激活HUVEC 细胞的Pink1/Parkin 通路,可能通过HUVEC 细胞线粒体自噬的途径导致细胞损伤。而SOP-1 处理后,BaP 暴露导致的Pink 1、LC 3-Ⅱ和Parkin 蛋白表达增加及p62蛋白表达减少均被逆转,其中50 μmol/L的SOP-1 甚至可以将Pink1/Parkin 通路相关蛋白恢复至接近正常水平。结果表明,SOP-1 发挥抗氧化活性可能与抑制BaP 诱导的HUVEC 细胞Pink1/Parkin 信号通路的激活从而抑制线粒体自噬密切相关。
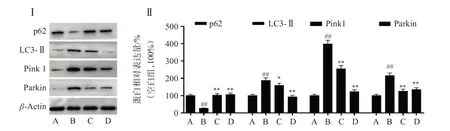
图6 SOP-1调控BaP诱导的HUVEC细胞Pink1/Parkin通路相关蛋白表达Figure 6 Effect of SOP-1 on the expression of Pink1/Parkin pathway related proteins in HUVEC cells induced by BaP(n=3)
3 讨论
PAHs 是重要的环境和食品污染物,它们是煤、烟草等不完全燃烧产生含有苯环的稠环芳烃化合物。研究表明,AS 患者血清中PAHs 的含量明显高于健康人群,同时在与PAHs 相关的AS 病理反应中,发生了氧化应激和炎症反应[7]。中药全蝎具有多种药理活性,然而,尚未发现针对全蝎中的肽类成分的抗氧化、抗炎和缓解AS 功效方面的研究。本研究使用活性追踪方法分离了全蝎活性肽,并研究了其在体外的抗AS活性。结果显示,SOP-1能够有效抑制由BaP暴露引起的HUVEC细胞损伤。
AS是由多种外界刺激和其他因素诱导形成的,其中氧化应激和炎症损伤是AS发生的主要机制[20]。COX-2 是一种酶,它在炎症和伤害时被激活,从而合成包括PGE2前列腺素类物质,已有证据表明,COX-2 的缺失会抑制AS 的发生和发展,因此COX-2/PGE2在AS 中起到重要作用[21]。在本研究中,SOP-1可以通过抑制BaP暴露引发的细胞内ROS和炎症因子(TNF-α、IL-1β、IL-6 和IL-8)的过量产生,同时抑制COX-2/PGE2的表达,从而缓解了细胞的氧化应激和炎症损伤,提高了HUVEC细胞的活力。
VCAM-1 和ICAM-1 是表面黏附分子,在AS 模型中介导血管内皮细胞与白细胞的黏附。它们在内皮细胞的表达升高,会导致白细胞募集和炎症反应[22]。本研究中,BaP的暴露引发了HUVEC细胞中ICAM-1、VCAM-1 以及炎性因子的表达升高,ICAM-1、VCAM-1 以及炎性因子进一步相互作用,加剧了炎症反应,并对HUVEC 细胞造成损伤。SOP-1 可以通过抑制BaP 暴露所诱导的HUVEC 细胞中ICAM-1、VCAM-1 以及炎性因子的高表达,提高HUVEC细胞的活力,并发挥了保护作用。
NLRP3 炎性小体信号通路是AS 炎症反应的核心环节,NLPR3 受体识别细胞内积累的脂肪酸、胆固醇结晶等物质,形成激活的NLPR3 二聚体,进而组成炎性小体结构NLPR3/ASC/Caspase-1。该结构能够裂解炎症因子前体并增强炎症反应活性[23]。本研究结果表明,SOP-1 能有效抑制BaP 引发的HUVEC 细胞NLRP3 炎症小体激活,从而进一步抑制BaP 引起的HUVEC 细胞炎性细胞因子的分泌,并发挥保护作用。
线粒体功能障碍同样与AS 的发生和发展密切相关。自噬是细胞自我修复的重要途径之一,其中线粒体自噬通过细胞自噬来清除受损的线粒体,维持线粒体数量和质量的动态平衡。线粒体自噬可以降解线粒体小碎片,从而减少ROS 释放,减轻氧化应激损伤[20]。Pink1 和parkin 是线粒体自噬关键因子。在正常情况下,Pink1 被转运到线粒体内膜并被泛素-蛋白酶系统剪切和降解。当线粒体受损后,Pink1 在线粒体表面累积和激活,激活的Pink1会招募parkin到线粒体表面,并将其磷酸化,进一步与LC3 适配体蛋白相互作用,最终降解受损的线粒体[24]。p62 是一个重要的蛋白负载体,可以促进受损蛋白通过蛋白酶体和自噬体的清除。自噬激活后,p62 也会被大量清除,因此p62 的减少是自噬活跃的标志[25]。本研究发现,暴露于BaP 的HUVEC细胞,其细胞内ROS 水平明显上升,相应的线粒体自噬相关蛋白Pink1和parkin的表达上调,而与自噬小体和溶酶体相关的LC3 蛋白的表达增加,p62 蛋白减少。推测BaP 的暴露通过激活Pink1/parkin 通路诱导线粒体自噬,从而对HUVEC 细胞造成氧化应激和严重的氧化损伤。本研究结果提示SOP-1可以逆转这个现象,这表明SOP-1能够抑制Pink1/parkin 通路的激活,减少线粒体自噬,并减轻BaP 对HUVEC细胞的损伤。
本研究结果表明全蝎中存在的寡肽成分具有抑制由环境污染物BaP 暴露引起的血管内皮细胞NLRP3 炎症小体和Pink1/Parkin 信号通路激活的能力,从而减轻BaP 暴露引起的血管内皮细胞的氧化和炎性损伤,并发挥保护作用。全蝎中的寡肽类活性物质具有抗氧化和抗炎活性,可以用于预防和治疗AS,对功能性食品和药物研发具有重要的指导意义。
