维A酸脂质体乳膏的制备与质量评价
2023-12-24郑燕燕颜利郝吉福何玉静
郑燕燕,颜利,郝吉福,何玉静
[山东第一医科大学(山东省医学科学院)药学院/先进药物递送系统全国重点实验室,山东 济南 271000]
维A 酸(retinoic acid,RA)属于维生素A 类化合物,用于治疗寻常痤疮、扁平苔藓、白斑、老年性皮肤萎缩等,也作为银屑病的辅助治疗药物,被称为皮肤科治疗学的“第三个里程碑”[1-2]。该化合物含有多共轭双键的侧链结构,稳定性差,对光热极为敏感,易氧化和异构化失效,对皮肤有强烈的刺激性[3]。维A 酸的结构特点和不良反应对常用的维A 酸外用制剂造成局限,如维A 酸软膏剂、霜剂、凝胶等制剂中维A 酸易氧化失效且生物利用度较低[4]。
脂质体(liposomes)是指药物被类脂双分子层包封成的微小囊泡,对药物的包封效果较好,具有良好的生物相容性,能够有效增加药物的透皮吸收[5]。与传统剂型相比,脂质体具有靶向性、高效长效、降低药物不良反应等优点,是皮肤外用药物的理想载体[6-7]。乳膏剂系指原料药物溶解或分散于乳状液型基质中形成的均匀半固体制剂。乳膏剂中乳化剂的表面活性作用使其对油、水均具有一定亲和力,既不影响皮肤表面分泌物的分泌,也不影响水分蒸发,为皮肤病治疗的常用外用制剂[8]。将维A 酸包封于脂质体内可减轻皮肤刺激性,提高透皮吸收速率和生物利用度。本研究拟将维A 酸制成脂质体后再制作成乳膏剂,旨在为维A 酸用于皮肤病的治疗提供新的方法[9]。
1 仪器与材料
1.1 仪器
FA1104N 型电子天平(上海菁海仪器有限公司);UV-1800PC 型紫外可见分光光度计[翱艺仪器(上海)有限公司];KQ3200E 型超声波清洗器(昆山市超声仪器有限公司);DF-101S型集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);SHC-2 型智能数显恒温水浴锅(巩义市英欲高科仪器厂);JY92-2D 型超声波细胞粉碎机(宁波新芝生物科技股份有限公司);RYJ-6B 型药物透皮扩散实验仪(上海黄海药检仪器有限公司)。
1.2 药品与试剂
维A酸(质量分数98%,上海麦克林生化科技有限公司);胆固醇(CH,国药集团化学试剂有限公司);卵磷脂(SPC,石家庄宁诺商贸有限公司);透析袋(北京索莱宝科技有限公司);液体石蜡(纯度:化学纯,天津市富宇精细化工有限公司);水为纯化水,其他试剂均为分析纯。
1.3 动物
雄性SPF 级健康昆明小鼠,体质量(22±5)g,购自济南朋悦实验动物繁育有限公司,生产许可证号SCXK(鲁)20220006。所有动物实验均经山东第一医科大学(山东省医学科学院)动物伦理委员会批准,批准号为202004038。
2 方法与结果
2.1 标准曲线的制备
精密称取维A 酸1.02 mg,置于10 mL 容量瓶中加入异丙醇至刻度,所得溶液移至50 mL 容量瓶中,加入甲醇稀释至刻度,得到20 μg/mL 的维A 酸溶液,精密量取该溶液加入甲醇最终稀释成质量浓度分别为2.0、2.5、3.0、3.5、4.5 μg/mL 的系列溶液,紫外分光光度法分别测定其在350 nm 处吸光度值,以质量浓度(x)为横坐标,吸光度(y)为纵坐标绘制标准曲线,得标准曲线y=0.135 5x-0.020 9,R2=0.999 9。
2.2 维A酸脂质体的制备
参考文献[10]采用乙醇注入法制备维A 酸脂质体:精密称取CH、SPC、维A 酸,于适量无水乙醇中超声使其充分溶解;配制pH=6.5 的磷酸盐缓冲液(PBS)作为水合介质;取适量水合介质置于磁力搅拌器上,在一定水浴温度下搅拌,转速350 r/min,用5 mL 注射器吸取脂质溶液将其缓慢匀速地注入到水合介质中,继续恒温搅拌1 h,使乙醇完全挥发即得。
2.3 包封率和载药量测定
采用透析法测定包封率和载药量[11]。精密吸取维A 酸脂质体混悬液2 mL 于透析袋中密封,置于100 mL 纯水中透析6 h,分别于0.5、2、4 h 更换透析介质。精密量取未经透析的脂质体混悬液和透析后的脂质体混悬液各0.5 mL,分别加入甲醇破乳,紫外分光光度法测得维A 酸药物总量和脂质体包封维A酸的量。按以下公式计算包封率和载药量:
2.4 单因素实验筛选维A酸脂质体制备处方工艺
2.4.1 SPC 质量浓度的影响 固定其他因素不变,改变SPC 投药量,使SPC 质量浓度分别为4、8、16、32、64 mg/mL,考察包封率和载药量随SPC 质量浓度变化的情况,结果见图1。可见,维A 酸的包封率和载药量均受SPC 质量浓度的影响,当SPC 质量浓度为32 mg/mL时,包封率和载药量最高。

图1 SPC质量浓度对包封率和载药量的影响Figure 1 The effect of SPC mass concentration on encapsulation rate and drug loading capacity
2.4.2 SPC 与CH 质量比的影响 固定其他因素不变,改变SPC 与CH 投药量的比值(SPC∶CH),使SPC∶CH 分别为2∶1、3∶1、4∶1、5∶1、6∶1(质量比,下同),考察包封率和载药量随SPC∶CH 变化的情况,结果见图2。可见,维A 酸的包封率和载药量均受SPC∶CH 质量比的影响,当SPC∶CH=4∶1 时,包封率和载药量最高。
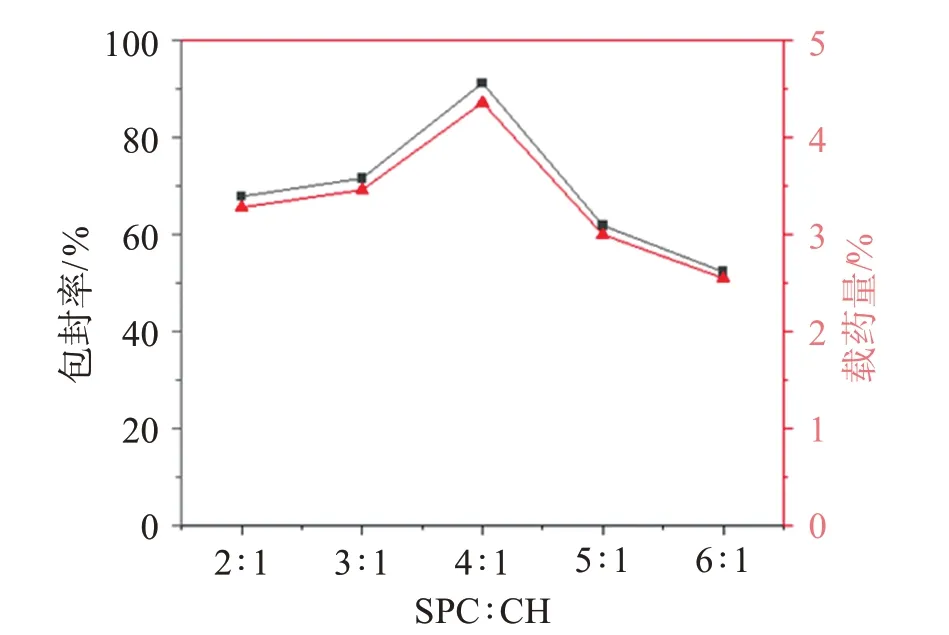
图2 SPC∶CH比值对包封率和载药量的影响Figure 2 The effect of SPC:CH ratio on encapsulation rate and drug loading capacity
2.4.3 维A 酸与脂质(SPC+CH)的质量比(药脂比)的影响 固定其他因素不变,改变药脂比的比值,使药脂比分别为1∶10、1∶20、1∶30、1∶40、1∶50,考察包封率和载药量随药脂比变化的情况,见图3。可见,维A 酸的包封率和载药量均受药脂比的影响,当药脂比为1∶20 时包封率最高,药脂比1∶10 时载药量最高。
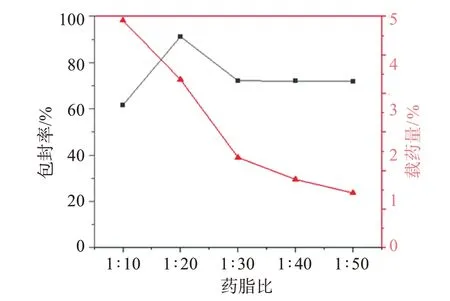
图3 药脂比对包封率和载药量的影响Figure 3 The effect of drug lipid ratio on encapsulation rate and drug loading capacity
2.4.4 水浴温度的影响 固定其他因素不变,改变水浴温度,使水浴温度分别为45、50、55、60、65 ℃,考察包封率和载药量随水浴温度变化的情况,结果见图4。可见,维A 酸的包封率和载药量均受水浴温度影响,当水浴温度为60 ℃时,包封率和载药量最高。
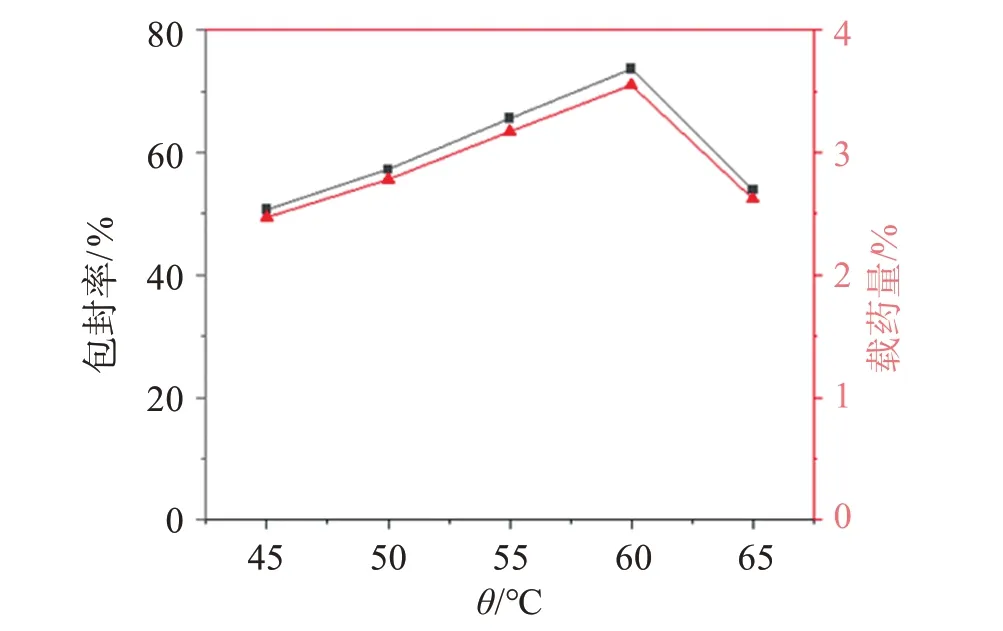
图4 水浴温度对包封率和载药量的影响Figure 4 The effect of water bath temperature on encapsulation rate and drug loading capacity
2.5 正交实验优化维A酸脂质体的制备工艺
2.5.1 正交实验 根据单因素实验所得结果,以SPC 浓度(A)、SPC∶CH(B)、药脂比(C)、水浴温度(D)为4 个因素,每个因素选择3 个不同水平(见表1),以包封率比重30%和载药量比重70%为综合评价指标进行考察,以L9(34)正交实验法筛选最佳制备工艺。
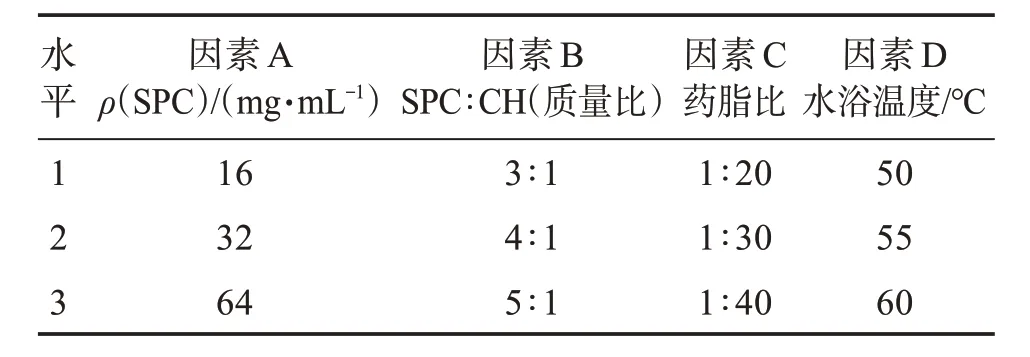
表1 正交实验因素水平Table 1 Orthogonal experimental factors and levels
2.5.2 正交实验结果 正交实验结果见表2,结果表明各因素对综合评价指标的影响效果依次为C>A>B>D,确定最优制备工艺为A1B3C3D3,即SPC 质量浓度为16 mg/mL,SPC∶CH=5∶1,药脂比=1∶40,水浴温度60 ℃。
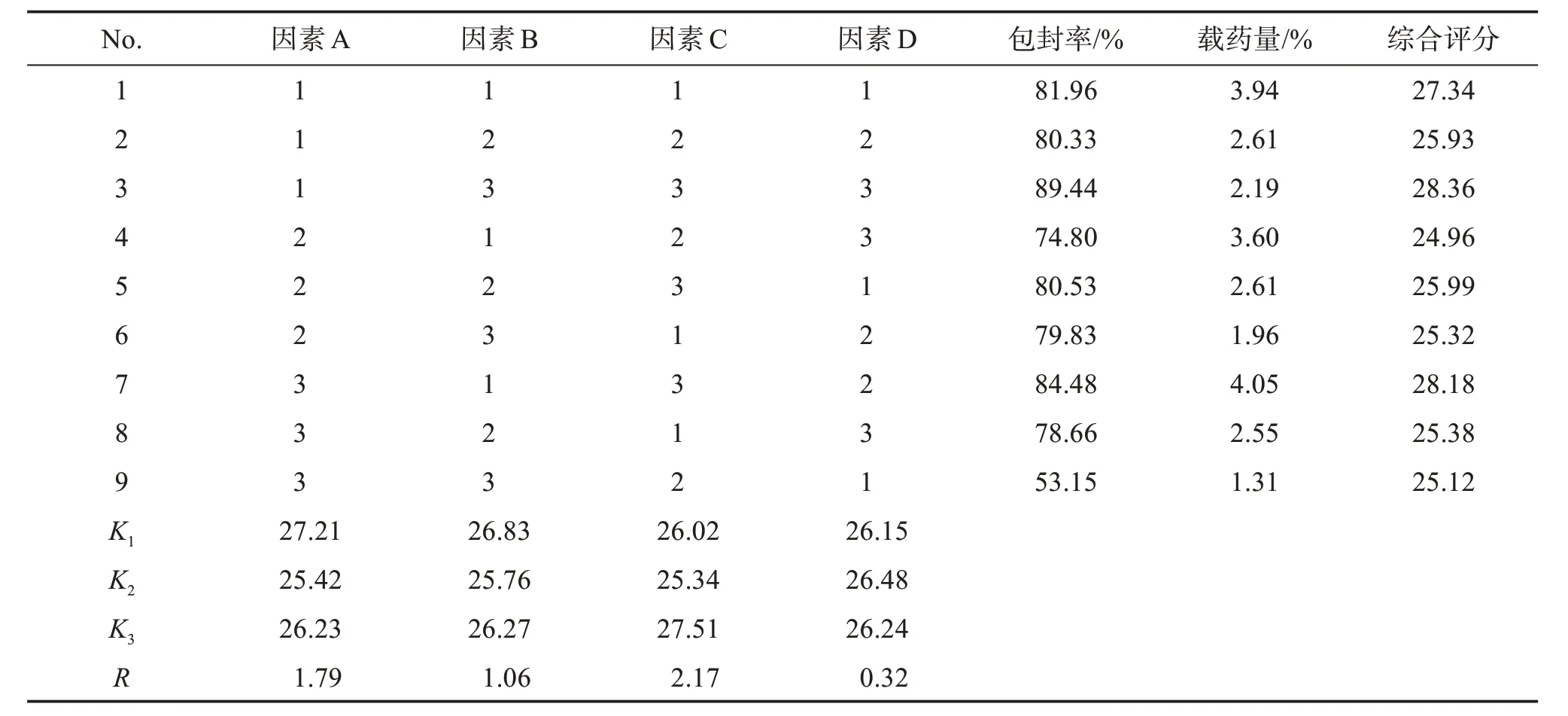
表2 正交实验结果Table 2 Results of orthogonal experiment
2.5.3 验证实验 按“2.5.2”项筛选的最优制备工艺制备3 批维A 酸脂质体,按“2.3”项方法测定包封率和载药量,结果显示包封率为(89.27±1.12)%(n=3),载药量为(2.30±0.53)%(n=3),表明筛选的最优制备工艺稳定性和重现性良好。
2.6 维A酸脂质体的质量评价
维A 酸脂质体混悬液呈现均匀淡黄色,具有明显的丁达尔效应(见图5),平均粒径为(154.6±2.5)nm,PDI 为(0.171±0.028),Zeta 电位(-37.7±0.59)mV,pH=6.3,脂质体在4、25 ℃条件下粒径和PDI变化见图6。可见,粒径和PDI 变化较小,所得脂质体在4 ℃和25 ℃条件下稳定性良好。

图5 维A酸脂质体混悬液的外观及丁达尔效应Figure 5 Appearance and Dingdall effect of retinoic acid liposome suspension

图6 维A酸脂质体的粒径和PDI值Figure 6 Particle size and PDI value of retinoic acid liposomes
2.7 维A酸脂质体乳膏的制备
维A 酸脂质体乳膏采用乳化法制备[12],取硬脂醇、白凡士林、液体石蜡加热至80 ℃熔化为油相,将甘油及纯化水加热至80 ℃,再加入十二烷基硫酸钠溶解为水相。然后将水相缓缓加入油相中,边加边搅拌,直至冷凝,即得乳剂型基质。取5 mL 以最佳制备工艺制得的维A 酸脂质体加入上述基质中,搅拌均匀即得。
2.8 维A酸脂质体乳膏的质量评价
从图7 可见,维A 酸乳膏色泽均匀、质地细腻、无污物,易涂于皮肤,无粗糙感和颗粒感。

图7 维A酸脂质体乳膏外观性状Figure 7 Appearance characteristics of retinoic acid liposome cream
小鼠腹部脱毛处理24 h 后对照组涂布生理盐水,给药组涂布维A 酸脂质体乳膏,进行皮肤过敏性实验。48 h 内小鼠皮肤表面均未见红肿,未出现过敏现象,结果见图8。

图8 小鼠皮肤过敏性实验结果Figure 8 Results of skin allergy experiment in mice
2.9 体外经皮渗透速率的测定
2.9.1 离体鼠皮的制备 先用剃毛刀剔去小鼠腹部的毛,再用脱毛膏除去残留碎毛,用湿棉球擦洗干净,正常喂养24 h 后将小鼠脱臼处死,将腹部皮肤剥下,并刮除皮下脂肪组织及粘连物,检查皮肤完整性,用生理盐水反复冲洗。
2.9.2 体外透皮试验 将小鼠皮肤角质层面向给药池,真皮层面向接收池固定在Franz 扩散池两半池之间,接收池中加入异丙醇-pH7.4 PBS 溶液(体积比3∶7)混合溶液作为接收介质,排净气泡,给药池中加入制得的维A 酸脂质体乳膏,温度34 ℃,搅拌速度300 r/min,置于透皮扩散仪中,于0.5、1、1.5、2、4、6、8、10、12、24 h 取出接收液5 mL,立即补加相同体积的接收液。取出的接收液用0.22 μm 的微孔滤膜过滤,弃去初滤液,取续滤液测定维A 酸浓度。按以下公式计算药物的累积渗透量(Qn):
式中:Qn为药物的累积渗透量;V为接受池总体积(7 mL);Cn为第n次取样时接收液中药物的质量浓度;Ci为第n-1 次取样时所检测到的药物的质量浓度;Vi为取样体积;A为有效扩散面积(0.785 cm2)。以药物累积渗透量(Qn)对取样时间(t)进行数据拟合,并对曲线中的直线部分进行线性回归,求得直线斜率即为稳态透皮速率Js[13]。
2.9.3 体外透皮试验结果 体外经皮渗透速率曲线如图9 所示,结果显示维A 酸脂质体乳膏的渗透速率和24 h 累积渗透量均高于普通维A 酸乳膏。维A 酸脂质体平均透皮渗速率为(0.655 8±0.031 9)(μg·h)/cm2,高于普通维A酸乳膏[(0.442 7±0.034 5)(μg·h)/cm2];维A 酸脂质体乳膏24 h 累积渗透量为(17.18±1.96)μg/cm2,高于普通维A 酸乳膏[(8.964 6±0.394 2)μg/cm2]。

图9 透皮吸收曲线图Figure 9 The transdermal absorption curves
3 讨论
本文采用乙醇注入法制备脂质体,以包封率和载药量作为评价指标筛选了最优处方。将以最优处方制备的维A 酸脂质体制备成乳膏并考察了其体外透皮渗透速率。结果表明,维A 酸脂质体乳膏的渗透速率和24 h 累计渗透量均高于普通维A 酸乳膏,借助脂质体较好的生物相容性,可提高维A酸的透皮吸收速率和生物利用度。本研究解决了以往研究中药物联用或复合乳膏难以实现剂量调整和个体化用药的问题[14],与逆向蒸发法和醋酸钙梯度法制备相比,乙醇注入法制备工艺更加简便,适用于工业化生产。
在维A 酸脂质体的制备过程中,乙醇注入应缓慢进行以保证药液能够均匀分散在PBS 注入介质中,避免药物大量聚集析出,以保证制得的脂质体粒径较小且均匀。维A 酸稳定性差,易氧化异构化,因此实验过程应尽量避光且水浴温度不宜过高。在制备乳膏时,本文采用等量递加法将维A 酸脂质体加入到乳膏基质中以保证混合均匀[15]。体外透皮实验虽然能够直观地评价药物的透过量,但在体外透皮渗透速率的测定中,皮肤的来源和完整性以及接收介质的极性和pH 值等因素均会影响最终结果。一直以来啮齿类动物皮肤应用最为广泛。此外,接收介质的用量应尽可能达到“漏槽条件”。但受到接收池容积和药物溶解度的限制,常用吸收介质生理盐水和PBS 很难达到漏槽条件,故常加入一定比例的乙醇、异丙醇等有机溶剂[16]。
本文提供了一种维A 酸应用的新思路,即维A酸脂质体乳膏。但若要作为上市成品投入使用还应该加入保湿剂维持乳膏的湿度,并通过失水率的测定进行乳膏剂处方优化,筛选出保湿剂的最佳用量。对于乳膏的黏度、长期稳定性以及贮藏条件的探索也需要进一步探索。
