常压室温等离子体诱变选育黄原胶生产菌
2023-12-21吕伟峰宋文枫侯靖杰汤岳琴
王 鸿,王 璐,吕伟峰,宋文枫,侯靖杰,苟 敏,汤岳琴
(1.四川大学 建筑与环境学院 四川省环境保护有机废弃物资源化利用重点实验室,成都 610065;2.中国石油勘探开发研究院提高石油采收率国家重点实验室,北京 100083;3.中国石油勘探开发研究院,北京 100083; 4.冀东油田分公司,唐山 063200)
长链有机物和大分子物质常作为水土污染修复剂的稳定性改良剂,包括聚丙烯酸酯[1]、羧甲基纤维素(CMC)[2]、瓜尔胶[3]和黄原胶等。其中,黄原胶是由黄单胞菌属(Xanthomonas)合成的一种酸性多糖胞外聚合物[4-5],凭借优异的流变性、稳定性及环境相容性,黄原胶得到广泛应用[6]。如Pandey等[7]通过微波诱导丙烯酸乙酯和黄原胶共聚有效去除了水中重金属离子。Xin等[8]将黄原胶用作微米零价铁颗粒(mZVI)涂层剂,成功提高了小粒径铁的稳定性并应用于水体修复。此外,黄原胶还可以提高土壤孔隙率以及抗侵蚀能力,为水分输送和根系渗透提供了更多的途径,是传统土壤添加剂的环保替代品[9-10]。
黄原胶的工业产量目前为30~50 g/L,生产效率为0.40~0.70 g/(L·h),但产胶率低、成本高制约了黄原胶的大规模生产。虽然优化培养基成分或培养条件(如pH[11]、曝气率[11]、氮源和碳源[12]等)可改进黄原胶生产,但产量提升效果有限。此外,黄原胶作为改性剂时,pH、盐度、温度等对黄原胶的黏度有较大影响,因此,对黄原胶的性能稳定性有更高的要求[13-14]。现阶段物理(如紫外线、γ射线、X-射线等)或化学(如烷化剂、叠氮化物等)诱变等手段是获得高产/高品质菌株的常用方法[15-17]。与上述常规诱变方式相比,常压室温等离子体(Atmospheric room temperature plasma,ARTP)诱变技术可在正常大气压下产生离子体射流实现菌株的诱变,具有诱变速度快、操作条件温和安全、遗传物质损伤机制多样、基因损伤强度高等优点[18-19]。
目前,ARTP诱变技术已成为微生物的高效育种新方法,并显著提高了各类微生物产品的产量,如1,3-丙二醇(提升29.48%)[20]、氢气(提升2.7~3.1倍)[21]、高酸性蛋白酶(提升8.5%~17.3%)[22]和番茄红素(提升55%)[23]等,但利用此技术选育黄原胶生产的优良菌株尚未见报道。因此,本研究以一株野油菜黄单胞菌为出发菌株,利用ARTP诱变技术选育具有优良黄原胶生产能力的突变菌株,通过考察突变菌株的遗传稳定性、发酵性能以及产物稳定性,评估其在环境修复行业的应用潜力。
1 材料与方法
1.1 材料
1.1.1 出发菌株
生产黄原胶的出发菌株为野油菜黄单胞菌(Xanthomonascampestris),购于广东省微生物菌种保藏中心(保藏号:GDMCC 1.857)。
1.1.2 培养基
LB固体培养基(g/L):蛋白胨10,酵母粉5,NaCl 10,琼脂粉15。种子培养基(g/L):蛋白胨10,酵母粉5,NaCl 10。固体筛选培养基(g/L):葡萄糖20,蛋白胨1,NaCl 10,琼脂粉15。液体筛选培养基(g/L):葡萄糖20,蛋白胨1,NaCl 10。发酵培养基(g/L):葡萄糖20,氮源1,CaCO33,KH2PO45,MgSO40.50,FeSO4·7H2O 0.25,C6H8O7·H2O 1。氮源种类:NH4Cl、蛋白胨和谷氨酸。
上述培养基调节pH值至7.0,并在121 ℃条件下灭菌15 min后使用。其中,葡萄糖单独灭菌后加入培养基。
1.1.3 实验仪器
常温常压等离子体诱变育种仪:ARTP-M(无锡源清天木生物科技有限公司);紫外分光光度计:UV-VIS(JASCO,日本);恒温摇床:SKY-1102W(SUKUN,日本);黏度仪:TVB-10(TOKI SANGYD,日本);高效液相色谱:SCL-10AVP(Shimadzu,日本)。
1.2 方法
1.2.1 菌株活化及培养
将保存于-80 ℃冰箱的X.campestris划线接种于LB固体培养基上,30 ℃倒置培养。挑取长出的单菌落接种到种子培养基中,并在30 ℃、150 r/min条件下培养48 h至对数生长后期,以用于后续诱变处理[24-25]。
1.2.2 菌株的ARTP诱变
取1 mL对数生长后期的细胞培养液,于14 000 r/min下离心5 min后舍弃上清液保留菌体,并加入等量的PBS缓冲液洗涤2次后均匀混合,待菌体细胞均匀分散后,稀释浓度至108个菌体/mL[26]。取10 μL菌液浸在诱变仪的无菌不锈钢板上,进行诱变[27-28]。射频功率输入功率设为100 W,等离子炬喷嘴出口与样品板之间的距离为2 mm,空气流量为10 mL/min,等离子流温度为25~35 ℃,诱变时间分别设置为10、20、30、40和50 s。诱变后,将钢板浸入含有1 mL缓冲溶液的EP管中,并放置于涡旋振荡器上充分振荡5 min,确保所有菌体进入缓冲溶液中。随后将菌液稀释至10-5后,分别吸取100 μL均匀涂布于固体筛选培养基上,每个诱变时间涂布3个平行,并于30 ℃恒温培养箱中培养3~4 d,记录平板上的菌落数量。根据致死率确定最佳诱变时间,致死率计算公式如下。
1.2.3 诱变菌株的筛选
初筛:将最佳诱变时间下的菌液涂布于固体筛选培养基上,挑选比出发菌株更大、更光滑饱满的菌落为阳性克隆。菌落越大代表产黄原胶的能力越强[13]。并对初筛的阳性克隆进行直径测定、培养及编号保存。复筛:将出发菌株和初筛阳性菌株分别接种于种子培养基中,于30 ℃、150 r/min条件下培养48 h至对数后期;并接种至液体筛选培养基中,在30 ℃、150 r/min条件下培养6 d后测量黄原胶产量及发酵液黏度。
1.2.4 诱变菌株的传代稳定性
以NH4Cl为氮源,对诱变菌株进行10次连续传代,利用发酵培养基比较传代菌株的OD600、黄原胶产量及黏度,评估诱变菌株的遗传稳定性。
1.2.5 诱变菌株的发酵性能评估
(1) 不同氮源对产黄原胶的影响。研究表明黄原胶生产与氮源种类有着密切的联系[29]。采用3种氮源(氯化铵、蛋白胨、谷氨酸)进行发酵,通过考察黄原胶产量及黏度,比较不同氮源对诱变菌株产黄原胶的影响。
(2) 氮源质量浓度对产黄原胶的影响。研究表明在低氮条件下黄原胶发酵产量更加优异[30]。采用谷氨酸为氮源,在不同氮源质量浓度下(1、2、4 g/L)进行发酵,通过考察黄原胶的产量及黏度,比较不同质量浓度谷氨酸对诱变菌株产黄原胶的影响。
(3) pH对产黄原胶的影响。pH会通过影响黄原胶的聚合度从而影响黄原胶黏度[31]。采用谷氨酸为氮源,在不同pH条件下(6.5、7.0、7.5)发酵,通过考察黄原胶的产量及黏度,比较不同pH对诱变菌株产黄原胶的影响。
(4) 盐度对产黄原胶的影响。Rojas等[32]发现在以谷氨酸为氮源时,增加Na+浓度可以增加黄原胶产量。采用谷氨酸为氮源,在不同盐度条件下(NaCl 0、6、8 g/L)发酵,通过考察黄原胶的产量及黏度,比较不同盐度对诱变菌株产黄原胶的影响。
(5) 发酵产物的热稳定性评估。以NH4Cl为氮源分别对出发菌株和诱变菌株进行发酵。在发酵第6天时,取40 mL发酵上清液于50 mL离心管中,在水浴锅中分别加热至40、60和80 ℃,并保持加热30 min;随后取出发酵液测量其黏度变化,评估发酵产物的热稳定性。
(6) 发酵产物的耐盐性评估。以NH4Cl为氮源分别对出发菌株和诱变菌株进行发酵。在发酵第6天时,取40 mL发酵液于50 mL离心管中,加入矿化度为28.9 g/L的模拟高盐废水[(NH4)2SO45.00 g/L,KCl 1.10 g/L,NaCl 10.00 g/L,MgSO44.40 g/L,K2HPO43.40 g/L,CaCl25.00 g/L],充分振荡10 min,然后静置20 min后测量发酵液黏度变化,评估发酵产物在高盐条件下的稳定性。
1.2.6 分析方法
黄原胶产量分析:用无菌移液管吸取20 mL发酵液置于50 mL离心管中,在4 ℃、8 500 r/min条件下离心10 min以去除细胞。然后将含有黄原胶的上清液与无水乙醇1∶2(体积比)混合,搅拌静置。经0.45 μm膜过滤后获得的沉淀即为黄原胶。将黄原胶在105 ℃下干燥48 h至恒重,然后称重计算产量。黏度分析:取20 mL发酵液,用旋转黏度计的M2型转子在30 r/min条件下测量黏度,最大测量量程为1 000 mPa·s。
2 结果与分析
2.1 等离子体诱变处理
诱变时间是获得优良突变菌株的关键参数。在不同时间下,对野油菜黄单胞菌进行ARTP诱变,其致死率结果如图1所示。随着诱变时间的增加,菌株的致死率不断升高;诱变10 s和20 s的致死率分别为85.47%和86.32%;当诱变时间高于20 s时,死亡率超过90%。梁玲等[24]和耿海波等[25]研究发现致死率为80%~90%时诱变效果最佳。因此,选择20 s为最佳诱变时间。

图1 等离子体辐射时间对菌株致死率的影响
2.2 黄原胶高产菌株的筛选
2.2.1 诱变菌株初筛
将最佳诱变条件下(处理20 s)的菌液涂布于固体筛选培养基上,经过3 d的培养比较菌落直径的大小。如表1所示,在平板上长出的25个菌落中,有5个诱变菌株的菌落直径显著大于出发菌株。其中,X20菌落的直径最大(约3.2 mm),可能为高产黄原胶菌株。

表1 初筛平板上的菌落直径
2.2.2 诱变菌株复筛
对出发菌株及初筛获得的5株诱变菌株,同时在液体筛选培养基中发酵6 d,各菌株的黄原胶产量与黏度如图2所示。出发菌株的黄原胶产量为1.98 g/L,黏度为55.20 mPa·s。在5株诱变菌株中,X19、X24的黄原胶产量和黏度均低于出发菌株;而X20的产量与黏度最高,分别达到3.52 g/L和77.30 mPa·s,比出发菌株分别提高了77.78%和40.03%。

(a)产量;(b)黏度。X-WT:出发菌株;X12~X25:诱变菌株。* 为P<0.05;** 为P<0.01;*** 为P<0.001;未标注则表示无显著相关性。
2.3 诱变菌株X20的传代稳定性
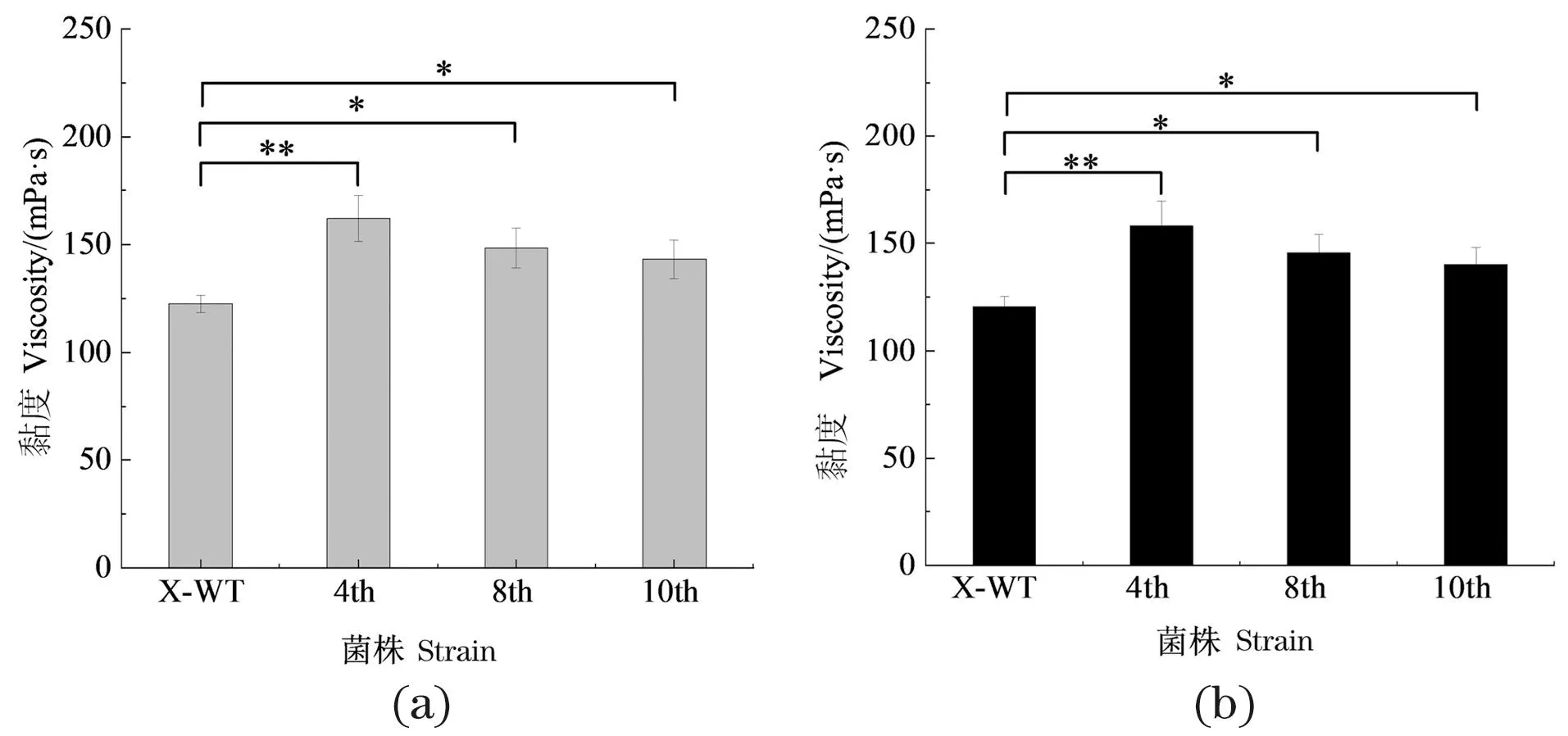
以NH4Cl为氮源,将诱变菌株X20连续传代10次,利用黄原胶产量以及发酵液黏度评估其遗传稳定性。如图3(a)所示,出发菌株在发酵第1 天开始合成黄原胶,在第4天时进入生长稳定期(OD600约为6.13),在第6天时黄原胶产量和黏度达到最大,分别为5.35 g/L和122.47 mPa·s。诱变菌株X20经过多次传代后,生长和发酵能力仍保持相对稳定[图3(b)~(d)]。各代菌株也分别在第4天进入生长稳定期,生物量与出发菌株较为接近。但发酵第6天时黄原胶产量和黏度均优于出发菌株,最大产量及黏度分别可达6.78 g/L和162.01 mPa·s。对第6天的黄原胶产量及黏度进行相关性分析,结果显示[图3(e)和(f)],出发菌株与诱变菌株的发酵性能具有显著差异(P<0.05),且不同代诱变菌的黄原胶生产能力较为稳定。

(a)出发菌X-WT;(b)第4代X20;(c)第8代X20;(d)第10代X20;(e)产量;(f)黏度。* 为P<0.05;未标注则表示无显著相关性。
2.4 诱变菌株X20的发酵性能
2.4.1 氮源对诱变菌株产黄原胶的影响
比较了不同氮源(氯化铵、蛋白胨和谷氨酸)对诱变菌株产黄原胶的影响。由图4可知:利用3种氮源发酵时,出发菌株的黄原胶产量差异不大(4.60~5.20 g/L);但黏度呈现以下规律:谷氨酸(495.50 mPa·s)>蛋白胨(235 mPa·s)>NH4Cl(188.70 mPa·s)。与出发菌株相比,诱变菌株X20在3种氮源下的黄原胶产量和发酵液黏度均有提升。以NH4Cl为氮源时,黄原胶产量为5.70 g/L,提升了23.91%,黏度达到188.70 mPa·s,提升了35.76%;以蛋白胨为氮源时,黄原胶产量为6.50 g/L,提升了25%,黏度达到235 mPa·s,提升了20.51%;以谷氨酸为氮源时,黄原胶产量达到7.30 g/L,提升了46%,黏度达到495.50 mPa·s,提升了22.28%。

(a)产量;(b)黏度。* 为P<0.05;** 为P<0.005;未标注则表示无显著相关性。
2.4.2 氮源质量浓度对诱变菌株产黄原胶的影响
比较了谷氨酸质量浓度(1、2和4 g/L)对诱变菌株产黄原胶的影响。由图5可知:对诱变菌株X20和出发菌株,氮源浓度越低黄原胶产量和黏度均更高;当谷氨酸质量浓度为1 g/L时[图5(a)和(b)],两个菌株的葡萄糖消耗差异不大,但在第6天出发菌株的黄原胶产量和黏度(8.46 g/L,457.70 mPa·s) 明显低于X20(9.59 g/L,552.90 mPa·s),X20分别提高了13.36%和20.80%;当谷氨酸质量浓度为2 g/L时[图5(c)和(d)],X20的黄原胶产量和出发菌株接近(分别为7.43 g/L和7.10 g/L),但黏度(130.60 mPa·s)低于出发菌株(201.85 mPa·s);当谷氨酸质量浓度为4 g/L时[图5(e)和(f)],出发菌株和诱变菌株X20的黄原胶产量分别降低到5和6 g/L,黏度分别降低至21.8和25.93 mPa·s,第6天发酵结束时仍有6 g/L葡萄糖残留。

(a)和(b):1 g/L谷氨酸; (c)和(d):2 g/L谷氨酸;(e)和(f):4 g/L谷氨酸。(a)、(c)和(e)为出发菌X-WT;(b)、(d)和(f)为诱变菌X20。
2.4.3 pH对诱变菌株产黄原胶的影响
比较了不同初始pH(6.5、7.0和7.5)对诱变菌株产黄原胶的影响。由图6可知,发酵第6天时,X20在不同pH条件下的发酵结果始终优于出发菌株。当初始pH 7.5时[图6(a)和(b)],出发菌的黄原胶产量和黏度分别为5.77 g/L和325.70 mPa·s;X20为6.79 g/L和484 mPa·s,比出发菌株分别提高了17.68%和48.60%。当初始pH 7.0时[图6(c)和(d)],出发菌株的黄原胶产量和黏度分别为7.46 g/L和448.76 mPa·s;X20为9.59 g/L和545.2 mPa·s,比出发菌株分别提高了28.55%和21.49%。当初始pH 6.5时[图6(e)和(f)],X20的黄原胶产量与出发菌株接近 (分别为5.61 g/L 和5.12 g/L),但黏度(546.50 mPa·s)明显高于出发菌株(325.70 mPa·s),表明X20比出发菌株更适应低pH发酵环境。
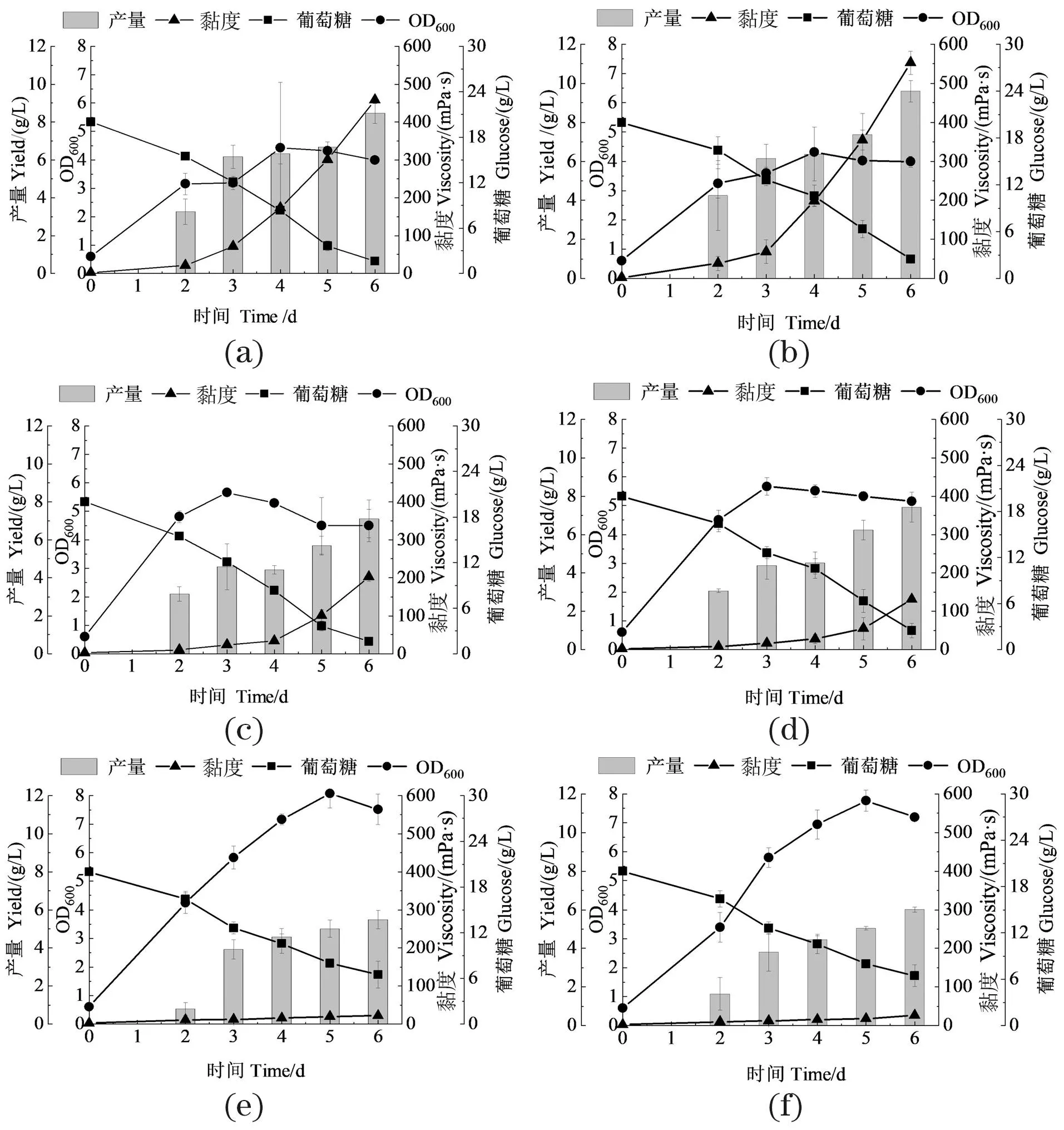
(a)和(b):pH 7.5;(c)和(d):pH 7.0;(e)和(f):pH 6.5。(a)、(c)和(e)为出发菌X-WT;(b)、(d)和(f)为诱变菌X20。
2.4.4 盐度对诱变菌株产黄原胶的影响
比较了不同盐度(0、6和8 g/L)对诱变菌株产黄原胶的影响。由图7可知,随着盐度增加,出发菌株和诱变菌株的黄原胶产量均有提升,但黏度受到抑制,且出发菌株受抑制程度更高。未添加NaCl时[图7(a)和(b)],出发菌株的黄原胶产量和黏度分别为8.46 g/L和457.76 mPa·s;X20分别为9.59 g/L和552.93 mPa·s,比出发菌株分别高13.36%和20.79%。当NaCl浓度为6 g/L时[图7(c)和(d)],出发菌株的黄原胶产量为8.55 g/L,黏度为139.8 mPa·s;X20的产量为10.12 g/L,黏度为175 mPa·s,比出发菌株分别高18.36%和25.18%。当NaCl含量达到8 g/L时,出发菌株的黄原胶产量和黏度分别为9.38 g/L和158.4 mPa·s,X20的产量为12.19 g/L,黏度为331.2 mPa·s,比出发菌株分别高29.96%和109%。
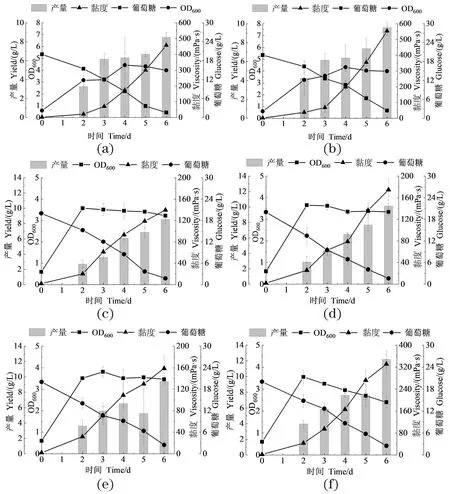
(a)和(b):0 g/L NaCl;(c)和(d):6 g/L NaCl;(e)和(f):8 g/L NaCl。(a)、(c)和(e)为出发菌X-WT;(b)、(d)和(f)为诱变菌X20。
2.4.5 诱变菌株发酵产物的热稳定性
以NH4Cl为氮源,比较了第6天发酵液在不同温度(20~80 ℃)下的黏度。如图8所示:出发菌株的发酵液黏度在20~40 ℃时未有明显变化(约为123 mPa·s);当温度升高至60 ℃时,黏度略有下降(116.8 mPa·s);而温度升高至80 ℃时黏度下降了23% (94.7 mPa·s)[图8(a)]。X20的发酵液黏度也有类似变化趋势,但不同代菌株的黏度变化程度存在一定差异[图8(b)~(e)]。与40 ℃相比,在60 ℃时X20第4代、第10代菌株的发酵液黏度分别降低了5.35%(153.4 mPa·s)和5.8%(134.67 mPa·s);在80 ℃时分别降低了14.83%(138.03 mPa·s)和14.26%(122.7 mPa·s)。各温度条件下X20的发酵液黏度始终高于出发菌株,且每代诱变菌株在不同温度(20~80 ℃)下的黏度无显著差异[图8(f)~(h)],表明诱变菌株生产的黄原胶具有更好的热稳定性。
2.4.6 诱变菌株发酵产物的耐盐性
比较了诱变菌株发酵产物的耐盐性。结果如图9所示,出发菌株和诱变菌株X20的发酵液均能在28.90 g/L的高矿化度条件下保持黏度稳定,且X20发酵液黏度均高于出发菌株,表明诱变菌株生产的黄原胶具有较好的耐盐性。
(a)未添加无机盐;(b)添加无机盐。* 为P<0.05;** 为P<0.01;未标注则表示无显著相关。
3 讨论与结论
现阶段大多关注获得的黄单胞菌诱变菌株产量的改进,较少关注黏度性能的提升。李元鑫等[33]对X.campestrisXG30-18经微波辐射后再进行亚硝基胍(NTG)处理,黄原胶产率达到3.92%,黏度未有明显差异,但经培养基优化后黏度提升至1 790 cP。Li等[34]将X.campestrisATCC 13951暴露于浓度递增的氨苄青霉素中,并进行连续传代155次,成功提升15%的黄原胶产量和33%的黏度,但传代时间长,步骤复杂。本研究通过ARTP技术快速获得了一株黄原胶产量及黏度均提升的稳定诱变菌株X20,产量与黏度最大分别可提升43.27%和35.75%,表明该技术应用于黄原胶生产微生物育种的可行性。
黄原胶是由一系列五糖重复结构单元(葡萄糖、甘露糖和葡萄糖醛酸组成)堆叠形成的大分子聚合物。其产量与黏度的提升与黄原胶结构直接相关,如研究发现黄原胶聚合度越大黏度越高[34]。氮源被认为是黄原胶生产的重要限制因子,其种类及浓度会极大影响黄原胶的产量和黏度。与出发菌株相比,诱变菌株X20在3种氮源条件下的黄原胶产量及黏度均有较大提升,且谷氨酸优于蛋白胨和氯化铵。此外,低浓度谷氨酸(1 g/L)更有利于黄原胶合成。Rojas等[32]发现低浓度L-谷氨酸不仅会刺激X.axonopodispv.citri306生长,同时也增加了黄原胶产量。在培养土壤真菌高山孢霉属(Alpinesporospora)时,添加谷氨酸后提高了细胞中的葡萄糖6-磷酸脱氢酶活性,使细胞产生了更多的NADPH,表明葡萄糖6-磷酸脱氢酶与谷氨酸之间存在密切联系[35-36]。因此,谷氨酸可能影响X.campestris细胞中的葡萄糖6-磷酸脱氢酶活性水平,进而影响黄原胶的合成,但目前对黄单胞菌属碳氮代谢制约因素的认识还很有限。Na+浓度也是影响黄原胶合成的重要因素。Monaco等[37]发现NMB1965缺陷突变体的谷氨酸摄取能力受到限制,但当Na+浓度高于60 mmol/L时谷氨酸吸收变得正常,可能是因为Na+浓度增加会促进二级转运蛋白活性,进而提高了黄原胶产量。pH值对黄原胶黏度影响较大,它会影响黄原胶的电荷密度,从而改变黄原胶分子间的缔合程度,导致黏度的巨大差异[38]。在不同pH条件下,诱变菌株X20的黏度均高于出发菌株,表明其更适应低pH发酵环境。
此外,诱变菌株X20的发酵液黏度在不同温度(20~80 ℃)及高矿化度(28.90 g/L)条件下均保持稳定,且始终优于出发菌株。黄原胶的耐温性源于其结构构像的变化:当环境温度低于或高于转变温度Tm时,黄原胶通过双螺旋结构和无序不定型结构的转换来维持黏度的稳定[39]。黄原胶的耐盐性则与其非牛顿流体的属性有关:黄原胶通过分子间作用构成了高度缠绕的网状结构,同时黄原胶可与发酵液中的多糖侧链、蛋白质等物质相互作用从而形成凝胶,这种分子间嵌合作用在增加黏度的同时可提升耐盐稳定性[39]。未来将对X20的最适发酵条件进行优化,并结合比较转录组学及基因工程手段解析ARTP诱变技术对黄原胶产量及黏度的提升机制。
