盐单胞菌假定蛋白基因的功能预测与克隆表达及耐盐相关性
2023-12-21舒志万王智博陶宇杰沈国平邢江娃朱德锐
舒志万,王智博,陶宇杰,王 嵘,沈国平,邢江娃,朱德锐
(青海大学 医学院 基础医学研究中心,西宁 810016)
假定蛋白(hypothetical protein)是一类能从转录组海量数据中预测基因开放阅读框的表达蛋白质,而在基因或基因组数据库中无明显的同源蛋白,或属于某一未知功能的潜在蛋白[1]。蛋白质作为基因功能的执行者,其功能注释是后基因组学时代的重要任务[2]。目前,蛋白Uniprot KB和Protein Data Bank (PDB)数据库中有超过1.2亿条蛋白质序列,仅有少量获得功能注释[3]。基于基因组学和转录组学高通量测序的广泛应用,各类生物细胞中存在大量的假定蛋白基因序列,可能参与多种细胞过程和信号传递通路,在细胞生化代谢、环境适应和药物靶点筛选等方面发挥潜在的应用作用。研究表明:专性嗜冷细菌的某些假定蛋白,能在低温和中等温度下维持蛋白活性,参与细菌的冷适应机制,涉及蛋白质折叠运输、能量代谢和酶调节等方面[4-5]。在金黄色葡萄球菌、沙眼衣原体、核型化脓杆菌和鼠疫耶尔森菌体内,利用假定蛋白的结构特征识别可能参与致病机制的毒力蛋白,探究细菌性传染病的药物新靶点[6-11]。因此,注释假定蛋白的潜在功能,可能为阐明宿主物种的生理调节、信号转导和生化代谢途径等发挥重要作用,尤其是某一类假定蛋白仅存在于某一特定物种属群,明确此类假定蛋白的功能,可能有助于探讨相关代谢机制[12]。
盐单胞菌属(Halomonas)是一类典型的嗜盐细菌,已自然进化形成两种经典策略应对高渗环境,其一是胞内积累K+/Cl-排出Na+,以维持细胞内外的渗透压平衡;其二是胞内吸收或生物合成有机相容溶质(compatible solute),以维持各类生物大分子的结构稳定[13]。然而,转录组学揭示盐梯度诱导条件下,盐单胞菌的盐适应机制错综复杂,涉及多种生化代谢过程[14]。主要参与的蛋白或因子集中在:(1) 涉及无机离子吸收/转运相关的通道蛋白或系统组分,如ABC转运系统、Na+/H+逆向转运蛋白、铁调节蛋白Fur(铁摄取)、双组分调节系统PhoPQ(镁和质子感知)、RpoS和OmpR等[15];(2) 相容性溶质(四氢嘧啶、甜菜碱及脯氨酸)生物合成和转运关联的蛋白或酶类,如谷氨酸合酶(GltD/B)、琥珀酸脱氢酶(SdhA/D)、琥珀酸半醛脱氢酶(Sad/GabD)和乌头酸水解酶(AcnA)等[16-17]。(3)物质运输、氨基酸及核苷酸生物合成等过程关联的核心碳代谢(Central carbon metabolism,CCM)枢纽涉及的蛋白或酶类,如6-磷酸果糖激酶、6-磷酸-β-葡萄糖苷酶和海藻糖-6-磷酸-磷酸化酶等[18];(4)细胞膜/壁组成的不饱和脂肪酸、磷脂及肽聚糖等合成过程涉及的蛋白或酶类,如3-羟基癸酰-ACP脱水酶(FabN)、烯酰-ACP还原酶(FabI)、3-氧代酰基-ACP合成酶Ⅱ(FabF)和β-羟基酰基-ACP脱水酶(FabZ)等[16]。同时,细菌基因组中存在约30%的未知功能新基因,参与盐胁迫过程,且表达水平变化显著,可能在渗透调节过程中发挥关键作用[19],具体调控机制有待深入探讨。我们前期实验通过RNA-seq分析H.campaniensisstrain XH26在无盐(0 mol/L NaCl)、中盐(1.0 mol/L NaCl)和高盐(2.5 mol/L NaCl)3种盐度条件下的基因表达水平,对比鉴定出差异表达基因2 599个,共同表达差异基因51个[20]。鉴于此,本研究通过筛选显著上调表达的假定蛋白基因orf03282,并对蛋白进行生物信息学分析和耐盐相关性验证,以期明确假定蛋白的可能功能,为深入研究盐单胞菌的耐盐特性和适应机制提供一定的理论参考依据。
1 材料与方法
1.1 材料
野生菌株H.campaniensisstrain XH26(CCTCC2019776M)分离于柴达木盆地小柴旦盐湖,现保存于青海大学医学院基础医学研究中心。NaCl、琼脂、MgSO4·7H2O、胰蛋白胨、无水氯化钙、氯化钾、Yeast extract、柠檬酸钠、L-谷氨酸钠、酶水解酪素、C6H12O6购自天津永大公司(分析纯);T4 DNA连接酶、限制性内切酶NcoⅠ和XhoⅠ、克隆载体pMD18-T、表达载体pET28a(+)、E.coilDH5α和E.coilBL21感受细胞菌株均购自大连TaKaRa公司;GeneGreen Nucleic Acid Dye、DNA凝胶回收试剂盒、TIANprep Mini Plasmid Kit和TIANamp Bacteria DNA Kit均购自北京天根生化科技有限公司;PCR Mix购自广州东盛生物科技有限公司;钙含量显色检测试剂盒购自上海碧云天生物科技有限公司。
1.2 方法
1.2.1 假定蛋白基因的表达验证分析
采用Trizol碱裂解法提取细菌总RNA[无盐组No salt(NS)、中盐组Medium salt(MS)和高盐组High salt(HS),3个重复组],并用Nanodrop检测RNA纯度,Qubit 2.0定量RNA浓度。使用反转录试剂盒合成cDNA,反转录产物-20 ℃保存。实时定量PCR对不同盐梯度条件下新型基因表达量进行分析。利用软件Primer 5.0设计qRT-PCR引物,并由生工生物工程(上海)股份有限公司合成(F:5′-TTGGCATTTTAGGCGTATCGTTTGG-3′,R:5′-CCTTGCTCATCCTGGGTCGTTTC-3′)。按照qRT-PCR试剂盒操作说明书进行聚合酶反应,上机运行(Roche Light Cycler®480 Ⅱ,Roche),运行参数:95 ℃预变性3 min;95 ℃变性10 s,65 ℃退火20 s,72 ℃延伸30 s,40个循环。内参基因为GADPH,每个生物学样品都进行3个重复,采用 2-ΔΔCT计算各基因的相对表达水平。
1.2.2 假定蛋白基因生物信息学分析
基于转录组中的注释序列,运用NCBI-BLAST(http:∥www.ncbi.nlm.nih.gov/BLAST/)进行基因相似序列分析。利用细菌启动子在线程序(http:∥www.bacpp.bioinfoucs.com/)分析基因启动子结构。采用ExPASy:ProtParam(http:∥web.expasy.org/protparam/)在线程序分析蛋白的理化性质[21]。通过SignalP-5.0(https:∥services.healthtech.dtu.dk/service.php/SignalP-5.0/)、TMHMM-2.0(http:∥www.cbs.dtu.dk/services/TMH-MM-2.0/)和PSIPRED(http:∥bioinf.cs.ucl.ac.uk/psipred/)在线程序分别进行蛋白信号肽、跨膜结构域和二级结构预测[22-24];运用I-TASSER服务器(umich.edu)进行蛋白三级结构预测;使用LIGPLOT v.4.5.3软件预测并绘制蛋白质-配体互作图;利用Gneg-mPLoc(http:∥www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)在线程序进行蛋白定位分析[25];通过转运蛋白分类数据库(TCDB)和电压门控钾通道数据库(VKCDB)进行蛋白序列相似性对比,运用COACH-D(http:∥yanglab.nankai.edu.cn/COACH-D/)在线程序进行蛋白质-配体结合位点分析。
1.2.3 原核表达载体构建及验证
根据注释序列,设计含NcoⅠ-XhoⅠ的引物。F:5′-ATGCCATGGGCATGAAAAAGGAAGCTCTC-3′;R:5′-CCCTCGAGCCAACCGGAATCATCTTC-3′,序列中下划线标记部分保护碱基,CCATGG与CTCGAG为酶切位点序列。以cDNA为模板,PCR扩增目的基因。反应体系:DNA模板1 μL,正/反向引物各2 μL,PCR Mix 25 μL,ddH2O 20 μL。PCR反应条件:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃ 延伸1 min,35个循环;72 ℃再延伸7 min。纯化回收后的目的基因片段与pMD18-T载体连接,并转化至E.coilDH5α构建重组菌株。连接体系:目的基因2 μL,pMD 18-T载体1 μL,ddH2O 2 μL,Solution 5 μL,16 ℃连接30 min。重组菌株菌液进行PCR验证并测序。将重组质粒pMD18-T-orf03282和表达载体pET28a进行酶切。酶切体系:pET28a/质粒DNA 30 μL、NcoⅠ/XhoⅠ 3 μL、10× K buffer 6 μL、BSA 6 μL、ddH2O 12 μL。酶切获得的目的基因片段与载体pET28a酶切产物16 ℃过夜连接。反应体系:目的基因片段7 μL、pET28a载体片段1 μL、T4DNA连接酶1 μL、连接酶缓冲液1 μL。连接产物再转化至E.coliDH5α,挑选转化菌落。从重组菌株E.coliDH5α/pET28a-orf03282中提取重组质粒并通过热激法转化到E.coilBL21中,挑取单菌落并培养16 h,重组菌株E.coilBL21/pET28a-orf03282由生工生物工程(上海)股份有限公司测序,菌液PCR验证目的基因。
1.2.4 蛋白质异源表达
重组菌株E.coilBL21/pET28a-orf03282活化于LB液体培养基(含Kan),然后接种于100 mL的LB液体培养基,37 ℃条件下180 r/min振荡培养,至菌液OD600值为0.5~0.8时加入IPTG,15 ℃和37 ℃振荡培养16 h。培养获得的重组菌株12 000 r/min离心5 min,弃去上清液,留取沉淀,并用500 μL的PBS缓冲液悬浮沉淀。将细菌悬浮液置于冰上进行超声破碎,超声时间12 s,间隔时间10 s,7 min后细菌悬浮液变澄清。将超声破碎后的细菌悬浮液12 000 r/min离心2 min,分别收集沉淀和上清液进行SDS-PAGE电泳鉴定。
1.2.5 重组菌株耐盐相关性测定
将活化后的重组菌株E.coilBL21/pET28a-orf03282和E.coilBL21/pET28a按1%的接菌量接种至OSM液体培养基(含Kan),37 ℃条件下180 r/min振荡培养至OD600值约为0.5,加入IPTG至终浓度为0.2 mmol/L,继续放入摇床4 h。将诱导后的菌株接种至OSM液体盐梯度(设置0、0.2、0.4、0.6、0.8和1.0 mol/L)培养基中,16 ℃条件下180 r/min摇晃24 h后,检测不同盐浓度下菌液的OD600值及细菌胞内的Ca2+浓度。
1.2.6 重组菌株胞内Ca2+浓度检测
使用钙含量显色检测试剂盒测定细菌胞内Ca2+浓度。收集不同盐梯度下诱导培养24 h的重组菌株E.coilBL21/pET28a-orf03282和E.coilBL21/pET28a细菌菌泥,并用预冷的1×PBS洗涤2~3次。向每个样本中加入200 μL预冷的样品裂解液,使细胞完全裂解。细胞裂解完成后,在4 ℃下收集细胞裂解液并12 000 r/min离心5 min后收集上清液,通过钙离子标准显色溶液获得每个样本的吸光值并量化为相应的Ca2+浓度[26]。
2 结果与分析
2.1 qRT-PCR验证假定蛋白基因表达水平
基于高通量转录组测序数据筛选的假定蛋白基因orf03282,运用荧光qRT-PCR进行假定蛋白基因的表达差异验证(图1)。结果表明:在NS、MS和HS 3种盐度条件下,基因orf03282的qRT-PCR检测结果[图1(b)]与RNA-seq测序结果[图1(a)]趋势相同,即在NSvsMS、NSvsHS和MSvsHS比较组中,假定蛋白基因均出现不同程度的上调表达,说明随外界NaCl浓度的升高,假定蛋白基因的表达量增加。
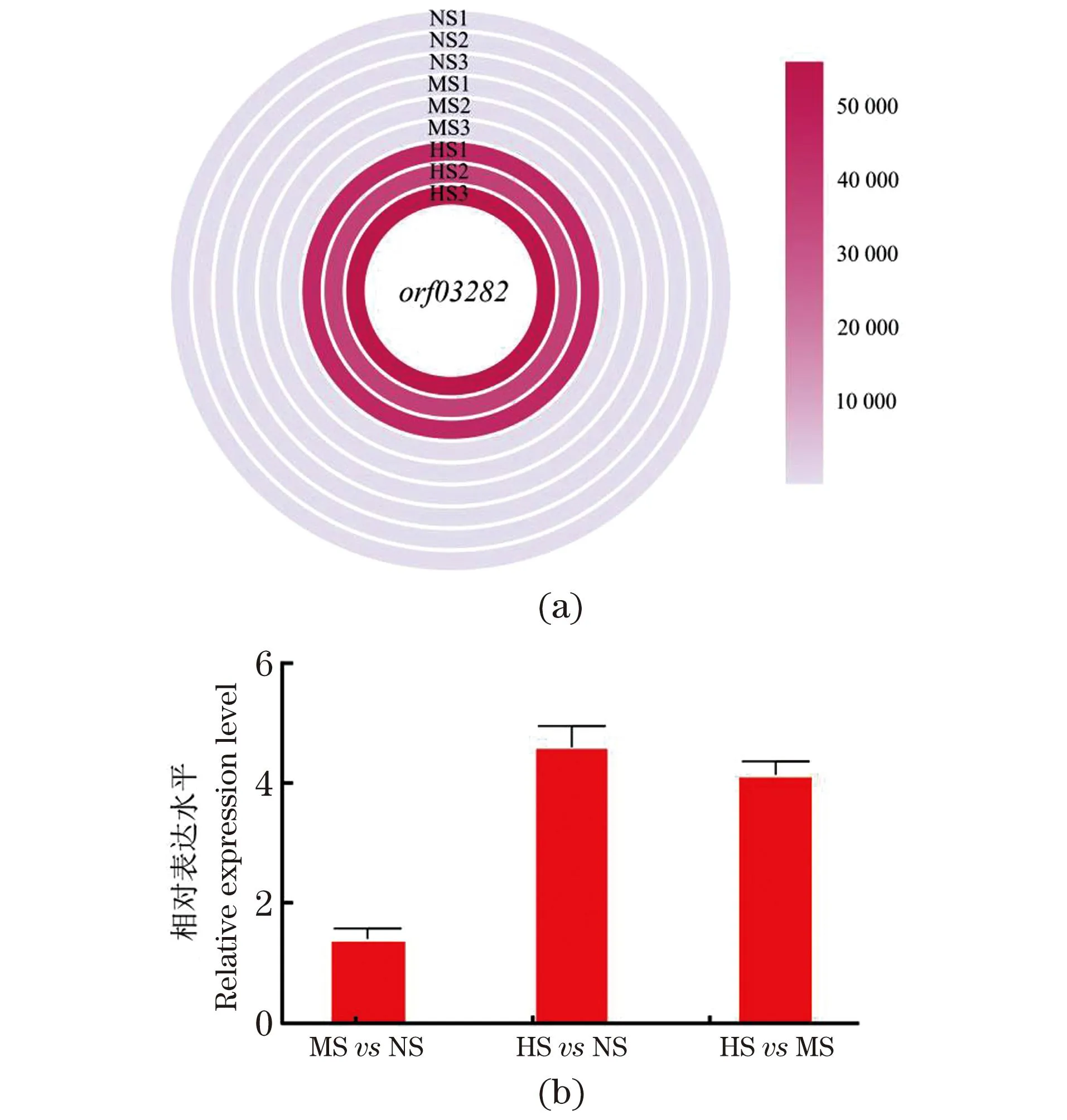
NS:0 mol/L NaCl; MS:1.0 mol/L NaCl; HS:2.5 mol/L NaCl。P<0.05。
2.2 基因序列相似性和启动子特征分析
在XH26菌株中,假定蛋白基因orf03282的开放阅读框长度为300 bp。采用NCBI数据库BLAST程序分析基因的启动子结构和序列相似性。预测结果显示:基因orf03282的上游操纵子区域[图2(a)],存在特异性σ38和σ70启动子的结合和识别位点,其中,σ70常见启动子序列的-35区(TCTTGC)和-10区(ATGAT)分别位于起始密码子上游-59 bp和-83 bp处,转录起始位点(transcription start site,TSS)位于起始密码子上游-49 bp处,核糖体结合位点(Ribosome binding site,RBS)位于起始密码子上游-20 bp处(GAAGC);盐渗透压特征启动子σ38的-35区(TCTCTG)和-10区(TTATT)位于起始密码子上游-160 bp和-180 bp处,TSS位于起始密码子(ATG)上游-122 bp处。序列相似性分析显示,基因orf03282与H.campaniensisstrain LS21和H.alkaliphilaX3基因的相似性最高,分别为99.67%和99.33%,序列保守,表明序列进化同源[图2(b)]。
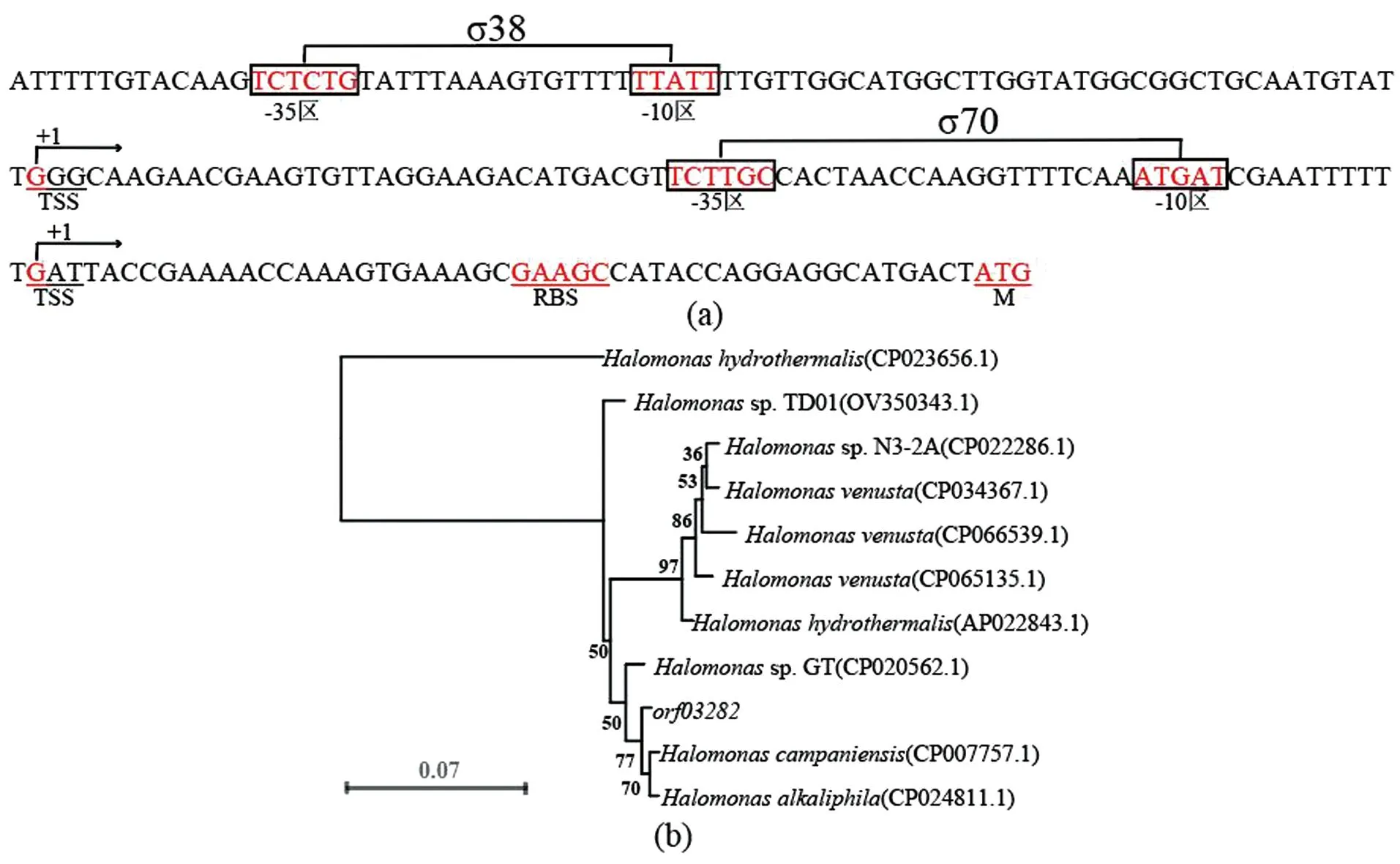
图2 基因orf03282的启动子结构(a)与系统发育分析(b)
2.3 蛋白序列比对和结构功能预测
运用BLASTp程序检索同源蛋白和比对分析氨基酸序列[图3(a)],表明盐单胞菌中假定蛋白Orf03282广泛存在,且序列高度同源。蛋白质理化特征分析显示:假定蛋白Orf03282由99个氨基酸残基组成,分子式为C480H701N115O191S2,分子质量为11.2 ku,蛋白等电点、不稳定性指数、疏水性平均值和脂肪系数分别为3.54、76.41、1.248和40.51。蛋白信号肽预测显示[图3(b)]:蛋白Orf03282具有“标准”的分泌型信号肽特征(相似性98.21%),即位于N末端第1~26残基序列(MKKEALKKLGLLGVSFGLLASPLAFA)。亚细胞定位和跨膜结构域分析表明[图3(c)]:Orf03282可能定位于细胞外膜,存在单次跨膜结构域,跨膜区为N末端第9~28个残基序列(GLLGVSFGLLASPLAFAGM)。同时,在TCDB和VKCDB数据库中进行序列比对,发现Orf03282分别与人Sodium/potassium/calcium exchanger 1(39.1%)和Voltage-dependent L-type calcium channel subunit alpha-1F(36.7%)存在一定的序列相似性。此外,Orf03282还与细菌Parameciumtetraureliastrain d4-2的钠、钾/钙离子通道假定蛋白存在一定相似性(31%)。蛋白质二级结构预测显示[图3(d)]:蛋白Orf03282主要由α螺旋(5个)和无规则卷曲(6个)构成。LIGPLOT软件分析显示[图3(e)]:假定蛋白Orf03282多肽链中的第69、72、74和76位的Glu残基参与构成金属离子结合配位点。COACH-D蛋白质-配体结合预测表明[图3(f)]:在所有可能参与的结合配体中,假定蛋白Orf03282与配体Ca2+结合的可能性最高,两者的结合位点可能是在由假定蛋白Orf03282的第69位和第72位谷氨酸残基所构成的“口袋”之中。
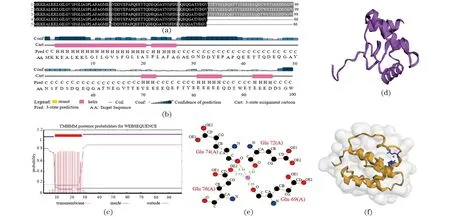
(a)蛋白Orf03282的氨基酸序列相似性比对(1:H.campaniensis sp.XH26; 2:Halomonas sp.LS21; 3:H.hydrothermalis; 4:H.venusta; 5:Halomonas sp.N3-2A);(b)蛋白质二级结构预测;(c)蛋白质跨膜结构域分析;(d)蛋白质二级结构分析;(e)蛋白质-配体相互作用分析(粉色圆球为金属离子结合位点);(f)蛋白质与配体Ca2+结合模拟分析(黄色条带为蛋白质三维结构,蓝色条带为结合位点残基,粉色圆点为配体Ca2+)。
2.4 重组表达载体的构建和验证
以cDNA为模板,PCR克隆扩增目的基因[图4(a)],其中基因orf03282片段大小为300 bp。将目的基因与pMD18-T连接,筛选重组克隆载体质粒pMD18-T-orf03282,并转化至菌株E.coilDH5α,成功构建重组菌株E.coilDH5α/pMD18-T-orf03282。测序结果显示[图4(d)]:基因序列与目的基因序列相似性为100%,无点突变。菌液PCR分析表明,电泳条带的位置、大小与预期结果相一致[图4(b)]。将目的基因片段与表达载体质粒pET28a酶切连接,转化至E.coilBL21(DE3)形成重组菌株E.coilBL21/pET28a-orf03282,测序结果显示[图4(e)]:载体基因序列与目的基因序列相一致。菌落PCR验证结果显示成功构建重组表达菌株[图4(c)]。
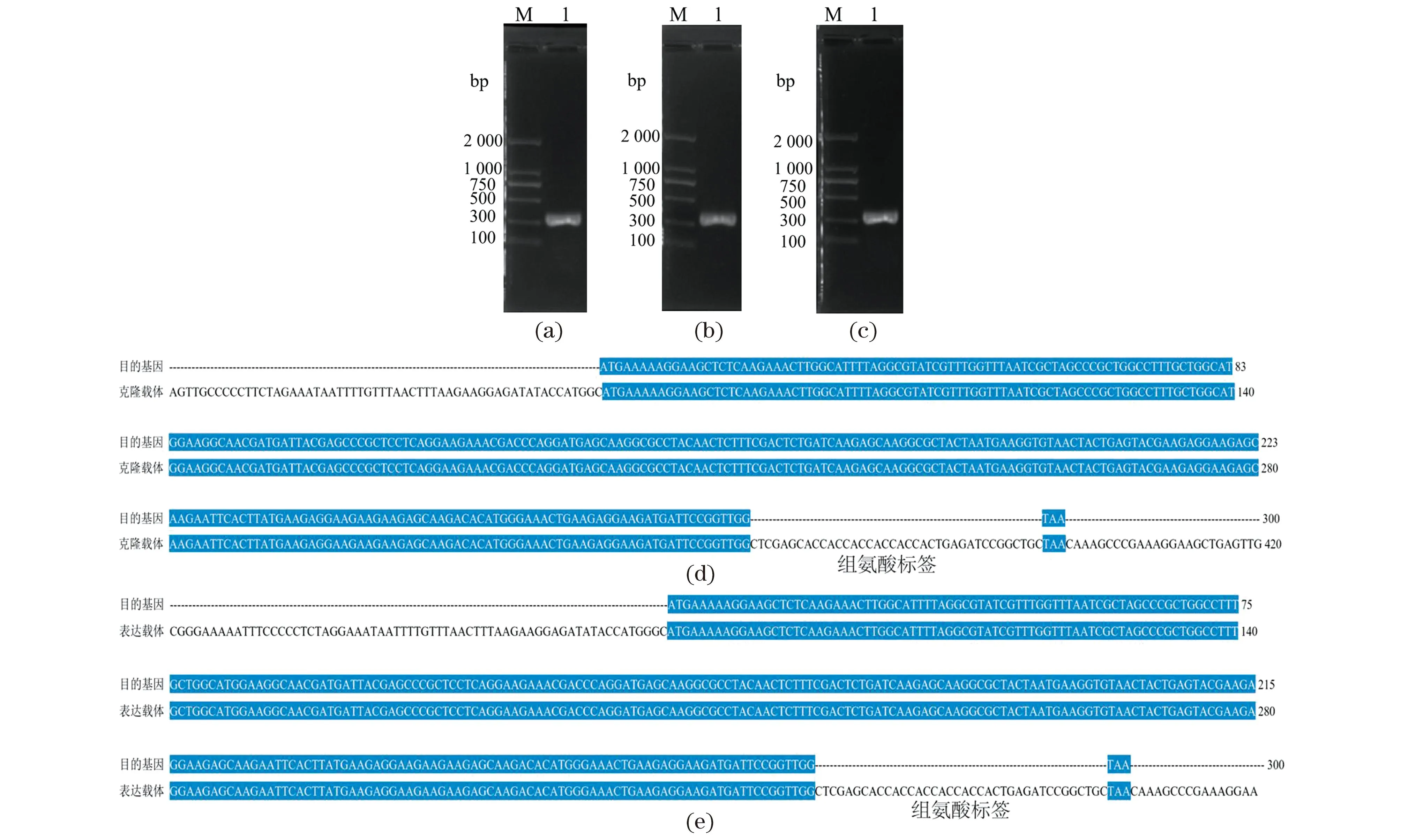
(a)目的基因PCR扩增(M:DNA Marker;1:基因orf03282);(b)克隆载体重组菌液PCR(M:DNA Marker;1:克隆载体质粒pMD18-T-orf03282上的目的基因片段);(c)表达载体重组菌液PCR(M:DNA Marker;1:重组表达载体质粒pET28a-orf03282上的目的基因片段);(d)重组克隆载体与目的基因序列比对;(e)重组表达载体与目的基因序列比对。
2.5 目的蛋白异源表达
将重组质粒pET28a-orf03282转化到E.coilBL21中,并用0.2 mmol/L的IPTG分别在15 ℃和37 ℃进行诱导。将含有重组质粒和pET28a的E.coilBL21经超声破碎后,分别取破碎后全菌、上清液和沉淀进行SDS-PAGE分析(图5)。结果显示:假定蛋白Orf03282在上清液和沉淀中都有存在,蛋白条带分子质量大小与预期大小一致(11.2 ku),表明假定蛋白Orf03282能在E.coilBL21体内实现异源表达,且在15 ℃条件下诱导表达量最大。
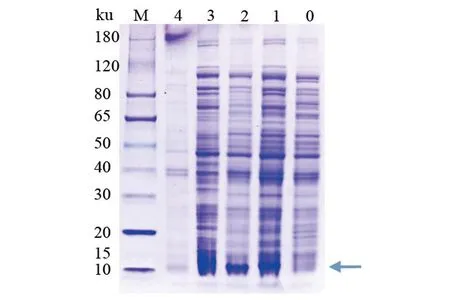
M:Protein Marker;0:对照(不加IPTG);1:15 ℃诱导全菌;2:37 ℃诱导全菌;3:15 ℃诱导菌体裂解后上清液;4:15 ℃诱导菌体裂解后沉淀。
2.6 重组菌株耐盐相关性及胞内Ca2+浓度检测
将重组菌株E.coilBL21/pET28a-orf03282和空载对照菌株E.coilBL21/pET28a进行胞内Ca2+浓度和耐盐度分析(图6)。结果表明:在0、0.2和0.4 mol/L NaCl盐度条件下,重组菌株E.coilBL21/pET28a-orf03282与对照菌株E.coilBL21/pET28a的生长量无明显差异,而当NaCl浓度升高到0.6 mol/L时,E.coilBL21/pET28a-orf03282生长量高于E.coilBL21/pET28a;当NaCl浓度升高到0.8 mol/L时,E.coilBL21/pET28a-orf03282优势最为明显。胞内Ca2+浓度分析显示:在不同盐度条件下,E.coilBL21/pET28a-orf03282胞内Ca2+浓度均高于对照菌株E.coilBL21/pET28a。胞内Ca2+含量随盐浓度的增加而逐渐升高,其中重组菌株E.coilBL21/pET28a-orf03282的上升趋势优于对照菌株E.coilBL21/pET28a。由此说明假定蛋白Orf03282的表达能有效提高宿主大肠杆菌的耐盐生长,可能的原因是提高了重组菌株E.coilBL21对Ca2+的吸收。

图6 重组菌株和对照菌株的耐盐度与胞内Ca2+浓度分析
3 讨论与结论
研究从H.campaniensisXH26菌株中筛选出假定蛋白基因orf03282。BLASTn软件对比分析发现:该假定蛋白基因普遍且仅存在于盐单胞菌基因组之中,序列高度相似,最高可达99.67%。qRT-PCR实验表明:基因orf03282的胞内表达水平随盐度增加而升高,因此推测假定蛋白基因orf03282在嗜盐微生物基因组中广泛存在,可能参与细胞的高渗抵抗作用。假定蛋白Orf03282的高效表达,能有效提高宿主菌株E.coilBL21的耐盐生长,可能原因是增加了胞内的Ca2+吸收。我们预测发现蛋白Orf03282的二级和三级结构由α螺旋和无规则卷曲构成,极可能存在EF-手型结构,并且氨基酸序列的某些区域密集分布Glu和Asp,与蛋白Sodium/potassium/calcium exchanger 1和蛋白Voltage-dependent L-type calcium channel subunit α-1F的序列相似区域类似(高比例Glu)。蛋白-配体相互作用分析表明,蛋白Orf03282序列中存在多个Glu(16个),为募集金属离子的配位点。为进一步确定假定蛋白Orf03282的功能,运用COACH-D分子对接技术,发现蛋白Orf03282与Ca2+的蛋白质-配体结合力最高。因此,根据上述证据可初步推测蛋白Orf03282在XH26菌株的细胞膜上,可能具有钙结合蛋白功能。
克隆获得的基因orf03282成功导入E.coilBL21中,构建异源表达载体,并进行盐梯度和胞内Ca2+浓度检测。结果表明:假定蛋白Orf03282的异源表达能有效增强菌株E.coilBL21的盐胁迫耐受性。重组菌株胞内的Ca2+含量显著高于对照菌株,说明假定蛋白Orf03282可能通过增加Ca2+含量提高细胞对盐胁迫的抵抗能力。本研究中基因orf03282的表达水平是否关联作用Ca2+信号通路途径,或钠/钙转运蛋白与钙调蛋白等,有待转录水平验证和基因敲除等后续的深入研究。
