环索奈德通过靶向HIV-1衣壳蛋白六聚体调节其体外装配
2023-12-21张大为包小峰
张 莉,张大为,包小峰
(1.南通大学 药学院,南通 226001; 2.江苏理工学院 生物信息与医药工程研究所,常州 213001)
艾滋病(acquired immunodeficiency syndrome,AIDS)的病原体为人类免疫缺陷病毒1型(human immunodeficiency virus 1,HIV-1)[1]。在临床上使用“高效抗逆转录疗法”(即俗称的鸡尾酒疗法)治疗艾滋病,已经取得巨大成功,甚至已经将该病逆转为一种可控的慢性疾病[2]。但是,HIV-1的基因高度可变性和潜伏性,使得病人需要终生服药,由此带来的患者依从性、药物副作用和耐药性问题,使治疗艾滋病的效果明显降低[3]。因此,针对具有成药潜力的新靶标,寻找新的抗HIV-1药物是解决现有问题的关键。
HIV-1是逆转录病毒,其核心中的蛋白-RNA复合物由衣壳包裹[4]。衣壳由1 500个衣壳蛋白(capsid,CA)单体装配而成[5]。CA参与HIV-1复制过程中的诸多重要过程,与病毒的复制及感染性密切相关[6]。针对CA设计HIV-1抑制剂已得到广泛关注,目前已有许多CA抑制剂见诸报道[7-8]。PF74是第一个被报道的CA装配抑制剂,但因其药理存在诸多缺陷,未能进入临床研究[9]。有研究在PF74基础上经过结构优化得到了活性突出的GS-6207,目前该化合物进入临床试验阶段[10]。尽管目前尚无CA抑制剂被FDA批准用于临床,但是已发现的诸多CA抑制剂却有力地证明了CA是开发抗病毒药物的有效靶点。
HIV-1 CA单体由两个结构域,即N端结构域(N-terminal domain,NTD)和C端结构域(C-terminal domains,CTD),以及二者中间的柔性部分组成[11]。已报道的大部分CA装配调节剂作用于衣壳蛋白的NTD,只有极少的化合物靶向衣壳蛋白的CTD。CAI是一个具有12个残基(ITFEDLLDYYGP)的多肽。研究发现CAI能结合到CA CTD上一个保守的口袋,导致CA在体外无法完成装配[12-14]。在此基础上,后续的研究发现了诸多作用于该口袋的订书肽和小分子,这些分子均具有抑制HIV-1复制的活性[15-18]。因此,CAI在CA CTD上的结合口袋可以用来筛选抗HIV-1药物。
本文以CA CTD-CAI相互作用,即以CAI结合口袋为靶点,采用已经建立的基于时间分辨荧光(homogeneous time resolved fluorescence,HTRF)技术的筛选方法[19],评估399个化合物抑制该相互作用的活性,旨在寻找更多的CA抑制剂,为开发新的抗HIV-1药物奠定基础。
1 材料与方法
1.1 材料
1.1.1 试剂
小分子化合物库InterBioScreen(国家小分子化合物资源中心);HiTrapTMQ FF阴离子交换层析柱和HiTrapTMSP HP阳离子交换层析柱均购自GE公司;蛋白分子量标准购自Thermo公司;β-巯基乙醇(2-Mercaptoethanol,β-ME)、氨苄西林、异丙基-β-D-硫代半乳糖苷(Isopropyl-β-D-thiogalactoside,IPTG)、吐温-20(Tween-20)、磷酸盐缓冲液(Phosphate buffered solution,PBS)购自康为世纪生物科技股份有限公司;Streptavidin-XL665受体微珠和Anti-GST-Eu供体微珠购自法国Cisbio公司;SA(Streptavidin)传感器购自Sartorius公司。生物素化试剂盒(包括生物素化试剂和脱盐柱)购自苏州博美达生命科学有限公司;AmiconTM超滤管购自Merck公司;OptiPlateTM白色384孔浅孔板购自Perkin Elmer公司;黑色96孔板购自Greiner公司;透析袋(截留分子质量10 ku)购自Spectrum Labs;CAI多肽和生物素化的CAI由吉尔生化(上海)有限公司合成;大肠杆菌(Escherichiacoli)菌株BL21(DE3)购自上海唯地生物技术有限公司;Protease Inhibitor Cocktail购自MedChemExpress公司;表达载体pET28a-WT CA(表达带有6个组氨酸标签的野生型HIV-1衣壳蛋白)、pET11a、pGEX4T-1由本实验室保存;GST-CA CTD由本实验室保存。
1.1.2 仪器
超净工作台(苏州净化设备有限公司);金属浴(Thermo公司);高速冷冻离心机(Thermo公司);蛋白质电泳仪(Bio-Rad公司);BE-9008微孔板恒温振荡器(其林贝尔仪器制造有限公司);恒温摇床(上海知楚仪器有限公司);超声破碎仪(宁波新芝生物科技股份有限公司);NGC Quest 10 Plus层析系统(Bio-Rad公司);Bio-Rad Gel Doc XR+凝胶成像系统(Bio-Rad公司);EnVision多功能微孔板检测仪(PerkinElmer公司);分子相互作用检测仪(Octet Red96,Pall公司)。
1.2 方法
1.2.1 HIV-1衣壳蛋白(单体和六聚体)的表达纯化[20]
以质粒pET28a-WT CA(基因来自HIV-1标准株HXB2)为母本质粒,PCR扩增WT CA基因克隆至表达载体pET11a的NdeI-BamH I位点(苏州金唯智生物科技有限公司构建)。正确构建含WT CA编码基因的重组表达质粒命名为pET11a-WT CA,然后以热激法转化至E.coliBL21(DE3)感受态细胞中,涂于含氨苄西林的平板过夜培养筛选阳性重组子。挑取单个克隆接种到含50 μg/mL氨苄西林抗性的LB 液体培养基中,37 ℃,250 r/min振荡培养过夜。按1∶100的比例扩大培养至对数中期,添加0.4 mmol/L IPTG,37 ℃继续诱导表达4 h,收集菌体。用缓冲液A(50 mmol/L Tris,pH 8,50 mmol/L NaCl,5 mmol/L β-ME,protease inhibitor)重悬菌体,超声破菌,离心收集上清液。缓慢加入25%硫酸铵,4 ℃搅拌过夜。8 000 r/min离心20 min收集沉淀,使用体积为缓冲液A一半的缓冲液B(5 mmol/L HEPES,pH 6.8)重悬沉淀。将重悬的沉淀于缓冲液B中4 ℃透析过夜。透析后的蛋白样品上HiTrap SP HP阳离子交换柱,以缓冲液B进行NaCl梯度(0~1 mol/L)洗脱。收集洗脱峰,于透析液(20 mmol/L Tris,pH 8,40 mmol/L NaCl,2 mmol/L β-ME)中过夜透析。透析后的蛋白样品上HiTrap Q FF阴离子交换柱,收集穿柱液,即得到HIV-1衣壳蛋白单体。向pET11a-WT CA质粒中引入4个点突变A14C/E45C/W184A/M185A(苏州金唯智生物科技有限公司构建),命名为pET11a-4Mu-CA。表达纯化方法同上,可得到HIV-1衣壳蛋白六聚体。采用SDS-PAGE检测蛋白表达纯化。用ProtParam tool计算蛋白的消光系数,用测得的A280除以该蛋白的消光系数,得到蛋白的准确浓度。
1.2.2 基于HTRF的CA CTD-CAI相互作用抑制剂的筛选[19]
N端带有GST标签的HIV-1 CA CTD(GST-CA CTD)和N端带有生物素(biotin)的多肽CAI(Bio-CAI)相互作用时(空间距离小于10 nm),Streptavidin-XL665受体微珠和Anti-GST-Eu供体微珠也会相应靠近,从而发生共振能量转移(FRET)现象。当抑制剂分子阻断GST-CA CTD和Bio-CAI的相互作用时,FRET现象减弱。因此,FRET信号的强弱可以反映抑制剂分子阻断该相互作用的强弱,可用于CA CTD与CAI相互作用抑制剂的筛选。
实验在384孔板中进行,反应buffer为含有0.05% Tween-20和2 mmol/L β-ME的PBS。将以下成分加入孔板中:2 μL 30 nmol/L Bio-CAI、2 μL 30 nmol/L CA CTD、1 μL化合物,混匀后25 ℃,200 r/min反应30 min。然后加入2.5 μL 0.8 nmol/L的Anti-GST-Eu供体磁珠和2.5 μL 4 nmol/L的Streptavidin-XL665受体磁珠(含100 mmol/L KF),混匀后25 ℃,200 r/min反应1 h。使用多功能酶标仪,以320 nm为激发光,读取665 nm和620 nm处的发射光。CAI作为阳性对照。
1.2.3 BLI技术检测化合物与HIV-1衣壳蛋白的相互作用
检测在Octet Red96中进行,体积为200 μL,缓冲液为PBSTD(PBS,pH 7.4,0.02% Tween-20和1% DMSO)。方法:(1)分别生物素化CA单体和CA六聚体,过脱盐柱去除游离的生物素后用PBSTD稀释为50 μg/mL。用1根streptavidin(SA)传感器检测生物素化效果,并确定生物素化的时间。(2)向PCR管中加入15 μL PBSTD,将SA传感器置于其中,预湿20 min。传感器转移到含15 μL生物素化的蛋白液中生物素化5 min。(3)为了消除非特异性作用,同时使用一列生物素化的SA传感器和一列空白的SA传感器检测蛋白和小分子的相互作用,也就是所谓的“双扣除”法。依次按照基线(baseline)平衡60 s,结合(association)120 s和解离(association)120 s的顺序检测化合物和传感器的结合。使用Data analysis 9.0软件中的global 1∶1模型,对数据进行分析并计算响应值和KD值。
1.2.4 化合物对HIV-1衣壳蛋白体外装配的影响
使用分光光度计在波长350 nm处通过监控体系浊度的改变来检测化合物对衣壳装配的影响[20-22]。具体方法:将CA蛋白单体置于磷酸钠盐(pH 8.0)中透析过夜,浓缩至浓度至少为120 μmol/L。将1.0 μL化合物(DMSO溶解)添加到74 μL反应缓冲液中(由2 mL 5 mol/L NaCl溶液与1 mL 200 mmol/L NaH2PO4pH 8.0溶液混合制得)。然后加入25 μL透析过的衣壳蛋白引发反应。每隔1 min在350 nm处读取一次,持续39 min。以DMSO和CAI分别作为阴性和阳性对照。
1.2.5 分子模拟
从PDB数据库中下载CA CTD的晶体复合物(PDB ID:2BUO)和CA六聚体的晶体复合物(PDB ID:4XRO)用于分子模拟。先使用在线工具Swiss Dock模拟小分子和CA CTD的结合模式,然后将小分子CA CTD的复合物与CA六聚体的晶体复合物进行叠合,得到小分子与CA六聚体以及与CA CTD和CA NTD结合界面的结合模式[23-24]。所有的模拟结果使用PyMol进行可视化[25]。
2 结果与分析
2.1 CA蛋白(单体和六聚体)和GST-CA CTD的表达纯化
CA蛋白(单体和六聚体)经过HiTrap SP HP阳离子交换柱纯化后的结果见图1(a)。在预期的分子质量24 ku处有明显的蛋白条带。CA蛋白(单体和六聚体)经过HiTrap Q FF阴离子交换柱纯化后的结果见图1(b),在预期的分子质量24 ku处均呈现单一条带,说明纯化的CA蛋白具有很高的纯度。
2.2 IB库中CA CTD-CAI相互作用抑制剂筛选
利用已建立的基于HTRF的方法,评价IB库中399个化合物的抗CA CTD-CAI相互作用的活性。Z因子是评价药物筛选数据质量的主要参数,研究计算了每一次筛选的Z因子,结果如图2(a)所示:5次筛选的Z因子均大于0.8,说明筛选的数据是可信的。初筛结果如图2(b)所示,化合物溴苯苄胺(Brompheniramine)、环索奈德(Ciclesonide)、丙酸氟替卡松(Fluticasone propionate)、水杨烟肼(Salinazid)、SP600125(1,9-Pyrazoloanthrone)和埃罗替尼(Erlotinib)对CA CTD-CAI相互作用的抑制率均达到70%以上。将这6个化合物在反应体系中的终浓度以50 μmol/L作为起始浓度进行倍比稀释,测定其抑制CA CTD-CAI相互作用的半数抑制浓度IC50,只有溴苯苄胺和环索奈德对CA CTD-CAI相互作用的抑制作用呈现浓度依赖性,其IC50值分别为15.96和6.06 μmol/L,见图2(c)和图2(d)。选择IC50值小于10 μmol/L的环索奈德作为进一步研究的目标化合物。
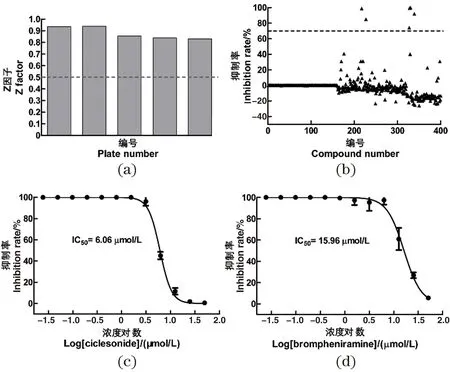
图2 化合物库的筛选
2.3 环索奈德与CA蛋白的相互作用
为验证环索奈德[化合物结构见图3(a)]与其作用靶点CA蛋白的结合亲和力,运用生物膜干涉技术(BLI)测定该化合物与HIV-1 CA单体和六聚体的结合能力。环索奈德及阳性化合物PF74与衣壳蛋白(单体和六聚体)的BLI结果如图3(b)和3(c)所示。PF74结合CA六聚体的亲和力常数(KD)为188 nmol/L,相比之下,PF74与CA单体的亲和力要低的多(KD=24.3 μmol/L)。与PF74类似,环索奈德与CA六聚体的亲和力较高(KD=159 nmol/L),与CA单体的亲和力非常弱(KD=1.68 mmol/L)。环索奈德和PF74与CA六聚体结合的模式均属于快结合慢解离。
2.4 环索奈德对体外衣壳蛋白装配的影响
环索奈德能够结合CA六聚体,推测其可能会影响CA蛋白在体外的装配。结果如图4所示,与DMSO(mock)相比,CAI在体外显著抑制CA的装配。环索奈德却在同一实验中显著加快了HIV-1 CA蛋白的组装,且表现出计量依赖性的特点。
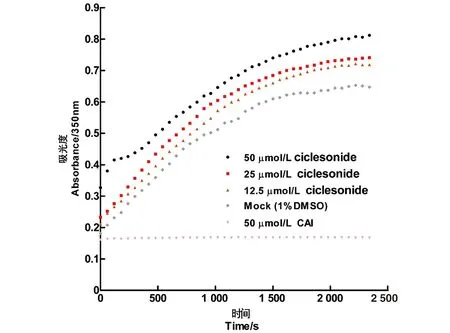
图4 环索奈德对衣壳蛋白体外装配的影响
2.5 环索奈德与CA蛋白的结合模式
使用分子对接模拟环索奈德与CA CTD的结合模式。从PDB数据库下载CA CTD三维结晶图(PDB code:2BUO),绘制化合物结构[CAS:126544-47-6,图3(a)],使用在线对接工具Swiss Dock,将化合物与作用靶点CA CTD进行对接,结果(图5)显示,环索奈德分别与CA CTD中的N183和L211残基形成了氢键,可能对化合物与蛋白的结合提供了主要作用。将环索奈德与CA CTD形成的复合物结构与CA六聚体(PDB code:4XRO)叠合,结果显示:环索奈德可与CA六聚体结合(图6),结合位点位于CA六聚体相邻亚基N末端-C末端(NTD-CTD)界面。环索奈德分别与CTD的L211残基和NTD的H67残基形成了氢键。
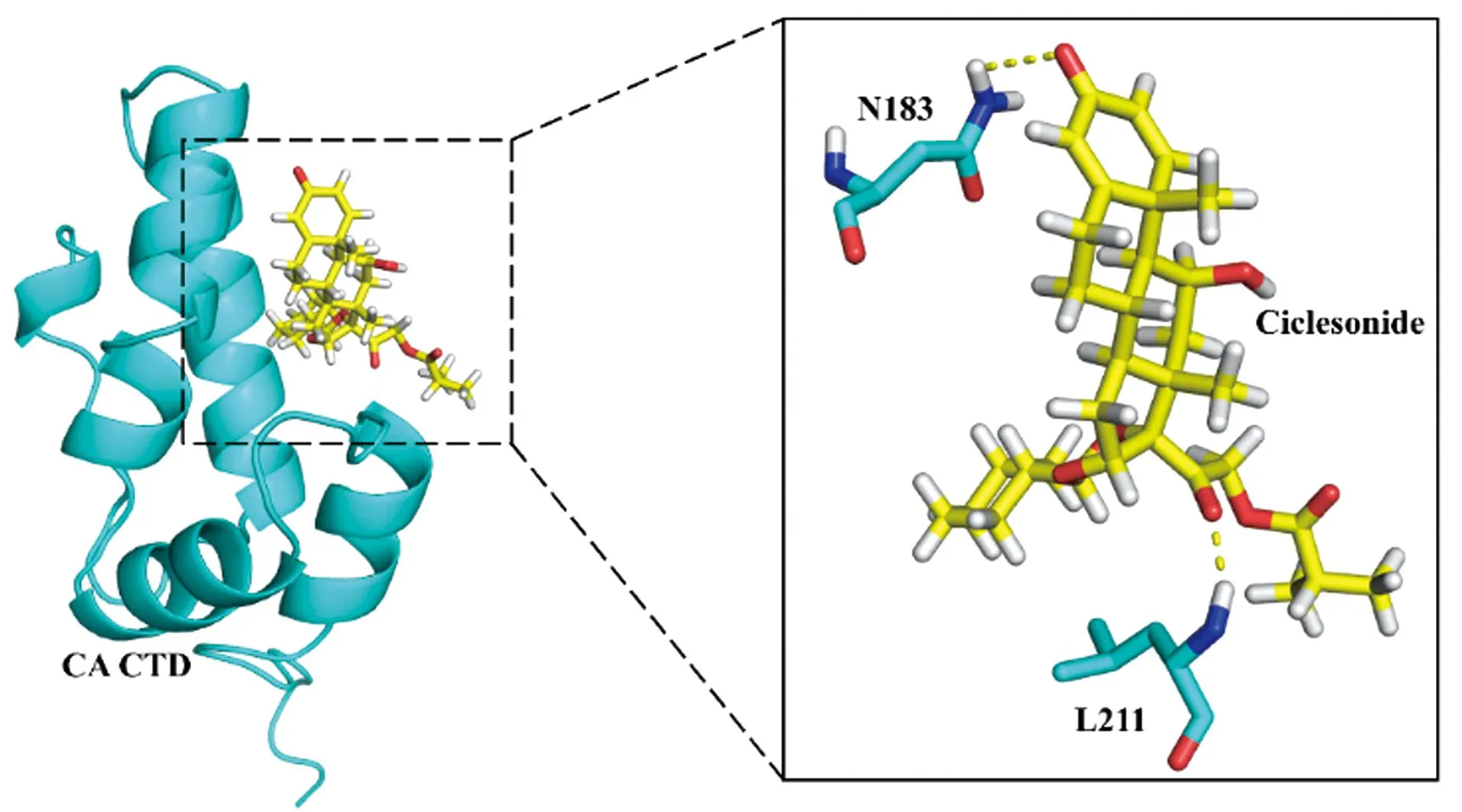
图5 CA CTD与环索奈德的结合模式分析
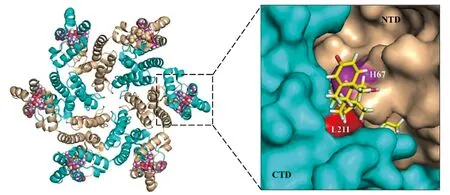
图6 环索奈德靶向衣壳蛋白六聚体相邻NTD/CTD的结合界面
3 讨论与结论
CA CTD对HIV-1的装配至关重要[26-27]。研究发现,多肽CAI结合到CTD中一个保守的疏水口袋,通过变构作用导致CA的装配受到抑制。位于CA CTD中的变构位点是筛选抗病毒药物的理想靶点。我们在之前的研究中基于HTRF的方法,构建靶向该变构位点的抑制剂筛选方法,筛选到3个能够有效抑制剂HIV-1复制的小分子抑制剂[19,28]。本文继续采用该方法,从399个化合物中筛选到一个化合物环索奈德,其能在体外扰乱CA蛋白的装配,主要靶向CA蛋白六聚体。
病毒的衣壳是由病毒衣壳蛋白亚基组装形成的病毒外壳,是病毒的重要结构蛋白,内部包裹着病毒的遗传物质和多种蛋白质,在病毒的生命周期中发挥重要作用。衣壳蛋白抑制剂通过稳定衣壳或破坏病毒衣壳的稳定性来阻断病毒的生命过程[29]。2022年8月,新型HIV-1抗病毒药衣壳抑制剂Lenacapavir(Sunlenca,GS-6207)获得了欧盟的上市许可,可与抗逆转录病毒药物联合用药治疗艾滋病毒感染,用于患有多重耐药艾滋病毒感染的成年人[30]。Lenacapavir虽未获FDA批准上市,却证明了CA是开发抗HIV-1药物的有效靶点。迄今为止已发现诸多靶向HIV-1衣壳蛋白的小分子化合物,它们中一些(以CAI和BI64为代表)在体外抑制CA的装配,另一些(以PF-74和GS-CA1为代表)则在体外促进CA的装配[7]。研究认为这些小分子对CA装配的不同影响源于它们与CA单体和CA六聚体的亲和力不同[31]。对PF-74和GS-CA1而言,它们对CA六聚体的亲和力要强于CA单体,而CAI和BI64则只结合CA单体。本研究发现的小分子环索奈德对CA六聚体的亲和力远高于CA单体,分子模拟亦表明环索奈德的作用位点位于CA六聚体相邻亚基NTD-CTD界面,这些数据解释了环索奈德在体外促进CA蛋白装配的原因,也符合之前的文献报道[31]。
环索奈德是一种具有强效抗炎活性的糖皮质激素,临床用于治疗哮喘、季节性变应性鼻炎和嗜酸性食管炎[32]。姚债文等[33]发现,环索奈德在体外抑制寨卡病毒(Zika virus,ZIKV)复制,其主要作用于ZIKV的RNA合成阶段。Iwabuchi等[34]报道了使用环索奈德成功治愈了3例新冠肺炎。Kimura等[35]认为环索奈德抑制新冠病毒(Severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)复制的作用靶点为其核酸内切酶NSP15。Matsuyama等[36]的研究发现,环索奈德通过靶向SARS-CoV-2的复制-转录复合物抑制其RNA的复制,并且环索奈德对冠状病毒的抑制具有广谱性,能同时抑制β冠状病毒,包括鼠肝炎病(murine hepatitis virus type 2)、中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus)、SARS冠状病毒(Severe acute respiratory syndrome coronavirus 1)和新冠病毒及1种α冠状病毒人类冠状病毒229E(Human coronavirus 229E)的复制。至今尚未见环索奈德抗HIV-1活性的相关报道。尽管如此,与环索奈德结构骨架类似的甘氨脱氧胆酸(Glycodeoxycholate)和牛磺胆酸(Taurocholic acid)均能在体外抑制HIV-1衣壳蛋白的装配,并能抑制HIV-1病毒的复制[37],因此,我们推测环索奈德也能抑制HIV-1的复制。本研究是在体外开展的,为了进一步证明环索奈德的抗HIV-1活性,我们未来的研究将聚焦于阐明环索奈德的抗HIV-1活性及其机制,包括其抑制病毒复制的阶段以及对病毒体内组装的影响。
