电针调节PI3K/AKT/mTOR 信号通路激活帕金森大鼠脑组织自噬改善行为学反应机制
2023-12-21王飞李亚楠张小蕾胡梦妮李含章马骏
王飞,李亚楠,张小蕾,胡梦妮,李含章,马骏*
1.武汉市第一医院中医部,武汉 430022; 2.湖北中医药大学针灸骨伤学院,武汉 430022
帕金森病是中枢神经系统退行性疾病,多发于老年人,近年来该疾病趋于年轻化,成为影响中老年人健康的主要疾病之一[1]。深部脑刺激(deep brain stimulation,DBS)手术可以改善晚期帕金森患者的运动症状和生活质量[2]。然而,该手术仅用于药物不能充分控制症状的患者,大多数患者术后仍需服药。因此,亟需开发特异性的治疗手段、辅助药物。已知多条通路参与调控该疾病,磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋 白 激 酶 B(protein kinase B,AKT)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路的激活参与调控神经细胞的多个生理活动,如抑制细胞死亡、缓解细胞自噬等[3]。该通路可加速神经细胞增殖和分化,过度激活则会导致神经信号传递异常,造成中枢神经系统损伤,引发阿尔兹海默症[4]。通过调控该通路,抑制通路蛋白表达和激活,可显著促进细胞自噬反应,提升酪氨酸羟化酶(Tyrosine hydroxylase,TH)含量,降解多余α-突触核蛋白(αsynuclein,α-syn),从而保护神经元,缓解帕金森病[5]。针灸作为传统中医学的重要治疗手段,可延缓神经递质传递,缓解神经疼痛,广泛应用于神经疼痛治疗,对于神经系统疾病具有良好的治疗效果,越来越成为医学界研究的热点[6,7]。针灸对于帕金森病具有良好疗效,但作用机理有待明确[8]。本研究构建帕金森大鼠模型,探究电针治疗通过调控PI3K/AKT/mTOR 信号通路影响帕金森大鼠脑组织的自噬和行为学反应作用机制,为帕金森病的临床治疗提供理论依据。
1 材料与方法
1.1 材料
1.1 主要试剂与仪器 鱼藤酮(货号ST80190120)购于诗丹德(上海)标准技术服务有限公司,西罗莫司(批准文号H20130698)购于辉瑞爱尔兰药品公司,线粒体提取试剂盒(货号MP-007)购于英文特生物技术有限公司,柠檬酸抗原修复液(货号SJH0712)购于如吉生物(上海)科技有限公司,H2O2(货号H112520)购于aladdin 公司,兔抗鼠GAPDH 抗体(货号ab9485)、兔抗鼠TH 抗体(货号ab137869)、兔抗鼠α-syn 抗体(货号ab212184)、兔抗鼠PI3K 抗体(货号ab133595)、兔抗鼠AKT 抗体(货号ab38449)、兔抗鼠mTOR 抗体(货 号ab134903)、兔 抗 鼠p-PI3K 抗 体(货 号ab207484)、兔抗鼠p-mTOR 抗体(货号ab109268)、兔抗鼠微管相关蛋白1 轻链3(microtubule-associated protein 1 light chain 3,LC3)B-II/LC3B-I 抗体(货号ab63817)、兔抗鼠Beclin1 抗体(货号ab207612)购于Abcam 公司,兔抗鼠p-AKT 抗体(货号9271T)购于CST 公司,电针治疗仪(6805-A,武汉科尔达医疗科技有限公司),线粒体呼吸检测仪(Oxytherm,汉莎科学仪器有限公司),荧光定量PCR 仪(7500,ABI 公司),凝胶成像系统(CA-268,上海精密仪器仪表有限公司)。
1.1.2 实验动物及建模 由华中科技大学动物实验中心购得清洁级SD 大鼠60 只,6 周龄,体质量(200±25)g,SCXK(鄂)2021-0009。麻醉所有大鼠,配置鱼藤酮溶液(2 g/L,葵花油溶解)[9],随机选取48 只于颈背部皮下注射鱼藤酮溶液1 mL,余12 只作为对照组注射等剂量葵花油,每日1 次,连续注射4 周。末次注射12 h 后,观察大鼠行动能力,行动偏向一侧、身体持续震颤、动作迟缓且活动能力较弱判定为构模成功。将帕金森大鼠模型分为帕金森组、电针组、西罗莫司组、电针+PI3K 激活组,每组12 只。电针组、电针+PI3K 激活组大鼠选取穴位“太冲”、“风府”进行电针治疗,选用0.5 寸毫针,针灸深约5 mm,接通正负极,电流强度1 mA,持续通电15 min,1 次/日;西罗莫司组大鼠腹腔注射西罗莫司1 mg/kg;电针+PI3K 激活组腹腔注射PI3K 激活剂Recilisib 5 mg/kg;对照组、帕金森组、电针组大鼠腹腔注射等剂量生理盐水。持续处理14 d。
1.2 研究方法
1.2.1 动物行为学评定 各组大鼠末次治疗12 h 后通过斜板实验和旷场实验进行行为学评定。斜板实验:准备一块平整的木板,木板上放置橡胶垫(厚约0.5 cm),依次将大鼠置于橡胶垫中心位置,确保大鼠不抓挠依附木板边缘,将木板倾斜角缓慢提升至30°,随后逐渐增大倾斜角,如果大鼠能在木板上停留5 s以上,则再次提升角度,直至大鼠停留时间短于5 s,记录此刻的斜板角度,每只大鼠连续重复3 次,取平均值作为斜板停留最大角度。旷场实验:利用特制的旷场分析箱进行试验,箱底部区域为横五排竖五排的方格,每个方格大小25 cm×25 cm。将大鼠放置于箱底中央格子中,记录3 min 内大鼠跨越格子数(3 爪以上跨入即算)和站立次数(前肢离地1 cm 以上)[10]。
1.2.2 脑组织线粒体活性检测 各组随机选取6 只大鼠,麻醉后迅速处死,剖开脑部,分离脑组织,匀浆器打磨至匀浆状态,按照线粒体提取试剂盒说明书提取线粒体,线粒体呼吸检测仪检测state3、state4 呼吸速率,计算线粒体呼吸控制比(mitochondrial respiration controlling rate,RCR),RCR=state3 呼吸速率/state4 呼吸速率×100%。采用荧光素酶标记法检测ATP 合成酶活性,配置反应体系,ADP 激活反应,记录发光强度,确定ATP 合成量。
1.2.3 免疫组化检测脑黑质TH、α-syn 蛋白表达 各组剩余6 只大鼠麻醉后迅速处死,剥离脑组织分离黑质区,部分切下经液氮处理后研磨至粉冻存备用,部分置于4%多聚甲醛中固定。固定24 h 后,常规脱水包埋制作石蜡切片,脱蜡至水,柠檬酸抗原修复液加热处理修复组织抗原,滴加H2O2室温孵育5 min,PBS清洗3 次,山羊血清封闭液封闭10 min,滴加一抗(TH抗体、α-syn 抗体,1:200),4 ℃孵育过夜,PBS 清洗3次,滴加生物素标记的羊抗兔二抗,室温孵育15 min,PBS 清洗3 次,滴加链霉菌抗生物素-过氧化物酶溶液,室温孵育15 min,PBS 清洗3 次,滴加DAB 溶液,完全显色后清水洗净,苏木素染色复染,PBS 清洗直至返蓝,酒精梯度脱水后封片置于显微镜下观察。
1.2.4 Western blot 检 测 自 噬 及PI3K/AKT/mTOR 通 路相关蛋白表达及磷酸化 取出1.2.3 中冻存的脑组织粉末,滴加蛋白裂解液后充分混合,使蛋白充分裂解提取总蛋白,按照试剂盒说明书检测提取蛋白质量,取定量与上样缓冲溶液混合加热变性,加入凝胶孔道中,进行电泳跑胶,转膜后脱脂牛奶封闭2 h,加入一抗(GAPDH 抗体、PI3K 抗体、p-PI3K 抗体、AKT 抗体、p-AKT 抗体、mTOR 抗体、p-mTOR 抗体、LC3B 抗体、Beclin1 抗体,1:1000),4 ℃孵育过夜。TBST 清洗3次,加入羊抗兔二抗(1:800),室温孵育45 min,TBST清洗3 次,将发光试剂A 液和B 液混合均匀,倒于膜上,静置1 min 后吸干多余水分,利用光密度扫描系统(Syngene)分析条带灰度。
1.3 统计学方法
2 结果
2.1 电针治疗对帕金森大鼠行为学反应影响
斜板停留最大角度、跨格次数、站立次数统计,与对照组相比,帕金森组大鼠显著降低(P<0.05);与帕金森组相比,电针组、西罗莫司组大鼠显著升高(P<0.05);与电针组相比,电针+PI3K 激活组大鼠显著降低(P<0.05);西罗莫司组与电针组相比无统计学差异(P>0.05),见图1。
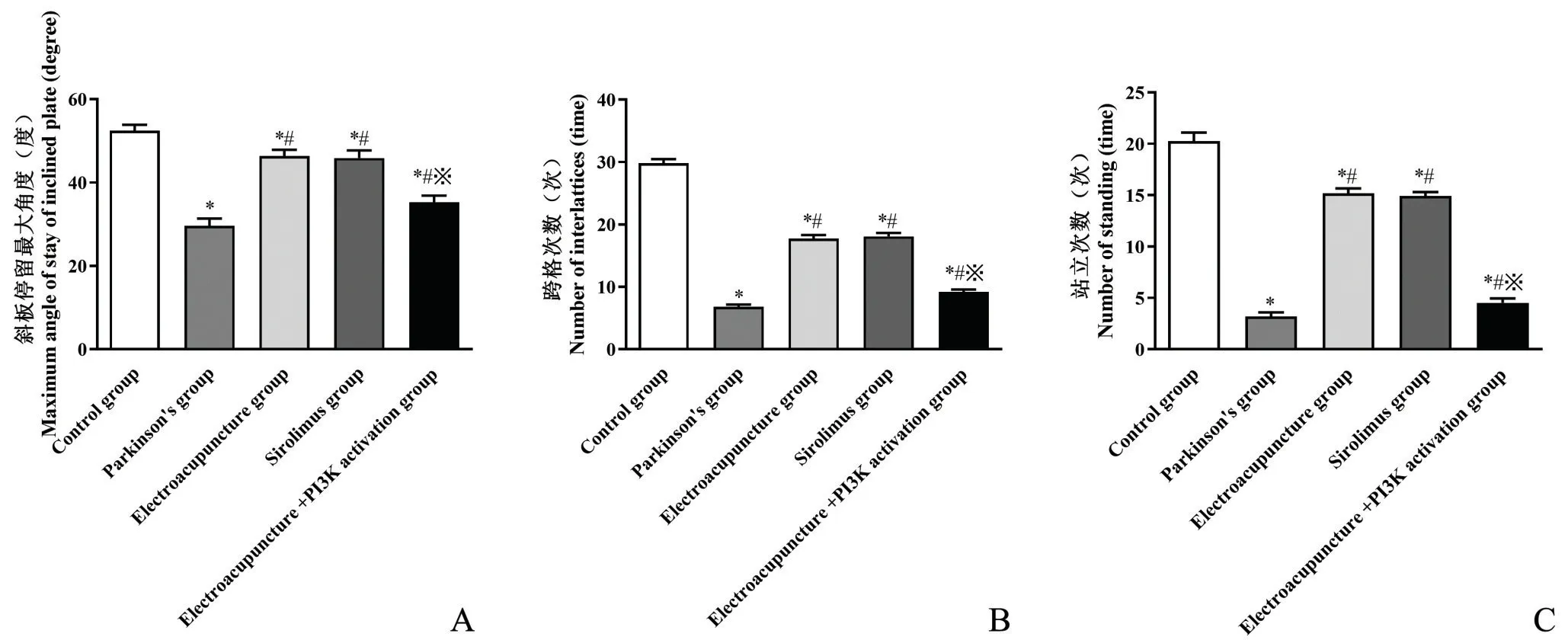
图1 各组大鼠斜板停留最大角度(A)、跨格次数(B)、站立次数(C)统计图* P<0.05,与对照组相比 #P<0.05,与帕金森组相比 ※P<0.05,与电针组相比n=12Fig.1 Comparison of maximum angle of sloping plate stay (A), times of crossing lattice (B), and times of standing (C) of rats in each group Compared with control group, *P<0.05; Compared with Parkinson group, #P<0.05; Compared with electropuncture group, ※P<0.05 n=12
2.2 电针治疗对帕金森大鼠脑组织病理学影响
大鼠脑组织RCR、ATP 合成酶活性、黑质内TH 平均光密度检测,与对照组相比,帕金森组大鼠显著降低,α-syn 平均光密度显著升高(P<0.05);与帕金森组相比,电针组、西罗莫司组大鼠显著升高,α-syn 平均光密度显著降低(P<0.05);与电针组相比,电针+PI3K激活组大鼠显著降低,α-syn 平均光密度显著升高(P<0.05);西罗莫司组与电针组大鼠相比无显著差异(P>0.05),见图2~3。

图2 各组大鼠脑组织RCR、ATP 合成酶活性统计图* P<0.05,与对照组相比 #P<0.05,与帕金森组相比 ※P<0.05,与电针组相比n=6Fig.2 Comparison of RCR and ATP synthase activity in brain tissue of rats in each group Compared with control group, *P<0.05; Compared with Parkinson group, #P<0.05; Compared with electropuncture group, ※P<0.05 n=6
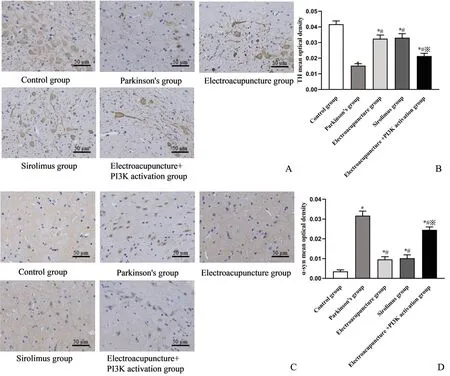
图3 各组大鼠黑质TH、α-syn 表达A:TH 免疫组化染色结果B:TH 平均光密度统计图C:α-syn 免疫组化染色结果D:α-syn 平均光密度统计图*P<0.05,与对照组相比 #P<0.05,与帕金森组相比 ※P<0.05,与电针组相比n=6Fig.3 Expression of TH and α-syn in substantia nigra of rats in each group A: Results of TH immunohistochemical staining; B: Statistical diagram of TH average optical density value; C: Results of α-syn immunohistochemical staining; D: Statistical diagram of average optical density values of α-syn Compared with control group, *P<0.05; Compared with Parkinson group, #P<0.05; Compared with electropuncture group, ※P<0.05 n=6
2.3 电针治疗对帕金森大鼠脑组织自噬反应影响
大鼠脑组织Beclin1 蛋白表达量、LC3B-II/LC3B-I检测,与对照组相比,帕金森组大鼠显著升高(P<0.05);与帕金森组相比,电针组、西罗莫司组大鼠显著升高(P<0.05);与电针组相比,电针+PI3K 激活组大鼠显著降低(P<0.05);西罗莫司组与电针组大鼠相比无显著差异(P>0.05),见图4。

图4 各组大鼠脑组织LC3B-I、LC3B-II、Beclin1 蛋白表达量*P<0.05,与对照组相比 #P<0.05,与帕金森组相比 ※P<0.05,与电针组相比n=6Fig.4 Protein expressions of LC3B-I, LC3B-II and Beclin1 in brain tissue of rats in each group Compared with control group, *P<0.05; Compared with Parkinson group, #P<0.05; Compared with electropuncture group, ※P<0.05 n=6
2.4 电针治疗对帕金森大鼠脑组织PI3K/AKT/mTOR通路相关蛋白磷酸化影响
大鼠脑组织p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR 值检测,与对照组相比,帕金森组大鼠显著升高(P<0.05);与帕金森组相比,电针组、西罗莫司组大鼠显著降低(P<0.05);与电针组相比,电针+PI3K 激活组大鼠显著升高(P<0.05);西罗莫司组与电针组大鼠相比无显著差异(P>0.05),见图5。

图5 各组大鼠脑组织PI3K、AKT、mTOR、p-PI3K、p-AKT、p-mTOR 蛋白表达量*P<0.05,与对照组相比 #P<0.05,与帕金森组相比 ※P<0.05,与电针组相比n=6Fig.5 Protein expressions of PI3K,AKT, mTOR, p-PI3K, p-AKT and p-mTOR in brain tissue of rats in each group Compared with control group, *P<0.05; Compared with Parkinson group, #P<0.05; Compared with electropuncture group, ※P<0.05 n=6
3 讨论
帕金森病的发作受遗传和多种环境因素影响,患者脑组织内线粒体代谢异常,细胞自噬不足,导致αsyn 大量积累,破坏神经功能,使患者产生强烈的震颤,造成肌强直,严重者肢体扭曲,生活不能自理[11]。了解帕金森病的发展机制、寻找有效的治疗措施至关重要。检测行为学功能是评估该病的重要指标。本研究应用斜板实验和旷场实验验证大鼠模型构建成功,帕金森大鼠产生行为学障碍,斜板停留最大角度、跨格次数、站立次数显著降低,具有帕金森病的典型症状[12]。
电针治疗为常见中医药治疗手段,在缓解疼痛方面具有良好的疗效,专家推测其对于帕金森病具有一定的治疗效果[13]。研究发现,电针治疗可缓解帕金森大鼠的神经功能障碍,改善大鼠的认知功能[14]。药物配合电针治疗被临床验证具有良好的效果[15]。但电针治疗的作用机理有待进一步明确。本研究选用对于帕金森具有良好缓解效果的西罗莫司作为阳性对照[16],结果发现电针治疗和西罗莫司处理后,大鼠的斜板停留最大角度、跨格次数、站立次数显著升高,表明电针治疗后帕金森大鼠的行为学功能得到改善,但作用途径有待明确。
帕金森是由脑组织线粒体活性异常,引发ATP 合成受阻,自噬活性降低,TH 含量减低,造成α-syn 蛋白沉积,导致神经元受损[17]。通过该途径相关指标发现,帕金森大鼠脑组织内RCR、ATP 合成酶活性、TH含量显著降低,α-syn、Beclin1 蛋白表达量、LC3B-II/LC3B-I 显著升高,与既往研究一致。电针治疗和西罗莫司处理后,RCR、ATP 合成酶活性、TH 含量、Beclin1 蛋白表达量、LC3B-II/LC3B-I 显著升高,α-syn蛋白表达量显著降低,表明电针治疗可显著改善脑组织线粒体活性,激活自噬,提高TH 表达,加速降解αsyn,从而缓解帕金森,但作用机理有待进一步明确。
PI3K/AKT/mTOR 信号通路激活可加速细胞因子生长,抑制自噬,是常见的自噬调控通路。川芎嗪可通过抑制该通路相关蛋白激活,从而加速自噬,缓解糖尿病大鼠的肾损伤[18]。PI3K/AKT/mTOR 信号通路在帕金森病中同样发挥作用。姜黄素可通过调控PI3K/AKT/mTOR 信号通路,激活自噬的同时改善帕金森病[19]。研究发现,电针治疗可抑制PI3K/AKT/mTOR 信号通路相关蛋白激活,缓解骨骼肌萎缩大鼠的神经损伤[20],推测电针治疗影响帕金森大鼠病情与调控PI3K/AKT/mTOR 信号通路有关。本研究发现,帕金森组大鼠脑组织PI3K、AKT、mTOR 蛋白磷酸化程度显著升高,电针治疗和西罗莫司处理后,大鼠脑组织PI3K、AKT、mTOR 蛋白磷酸化程度显著降低,证实电针治疗很可能通过调控PI3K、AKT、mTOR 蛋白磷酸化影响帕金森病情。为进一步验证,本实验在电针治疗的同时激活PI3K,结果发现PI3K、AKT、mTOR 蛋白磷酸化程度显著升高,同时大鼠脑组织内RCR、ATP 合成酶活性、TH 含量、Beclin1 蛋白表达量、LC3B-II/LC3B-I 显著降低,α-syn 蛋白表达量显著升高,斜板停留最大角度、跨格次数、站立次数显著降低,进一步验证相关假设。
综上所述,电针治疗可通过抑制PI3K、AKT、mTOR 蛋白磷酸化,增强线粒体活性,增加TH 含量,激活脑组织自噬,缓解α-syn 蛋白沉积,从而改善帕金森大鼠运动行为功能。但电针治疗是否通过其他通路间接参与调控帕金森病,还有待进一步实验加以明确。