胰后入路托出式脾门淋巴结清扫在胃癌根治术中的应用
2021-04-28常绪生蔡慧丁丹龚晓黎旭徐俊印慨
常绪生,蔡慧,丁丹,龚晓,黎旭,徐俊,印慨
(海军军医大学附属长海医院胃肠外科,上海200433)
胃癌是我国常见的恶性肿瘤之一,2015年中国癌症数据报告显示[1],我国新发胃癌病例数占世界新发胃癌病例数的50%,其中以进展期胃癌为主。日本第4版《胃癌治疗指南》[2]的胃癌D2根治术包括No.10淋巴结(脾门淋巴结)清扫,但第5版[3]根据JCOG0110研究结果将清扫No.10淋巴结剔除出胃癌D2根治术范畴,但这个做这法有待商榷,该研究主要针对非大弯侧胃癌是否需做脾切除而开展的,并不能回答脾门淋巴结是否需清扫的问题。文献报道脾门淋巴结在中上部胃癌中的转移率为8.8%~20.9%,所以并不能由此否定No.10淋巴结清扫的价值,但应尽量避免切脾,而是行保脾的No.10淋巴结清扫。由于脾门解剖结构复杂且手术操作空间狭小,脾门淋巴结清扫容易损伤脾门血管或脾脏引起无法控制的出血等严重并发症,如何安全、有效地清扫脾门淋巴结一直是探讨的热点。保留脾脏的脾门淋巴结清扫根据清扫方式的不同分为原位清扫及托出式清扫。托出式清扫需游离脾脏和胰体尾,并将其移出腹膜腔外进行清扫,能充分暴露解剖结构,同时能清扫脾门后方的淋巴脂肪组织。本研究采用胰后入路运用胰腺上下缘会师及抬脾的技术方法进行拖出式脾门淋巴结清扫,对此回顾性分析50例患者的临床病理资料,探讨该技术的可行性和安全性,现报道如下。
1 资料与方法
1.1 临床资料选取2016年4月至2019年3月本院胃肠外科采用胰后入路拖出式脾门淋巴结清扫方法的50例胃癌手术患者(其中3例为新辅助化疗患者),男24例,女26例;年龄34~82岁;肿瘤位于贲门24例,胃底5例,胃体21例;肿瘤T分期:T2 1例,T3 32例,T4 17例。
1.2 方法50例患者均行全胃切除+胰后入路托出式脾门淋巴结清扫。全身麻醉,常规先行全胃切除+除脾门淋巴结之外的淋巴脂肪组织清扫,离断食管及十二指肠,移除胃标本,蒸馏水冲洗腹腔。
胰腺上下缘会师技术:脾动脉起始部进入胰腺上缘后间隙(见图1a),沿此间隙顺胰腺向左侧游离至胰体尾后方达脾上极,吸引器抬起脾脏上极,切断脾膈韧带(见图1b)。胰腺中部下缘切开后腹膜进入胰腺后方Toldt间隙(见图1c),切断脾结肠韧带(见图1d),向外游离此间隙至胰尾、脾蒂、脾脏后方,向上与之前分离的胰腺上缘后间隙会师。
抬脾技术:胰腺上下缘会师后,胰腺体尾部贯通,吸引器抬起脾上极,切断脾膈韧带,从脾脏外侧由上至下切断外侧脾肾韧带,抬起脾下极由下向上切断脾肾韧带与之前切断的脾肾韧带连接(见图1e),此时胰体尾、脾脏已完全从腹膜后游离,将脾脏连同胰体尾部一同翻向内侧,拖出切口外。
淋巴结的清扫采用先上缘后下缘再脾门的顺序,助手牵好脾脏,保持胰腺上缘张力,超声刀顺着脾动脉完整清扫No.11p、No.11d淋巴结。紧贴胰腺下缘清扫表面的淋巴脂肪组织至胃网膜左血管,根部切断结扎,清扫No.4sb组淋巴结。最后清扫胰尾远端No.10淋巴结,清扫从下向上、从胰尾向脾门方向分离前方的淋巴脂肪组织,将脾血管及各分支脉络化,尽量不打开脾血管鞘,胃短血管根部结扎离断。将脾脏翻转,清扫后方的淋巴脂肪组织,清扫后将脾脏放回脾窝。所有操作均在直视下进行。胰腺后间隙内无重要神经、血管等结构,是Gerota筋膜前方疏松的Toldt间隙,游离时沿此间隙进行,不要突破胰腺后筋膜和Gerota筋膜。清扫后的脾门情况(见图1f)。
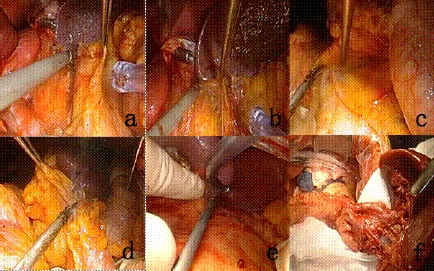
图1 手术过程图片
2 结果
50例患者均采用此技术顺利完成脾门淋巴结清扫。清扫脾门淋巴结时间30~65 min,失血量20~100 mL。脾门淋巴结阳性患者6例,脾门淋巴结阳性率为12.0%。术后1例腹腔出血行脾脏切除术,1例胰瘘经保守治疗好转。
3 讨论
胃上部淋巴结转移途径复杂,与周围重要脏器关系密切,Yukio Maezawa等[4]研究发现第10组淋巴结的转移率为13%,治疗价值指数与其他胰腺上淋巴结相同。Chikara等[5]对根治性胃癌手术的患者进行11年的随访研究发现,存在第10组淋巴结转移的患者生存率为11%,而无第10组淋巴结转移的为27%。Chikara等[6]研究发现,第10组及第11组淋巴结转移阳性者的5年生存率明显低于阴性者(23.8%vs.41.4%,P<0.05)。第10组是淋巴结的转移阳性影响预后的重要因素之一。日本第5版胃癌治疗指南基于JCOG0110研究将清扫No.10淋巴结剔除出胃癌D2根治术清扫范畴。这个临床研究并没有回答是否需要No.10淋巴结清扫的问题,也未回答是否需行保留脾脏的No.10淋巴结清扫,仅说明对于非大弯侧胃癌做脾切除并未使患者获益。目前,是否需要No.10淋巴结的清扫仍有很大争论,有学者认为,在没有高级别临床证据出现前,全胃切除术T3以上的胃中上部癌,应行No.10淋巴结清扫,但尽量避免切脾[7]。反对的学者认为No.10淋巴结转移发生率低,尤其是早期及小弯侧的肿瘤,且手术技术难度大,没有必要进行[8]。本研究中脾门淋巴结阳性率为12.0%,6例脾门淋巴结阳性病例中有2例肿瘤位于胃底贲门,3例肿瘤位于胃体大弯,1例为革袋胃,表明在进展期胃癌侵及胃大弯行脾门淋巴结清扫术可能会使患者获益。
以往为了更好地清扫No.10淋巴结,多采用脾脏切除的方法。但术后近期并发症发生率和病死率较高,与保脾No.10淋巴结清扫相比,远期生存并未提高[7-9]。目前保留脾脏的淋巴结清扫被广泛接受。但脾门的解剖位置深,手术空间有限,同时脾脏组织质脆,脾门血管变异多,原位彻底清扫淋巴结相当困难,特别是清扫脾门血管后方的淋巴脂肪组织。胰腺后入路托出式方法,能够轻松将胰体尾与脾脏搬到腹腔外,直视下对胰尾脾门淋巴结包括脾门后方淋巴结进行“立体”清扫,保证淋巴结清扫的彻底性。脾脏、胰尾托出切口,显露充分,清扫操作简便易行。本组清扫脾门淋巴结时间30~65 min,手术时间略长于原位脾门淋巴结清扫时间,但熟悉解剖路径后,通过固定的手术流程将胰尾脾脏游离托出切口的操作并不明显延长手术时间。在开展此技术的过程中发现,胰体尾脾脏拖出后能更好的控制医源性的脾实质的撕脱出血,本研究有3例在游离胃脾韧带时引起脾下极脾出血,托出脾脏后有2例出血自行停止,1例电凝止血,对手术过程中引起的脾脏实质或脾血管的出血,可采用脾脏拖出的方法进行止血。
在膜解剖的基础上采用胰腺上下缘会师技术及抬脾技术使手术更加简化,层面更清晰。胰腺背面的“胰床”Toldt间隙是胰腺和肾脏融合筋膜,是一层无血管的组织间隙,在此平面采用会师技术易能将上下缘贯通。脾肾韧带的游离离断是整个脾脏拖出的难点,在胰体尾游离后采用吸引器抬脾的方法能增加操作空间,方便离断脾肾韧带。
脾门淋巴结清扫是胃癌根治术的难点,操作难度大,以膜解剖为基础通过胰后间隙采取胰后入路托出式方法能更好的完成脾门淋巴结的清扫,是一种安全易行的方法。
